Einleitung
Die Erwartungen und Ansprüche an die prothetische Versorgung von Hand- oder Arm-Amputierten steigen stetig, und somit erhöhen sich auch die Anforderungen an den Amputationsstumpf 1. Die technischen, aber auch die chirurgischen Errungenschaften der letzten Jahre haben vor allem die Schnittstelle Mensch/Maschine optimiert und somit die Prothesenfunktion und damit auch die Akzeptanz myoelektrischer Prothesen erhöht 2 3.
Vor allem bei hohen Amputationen der oberen Extremität ist eine stabile Prothesenanbindung und gleichzeitig ein hoher Informationsfluss für eine zufriedenstellende prothetische Versorgung essentiell. Ist bei der transradialen Amputation mit adäquater Stumpflänge aufgrund der querovalen Form und der meist reichlich vorhandenen intuitiv steuerbaren Muskulatur eine rotationsstabile Anbindung und sinnvolle Prothesensteuerung verhältnismäßig einfach, so stellt z. B. die transhumerale Amputation das therapeutische Team vor deutlich größere Herausforderungen 4 5.
Nicht nur die Stumpflänge, sondern auch die Beschaffenheit und die Qualität spielen eine entscheidende Rolle. Als Folge traumatischer Amputationen kommt es häufig zu einer unzureichenden Weichteildeckung, weshalb ein Weichteilverschluss erst durch Kürzung des Knochens oder z. B. Spalthauttransplantation ermöglicht werden kann. Allerdings ist für eine suffiziente prothetische Versorgung transhumeral Amputierter eine Humeruslänge von etwa 50 % der normalen Länge akzeptabel, 70 % wären optimal 6. Die fehlenden Epikondylen, ausgenommen Exartikulations-Amputationen, führen aufgrund der runden Form des Oberarmknochens mit den umliegenden Weichteilen meist zu einer rotationsinstabilen Situation, die selbst mit Schultergurten schwer auszugleichen ist, ohne dem Patienten jegliche Mobilität im Schultergelenk zu nehmen 7 8.
Bei hohen Amputationen – transhumeral und glenohumeral – erhöht sich naturgemäß die Anzahl der zu ersetzenden Gelenke bei gleichzeitig deutlich geringerer Anzahl an verschiedenen Muskelsignalen im Vergleich zu transradial Amputierten. Des Weiteren sind die vorhandenen Muskelsignale zum Großteil nicht intuitiv steuerbar. Dies führt unweigerlich zu einer schlechteren Akzeptanz der Prothesen auf diesen hohen Amputationsniveaus.
Im folgenden Beitrag werden verschiedene Konzepte der chirurgischen Stumpfoptimierung dargestellt, um die genannten Probleme und Limitationen speziell bei hohen Amputationen der oberen Extremität zu verbessern.
Selektive Nerventransfers zur Optimierung der Prothesensteuerung
Die konventionelle Steuerung myoelektrischer Armprothesen erfolgt über zwei Oberflächen-Elektroden, die über zwei getrennt innervierte Muskelgruppen der verbliebenen Stumpfmuskulatur angesteuert werden. Bei Patienten mit transhumeralen Stümpfen werden der M. biceps und triceps, bei glenohumeralen Stümpfen meist der M. pectoralis major und der M. latissimus dorsi verwendet. Die verschiedenen Steuerungsebenen wie Hand, Handgelenk und Ellenbogen werden durch Ko-Kontraktionen dieser Muskeln angewählt und in der jeweiligen Ebene mit denselben Muskeln linear gesteuert 9. Die Schwierigkeit dabei ist, dass ein und dieselbe „Bewegung“ mit verschiedenen Funktionen belegt ist und somit für den Patienten nur unter größtmöglicher Konzentration einsetzbar ist. Ein harmonischer, dem natürlichen Bewegungsmuster entsprechender Bewegungsablauf ist mit diesem Steuerungsmechanismus nicht möglich, da eine simultane Bewegung mehrerer prothetischer Gelenke nicht durchführbar ist 10.
Die von Kuiken 11 vorgestellte Technik der TMR-Operation (TMR = Targeted Muscle Reinnervation) führt zu einer wesentlichen Erweiterung dieser Steuerungsmöglichkeiten. Bei dieser Operation werden die Nerven, die vormals für die verschiedenen Hand- bzw. Armfunktionen zuständig waren, im Wesentlichen N. radialis, N. medianus, N. ulnaris und bei glenohumeralen Amputationen auch N. musculocutaneus, auf Muskeläste der verbliebenen Muskulatur im Stumpfbereich transferiert. Dadurch werden neue, kognitiv sinnvolle und somit intuitive neuromuskuläre Einheiten geschaffen, die als Impulsgeber für die Steuerung myoelektrischer Prothesen dienen können. Die Zielmuskeln kontrahieren schließlich entsprechend der Aktivität der transferierten Nerven (Tab. 1 u. 2). Das dadurch generierte elektromyographische Signal kann dann über transkutane Elektroden an die Prothese weitergeleitet werden. Auf diese Weise ist eine harmonische, intuitive, dem natürlichen Bewegungsmuster entsprechende Steuerung gewährleistet, ohne dass der Patient zwischen den einzelnen Bewegungsebenen wechseln muss 12. Ziel dieser TMR-Operation ist es, transhumeral bzw. glenohumeral Amputierte mit bis zu sechs individuellen und intuitiven Muskelsignalen auszustatten 13.
Voraussetzung für eine erfolgreiche TMR-Operation sind intakte Muskeln im Bereich des Amputationsstumpfes und ein weitgehend intaktes proximales Armnervengeflecht. Um etwaige Vorschädigungen auszuschließen, sind eine präoperative MRT-Untersuchung, hochauflösender Ultraschall und bilanzierende NLG und EMG des verbliebenen Armnervengeflechtes zu empfehlen. Postoperativ kann der Patient die ausgewählten Muskeln im Stumpfbereich aufgrund der notwendigen Denervation nicht ansteuern; somit ist die Steuerung einer myoelektrischen Prothese in der Zeit der Reinnervation nur eingeschränkt möglich. Etwa nach drei Monaten zeigen sich meist die ersten Muskelkontraktionen der neuen Signalgeber. Abhängig von den anatomischen Gegebenheiten und den notwendigen Reinnervationsstrecken wird in den darauffolgenden Wochen und Monaten ein Signal nach dem anderen aktiv, bis nach ca. sechs bis neun Monaten alle (bis zu sechs) verschiedenen Muskelsignale im Stumpfbereich aktiv sind.
In diesen Monaten ist neben klassischem Haltungs- und Rumpfstabilisationstraining ein komplexes Rehabilitationsprogramm notwendig, um die einzelnen Signale kognitiv exakt zu trennen und somit dem Patienten ein optimales Ergebnis zu ermöglichen 14. Im Rahmen des Signaltrainings wird mit einem eigens entwickelten Biofeedbacksystem gearbeitet, mit dem auch ein virtueller Arm gesteuert werden kann. Sind alle zu erwartenden Signale in guter Qualität und ausreichender kognitiver Trennung vorhanden, kann bei glenohumeral Amputierten mit der ersten Prothesenanpassung begonnen werden. Bei transhumeral Amputierten können zu diesem Zeitpunkt die restlichen Signale in die Steuerung der Prothese integriert werden. In der Regel dauert dieser Prozess der bionischen Rekonstruktion ca. ein Jahr nach TMR-Operation.
Selektive Nerventransfers zur Verbesserung von Neurom- und Phantomschmerzen
Ein einzelnes schmerzhaftes Neurom im Bereich des Amputationsstumpfes kann das Tragen einer Prothese für den Patienten unmöglich machen und des Weiteren auch zu einer beeinträchtigenden psychologischen Belastungssituation führen 15. Obwohl Odier bereits zu Beginn des 19. Jahrhunderts über das schmerzhafte Neurom berichtete 16, dokumentiert die Vielzahl der in der Literatur beschriebenen Behandlungsmöglichkeiten die Komplexität und Kontroversität dieses Themas. Zur Behandlung eines schmerzhaften Neuroms wurden im Laufe des letzten Jahrhunderts zahlreiche chirurgische Therapiemöglichkeiten beschrieben: einfache Resektion des Neuroms, Koagulation, Gefrieren, chemische Verätzung, Versiegelung mit Silikon, Implantation in den Knochen oder Muskel, Koaptation mit sich selbst oder End-zu-End mit einem anderen Nerv, um nur einige zu nennen 17 18 19 20 21. Das grundlegendste Bedürfnis eines Nervs besteht allerdings aus einem funktionellen Endziel. Dies wird durch die eben genannten Methoden missachtet. Dadurch kommt es meist zu einem Rezidiv.
Nach Durchtrennung eines peripheren Nervs suchen die regenerierenden Axone das distale Nervenende oder ein Endorgan. Bleibt ihre Suche dabei allerdings erfolglos, kommt es am proximalen Stumpf des Nervs zur Ausbildung eines Neuroms. Falls die Axone ein distales Nervenende vorfinden, regenerieren sie entlang dieser. Somit führt eine End-zu-Seit- oder, wie im Falle der TMR-Operation, End-zu-End-Neurorrhaphie des betroffenen proximalen Nervenstumpfes an einen intakten sensiblen oder motorischen Nerv mit erhaltenem Endorgan zur Zufriedenstellung des Nervs. Da Axone entlang des koaptierten Nervs regenerieren, werden eine erneute Neurombildung und somit auch schmerzhafte Sensationen verhindert.
Bei hohen Amputationen der oberen Extremität ist das chirurgische Vorgehen analog der beschriebenen TMR-Operation. Da aufgrund der Amputation der distale Ansatz der Zielmuskulatur verloren gegangen ist, kann diese keine Gelenkbewegung mehr ausführen, und die vorhandene Extremitätenfunktion wird durch die Neurotomie im Zuge einer End-zu-End-Koaptation nicht negativ beeinflusst. Bestehen schmerzhafte Neurome bei weiter distalen Amputationen mit erhaltener Gelenkkette, ist eine End-zu-Seit-Neurorrhaphie durchzuführen, um die Gelenkmobilität nicht zu beeinflussen 22 23. Bei der End-zu-Seit-Neurorrhaphie wird der betroffene Nerv in seinem Verlauf an einer Stelle durchtrennt, wo er leicht an einen benachbarten Nerv anzulagern ist. Für manche Nerven mag das direkt im Bereich des Neuroms selbst sein, für andere kann dies viel weiter proximal sinnvoll sein. In jedem Fall sollte die Nahtstelle in einer möglichst gelenkfernen Region zu liegen kommen, um bewegungsinduzierte Verlagerungen zu vermeiden. Diese Nervenkoaptationen werden unter Lupenvergrößerung durchgeführt.
Das Phänomen des schmerzhaften Phantoms der Hand bzw. des Armes ist im Vergleich zu Neuromschmerzen noch deutlich schwieriger zu verstehen und auch zu behandeln. Aufgrund der fehlenden Rückmeldung des amputierten Körperteils kreiert das Gehirn ein meist schmerzhaftes Phantom der verlorenen Extremität 24. Die klinische Erfahrung mit diesem Patientengut hat jedoch gezeigt, dass ein intuitiv steuerbarer funktioneller prothetischer Extremitätenersatz zu einer Reintegration der Gliedmaße ins Körperbild des Patienten führt und ähnlich dem Prinzip der Spiegeltherapie zu einer deutlichen Schmerzreduktion führen kann.
Bei der Behandlung von Phantomschmerzen spielt auch der sozioökonomische Hintergrund eine beträchtliche Rolle. Viele Patienten können aufgrund des Funktionsgewinns der Prothese wieder in den beruflichen Alltag einsteigen. Dies hat nicht nur einen sozialen und wirtschaftlichen Nutzen, sondern durch die Lenkung von Aufmerksamkeit und Konzentration sicherlich auch eine positive Auswirkung auf den Phantomschmerz.
Weichteilerweiterung im Stumpfbereich
Die Beschaffenheit und vor allem die Länge des Amputationsstumpfes spielen eine entscheidende Rolle für die optimale Anpassung eines Prothesenschaftes und somit für eine zufriedenstellende Prothesenfunktion. Aufgrund traumatischer Amputationen und im Zuge der Akutversorgung oft fehlender Weichteildeckung werden viele Oberarmstümpfe knöchern gekürzt, um einen Weichteilverschluss zu ermöglichen. Für die suffiziente prothetische Versorgung eines Oberarmamputierten wäre allerdings eine Humeruslänge von etwa 50 % akzeptabel, 70 % wären optimal 25 26.
Bei diesem Patientengut spielen Amputationen im Kindes- und Jugendalter eine besondere Rolle. Diese unterscheiden sich von Amputationen Erwachsener aufgrund der stetigen Veränderung des Stumpfes in Länge und Breite. Aufgrund des oppositionellen Wachstums ist bei Kindern vor allem bei transhumeralen Stümpfen mit einer knöchernen Durchspießung zu rechnen 27. Die drohende Hautperforation hat trotz der bekannten Techniken von Ernst Marquardt oft mehrmalige Re-Amputationen zur Folge, die wiederum zu einem kurzen Stumpf und mangelnder Stabilität der prothetischen Versorgungen führen können 28 29.
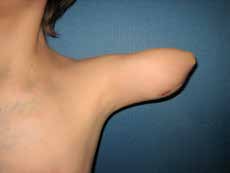
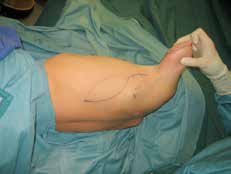
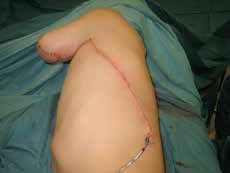
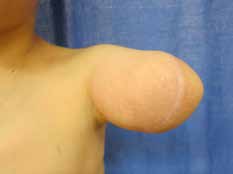
In den oben genannten Fällen mit adäquater knöcherner Länge, jedoch mangelnden Weichteilverhältnissen sollte statt einer Rückkürzung eine Weichteilerweiterung durchgeführt werden. Dies kann je nach den anatomischen Gegebenheiten mit einem gestielten oder aber auch freien Lappen erreicht werden. Hier bietet sich bei Oberarm-Amputierten ein an der A. und V. thoracodorsalis gestielter M.-latissimus-dorsi-Lappen zur Integumenterweiterung und Stumpfdeckung an (Abb. 1). Selbiges ist allerdings auch mit diversen freien Lappen möglich. Um eine suffiziente Weichteildeckung des Knochens zu gewährleisten, sollten allerdings bevorzugt Muskellappen verwendet werden. Der Muskel des freien sowie des gestielten Lappens kann in der Folge auch als Zielmuskel für Nerventransfers im Rahmen der TMR-Operation herangezogen werden. Somit kann ein weiteres Signal gewonnen und die Muskelatrophie auf ein Minimum reduziert werden.
Winkelosteotomie
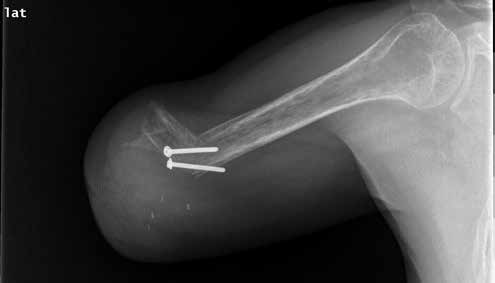
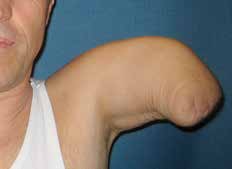
1974 entwickelten Marquardt und Neff die Winkelosteotomie für transhumeral amputierte Patienten 30. Das Ziel der Winkelosteotomie war einerseits, das Längenwachstum des Knochens und somit die Gefahr der Hautperforation bei Kindern und Jugendlichen zu reduzieren, andererseits eine möglichst rotationsstabile und zugfeste Stumpf-Prothesen-Anbindung zu ermöglichen 31. Bei der Winkelosteotomie nach Marquardt wird aus der Humerus-Diaphyse fünf bis sieben Zentimeter proximal des knöchernen Stumpfendes ein Keil mit einem Winkel von 70 bis 90 Grad entfernt, um das distale Humerus-Fragment annähernd rechtwinklig zum proximalen Humerus durch eine Knochenschraube oder einen Kirschner-Draht zu fixieren 32 (Abb. 2). Dadurch entsteht ein konturiertes Stumpfende mit der Möglichkeit, mittels spezieller Schafttechniken eine stabile Anbindung der Prothese ohne Schultergurte zu schaffen. Durch diese Methode kommt es allerdings unweigerlich zu einer Verkürzung der Stumpflänge. Die Winkelosteotomie sollte deshalb nur bei langen transhumeralen Stümpfen zur Anwendung kommen. Nachuntersuchungen haben allerdings eine Geradstellung des Knochenfragments bereits in den ersten 24 Monaten vor allem bei Patienten unter 16 Jahren gezeigt 33.
Verlängerung eines kurzen Oberarmstumpfes
Die prothetische Versorgung eines kurzen Oberarmstumpfes mit überschüssigem Weichteilgewebe stellt eine Herausforderung für den Orthopädie-Techniker dar. Aufgrund des rotierenden Weichteilmantels, geringer Hautauflagefläche und der schlechten Hebelverhältnisse bei kurzen Oberarmstümpfen führt dies meist zu nicht sehr zufriedenstellenden Ergebnissen. Eine relevante Verlängerung und Konturierung des Oberarmstumpfes kann deshalb zu einer solideren Stumpf-Prothesen-Verbindung beitragen, um somit das bestmögliche funktionelle Ergebnis für den Patienten zu erzielen.
In den frühen 70er Jahren wurden Distraktionssysteme verwendet, die über einen längeren Zeitraum einen Längengewinn von bis zu 6 cm ermöglichten 34. Dieses Verfahren führte zwar zu einer Verlängerung des Stumpfes, resultierte allerdings in einer für die prothetische Versorgung mangelnden Weichteildeckung des Stumpfes. Weitere Möglichkeiten der biologischen Stumpfverlängerung sind zum Beispiel ein osteomuskulokutaner Latissmus-Lappen mit Mitnahme einer Rippe, der gestielte Skapula-Transfer, die freie Fibula-Transplantation, aber auch die Allotransplantation von Leichenknochen 35 36 37. Die Verwendung der Fibula als freies Knochentransplantat ist aufgrund der Beschaffenheit des Knochens in Länge und Form eine verlässliche Möglichkeit der Stumpfverlängerung mit geringer Hebedefektmorbidität 38.
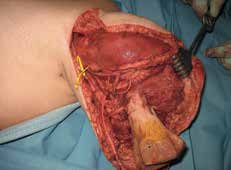
Die Transplantation einer vaskularisierten Fibula ist die Standardoperation in der Plastischen Chirurgie zur Überbrückung ausgedehnter Knochendefekte, die in Kombination mit homologen Knochen der Leiche als Capanna-Technik bekannt ist 39. Diese wird häufig bei Rekonstruktionen an der unteren Extremität oder in modifizierter Form auch zur Stumpfverlängerung bei Oberarmstümpfen angewandt. In diesem Fall wird eine Verlängerung mittels freier Fibula und homologem distalem Tibia-Ende zur Stumpfkonturierung durchgeführt. Die Fibula wird sowohl in den Humerus als auch in die Tibia versenkt, um eine optimale Vaskularisierung des Leichenknochens zu gewährleisten. Mit dieser Methode kann ein Längengewinn von etwa 6 bis 7 cm erzielt und ein epikondylenähnliches distales Stumpfende rekonstruiert werden (Abb. 3).
Osseointegration
Die aus der Zahnheilkunde stammende Methode der Osseointegration wird mittlerweile auf verschiedenen Amputationshöhen angewandt, um eine stabile Stumpf-Prothesen-Verbindung zu erreichen 40. Hierbei wird über ein aus der Endoprothetik bekanntes intramedullär eingebrachtes Implantat mit distalem Hautdurchtritt eine direkte Verbindung zwischen Oberarmknochen und Prothese geschaffen. Somit ist ein äußerer Schaft nur noch zur Platzierung der Elektroden notwendig, und es kann bei optimaler Stabilität der gesamte Bewegungsumfang des Schultergelenks erhalten bleiben 41 42.
Der notwendige Hautdurchtritt der Titan-Prothese ist allerdings naturgemäß eine Eintrittspforte für Bakterien, und es besteht somit die konstante Gefahr der Implantatinfektion bzw. Infektionen der Haut und des umliegenden Weichteilgewebes. Selbst in Zentren mit jahrzehntelanger Erfahrung werden Infektionsraten von bis zu 18 % in den ersten drei Jahren nach Implantation berichtet 43.
Aufgrund der hohen Infektionsgefahr dieser Implantat-Systeme wurden auch subkutan gelegene osseointegrierte Implantate entwickelt 44 45. Diese haben das Ziel, die verloren gegangenen Humerus-Kondylen nachzubilden, um eine suffiziente und rotationsstabile Stumpf-Prothesen-Verbindung zu schaffen. Diese Systeme kommen zwar ohne Hautdurchtritt aus, sind aber aufgrund des Weichteils über dem Implantat in Bezug auf konstante Belastung limitiert.
Diskussion
Die stetige Weiterentwicklung im Bereich der Prothetik stellt auch immer größere Anforderungen an die Stumpf-Prothesen-Anbindung. Mit den dargestellten Methoden und Konzepten zur chirurgischen Stumpfoptimierung kann ein bestmöglicher prothetischer Extremitätenersatz erreicht werden, um in weiterer Folge auch die Akzeptanz myoelektrischer Prothesen speziell bei hohen Amputationen der oberen Extremität zu steigern. Die verbesserte Stumpfqualität und dadurch stabilere Prothesenanbindung bei Amputationen an der oberen Extremität ist ebenso sinnvoll für den Einsatz mechanischer, zuggesteuerter oder auch Hybridprothesen.
Diese komplexe prothetische Rekonstruktion bei hoher Amputation der oberen Extremität benötigt eine funktionierende interdisziplinäre Zusammenarbeit verschiedener Disziplinen wie Plastischer Chirurgie, Orthopädie, Physiotherapie und Physikalischer Medizin, Technik und Orthopädie-Technik, aber auch der Klinischen Psychologie. An der Medizinischen Universität Wien ist hierfür ein eigenes Zentrum (Christian Doppler Labor für Wiederherstellung von Extremitätenfunktionen) geschaffen worden, das aus einem ca. 15-köpfigen Team besteht, um solch aufwendige Therapien anbieten zu können. Somit sollte die komplexe Rekonstruktion mit den oben vorgestellten Methoden von Zentren durchgeführt werden, die über entsprechende personelle, aber auch infrastrukturelle Ressourcen verfügen.
Für die Autoren:
Univ.-Prof. Dr. Oskar C. Aszmann
Leiter des Christian Doppler Labors für Wiederherstellung von Extremitätenfunktionen, Abteilung für Plastische und Rekonstruktive Chirurgie, Universitätsklinik für Chirurgie,
Medizinische Universität Wien
Währinger Gürtel 18–20
A‑1090 Wien, Österreich
oskar.aszmann@meduniwien.ac.at
Begutachteter Beitrag/reviewed paper
Salminger S, Mayer JA, Sturma A, Bergmeister KD, Riedl O, Aszmann O. C. Plastisch-chirurgische Verfahren zur Verbesserung der Stumpfqualität. Orthopädie Technik, 2016; 67 (7): 40–44
| Zielmuskeln/Signalgeber | Nerv | Pothesen-Funktion |
|---|---|---|
| M. biceps caput longum | N. musculocutaneus | Ellenbogen-Flexion |
| M. biceps caput breve | N. ulnaris | Hand schließen |
| M. brachialis | N. medianus | Pronation |
| M. triceps caput longum/mediale | N. radialis | Ellenbogen-Extension |
| M. triceps caput laterale | geteilter Ramus prof. N. radialis | Hand öffnen |
| M. brachioradialis | geteilter Ramus prof. N. radialis | Supination |
| Zielmuskeln/Signalgeber | Nerv | Pothesen-Funktion |
|---|---|---|
| M. pectoralis major Pars clavicularis | N. musculocutaneus | Ellenbogen-Flexion |
| M. pectoralis minor | N. ulnaris | Hand schließen |
| M. pectoralis major Pars sternocostalis | N. medianus | Umwendbewegung |
| M. pectoralis major Pars abdominalis | N. medianus | Umwendbewegung |
| M. latissimus dorsi | N. radialis | Ellenbogen-Extension |
| M. infraspinatus | Ramus prof. N. radialis | Hand öffnen |
- Dynamische Hüftabduktions-Lagerungsorthese zur Behandlung pathologisch veränderter Hüften bei neuromuskulären Erkrankungen in der Kinderorthopädie — 5. Juni 2025
- Ein neuronal gesteuertes Exoskelett in der Therapie von Patientinnen und Patienten mit Querschnittlähmung — 5. Juni 2025
- Digitale Wunddokumentation: Warum Papier keine Option mehr ist — 5. Juni 2025
- Salminger S, Sturma A, Herceg M, et al. Prothetische Rekonstruktion hoher Amputationen der oberen Extremität [Prosthetic reconstruction in high amputations of the upper extremity]. Orthopäde, 2015; 44 (6): 413–418. doi: 10.1007/s00132-015‑3113‑0
- Aszmann OC, Roche AD, Salminger S, et al. Bionic reconstruction to restore hand function after brachial plexus injury: a case series of three patients. Lancet, 2015; 385 (9983): 2183–2189. doi: 10.1016/ S0140-6736(14)61776–1
- Kuiken TA, Dumanian GA, Lipschutz RD, et al. The use of targeted muscle reinnervation for improved myoelectric prosthesis control in a bilateral shoulder disarticulation amputee. Prosthet Orthot Int, 2004; 28: 245–53
- Salminger S, Sturma A, Herceg M, et al. Prothetische Rekonstruktion hoher Amputationen der oberen Extremität [Prosthetic reconstruction in high amputations of the upper extremity]. Orthopäde, 2015; 44 (6): 413–418. doi: 10.1007/s00132-015‑3113‑0
- Salminger S, Roche AD, Hruby LA, et al. Prosthetic reconstruction to restore function in transcarpal amputees. J Plast Reconstr Aesthet Surg, 2016; 69 (3): 305–310. doi: 10.1016/j.bjps.2015.10.029
- Mixter RC, Rao VK, De Angelis A, Donald CE. Salvage of proximal humeral amputations with a remnant forearm flap. Plast Reconstr Surg, 1991; 87: 965–968
- De Luccia N, Marino HL. Fitting of electronic elbow on an elbow disarticulated patient by means of a new surgical technique. Prosthet Orthot Int, 2000; 24: 247–251
- Neusel E, Traub M, Bläsius K, Marquardt E. Results of humeral stump angulation osteotomy. Arch Orthop Trauma Surg, 1997; 116: 263–265
- Salminger S, Sturma A, Herceg M, et al. Prothetische Rekonstruktion hoher Amputationen der oberen Extremität [Prosthetic reconstruction in high amputations of the upper extremity]. Orthopäde, 2015; 44 (6): 413–418. doi: 10.1007/s00132-015‑3113‑0
- Aszmann OC, Dietl H, Frey M. Selektive Nerventransfers zur verbesserten Steuerung myoelektrischer Armprothesen [Selective nerve transfers to improve the control of myoelectrical arm prostheses]. Handchir Mikrochir Plast Chir, 2008; 40 (1): 60–65. doi: 10.1055/s‑2007–989415
- Kuiken TA, Dumanian GA, Lipschutz RD, et al. The use of targeted muscle reinnervation for improved myoelectric prosthesis control in a bilateral shoulder disarticulation amputee. Prosthet Orthot Int, 2004; 28: 245–53
- Aszmann OC, Dietl H, Frey M. Selektive Nerventransfers zur verbesserten Steuerung myoelektrischer Armprothesen [Selective nerve transfers to improve the control of myoelectrical arm prostheses]. Handchir Mikrochir Plast Chir, 2008; 40 (1): 60–65. doi: 10.1055/s‑2007–989415
- Salminger S, Sturma A, Herceg M, et al. Prothetische Rekonstruktion hoher Amputationen der oberen Extremität [Prosthetic reconstruction in high amputations of the upper extremity]. Orthopäde, 2015; 44 (6): 413–418. doi: 10.1007/s00132-015‑3113‑0
- Sturma A, Herceg M, Bischof B, et al. Advanced Rehabilitation for Amputees after Selective Nerve Transfers: EMG-Guided Training and Testing. In: Jensen W, Andersen OK, Akay M (eds). Replace, Repair, Restore, Relieve – Bridging Clinical and Engineering Solutions in Neurorehabilitation. Proceedings of the 2nd International Conference on Neurorehabilitation (ICNR2014), Aalborg, 24–26 June, 2014: 169–177
- Salminger S, Sturma A, Herceg M, et al. Prothetische Rekonstruktion hoher Amputationen der oberen Extremität [Prosthetic reconstruction in high amputations of the upper extremity]. Orthopäde, 2015; 44 (6): 413–418. doi: 10.1007/s00132-015‑3113‑0
- Odier L. Manuel de médecine-pratique. 2ème edition. Paris: J. J. Paschoud, 1811
- Salminger S, Sturma A, Herceg M, et al. Prothetische Rekonstruktion hoher Amputationen der oberen Extremität [Prosthetic reconstruction in high amputations of the upper extremity]. Orthopäde, 2015; 44 (6): 413–418. doi: 10.1007/s00132-015‑3113‑0
- Dellon AL, Mackinnon SE. Treatment of the painful neuroma by neuroma resection and muscle implantation. Plast Reconstr Surg, 1986; 77: 427–438
- Herndon JH, Eaton RG, Littler JW. Management of painful neuromas in the hand. J Bone Joint Surg Am, 1976; 58: 369–373
- Wu J, Chiu DT. Painful neuromas: a review of treatment modalities. Ann Plast Surg, 1999; 43: 661–667
- Salminger S, Riedl O, Bergmeister K, Aszmann OC. Immediate and secondary reconstruction of iatrogenic nerve lesions. Chir Prax, 2014; 78: 625–637
- Aszmann OC, Korak KJ, Rab M, et al. Neuroma prevention by endto-side neurorraphy: an experimental study in rats. J Hand Surg Am, 2003; 28: 1022–1028
- Aszmann OC, Moser V, Frey M. Die Behandlung chronisch schmerzhafter Neurome mittels End-zu-Seit Neurorraphie [Treatment of painful neuromas via end-to-side neurorraphy]. Handchir Mikrochir Plast Chir, 2010; 42 (4): 225–232. doi: 10.1055/s‑0030–1255053
- Flor H, Elbert T, Knecht S, et al. Phantom-limb pain as a perceptual correlate of cortical reorganization following arm amputation. Nature, 1995; 375: 482–484. doi: 10.1038/375482a0
- Mixter RC, Rao VK, De Angelis A, Donald CE. Salvage of proximal humeral amputations with a remnant forearm flap. Plast Reconstr Surg, 1991; 87: 965–968
- Pinsolle V, Tessier R, Casoli V, et al. The pedicled vascularised scapular bone flap for proximal humerus reconstruction and short humeral stump lengthening. J Plast Reconstr Aesthet Surg, 2007; 60: 1019- 1024. doi: 10.1016/j.bjps.2007.03.028
- Aitken GT. Surgical amputation in children. J Bone Joint Surg Am, 1963; 45: 1735–1741
- Marquardt E. Plastische Operationen bei drohender Knochendurchspießung am kindlichen Oberarmstumpf [Plastic surgery in imminent bone perforation at the infantile humerus stump. Preliminary report]. Z Orthop Ihre Grenzgeb, 1976; 114 (4): 711–714
- Pfeil J, Marquardt E, Holtz T, et al. The stump capping procedure to prevent or treat terminal osseous overgrowth. Prosthet Orthot Int, 1991; 15: 96–99
- Marquardt E, Neff G. The angulation osteotomy of above-elbow stumps. Clin Orthop Relat Res, 1974; (104): 232–238
- Neusel E, Traub M, Bläsius K, Marquardt E. Results of humeral stump angulation osteotomy. Arch Orthop Trauma Surg, 1997; 116: 263–265
- Neusel E, Traub M, Bläsius K, Marquardt E. Results of humeral stump angulation osteotomy. Arch Orthop Trauma Surg, 1997; 116: 263–265
- Neusel E, Traub M, Bläsius K, Marquardt E. Results of humeral stump angulation osteotomy. Arch Orthop Trauma Surg, 1997; 116: 263–265
- Vavylov VN, Kalakutsky NV, Agrachyova IG. Reconstruction of very short humeral stumps. Ann Plast Surg, 1994; 32: 145–147
- Pinsolle V, Tessier R, Casoli V, et al. The pedicled vascularised scapular bone flap for proximal humerus reconstruction and short humeral stump lengthening. J Plast Reconstr Aesthet Surg, 2007; 60: 1019- 1024. doi: 10.1016/j.bjps.2007.03.028
- Vavylov VN, Kalakutsky NV, Agrachyova IG. Reconstruction of very short humeral stumps. Ann Plast Surg, 1994; 32: 145–147
- Weiland AJ. Current concepts review: vascularized free bone transplants. J Bone Joint Surg Am, 1981; 63: 166–169
- Yajima H, Tamai S, Ono H, Kizaki K. Vascularized bone grafts to the upper extremities. Plast Reconstr Surg, 1998; 101: 727–735; discussion 736–737
- Capanna R, Manfrini M, Ceruso M, et al. A new technique for reconstruction of large metadiaphyseal bone defects: a combined graft (allograft shell plus vascularized fibula), preliminary results. In: Brown KLB (ed.). Complications of limb salvage. Prevention, Management and Outcome. 6th International Symposium on Limb Salvage (ISOLS), Montreal, September 8–11, 1991. Montreal (Canada), 1991: 319–321
- Brånemark PI, Albrektsson T. Titanium implants permanently penetrating human skin. Scand J Plast Reconstr Surg, 1982; 16: 17–21
- Brånemark R, Brånemark PI, Rydevik B, Myers RR. Osseointegration in skeletal reconstruction and rehabilitation: a review. J Rehabil Res Dev, 2001; 38 (2):175–181
- Kang NV, Pendegrass C, Marks L, Blunn G. Osseocutaneous integration of an intraosseous transcutaneous amputation prosthesis implant used for reconstruction of a transhumeral amputee: case report. J Hand Surg Am, 2010; 35: 1130–1134. doi: 10.1016/j.jhsa.2010.03.037
- Tillander J, Hagberg K, Hagberg L, Brånemark R. Osseointegrated titanium implants for limb prostheses attachments: infectious complications. Clin Orthop Relat Res, 2010; 468: 2781–2788. doi: 10.1007/ s11999-010‑1370‑0
- Witsø E, Kristensen T, Benum P, et al. Improved comfort and function of arm prosthesis after implantation of a Humerus-T-Prosthesis in trans-humeral amputees. Prosthet Orthot Int, 2006; 30: 270–278. doi: 10.1080/03093640600605013
- Gradischar A, Skiera R. Einsatz von subkutanen Implantaten zur Verbesserung der Anbindung von Oberarmprothesen. Orthopädie Technik, 2007; 58 (1): 22–27