Einleitung
Bei der Multiplen Sklerose (MS) handelt es sich um die häufigste autoimmune chronisch-entzündliche Erkrankung des zentralen Nervensystems (ZNS). MS zerstört primär die Myelinschicht der Axone (axonale Schädigung) im zentralen Nervensystem. Sie tritt zu Beginn normalerweise in Schüben (RRMS, „relapsing remitting multiple sclerosis“) auf und kann sich später progredient (SPMS, „secondary progressive multiple sclerosis“) entwickeln; dies bedeutet, dass der Patient eine stetig schleichende Verschlechterung der Symptomatik bemerkt. Aktuell erkranken in Deutschland jedes Jahr etwa 12.600 neue Patienten an Multipler Sklerose, die Gesamthäufigkeit liegt bei ca. 224.000 Patienten. Frauen sind deutlich häufiger von MS betroffen als Männer, wobei eine exakte Bestimmung von Ursachen und Verlaufsformen bis heute nicht eindeutig ist 1 2 3 4.
Eine aktuelle Untersuchung an Versorgungsdaten aus Bayern prognostiziert auch für die kommenden Jahrzehnte weiter steigende Prävalenzen 5. Inwieweit diesem Anstieg eine tatsächliche Zunahme der Erkrankungen zugrunde liegt oder verbesserte diagnostische Kriterien, die eine frühere Diagnose erlauben, ist unklar. Der wachsende Anteil von Patienten mit Multipler Sklerose (PwMS) bei gleichzeitig signifikanter Steigerung der „Disability-Adjusted Life-Years“ 6 (der gesunden Lebensjahre – also die Zeit, in der die Patienten keine oder nur wenig Einschränkungen erfahren) führt nicht nur zu einer erhöhten Therapienachfrage, sondern ebenfalls zu einer Zunahme gesundheitsökonomischer Belastungen 7. Dennoch sind die Ausgaben für Heil- und Hilfsmittel im Vergleich zu anderen Leistungsbereichen der GKV marginal: Im Jahr 2018 betrugen sie lediglich 3,73 % bzw. 3,35 % und stellen nach wie vor keineswegs einen primär kostentreibenden Faktor im Gesundheitswesen dar 8 9.
Gangstörung und eingeschränkte Mobilität
Funktionelle Bedeutung
Gangstörungen und Mobilitätseinschränkungen bedingen verringerte Alltagsaktivitäten, schränken die berufliche Leistungsfähigkeit ein und werden von Patienten als hoch relevantes Problem der MS bezeichnet 10. Nach der aktualisierten Auswertung des MS-Registers der DMSG leiden 52,3 % der untersuchten Patienten unter Gangschwierigkeiten und 49,9 % unter Fatigue 11.
Therapieziele
Zu den Therapiezielen gehören die Steigerung von Gehfähigkeit, Gehgeschwindigkeit, Ausdauer, Gangsicherheit und Balance, Reduktion des Sturzrisikos und Verbesserung von Alltagsaktivitäten und Lebensqualität 12.
Ganganalyse
Personen mit MS (PwMS) zeigen als funktionelles Hauptproblem im Alltag vor allem Paresen als Minussymptomatik des UMNS („upper motor neuron syndrom“ = Schädigung des 1. Motoneurons). Die Plussymptomatik stellt die Spastik dar, die sich bei MS als Reflexsteigerung oder auch als Klonus zeigt. Funktionell nimmt die Plussymptomatik (Spastik) gerade für den Gang eine eher untergeordnete Rolle ein, im Gegenteil, oft kompensiert die Plussymptomatik bei Transfers und beim Gehen die Schwächen (Minussymptomatik).
Der Fußheber ist ein Muskel, der früh bei MS betroffen ist. Im Alltag zeigt sich dies durch Stolpern oder auch Hängenbleiben der Fußspitze. Bedingt durch die Fatigability kann sich dies auch erst nach einer längeren Gehstrecke zeigen. Später ist der Hüftbeuger oft stark mitbetroffen. Dies bedeutet, dass PwMS häufig Probleme in der Spielbeinphase haben, wenn Fußheber und Hüftbeuger zusammenarbeiten müssen. Beim Gehen bedeutet dies, dass die Fußheberschwäche nicht mit einem vermehrten Anheben des Beines kompensiert werden kann, da der Hüftbeuger auch mitbetroffen ist. Deshalb haben viele MS-Patienten beim Gehen Schwierigkeiten, das Bein nach vorne zu bringen. Dies führt wiederum dazu, dass diese MS-Patienten den Stock auf der Seite des mehrbetroffenen Beines einsetzen, um das „Nachvorne-Schwingen“ des Beines zu unterstützen.
Gerade hier kann durch die Hilfe einer funktionellen Elektrostimulation (FES) des Fußhebers die fehlende Kompensationsmöglichkeit durch die Schwäche des Hüftbeugers kompensiert werden. Denn normalerweise wird eine Schwäche des Fußhebers durch eine vermehrte Hüftflexion kompensiert (sogenannter Steppergang). Oder anders ausgedrückt führt die funktionelle Kombination von Fußheberschwäche und Hüftbeugerschwäche zu einer Potenzierung der Probleme. Häufig erzielt man durch eine gezielte Anwendung der FES, dass das Bein leichter vorgeschwungen werden kann. Dies wiederum führt dazu, dass die Patienten wieder mehr und weitere Strecken gehen und so ihre Gangausdauer und die geschwächte Muskulatur weiter trainieren. Außerdem kann die FES an die Fatigability angepasst werden, indem die Stimulation an die Ermüdung der Muskulatur adaptiert wird.
Wichtigstes Ziel bei der orthetischen Versorgung von MS-Betroffenen ist es, kein Gewicht in Form einer Orthese an das paretische Bein zu bringen. Deshalb sind die modernen FES-Systeme auch extrem leicht, in etwa vergleichbar mit Fußheberbandagen. Außerdem ist es entscheidend, wie distal das Gewicht am Bein/Hebel angebracht ist. Je distaler das Gewicht, desto schwerer wirkt es sich aus. Gerade ein distales Gewicht kann sich bei PwMS schon bei wenigen Gramm negativ auswirken und so das Gehen eher erschweren als optimieren. Dies kann dazu führen, dass MS-Betroffene die verordneten Orthesen nicht nutzen, da sie keinen Benefit von einer AFO („ankle foot orthosis“) erfahren. Wiegt die Orthese auch nur wenig, so muss doch der Patient bei jedem Schritt dieses zusätzliche distale Gewicht nach vorne bringen. Dies ist bei einem bestehenden Problem in der Spielbeinphase durch die zusätzliche Schwäche des Hüftbeugers sehr erschwert, und so verbessert die Orthese das Gehen nicht, sondern erschwert es sogar. Zusätzlich leiden die PwMS häufig wie erwähnt noch an Fatigability, der belastungsabhängigen motorischen Verschlechterung des Gehens. Durch ein Gewicht in Form einer Orthese kann diese verstärkt auftreten. Dies führt zu noch schnellerer Ermüdung insbesondere der Hüftbeugemuskulatur und funktionell zu einer deutlichen Verschlechterung des Gehens.
Weitere Muskeln, die bei MS häufig abgeschwächt sind, sind der M. quadriceps und die Wadenmuskulatur. Die Funktion dieser Muskeln ist jedoch für das Gehen essenziell. Im physiologischen Gang erfolgt der „initial contact“ mit der Ferse. Dadurch verläuft der Belastungsvektor bei „loading response“ hinter dem Kniegelenk und erzeugt so ein kniebeugendes Moment, welches durch den Quadrizeps exzentrisch kompensiert werden muss. Ist der Fußheber geschwächt, erfolgt der „initial contact“ mit dem Vorfuß, wodurch der Belastungsvektor vor dem Kniegelenk liegt, somit kniestreckend wirkt und ein Genu recurvatum begünstigt. Wird nun der Fußheber mittels FES stimuliert, erfolgt der „initial contact“ wieder mit der Ferse, und die exzentrische Aktivität des Quadrizeps wird wieder erforderlich. Bei einer Schwäche des Quadrizeps kann auch hier an eine elektrische Stimulation mit einem sogenannten FES-Plus-System gedacht werden. Am häufigsten profitieren die Betroffenen von einer Aktivierung des Tibialis anterior von „preswing“ bis „loading response“ und einer Aktivierung des M. quadriceps bei „loading response“ und früher „mid stance“. Der Einsatz von knieübergreifenden KAFOs („knee ankle foot orthoses“) muss sehr differenziert betrachtet werden, damit diese nicht wiederum deutlich vermehrtes Gewicht bedeuten. Sicherlich gibt es neue Entwicklungen, die hier eine Alternative in Einzelfällen darstellen können. Auch muss die Zielsetzung betrachtet werden: Soll die KAFO das Gehen optimieren oder als Steh- bzw. Aufstehmöglichkeit eingesetzt werden?
Im Gegensatz zur rein mechanisch wirkenden Orthese, die nur die Auswirkungen der muskulären Schwäche kompensiert, wird beim FES-System die funktionelle Ursache des Gangproblems, nämlich der abgeschwächten Fußheber, physiologisch über das intakte 2. Motoneuron aktiviert.
Eine interessante Neuentwicklung kann die Verwendung des „Incedo“-Systems (Nordic-NeuroSTIM ApS, Aalborg, Dänemark) bei MS sein. Dieses System aktiviert den Flexorenreflex und kann somit effektiv die Spielbeinphase unterstützen. Allerdings gibt es bis jetzt noch keine Erfahrungen mit MS-Betroffenen.
Fatigue – Definition und funktionelle Bedeutung
Unter Fatigue versteht man eine erhöhte Erschöpfbarkeit, die von den Betroffenen als abnorme Müdigkeit und Energiemangel erlebt wird. Sie kann entweder dauerhaft vorhanden sein („fatigue“) oder sich im Tagesverlauf entwickeln bzw. verstärken und eine mentale und/oder körperliche Komponente („fatigability“) aufweisen 13. Typischerweise wird die Fatigue bei Wärmeeinwirkung bzw. Anstrengung verstärkt („Uhthoff-Phänomen“). Die Fatigue kann bereits frühzeitig im Krankheitsverlauf auftreten 14 und ist unabhängig von der körperlichen Behinderung 15. Die Prävalenz wird mit bis zu 90 % angegeben 16. Die Fatigue ist ein vielschichtiges Symptom mit somatisch-psychischen, primär physischen, kognitiven und psychosozialen Aspekten. Sie führt zu erheblichen Beeinträchtigungen in Alltag und Beruf und ist eine wesentliche Ursache für vorzeitige Erwerbsunfähigkeit 17. Wichtig für die funktionelle Verbesserung des Gehens ist es, die motorische Fatigue oder nach Kluger 18 besser die Fatigability zu erkennen und dann adäquat und wirkungsvoll zu therapieren. Die Fatigability äußert sich in einer deutlichen, merkbaren und sichtbaren Verschlechterung des Gehens nach Belastung. Dies kann jedoch effektiv verbessert werden. Zum einen sollte man eine Verstärkung der Fatigability durch das Uhthoff-Phänomen vermeiden. Hier hilft jede Art von Kühlung 19, z. B. mit Kühlwesten (Abb. 1). Zum anderen kann nachhaltig und langfristig die Gangausdauer 20 sehr gut trainiert 21 werden, damit die Fatigability nicht so früh einsetzt und damit das Gehen länger und qualitativ besser möglich ist. Dies erfolgt mit einem Gangintervalltraining. Beim Training kann die FES einen wichtigen Beitrag leisten, indem diese, je nach motorischer Ermüdung (Fatigability), die Stimulation anpasst bzw. verstärkt und damit der Verschlechterung des Gangbildes vorbeugen kann. Dies führt wiederum dazu, dass sich die PwMS länger und ausdauernder belasten und somit gezielt und funktionell u. a. das Gehen trainieren. Langfristig wird dies zu einer Verbesserung der Gangausdauer, Ganggeschwindigkeit und Gangsicherheit führen 22.
Therapie- und Trainingsempfehlungen
Ein aktuelles Cochrane-Review 23 unterstreicht einmal mehr die Notwendigkeit strukturierter und multidisziplinärer Rehabilitationsprogramme für PwMS. Mit gezielten Inhalten zu Bewegung und körperlicher Aktivität lassen sich
- Mobilität,
- Muskelkraft,
- aerobe Kapazität und
- Lebensqualität
nachweislich verbessern. Die passenden Trainingsformen mit den jeweiligen mobilitätsbezogenen Outcomes finden sich im Detail in der aktuellen S2e-Leitlinie der DGNR in Zusammenarbeitmit Physio Deutschland 24. Die wichtigsten Empfehlungen lauten:
- Vorrangig sollte ein regelmäßiges, therapeutisch angeleitetes Gangtraining stattfinden.
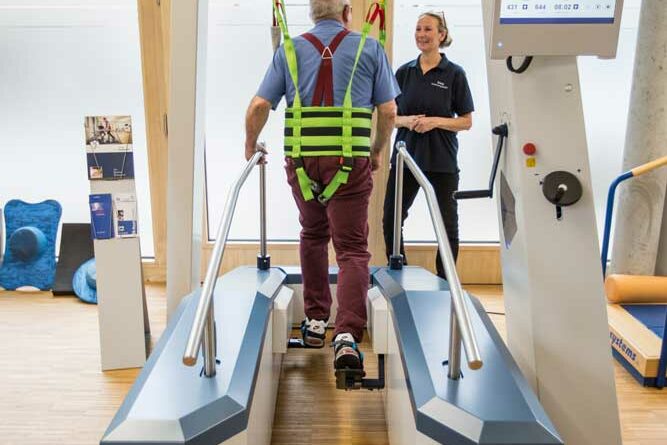
- Unterstützend sollte ein systematisches Ausdauertraining mittels eines Laufbands (Abb. 2), Ergometer, Gehen und gezieltes Krafttraining für Fußheber, Hüftbeuger, Wadenmuskulatur und Quadrizeps (Abb. 3) durchgeführt werden.
- Für schwer Betroffene (EDSS-Skala bzw. Expanded Disability Status Scale > 6) sollte ein roboterassistiertes Gangtraining eingesetzt werden (Abb. 4).
- Regelmäßige Physiotherapie sollte immer funktionell, ziel- und alltagsorientiert auf die bestehenden Beeinträchtigungen ausgerichtet sein.
- Individualisierte Trainingsprogramme verbessern nachweislich Fitness, Funktionsfähigkeit und Lebensqualität 25 26.
Konsequent umgesetzt, führt die Kombination gezielter Therapie- und Trainingsinhalte zu Verbesserungen von Gleichgewicht, Muskelkraft, Gang und Gangausdauer 27 28. Dennoch gibt es nach wie vor eine große Anzahl von PwMS, die Alltagstraining und Bewegung meiden. Als Gründe gelten primär der fehlende Transfer von Forschungsergebnissen in die Praxis, insbesondere aber auch ein gezielter Schulungsbedarf für Patienten und Therapeuten 29.
Therapieunterstützung durch Hilfsmittel 30
Zeitgemäße FES-Systeme (Abb. 5) verbinden neueste medizinisch-technische Errungenschaften mit therapeutischem Know-how und bieten in der Versorgung von PwMS besondere Perspektiven. Sie werden direkt am Körper getragen, können je nach Bedarf vom Patienten und Therapeuten ein- oder ausgeschaltet oder die Stimulation verstärkt werden und sollen sowohl in der stationären und ambulanten Rehabilitation als auch in der ambulanten Physiotherapie eingesetzt werden. Sie sind aber primär für den alltäglichen Gebrauch gedacht. Durch eine echtzeitgenaue Gangerkennung wird unmittelbar vor der Schwungphase ein Stimulationsimpuls gesendet, der einen sicheren und aktiven Bewegungsablauf gewährleistet und das Gehen nachhaltig verbessern kann. Allerdings muss dieser Impuls gekonnt und individuell an den Gang des Patienten angepasst werden. Hier sind kompetente und erfahrene Orthopädietechniker gefragt, die idealerweise zusammen mit den Therapeuten und dem Patienten die Erprobung und Anpassung durchführen. So konnte bei PwMS eine signifikante Reduktion der wahrgenommenen Anstrengung beim Gehen sowie eine deutliche Verbesserung der Lebensqualität nachgewiesen werden 31 32 33. Insbesondere unter dem Aspekt der Teilhabe zeigt eine gut eingestellte FES einen deutlichen Mehrwert im Vergleich zum bewährten Versorgungsstandard mit Orthesen. Allerdings bedingt sie von Anfang an eine präzise Patientenauswahl 34. FES ist dann ideal für die krankheitsspezifischen, funktionellen Gangprobleme bei PwMS. Folgende Gütekriterien sollte ein sicheres FES-System vorweisen:
- ausbalancierte Dorsalextension und Eversion;
- separate Ansteuerung von N. peroneus communis und N. tibialis, ebenfalls für eine saubere Fußhebung;
- absolut zuverlässige 3D-Bewegungsdetektion mittels Gyroskops und Accelerometers;
- einfache Repositionierung und kurze Rüstzeit;
- Möglichkeit, durch einfache Impulsverstärkung auf die motorische Fatigue (Fatigability) einzugehen;
- integrierte Assessments (z. B. 10-Meter-Gehtest) zur Dokumentation;
- Upgrade-Option für ein Oberschenkelmodul zur Vermeidung einer Hyperextension im Kniegelenk (z. B. bei Voranschreiten des Krankheitsbildes);
- Trainingsmodus für ein aktives und gezieltes Training des Fußhebers.
Da funktionell gesehen PwMS häufig besonders Probleme in der „swing phase“ haben, profitieren diese in besonderem Maße von FES, da die funktionelle Elektrostimulation besonders effektiv in der „swing phase“ und am Beginn der „stand phase“ unterstützen kann, hier besonders in „initial contact“ und „loading response“. Die Problematik der Hüftbeugerschwäche, die sich ebenfalls in der Spielbeinphase bemerkbar macht (das Bein kann nur schwer nach vorne gebracht werden), kann durch die FES ebenfalls positiv beeinflusst werden. Hier hilft die FES indirekt, indem sie den Fußheber unterstützt und damit der ohnehin schwache Hüftbeuger den Fußheber nicht mehr kompensieren muss. Zusätzlich kann gegen eine Schwäche des M. quadriceps in „loading response“ noch ein Plus-System eingesetzt werden und so auch Teile der Standbeinphase verbessert werden. Die Erfahrung zeigt, dass eine sensomotorische Einlage (Abb. 6) bei MS-Patienten zusätzlich einen wichtigen Beitrag zur Optimierung des Gehens und der Gangsicherheit leisten kann. Dies zeigt sich vor allem bei MS-Patienten mit ataktischen Symptomen. Neben der funktionellen Elektrostimulation können Orthesen eventuell ebenfalls einen Beitrag zur Verbesserung von Gangsicherheit und Lebensqualität leisten 35.
Allerdings müssen diese sehr leicht (Abb. 7) sein. Orthesen als distales Gewicht wirken wie schon erläutert bei PwMS eher kontraproduktiv, da der oft schwache Hüftbeuger kein zusätzliches Gewicht bewältigen kann und es so zu einer funktionellen Verschlechterung des Gangbildes kommen kann. Der Patient spürt eine deutliche Erschwerung des Beines und akzeptiert deshalb die Orthese häufig nicht. Eine umfangreiche Befragung betroffener Patienten zeigte auch, dass genauere Informationen zu Gebrauch und Handhabung von Orthesen sowie Verbesserungen in der Ästhetik wünschenswert wären 36.
Der Versorgung mit FES muss ein individuelles Patientenscreening vorausgehen, das u. a. mithilfe einer eindeutigen Video-Dokumentation (Treppe, Ebene, Rampe) den Mehrwert für den zu versorgenden Patienten zeigt. Sehr positiv ist, dass das Landessozialgericht Baden-Württemberg MS-Patienten eine FES zugesprochen hat 37 und somit die Kosten für FES für diese Patientengruppe von den Kostenträgern übernommen werden sollten.
Fazit
Gangverbesserung steht für viele PwMS im Vordergrund und gilt als eines der häufigsten Ziele bei MS. Dies kann nur mit einer zeitgemäßen Therapie und mit einem gezielten Training erfolgen, wie Gangtraining sowie spezifisches Krafttraining. Zusätzlich sollte eine kluge, individuelle und krankheitspezifische Hilfsmittelversorgung erfolgen, um das Gehen optimal zu unterstützen. Gerade FES mit und ohne Oberschenkel-Anlage stellt das ideale Hilfsmittel für PwMS dar, ggf. kombiniert mit einer sensomotorischen Einlage, um auch die Standbeinphase zu optimieren. Dabei ist die FES nicht nur als Hilfsmittel einzuordnen, sondern mit FES kann auch sehr gezielt Muskulatur und Ausdauer trainiert werden, und es sollte gerade auch in der Therapie, z. B. Laufbandtherapie, mit eingesetzt werden (Abb. 8). Da die Systeme auch über einen Trainingsmodus verfügen, kann der Patient auch im Eigentraining seine Muskulatur in einem effektiven und gezielten Kraftausdauertraining weiter beüben. Idealerweise wird mit FES im Alltag und in der Therapie trainiert und durch FES das Gehen und somit die Partizipation des Patienten enorm verbessert.
Das Gütekriterium, an dem sich die Versorgungsqualität messen lässt, ist u. a. die Compliance der Patienten. Letztendlich sollte das Hilfsmittel seitens der PwMS auch adäquat genutzt werden, um Aktivität und Teilhabe so lange wie möglich zu gewährleisten, und es muss außerdem in der Lage sein, die Partizipation langfristig und nachhaltig zu verbessern.
Die Autoren:
Sabine Lamprecht, M. Sc.
Hans Lamprecht
Physiotherapeuten
Geschäftsführende Gesellschafter
HSH Lamprecht GbR
Otto-Ficker-Straße 2
73230 Kirchheim/Teck
info@hsh-lamprecht.de
Begutachteter Beitrag/reviewed paper
Lamprecht S, Lamprecht H. Spezifische Ganganalyse bei MS und daraus resultierende optimale Orthesenversorgung, im Besonderen der Einsatz von FES. Orthopädie Technik, 2021; 72 (3): 16–22
- Dynamische Hüftabduktions-Lagerungsorthese zur Behandlung pathologisch veränderter Hüften bei neuromuskulären Erkrankungen in der Kinderorthopädie — 5. Juni 2025
- Ein neuronal gesteuertes Exoskelett in der Therapie von Patientinnen und Patienten mit Querschnittlähmung — 5. Juni 2025
- Digitale Wunddokumentation: Warum Papier keine Option mehr ist — 5. Juni 2025
- Flachenecker P, Zettl UK. Krankheitsverlauf und Prognose. In: Schmidt RM et al. (Hrsg.). Multiple Sklerose. München und Jena: Urban & Fischer/Elsevier, 2015: 59–68
- Zheleznyakova GY et al. Epigenetic research in multiple sclerosis: progress, challenges, and opportunities. Physiol Genomics, 2017; 49 (9): 447–461
- Holstiege J et al. Epidemiologie der Multiplen Sklerose – eine populationsbasierte deutschlandweite Studie. Zentralinstitut für die kassenärztliche Versorgung in Deutschland (Zi). Versorgungsatlas-Bericht Nr. 17/09. Berlin: Zi, 2017.https://www.versorgungsatlas.de/themen/alle-analysennach-datum-sortiert/?tab=6&uid=86 (Zugriff am 06.12.2020)
- Lamprecht S, Böing T. Therapeutische Aspekte zur Hilfsmittelversorgung von Patienten mit Multipler Sklerose. Neurol Rehabil, 2020; 26 (3): 179–184
- Daltrozzo T et al. A systematic assessment of prevalence, incidence and regional distribution of multiple sclerosis in Bavaria from 2006 to 2015. Front Neurol, 2018; 8: 871
- Flachenecker P, Zettl UK. Krankheitsverlauf und Prognose. In: Schmidt RM et al. (Hrsg.). Multiple Sklerose. München und Jena: Urban & Fischer/Elsevier, 2015: 59–68
- Flachenecker P et al. New insights into the burden and costs of multiple sclerosis in Europe: Results for Germany. Mult Scler, 2017; 23 (2): 78–90
- Lamprecht S, Böing T. Therapeutische Aspekte zur Hilfsmittelversorgung von Patienten mit Multipler Sklerose. Neurol Rehabil, 2020; 26 (3): 179–184
- GKV-Spitzenverband. Kennzahlen der gesetzlichen Krankenversicherung (2020). https://www.gkv-spitzenverband.de/media/grafiken/gkv_kennzahlen/kennzahlen_gkv_2019_q4/GKV_Kennzahlen_Booklet_Q4-2019_300dpi_2020-03–11.pdf (Zugriff am 02.04.2020)
- Rommer PS et al. Symptomatology and symptomatic treatment in multiple sclerosis: Results from a nationwide MS registry. Mult Scler, 2018. doi: 10.1177/1352458518799580
- Henze T et al. Neues zur symptomatischen MS-Therapie: Teil 5 – Fatigue. Nervenarzt, 2018; 89: 446–452
- Heine M, van de Port I, Rietberg MB, van Wegen EE, Kwakkel G. Exercise therapy for fatigue in multiple sclerosis. Cochrane Database Syst Rev, 2015 Sep 11; (9): CD009956. doi: 10.1002/14651858.CD009956.pub2. PMID: 26358158
- Flachenecker P, Meissner H. Fatigue in multiple sclerosis presenting as acute relapse: subjective and objective assessment. Mult Scler, 2008; 14: 274–277
- Flachenecker P et al. „Fatigue“ bei multipler Sklerose: Entwicklung und Validierung des „Würzburger Erschöpfungs-Inventar bei Multiper Sklerose“ (WEIMuS). Nervenarzt, 2006; 77: 165–172
- Kluger BM et al. Fatigue and fatigability in neurologic illnesses: proposal for a unified taxonomy. Neurology, 2013; 80: 409–416
- Penner IK et al. The Fatigue Scale for Motor and Cognitive Functions (FSMC): validation of a new instrument to assess multiple sclerosis-related fatigue. Mult Scler, 2009; 15: 1509–1517
- Flachenecker P, Meissner H. Fatigue in multiple sclerosis presenting as acute relapse: subjective and objective assessment. Mult Scler, 2008; 14: 274–277
- Khan F, Amatya B. Rehabilitation in Multiple Sclerosis: A Systematic Review of Systematic Reviews. Arch Phys Med Rehabil, 2017; 98: 353–367
- Deutsche Gesellschaft für Neurologie e. V. (DGN). Angemeldetes Leitlinienvorhaben: S2k-Leitlinie „Diagnose und Therapie der Multiplen Sklerose, Neuromyelitis Optica Spektrum und MOG-IgG-assoziierte Erkrankungen“ (AWMF-Leitlinienregister Nr. 030–050). Stand: 24.9.2020: Konsultationsphase abgeschlossen, Finalfassung der Leitlinie in Erstellung. https://www.awmf.org/leitlinien/detail/anmeldung/1/ll/030–050.html (Zugriff am 01.02.2021)
- Deutsche Multiple Sklerose Gesellschaft. Multiple Sklerose: Drei Viertel der befragten Erkrankten haben einen schubförmigen Verlauf (13.03.2019). https://www. dmsg.de/multiple-sklerose-news/ms-forschung/multiplesklerose-drei-viertel-der-befragten-erkrankten-habeneinen-schubfoermigen-verlauf/ (Zugriff am 01.02.2021)
- Flachenecker P et al. Multiple Sklerose in Deutschland: aktualisierte Auswertungen des MS-Registers der DMSG 2014–2018.Fortschr Neurol Psychiatr, 2020; 88 (07): 436–445
- Tholen R et al. Bewegungstherapie zur Verbesserung der Mobilität von Patienten mit Multipler Sklerose. Konsensusfassung für die S2e-Leitlinie der DGNR in Zusammenarbeit mit Physio Deutschland – Deutscher Verband für Physiotherapie (ZVK) e. V. Neurol Rehabil, 2019; 25 (1): 3–40
- Amatya B, Khan F, Galea M. Rehabilitation for people with multiple sclerosis: an overview of Cochrane Reviews. Cochrane Database Syst Rev, 2019 Jan 14; 1 (1): CD012732. doi: 10.1002/14651858.CD012732.pub2
- Halabchi F et al. Exercise prescription for patients with multiple sclerosis; potential benefits and practical recommendations. BMC Neurology, 2017; 17 (1): 185. doi: 10.1186/s12883-017‑0960‑9
- Halabchi F et al. Exercise prescription for patients with multiple sclerosis; potential benefits and practical recommendations. BMC Neurology, 2017; 17 (1): 185. doi: 10.1186/s12883-017‑0960‑9
- Kim Y et al. Exercise Training Guidelines for Multiple Sclerosis, Stroke, and Parkinson Disease: Rapid Review and Synthesis. American Journal of Physical Medicine & Rehabilitation, 2019; 98 (7): 613–621
- Sangelaji B et al. A combined exercise model for improving muscle strength, balance, walking distance, and motor agility in multiple sclerosis patients: A randomized clinical trial. Iranian Journal of Neurology, 2016; 15 (3): 111–120
- Tallner A et al. Multiple sclerosis relapses are not associated with exercise. Multiple Sclerosis Journal, 2012; 18 (2): 232–235
- Kersten S et al. Zum Sport- und Bewegungsverhalten von Multiple Sklerose-Patienten – eine explorative Analyse. Aktuelle Neurologie, 2014; 41 (2): 100–106
- Lamprecht S, Böing T. Therapeutische Aspekte zur Hilfsmittelversorgung von Patienten mit Multipler Sklerose. Neurol Rehabil, 2020; 26 (3): 179–184
- Khurana SR et al. Perceived Exertion Is Lower When Using a Functional Electrical Stimulation Neuroprosthesis Compared With an Ankle-Foot Orthosis in Persons With Multiple Sclerosis: A Preliminary Study. Am J Phys Med Rehabil, 2017; 96 (3): 133–139
- Street T, Singleton C. Five-Year Follow-up of a Longitudinal Cohort Study of the Effectiveness of Functional Electrical Stimulation for People with Multiple Sclerosis. Int J MS Care, 2018; 20: 224–230
- Street T et al. Effectiveness of Functional Electrical Stimulation on Walking Speed, Functional Walking Category, and Clinically Meaningful Changes for People With Multiple Sclerosis. Arch Phys Med Rehabil, 2015; 96 (4):667–672
- Böing T. Ein Leitfaden zu Versorgungsoptionen bei Fußheberschwäche. Orthopädie Technik, 2019; 70 (3): 16–22
- Stevens V et al. Gait impairment and optimizing mobility in multiple sclerosis. Phys Med Rehabil Clin N Am, 2013; 24 (4): 573–592
- Swinnen Eet al. What is the opinion of patients with multiple sclerosis and their healthcare professionals about lower limb orthoses? A qualitative study using focus group discussions. NeuroRehabilitation, 2018; 42 (1): 81–92
- Hülsenbeck B. Krankenkassen müssen MS-Erkrankten Fußheber-System bezahlen (03 Jul [o. J.]). http://www.gesundheitsanwalt.de/krankenkassen-muessen-mserkrankten-fussheber-system-bezahlen (Zugriff am 01.02.2021)