Einleitung
In der aktuellen Schmerzforschung gibt es zunehmend Hinweise dafür, dass es bei persistierenden, chronischen Schmerzen zu einem Verlust der Wahrnehmung für taktile Stimuli (Charakterisierung und Lokalisation) kommt 1. Der Verlust der Tastschärfe geht mit einer Veränderung der kortikalen Repräsentation einher 2. Nachweisen lässt sich die veränderte kortikale Repräsentation durch eine vergrößerte Zweipunktediskrimination (ZPD) 3.
Unter kortikaler Repräsentation versteht man die Projektion des Körpers (sensomotorisch) sowie von Gedanken, Gefühlen, Einstellungen etc. durch neuronale Netzwerke auf verschiedene Gehirnareale. Im Vordergrund steht der primäre somatosensorische Kortex (S1), in dem bei Stimulation bestimmter Körperabschnitte Aktivitätsmuster wachgerufen werden. Veränderungen dieser Repräsentation auf dem somatosensorischen Kortex werden als kortikale Reorganisation bezeichnet 4. Das Ausmaß der kortikalen Reorganisation geht mit einer Zunahme der Schmerzintensität und einer Abnahme der Tastschärfe einher 5.
Flor et al. 6 führten bei armamputierten Patienten ein sensorisches Diskriminationsprogramm mittels transkutaner Nervenstimulation durch. Dabei wiesen sie nach, dass dieses Programm die Phantomschmerzen reduzieren und die kortikale Repräsentation normalisieren kann. Moseley et al. 7 sowie Moseley und Wiech 8 belegten in Studien mit Patienten, die unter einem komplexen regionalen Schmerzsyndrom (CRPS) litten, dass taktile Stimulation alleine keinen Effekt hatte, mittels Diskriminationstraining hingegen eine deutliche Schmerzlinderung und Verbesserung der ZPD erreicht werden konnte. Die Patienten in der Gruppe mit taktiler Stimulation erhielten durch zweierlei Tastsonden taktile Impulse. Die Patienten in der Gruppe mit Diskrimination mussten anhand eines Fotos ihrer betroffenen Hand aufzeigen, wo und womit sie stimuliert wurden.
Luomajoki und Moseley 9 verglichen bei Patienten mit unspezifischen chronischen Rückenschmerzen und Gesunden die Tastschärfe und die lumbosakrale motorische Kontrolle. Es zeigte sich, dass bei den Patienten im Vergleich zu den Gesunden die ZPD vergrößert und die motorische Kontrolle vermindert war. 50–90 % der Patienten mit Amputationen leiden an Phantommodalitäten 10 11. Dieser Begriff beinhaltet den Phantomschmerz, das ‑gefühl und die ‑sensation. Phantomschmerz wird als anhaltender Schmerz im amputierten Körperteil definiert. Eine Phantomsensation beschreibt eine einschießende, schmerzhafte Sensation, die nur wenige Sekunden anhält. In der englischsprachigen Literatur wird der Begriff der Phantomsensation definiert als jede Sensation des amputierten Glieds außer Schmerz 12. Nicht-schmerzhafte Wahrnehmungen wie Position oder Schwellung des amputierten Körperteils, die in der englischsprachigen Literatur als nicht-schmerzhafte Sensationen bezeichnet werden, sind im deutschsprachigen Raum als Phantomgefühl definiert 13 14.
Ungeklärt bleibt, ob Phantommodalitäten gleich oder ähnlich wie der CRPS-Schmerz auf die ZPD als Therapieintervention bezüglich kortikaler Reorganisation reagieren.
Fallbeschreibung/ Methodik
Ein 47-jähriger Patient litt nach einer traumatischen Oberarmamputation (Autounfall) links vor zehn Wochen unter allen drei Phantommodalitäten. Die Intensität des Phantomschmerzes betrug bei Befunderhebung mit der visuellen Analogskala (VAS) 4.125/10 (Mittelwert von 4 Messungen innerhalb 24 h). Die Intensität des Phantomgefühls betrug 4.5/10 und die der Phantomsensationen 3.75/10. Der Nachtschlaf war nicht gestört. Die durchschnittliche Intensität aller Phantommodalitäten betrug am Erhebungstag 4.13.
Die Medikation des Patienten bestand aus Dichloranilinophenyl (75 mg 1–0‑1–0) und Pregabalin (150 mg 1–0‑1–0). Die Stumpflänge betrug ca. 10 cm. Die Narbe war geschlossen, reizlos und gut verschieblich. Das Gewebe am Stumpfende war reizlos. Dorsal im Bereich der Spalthautdeckung waren noch etwas gerötete Stellen sichtbar. Im ventromedialen Bereich des Stumpfs war die Sensibilität leicht eingeschränkt (bei taktilem Stimulus ein leicht wattiges Gefühl), sonst überall intakt. Die Beweglichkeit des glenohumeralen Gelenkes und der scapulothorakale Rhythmus waren unauffällig.
Zur Erfassung der drei verschiedenen Phantommodalitäten wurde ein Schmerztagebuch mit einer VAS verwendet. Der Patient wurde aufgefordert, viermal täglich zu festgelegten Tageszeiten während der ganzen Testphase seine momentanen Phantommodalitäten zu dokumentieren. Die numerische Auswertung der Daten erfolgte mit einem transparenten Deckblatt, das mit einer Skala von 0 bis 10 versehen war. Der Diskriminationsabstand wurde mittels einer Schieblehre in Anlehnung an das Messprotokoll von Moberg 15 und Moseley et al. 16 gemessen.
Auf einem Foto des eigenen Oberarmstumpfs wurden die vier Messstellen genau gekennzeichnet. Gemessen wurde am Stumpfende, im Schaftbereich lateral, außerhalb des Schaftbereichs lateral und am erhaltenen Arm auch außerhalb des Schaftbereichs lateral.
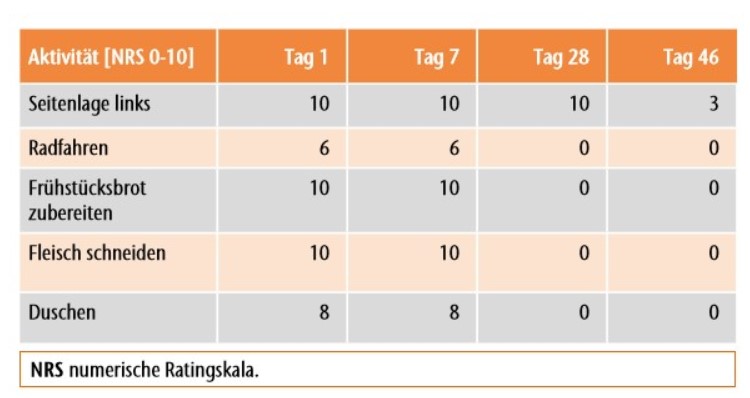
Für die Erfassung der funktionellen Einschränkungen wurde der „Task-specific scale”-Fragebogen in Form einer numerischen Rating-Skala (NRS) verwendet 17 18. Dieser Fragebogen erfasst fünf selbstbestimmte Tätigkeiten des täglichen Lebens, Aktivitäten oder Funktionen, bei denen sich der Patient zurzeit eingeschränkt fühlt.
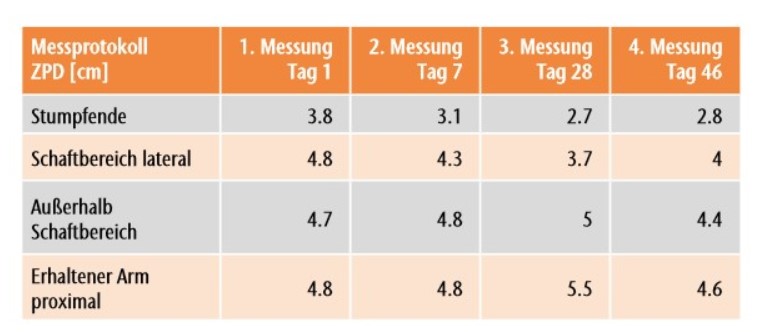
Bei der Befunderhebung betrug der Abstand der ZPD am Stumpfende 3.8 cm. Im „Task-specific scale”-Fragebogen erreichte der Patient einen Wert von 44 (50 würde bedeuten, dass der Patient keine der fünf Aktivitäten ausführen kann).
Vorgehen/ Datenerfassung
Die Interventionseinheit bestand aus taktilen Stimuli mittels der beiden Spitzen einer Schieblehre, die abwechselnd mit einer oder beiden Spitzen gleichzeitig in verschiedenen Abständen im Bereich des Stumpfendes appliziert wurde 19 20 (Abb. 1). Der Patient wurde dazu aufgefordert, jeweils über die Anzahl der wahrgenommenen Spitzen und über den Ort des jeweiligen taktilen Stimulus Auskunft zu geben. Auf einem Foto vom eigenen Oberarmstumpf zeigte er die von ihm wahrgenommenen Stellen an. Der Patient konnte während der Interventionen seinen Stumpf nicht sehen 21. Äußerst wichtig war bei der Intervention, dass der taktile Stimulus nicht als nozizeptiver Stimulus wahrgenommen wurde 22. Vom Tag 2 an bis einschließlich Tag 6 erhielt der Patient täglich drei Interventionseinheiten von jeweils zehn Minuten. Die Einheiten waren möglichst gut über den Tag verteilt.
Am Tag 7 erfolgte die zweite Befunderhebung des Diskriminierungsabstands, eine neue Beurteilung mittels „Task-specific scale”-Fragebogen und die Auswertung des Schmerztagebuchs der ersten Woche. Der Patient nahm in dieser Zeit (und auch schon zwei Wochen zuvor) am stationären Rehabilitationsprogramm teil; dieses bestand aus Einzelphysiotherapie (Erhalt der Beweglichkeit und Kräftigung des Stumpfs), Einzelergotherapie (Rekrutierung neuer motorischer Muster als Vorbereitung zur Steuerung der Armprothese), individueller Trainingstherapie zur Verbesserung von Propriozeption und Geschicklichkeit der erhaltenen oberen Extremität sowie allgemeinem Kraft- und Ausdauertraining.
Während weiterer drei Wochen fand nur noch einmal täglich eine zehnminütige Intervention der ZPD statt. Das beschriebene stationäre Rehabilitationsprogramm blieb bestehen. Um einen etwaigen Effekt der Intervention zu erkennen, wurde während und vor der ganzen Testphase bewusst auf die Spiegeltherapie und das Recognizeprogramm verzichtet 23 24.
Resultate
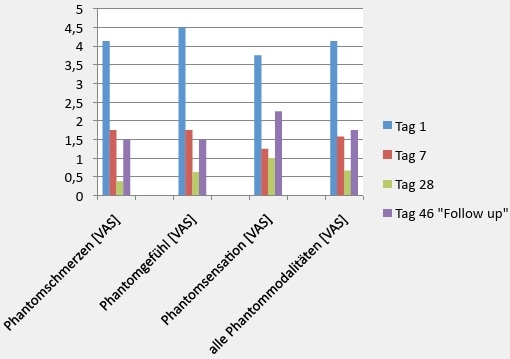
Der Mittelwert aller Phantommodalitäten wurde am Tag 1 mit 4.13/10 erhoben. Am Tag 28 betrug dieser Wert noch 0.67/10. Der Mittelwert aller Phantommodalitäten nahm kontinuierlich ab (Abb. 2). Auffallend war, dass sich der Phantomschmerz während der Testphase von den drei erhobenen Phantommodalitäten am meisten reduzierte. Die Phantomsensationen veränderten sich am wenigsten; der Patient reagierte am längsten mit Phantomsensationen sensitiv auf das Autofahren.
Das Absetzen aller Medikamente am Tag 11 zeigte seine Wirkung am Tag 12 durch einen klar erhöhten Mittelwert (3.21/10) aller Phantommodalitäten. Dieser erhöhte Mittelwert normalisierte sich aber nach drei Tagen.
Bei der Follow-up-Messung am Tag 46 war der Mittelwert aller Phantommodalitäten wieder auf 1.75/10 angestiegen. Der Abstand der ZPD veränderte sich nur am Stumpfende und im Schaftbereich lateral (Tab. 1). Diese zwei Stellen wurden auch während der Testphase mit ZPD stimuliert. Am Stumpfende veränderte sich der ZPD-Abstand von 3.8 cm (Tag 1) auf 2.7 cm (Tag 28) (siehe Tab. 1).
Diskussion
Diese Kasuistik gibt Hinweise darauf, dass die taktile Stimulation (im Sinne der ZPD) mit gleichzeitiger topografischer Zuordnung auf einem Stumpffoto den Phantomschmerz bzw. die drei Phantommodalitäten positiv beeinflussen kann 25. Die erhobenen Resultate könnten Hinweise auf eine Normalisierung der kortikalen Repräsentation geben. Moseley et al. 26 sowie Moseley und Wiech 27 belegten in Studien mit CRPS-Patienten, dass taktile Stimulation alleine keinen Effekt hatte, mit einem Diskriminationstraining aber eine deutliche Schmerzlinderung und Verbesserung der ZPD erreicht werden konnte.
Offen bleibt, ob der Abstand der ZPD wirklich mit dem Rückgang aller Phantommodalitäten korreliert ober dies Zufall ist. In unserer Rehabilitation war ein Prothesentraining leider nur bedingt durchführbar, weil es beim Anpassen der Prothese Schwierigkeiten gab (empfindliche, schmerzhafte Stellen). Am Ende der stationären Rehabilitation betrug die Tragezeit dieser Prothese ca. 4–6 Std. täglich. Inwieweit das Tragen der Prothese im Alltag die Schmerzsituation positiv beeinflusste, bleibt in dieser Kasuistik offen.
Überraschend war, dass sich die Phantommodalitäten nach einer Phase mit konstanten Schmerzen von ca. zwei Monaten Dauer reduzierten 28 29. Für ein überwiegend chronifizierendes Geschehen sprach in diesem Fall der geringe Effekt der Schmerzmedikamente Dichloranilinophenyl und Pregabalin und die konstante Phantomschmerzproblematik seit der Amputation. Klar gegen ein chronifizierendes Geschehen sprachen die differenzierten Phantomangaben des Patienten sowie das belastungs- und aktivitätsabhängige Auftreten und der schnelle Rückgang der Phantommodalitäten.
Wenn die ZPD als Therapieintervention bei der kortikalen Repräsentation den gleichen Effekt hat wie die transkutane Nervenstimulation in der Studie von Flor et al. 30, könnte es auch sein, dass die ZPD auch bei anderen armamputierten Patienten eine Reduktion der Phantommodalitäten zur Folge hat.
Der in dieser Kasuistik beschriebene Effekt ist sehr erfreulich, da es im Einzelfall gelang, innert kurzer Zeit die Phantommodalitäten eines Patienten deutlich und relevant zu mindern. Die Lebensqualität und die Leistungsfähigkeit konnten beim Patienten dadurch deutlich gesteigert werden (Tab. 2). Dies kann eine vielversprechende Grundlage für eine leichtere gesellschaftliche und arbeitsbezogene Reintegration sein.
Fazit
Die Verbesserung der Körperwahrnehmung mittels ZPD-Training könnte eine gute Möglichkeit sein, Patienten mit Phantomschmerzen nach einer Amputation zu helfen.
Interessenkonflikt: Der Autor gibt für sich und seinen Koautor an, dass kein Interessenkonflikt besteht.
Für die Autoren:
Thomas Koller, Dipl. Physiotherapeut FH
Fachexperte Therapien
Orthopädische und handchirurgische Rehabilitation
Rehaklinik Bellikon
CH-5454 Bellikon
Schweiz
thomas.koller@rehabellikon.ch
Der Nachdruck des Artikels erfolgt mit freundlicher Genehmigung der Springer Science+Business Media. Zuerst erschienen in: Der Orthopäde 6/2013, S. 449 ff.
Koller Th, Luomajoki H. Zweipunktediskrimination bei Phantomschmerzen – Effekt einer vierwöchigen Therapie bei einem oberarmamputierten Patienten mit Phantomschmerzen. Orthopädie Technik, 2015; 66 (5): 42–45
- Easypreg – ein Faserverbundwerkstoff zum Tiefziehen — 9. März 2026
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Moseley, GL, Zalucki NM, Wiech K. Tactile discrimination, but not tactile stimlation alone, reduces chronic limb pain. Pain, 2008; 137 (3), 600–608. doi: 10.1016/j.pain.2007.10.021
- Moseley, GL, Wiech K. The effect of tactile discrimination training is enhanced when patients watch the reflected image of their unaffected limb during training. Pain, 2009; 144 (3): 314–319. doi: 10.1016/j.pain.2009.04.030
- Luomajoki H, Moseley G. Tactile acuity and lumbopelvic motor control in patients with back pain and healthy controls. Br J Sports Med, 2011; 45 (5): 437–440. doi: bjsm.2009.060731 [pii]
- Flor H. The functional organization of the brain in chronic pain. Prog Brain Res, 2000; 129: 313–322. doi: S0079-6123(00)29023–7
- Luomajoki H, Moseley G. Tactile acuity and lumbopelvic motor control in patients with back pain and healthy controls. Br J Sports Med, 2011; 45 (5): 437–440. doi: bjsm.2009.060731 [pii]
- Flor H, Denke C, Schaefer M, Grüsser S. Effect of sensory discrimination training on cortical reorganisation and phantom limb pain. The Lancet, 2001; 357 (9270): 1763–1764. doi: 10.1016/s0140-6736(00)04890‑x
- Moseley, GL, Zalucki NM, Wiech K. Tactile discrimination, but not tactile stimlation alone, reduces chronic limb pain. Pain, 2008; 137 (3), 600–608. doi: 10.1016/j.pain.2007.10.021
- Moseley, GL, Wiech K. The effect of tactile discrimination training is enhanced when patients watch the reflected image of their unaffected limb during training. Pain, 2009; 144 (3): 314–319. doi: 10.1016/j.pain.2009.04.030
- Luomajoki H, Moseley G. Tactile acuity and lumbopelvic motor control in patients with back pain and healthy controls. Br J Sports Med, 2011; 45 (5): 437–440. doi: bjsm.2009.060731 [pii]
- Diers M, Christmann C, Koeppe C, Ruf M, Flor H. Mirrored, imagined and executed movements differentially activate sensorimotor cortex in amputees with and without phantom limb pain. Pain, 2010; 149 (2): 296–304. doi: 10.1016/j.pain.2010.02.020
- Kern U, Busch V, Rockland M, Kohl M, Birklein F. Prävalenz und Risikofaktoren von Phantomschmerzen und Phantomwahrnehmung in Deutschland. Schmerz, 2009; 23: 479–488. doi: DOI 10.1007/s00482-009‑0786‑5
- Hill A. Phantom limb pain: a review of the literature on attributes and potential mechanisms. J Pain Symptom Manage, 1999; 17 (2): 125–142. doi: S0885392498001365 [pii]
- Kern U, Busch V, Rockland M, Kohl M, Birklein F. Prävalenz und Risikofaktoren von Phantomschmerzen und Phantomwahrnehmung in Deutschland. Schmerz, 2009; 23: 479–488. doi: DOI 10.1007/s00482-009‑0786‑5
- Steffen P. Phantomschmerz: Diagnostik und Therapie [Phantom limb pain]. Anasthesiol Intensivmed Notfallmed Schmerzther, 2006; 41 (6): 378–386, quiz 387–378. doi: 10.1055/s2006-947304
- Moseley, GL, Zalucki NM, Wiech K. Tactile discrimination, but not tactile stimlation alone, reduces chronic limb pain. Pain, 2008; 137 (3), 600–608. doi: 10.1016/j.pain.2007.10.021
- Moberg E. Two-point discrimination test. A valuable part of hand surgical rehabilitation, e. g. in tetraplegia. Scand J Rehabil Med, 1990; 22 (3): 127–134
- Moseley, GL, Zalucki NM, Wiech K. Tactile discrimination, but not tactile stimlation alone, reduces chronic limb pain. Pain, 2008; 137 (3), 600–608. doi: 10.1016/j.pain.2007.10.021
- Westaway MD, Stratford PW, Binkley JM. The patient-specific functional scale: validation of its use in persons with neck dysfunction, J Orthop Sports Phys Ther, 1998; 27(5): 331–338
- Flor H, Denke C, Schaefer M, Grüsser S. Effect of sensory discrimination training on cortical reorganisation and phantom limb pain. The Lancet, 2001; 357 (9270): 1763–1764. doi: 10.1016/s0140-6736(00)04890‑x
- Moberg E. Two-point discrimination test. A valuable part of hand surgical rehabilitation, e. g. in tetraplegia. Scand J Rehabil Med, 1990; 22 (3): 127–134
- Moseley, GL, Zalucki NM, Wiech K. Tactile discrimination, but not tactile stimlation alone, reduces chronic limb pain. Pain, 2008; 137 (3), 600–608. doi: 10.1016/j.pain.2007.10.021
- Luomajoki H, Moseley G. Tactile acuity and lumbopelvic motor control in patients with back pain and healthy controls. Br J Sports Med, 2011; 45 (5): 437–440. doi: bjsm.2009.060731 [pii]
- Flor H. The functional organization of the brain in chronic pain. Prog Brain Res, 2000; 129: 313–322. doi: S0079-6123(00)29023–7
- Diers M, Christmann C, Koeppe C, Ruf M, Flor H. Mirrored, imagined and executed movements differentially activate sensorimotor cortex in amputees with and without phantom limb pain. Pain, 2010; 149 (2): 296–304. doi: 10.1016/j.pain.2010.02.020
- Kern U, Busch V, Rockland M, Kohl M, Birklein F. Prävalenz und Risikofaktoren von Phantomschmerzen und Phantomwahrnehmung in Deutschland. Schmerz, 2009; 23: 479–488. doi: DOI 10.1007/s00482-009‑0786‑5
- Moseley, GL, Zalucki NM, Wiech K. Tactile discrimination, but not tactile stimlation alone, reduces chronic limb pain. Pain, 2008; 137 (3), 600–608. doi: 10.1016/j.pain.2007.10.021
- Moseley, GL, Wiech K. The effect of tactile discrimination training is enhanced when patients watch the reflected image of their unaffected limb during training. Pain, 2009; 144 (3): 314–319. doi: 10.1016/j.pain.2009.04.030
- Flor H. The functional organization of the brain in chronic pain. Prog Brain Res, 2000; 129: 313–322. doi: S0079-6123(00)29023–7
- Kern U, Busch V, Rockland M, Kohl M, Birklein F. Prävalenz und Risikofaktoren von Phantomschmerzen und Phantomwahrnehmung in Deutschland. Schmerz, 2009; 23: 479–488. doi: DOI 10.1007/s00482-009‑0786‑5
- Flor H, Denke C, Schaefer M, Grüsser S. Effect of sensory discrimination training on cortical reorganisation and phantom limb pain. The Lancet, 2001; 357 (9270): 1763–1764. doi: 10.1016/s0140-6736(00)04890‑x