Einleitung
Nach einer Amputation ist oftmals die Versorgung der Betroffenen mit einer Arm- oder Handprothese erforderlich. Diese muss neben der Berücksichtigung von kosmetischen Fragen insbesondere die motorische und sensorische Funktionalität wiederherstellen.
Myoelektrische Handprothesen, deren Bewegungen durch die Erfassung von Muskelaktionspotenzialen der noch verbliebenen Muskulatur des Unterarmes gesteuert werden, gehören zum gegenwärtigen Stand der Technik. Die Zahl der erzielbaren Freiheitsgrade und die Bewegungsmuster sind jedoch begrenzt. Die derzeit übliche sequenzielle Ansteuerung einzelner Bewegungen der Prothese wie Öffnen, Schließen oder Drehen erfolgt durch die gezielte Kontraktion zweier Muskelgruppen und erfordert zusätzlich das Umschalten zwischen den gewünschten Bewegungen bzw. Funktionen durch eine Kokontraktion. Ihre Aktivität wird mittels Oberflächenelektroden erfasst. Die Steuerung der Griffkraft erfolgt über die Amplitude der abgeleiteten Signale. Damit wird die motorische Funktionalität zu einem großen Teil wiederhergestellt, wobei ein Feedback über die ausgeführte Bewegung oftmals nur visuell erfolgt.
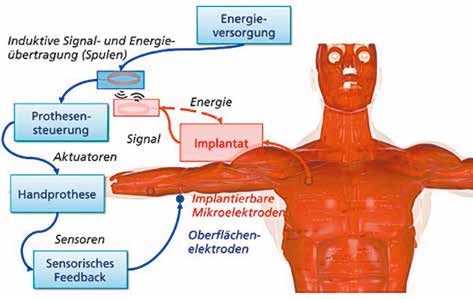
Das Ziel derzeitiger Entwicklungen bionischer Handprothesen 1 gilt der Bereitstellung sowohl komplexer Bewegungsabläufe der künstlichen Gliedmaße als auch ihrer multifunktionalen intuitiven, weil simultanen Steuerung 2. Hierzu sind je Bewegung der Prothese zwei Biosignale erforderlich, die auf unterschiedlichen Ebenen der motorischen Bahn generiert werden und mittels implantierbarer Elektroden erfasst werden können 3 4 5 6. Drei wesentliche Ableitorte – der motorische Kortex, der periphere Nerv und der innervierte Muskel – stehen hierfür zur Verfügung (Abb. 1). Bei einigen Anwendungen ist die transkutane Übertragung der erfassten Signale drahtgebunden 7 8. Die Wiederherstellung sensorischer Eindrücke, die durch propriozeptive und exterozeptive Rezeptoren der Hand entstehen, ist ebenfalls Gegenstand der gegenwärtigen Forschung. Die elektrische Stimulation peripherer Nerven eröffnet dabei Möglichkeit eines sensorischen Feedbacks 9 10.
Ein vielversprechender Ansatz der intuitiven Steuerung ergibt sich durch den Einsatz implantierter epimysialer Elektroden. Da diese Elektroden sich unmittelbar auf einzelnen Muskeln platzieren lassen, ist im Vergleich zum mit Oberflächenelektroden erfassten EMG eine höhere Selektivität zu erwarten. Liegt beispielsweise die Amputationshöhe weit proximal oder ist nur wenig Restmuskulatur vorhanden, kann durch einen selektiven Nerventransfer zur Brustmuskulatur (Targeted Muscle Reinnervation, TMR) eine epimysiale Signalerfassung weiterhin erfolgreich eingesetzt werden 11. Versucht nun der Betroffene seine Hand zu bewegen, werden die peripheren Nerven weiterhin aktiviert. Allerdings kommt es nun anstelle der Kontraktion der Handmuskulatur zu einer Kontraktion der Brustmuskeln, deren Potenziale erfasst werden.
Voraussetzung für einen erfolgreichen Einsatz derartiger implantierter Elektroden ist ein implantierbares vielkanaliges EMG-System mit einer telemetrischen Signalübertragung 12. Dieses wird im Folgenden vorgestellt.
Material und Methoden
Das zu entwickelnde Implantat (Abb. 2) soll der Erfassung, Vorverarbeitung und Übertragung myogener Signale dienen, welche die eigentliche Handprothese steuern sollen. Dabei wird es kabellos mit Energie versorgt und die Kommunikation mittels transkutaner Funkschnittstelle realisiert. Die gewünschte intuitive Steuerung der Handprothese erfordert eine Erhöhung der Selektivität der Signalerfassung und damit den Einsatz implantierbarer Mikroelektroden 13. Ihre Platzierung erfolgt epimysial entweder auf der Restmuskulatur des Armes oder wie bereits beschrieben nach einem selektiven Nerventransfer über der Brustmuskulatur.
Das implantierbare vielkanalige System besteht aus folgenden grundsätzlichen Komponenten:
- implantierbare flexible Mikroelektroden für die invasive epimysiale Erfassung myoelektrischer Aktivitäten
- anwendungsspezifische integrierte Schaltung (ASIC) und Mikrocontroller (Texas Instruments MSP430) zur Signalkonditionierung und Signalvorverarbeitung
- Telemetriemodul zur kabellosen Signalübertragung (Zarlink ZL70101)
- induktive Energieübertragung
Darüber hinaus sind folgende externen Komponenten erforderlich:
- intelligente Mustererkennung und Klassifizierung der Signale zur Erkennung der gewünschten Handbewegung und Berechnung der Steuersignale für die Bewegung der Prothese
- elektrische Stimulation definierter Hautareale und Erzeugung eines sensorischen Feedbacks
Ergebnisse
Das System und seine Komponenten wurden vor der ersten Erprobung im Tier in verschiedenen Settings zunächst im Labor getestet (Abb. 3). Hierbei ging es vorrangig um Energieversorgung, Signalkonditionierung und Signalübertragung. Ziel war es, die technischen Parameter des Implantates sowohl für das experimentelle Protokoll als auch die Signaleigenschaften zu optimieren.
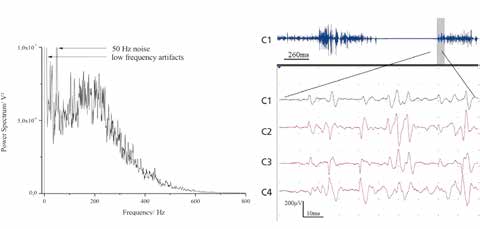
Gleichzeitig wurden zu Beginn der Experimente epimysiale Aktivitäten während der Ausführung verschiedener Armbewegungen transkutan drahtgebunden übertragen und mit dem konventionellen EMG-System „Topas” registriert, um Form, Amplitude und Frequenzbereich der zu erwartenden Signale abzuschätzen. Dies war eine der wesentlichen Voraussetzungen, um die Parameter der Signalkonditionierung im ASIC festzulegen. Die Signale wurden in einem Frequenzbereich von 1 Hz bis 10 kHz abgeleitet und das Frequenzspektrum berechnet (Abb. 4a). Die Abtastrate betrug 20 kHz. Das Frequenzspektrum zeigt zwei charakteristische Gipfel: im niederfrequenten Bereich von 10 bis 40 Hz und stärker ausgeprägt im höherfrequenten Bereich von 100 bis 500 Hz. Darüber hinaus sind Artefakte im Bereich um 50 Hz und im niederfrequenten Bereich sichtbar. Ein typisches Rohsignal, das in einem Frequenzbereich von 100 Hz bis 10 kHz abgeleitet wurde, ist in Abbildung 4b dargestellt. Es ist erkennbar, dass der Einfluss niederfrequenter Störungen (insbesondere der Artefakte aufgrund der Netzspannung) beseitigt werden konnten und hochfrequente Signalanteile nicht auftreten. Auch hier betrug die Abtastrate 20 kHz. Zusammenfassend kann festgehalten werden, dass die für eine weitere Analyse signifikanten Signalanteile im Frequenzbereich von 100 bis 500 Hz liegen.
Die Implantatelektronik ist mit Silikon gekapselt und hat eine Größe von 38 × 25 × 8 mm. Die Signalverstärkung erfolgt in einer Bandbreite zwischen 6 und 1500 Hz. Die Signalübertragung wird nahezu in Echtzeit MICS-konform zwischen 402 und 405 MHz bei einer Übertragungsrate von ca. 260 kBit/s durchgeführt. Bei einer optimalen Verbindung konnte eine Fehlerrate von ca. 1 % eingehalten werden. Die Latenz des Gesamtsystems beträgt ~23 ms ± 7 ms. Die Energieversorgung erfolgt induktiv, wobei es auf der Sekundärseite zu keinen nennenswerten Temperaturerhöhungen kam. Diese wurden thermografisch erfasst 14 15.
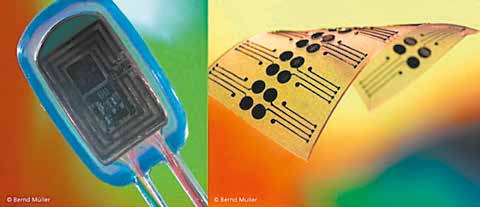
Die epimysial auf der Muskulatur fixierten Elektroden sind einer ständigen mechanischen Beanspruchung aufgrund einer bis zu 10-prozentigen Längendehnung des Zielmuskels bei Kontraktion ausgesetzt. Daher müssen diese Elektroden flexibel und dehnbar sein. Die Elektrodenstrukturen auf Polyimidbasis (siehe Abb. 3) aufgrund einer bis zu 10-prozentigen Längendehnung des Zielmuskels bei Kontraktion ausgesetzt. Daher müssen diese Elektroden flexibel und dehnbar sein. Die Elektrodenstrukturen auf Polyimidbasis (siehe Abb. 3) erwiesen sich für einen Langzeiteinsatz als ungeeignet. Erfolgreich wurde im späteren Tierversuch Silikon als Trägermaterial für die epimysiale Signalerfassung eingesetzt (Abb. 5) 16.
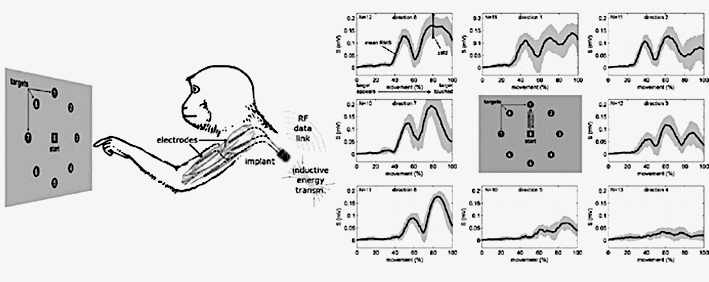
Am Deutschen Primatenzentrum wurden einem Rhesusmakaken die Mikroelektroden epimysial auf Trizeps, Bizeps und Deltoideus implantiert. Das eigentliche System wurde im Schulterbereich positioniert. Der Affe war vorher trainiert worden, definierte Bewegungen auszuführen und auf einem Monitor aufleuchtende Zielpunkte zu berühren (Abb. 6a). Alle Tierversuche entsprachen den Vorgaben des Deutschen Tierschutzgesetzes und waren durch das zuständige Landesamt genehmigt.
Das entwickelte Gesamtsystem wurde über mehr als neun Monate im Tiermodell erfolgreich eingesetzt und getestet. Es funktionierte über diesen Zeitraum ohne mechanische oder biologische Probleme und technische Ausfälle. Dabei wurde insbesondere die gesamte Übertragungsstrecke evaluiert, wobei die Qualität der Signale und die Stabilität der Energieversorgung im Mittelpunkt standen.
Die Erfassung der Signale startete 4 Wochen nach der Implantation. Das Aufzeichnungssystem wurde von den Armbewegungen gesteuert, wobei die Berührung des Bildschirmes der Trigger war. So ließen sich Korrelationen zwischen den zielgerichteten Armbewegungen und den erfassten bioelektrischen Potenzialen ermitteln.
Die bipolar vierkanalig erfassten myogenen Signale konnten nach einer Signalanalyse klassifiziert und den einzelnen Bewegungsrichtungen zugeordnet werden. Hierfür kamen 6 Klassifikatoren und 7 Merkmale aus dem Zeit- und Frequenzbereich zur Anwendung. Dadurch konnte die jeweilige Bewegungsrichtung aus dem EMG-Signal diskriminiert werden. Daraus ließ sich eindeutig die Intuition der Bewegung ableiten.
Die epimysiale Applikation der Elektroden ist im Vergleich zur nervalen Signalerfassung weniger invasiv und bietet eine Reihe weiterer Vorteile. Die abgeleiteten muskulären Signale haben eine höhere Amplitude (ca. 200 µV), einen geringeren Frequenzbereich (bis maximal 600 Hz) und ein höheres Signal-Rausch-Verhältnis. Auch sind sie weniger von störenden Artefakten überlagert 17.
Das System wurde über den mehrmonatigen Zeitraum von beiden Tieren gut toleriert. Auch konnte kein Einfluss durch das Implantat auf die Bewegungsfreiheit festgestellt werden. Nach erfolgter Explantation wiesen Implantat, Elektroden und Gewebe keine nennenswerten Veränderungen auf. Es gab keine Anzeichen entzündlicher Reaktionen. Somit kann insgesamt eingeschätzt werden, dass ein neuer Ansatz der motorischen intuitiven Handprothesensteuerung erfolgreich getestet wurde.
Schlussfolgerungen und Ausblick
Mit dem vorgestellten implantierbaren System war es möglich, epimysial erfasste Muskelsignale zu konditionieren und transkutan drahtlos zu übertragen. Die Möglichkeit ihrer Klassifikation und Zuordnung zu definierten Bewegungsmustern bietet die Grundlage einer möglichen intuitiven Steuerung von Handprothesen. Für ihren Träger wird es dann möglich werden, mit bionischen Handprothesen natürliche Bewegungsabläufe auszuführen. Dies wird insbesondere durch die höhere Zahl an Freiheitsgraden erreicht werden können. Bei einem hohen Amputationsniveau und einer nur geringen Restmuskulatur kann nach einem selektiven Nerventransfer (Targeted Muscle Reinnervation, TMR) zur Brustmuskulatur die muskuläre Signalerfassung trotzdem angewandt werden 18.
Die gute Verträglichkeit und Funktionalität des Gesamtsystems während seines Einsatzes sind zwei unentbehrliche Voraussetzungen für einen möglichen zukünftigen humanen Einsatz des Implantats.
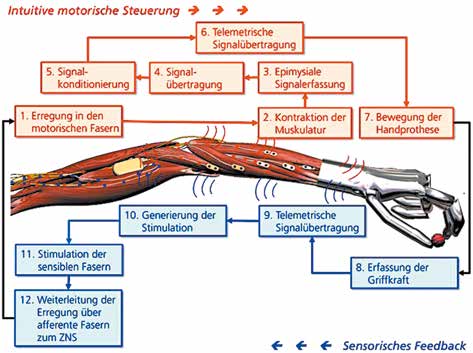
Neben der Wiederherstellung einer motorischen Funktionalität muss eine bionische Handprothese auch die sensorische Komponente berücksichtigen. Eine elektrische Stimulation der peripheren Nerven kann dem Betroffenen ein Gefühl der amputierten Hand vermitteln 19. Erste Erfolge mit der Detektion dreidimensionaler geometrischer Formen konnten bereits verwirklicht werden 20. Daraus ergibt sich die Möglichkeit, der Handprothesensteuerung ein sensorisches Feedback als Rückkopplung hinzuzufügen. Der so entstehende Regelkreis lässt sich als Closed-Loop-System (Abb. 7) realisieren. Dabei sind sowohl die Signalerfassung als auch die elektrische Stimulation in einem gemeinsamen Implantat zu integrieren. Dies wird ein wichtiger Schritt für zukünftige Entwicklungen einer bionischen Handprothese sein.
Besondere Bedeutung kommt dabei den implantierten Elektroden als Interfaces zwischen dem technischen System und dem biologischen Gewebe zu. Diese müssen die Bedingungen, die sich aus dem umgebenden Gewebe ergeben, tolerieren. Fortschritte verspricht man sich gegenwärtig von doppelseitigen Elektroden zur Stimulation 21 und funktionalisierten Polymeren mit leitenden und nichtleitenden Komponenten. Aufgrund gleicher mechanischer Eigenschaften der Komponenten können diese sogenannten All-Polymer-Elektroden (Abb. 8) die Bewegung der Muskulatur besonders gut kompensieren.
Wichtige technische Probleme, an denen auch weiterhin gearbeitet werden muss, sind neben Biokompatibilität und Langzeitstabilität insbesondere die Energieversorgung. Auch die Signalübertragung als größter Energieverbraucher lässt sich durch ein intelligentes Energiemanagement und den Einsatz von Komprimierungsalgorithmen weiter optimieren. Die dauerhafte Erhaltung der vollständigen Funktionalität des Gesamtsystems ist das Ziel der Entwicklung derartiger Systeme. Sie müssen die Einschränkungen der Betroffenen lebenslang so kompensieren, dass ihre Lebensqualität wiederhergestellt bzw. weiter verbessert wird.
Danksagung
Diese Arbeit wurde gefördert durch EU: Cyberhand (EU IST 2001–35094), Neurobotics (IST-FET Project 2003–001917), BMBF: Myoplant (BMBF 16SV3697) und FhG: Leitprojekt 2014 (Theranostische Implantate).
Für die Autoren:
Prof. Dr.-Ing. Klaus-Peter Hoffmann
Leiter der Abteilung für Medizintechnik & Neuroprothetik
Fraunhofer-Institut für Biomedizinische Technik
Ensheimer Straße 48
66386 St. Ingbert
klaus-peter.hoffmann@ibmt.fraunhofer.de
Begutachteter Beitrag/reviewed paper
Hoffmann KP, Abu-Saleh L, Cardona Audi JM, Dietl H, Frank H, Gail A, Kaniusas E, Krautschneider WH, Lewis S, Meiners T, Ruff R, Russold MF, Schroeder D, Westendorff S. Implantierbares myoelektrisches Assistenzsystem zur intuitiven Steuerung einer bionischen Handprothese. Orthopädie Technik, 2015; 66 (5): 36–40
- Silikon-Maßliner: effiziente Lösungen für anspruchsvolle Prothesenversorgungen — 5. Juli 2024
- Osseointegrierte Prothese versus Schaftprothese: Welche Gehfähigkeit erreichen Oberschenkelamputierte? — 5. Juli 2024
- „Ich fühle, wie ich gehe“ – ein innovatives, nicht-invasives, gangsynchrones, vibrotaktiles Feedbacksystem. Eine Roadmap zu Versorgungsmöglichkeiten — 5. Juli 2024
- Hoffmann K‑P, Carrozza MC, Micera S, Koch KP. Neuroprothesen – implantierbare Mikrosysteme auf der Grundlage von Methoden der Neurobionik. Orthopädie Technik, 2006; 57: 334–339
- Micera S, Rossini PM, Rigosa J, Citi L, Carpaneto J, Raspopovic S, Tombini M, Cipriani C, Assenza G, Carrozza MC, Hoffmann K‑P, Yoshida K, Navarro X, Dario P. Decoding of Grasping Information from Neural Signals Recorded Using Peripheral Intrafascicular Interfaces. Neuro Eng Rehab; 2011; 8 (1): 133–138
- Hochberg LR, Serruya MD, Friehs GM, Mukand JA, Saleh M, Caplan AH, Branner A, Chen D, Penn RD, Donoghue JP. Neuronal ensemble control of prosthetic devices by a human with tetraplegia. Nature, 2006; 442 (7099): 164–171
- Hoffmann K‑P, Koch KP, Dörge T, Micera S. New Technologies in Manufacturing of Different Implantable Microelectrodes as an Interface to the Peripheral Nervous System. Proceedings International Conference on Biomedical Robotics and Biomechatronics (BioRob). Pisa, 2006: 414–419
- Hoffmann K‑P, Koch KP, Stieglitz T. Implantable Microelectrodes as an Interface to the Peripheral Nervous System. Ergänzungsband der Zeitschrift Biomedizinische Technik, 2005; 50: 844–845
- Tathireddy P, Krummenacker S, Kammer S, Hoffmann K‑P, Solzbacher F. Towards High Aspect Ratio Tungsten Micro Electrode Array for Neural Recording and Stimulation Applications. Proceedings 13th Annual IFESS Conference. Freiburg, 2008: 235–237
- Hochberg LR, Serruya MD, Friehs GM, Mukand JA, Saleh M, Caplan AH, Branner A, Chen D, Penn RD, Donoghue JP. Neuronal ensemble control of prosthetic devices by a human with tetraplegia. Nature, 2006; 442 (7099): 164–171
- Rossini PM, Micera S, Benvenuto A, Carpaneto J, Cavallo G, Citi L, Cipriani C, Denaro L, Denaro V, Di Pino G, Ferreri F, Guglielmelli E, Hoffmann K‑P, Raspopovic S, Rigosa J, Rossini L, Tombini M, Dario P. Double Nerve Intraneural Interface Implant on a Human Amputee for Robotic Hand Control. Clin Neurophysiol, 2010; 121 (5): 777–783
- Rossini PM, Micera S, Benvenuto A, Carpaneto J, Cavallo G, Citi L, Cipriani C, Denaro L, Denaro V, Di Pino G, Ferreri F, Guglielmelli E, Hoffmann K‑P, Raspopovic S, Rigosa J, Rossini L, Tombini M, Dario P. Double Nerve Intraneural Interface Implant on a Human Amputee for Robotic Hand Control. Clin Neurophysiol, 2010; 121 (5): 777–783
- Benvenuto A, Raspopovic S, Hoffmann K‑P, Carpaneto J, Cavallo G, Di Pino G, Guglielmelli E, Rossini L, Rossini P, Tombini M, Micera S. Intrafascicular thin film multichannel electrodes for sensory feed-back: evidences on a human amputee. Proceedings 32nd Annual International Conference IEEE EMBS. Buenos Aires, 2010: 1800–1803
- Hoffmann K‑P, Dietl H. Handprothesen: Nach dem Vorbild der Natur. Deutsches Ärzteblatt, 2010; 107 (45): 11–14
- Hoffmann K‑P, Dietl H. Handprothesen: Nach dem Vorbild der Natur. Deutsches Ärzteblatt, 2010; 107 (45): 11–14
- Hoffmann K‑P, Koch KP, Dörge T, Micera S. New Technologies in Manufacturing of Different Implantable Microelectrodes as an Interface to the Peripheral Nervous System. Proceedings International Conference on Biomedical Robotics and Biomechatronics (BioRob). Pisa, 2006: 414–419
- Cardona Audi J, Müller C, Scholz O, Ruff R, Hoffmann K‑P. Real-time data link for wireless implantable applications. TAR 2011, Berlin
- Lewis S, Russold FM, Dietl H, Ruff R, Cardona J, Hoffmann K‑P, Abu-Saleh L, Schroder D, Krautschneider W, Westendorff S, Gail A, Meiners T, Kaniusas E. Fully implantable multi-channel measurement system for acquisition of muscle activity. IEEE Transactions on Instrumentation & Measurement, 2013; 62 (7): 1972–1981
- Lewis S, Hahn M, Klein C, Russold MF, Ruff R, Hoffmann K‑P, Unger E, Lanmüller H, Aszmann O, Dietl H, Kaniusas E. Implantable Silicone Electrode for Measurement of Muscle Activity: Results of First in Vivo Evaluation. Biomedizinische Technik/Biomedical Engineering, 2013 Sep 7. doi: 10.1515/bmt-2013–4368 [Epub ahead of print]
- Ruff R, Poppendieck W, Gail A, Westendorf S, Russold FM, Lewis S, Meiners T, Hoffmann K‑P. Acquisition of Myoelectric Signals to Control a Hand Prosthesis with Implantable Epimysial Electrodes. Proceedings 32nd Annual International Conference IEEE EMBS. Buenos Aires, 2010: 5070–5073
- Hoffmann K‑P, Dietl H. Handprothesen: Nach dem Vorbild der Natur. Deutsches Ärzteblatt, 2010; 107 (45): 11–14
- Benvenuto A, Raspopovic S, Hoffmann K‑P, Carpaneto J, Cavallo G, Di Pino G, Guglielmelli E, Rossini L, Rossini P, Tombini M, Micera S. Intrafascicular thin film multichannel electrodes for sensory feed-back: evidences on a human amputee. Proceedings 32nd Annual International Conference IEEE EMBS. Buenos Aires, 2010: 1800–1803
- Raspopovic S, Capogrosso M, Petrini FM, Bonizzato M, Rigosa J, Di Pino G, Carpaneto J, Controzzi M, Boretius T, Fernandez E, Granata G, Oddo CM, Citi L, Ciancio AL, Cipriani C, Carrozza MC, Jensen W, Guglielmelli E, Stieglitz T, Rossini PM, Micera S. Restoring Natural Sensory Feedback in Real-Time Bidirectional Hand Prostheses. Sci Transl Med, 2014; 222 (6): 222ra19
- Poppendieck W, Sossalla A, Krob M‑O, Welsch C, Khoa Nguyen TA, Gong W, DiGiovanna J, Micera S, Merfeld DM, Hoffmann K‑P. Development, manufacturing and application of double-sided flexible implantable microelectrodes. Biomedical Microdevices, 2014; 16 (6): 837–850

![Möglichkeiten der intuitiven Steuerung einer Handprothese entlang der motorischen Bahn, nach [efn_note]Hoffmann K-P, Dietl H. Handprothesen: Nach dem Vorbild der Natur. Deutsches Ärzteblatt, 2010; 107 (45): 11-14[/efn_note]. Die invasiv applizierten Elektroden sind (a) im motorischen Kortex, (b) im peripheren Nerv und (c) epimysial platziert. (d) State of the Art ist die Erfassung des EMG vom Armstumpf mit Oberflächenelektroden.](https://360-ot.de/wp-content/uploads/2020/07/ot_15-05_1_inituitive_Steuerung_hoffmann.jpg)