Einleitung
Der Begriff „Arthrogryposis multiplex congenita“ (AMC) ist eher eine phänomenologische Bezeichnung denn eine spezifische Diagnose. Er beschreibt eine angeborene Gelenksteife mit Kontrakturen und Deformationen. Per Definition sind die Auffälligkeiten in zwei oder mehr Körper arealen zu finden 1. Über 400 spezifischere Diagnosen fallen in den Themenkomplex 2, wobei die Erkrankung mit einer Häufigkeit von etwa 1:4.300–4.600 3 4 eher selten ist. Mangelnde fetale Bewegungen führen dabei vermutlich zu einer Weichteildysplasie. Etwa die Hälfte der Patienten fällt in den Bereich der Amyoplasie oder der distalen Arthrogryposen 5. Eine Amyoplasie ist in erster Linie eine Muskelerkrankung, die alle Extremitäten betrifft. Distale Arthrogryposen sind Erbkrankheiten, die hauptsächlich die distalen Extremitäten betreffen. Daneben ist eine Vielzahl von Syndromen assoziiert. Verteilung und Schwere der Kontrakturen variieren, aber eine begrenzte Gelenkbewegung ist allen gemeinsam. AMC ist immer mit einer Schwäche durch Atrophie und intramuskuläre Umbauprozesse sowie mit einer Einlagerung von Binde- und Fettgewebe verbunden 6 7.
Erscheinungsformen
Allgemein gilt bei AMC: Je mehr Gelenke betroffen sind, desto geringer sind Mobilität und Teilhabe 8 9 und desto größer ist der Bedarf an orthopädietechnischer Unterstützung. Oft sind sowohl Arme als auch Beine betroffen; einige Patienten zeigen auch eine Primärpathologie der Arme. Dann weisen die Schultergelenke oft eine eingeschränkte Bewegungsfähigkeit auf; die Ellenbogen sind in Beuge- oder Streckstellung. Auch Handgelenke, Daumen und Finger können betroffen sein 10 11.Vor allem Ellenbogenstreckkontrakturen werden als funktionell einschränkend eingestuft 12. Es gibt daher Befürworter, den oberen Gliedmaßen Vorrang bei der Behandlung einzuräumen 13.
Der aktuelle Artikel beschränkt sich zwar auf die untere Extremität; Einschränkungen der oberen Extremität werden aber selbstverständlich ebenfalls versorgt. Sie sind besonders limitierend und beeinflussen u. a. die Fähigkeit, weitere Hilfsmittel zu nutzen 14 oder auch einen Sturz abzufangen. Bezogen auf das Gehen kann bei Patienten mit Beeinträchtigung der oberen Extremität z. B. die fehlende Fähigkeit, das Treppengeländer beim Auf- und Abgehen zu fassen, einschränkend sein. An der unteren Extremität sind die Gelenke des Fußes und das Sprunggelenk etwas öfter betroffen als das Knie oder die Hüfte 15. Fußdeformitäten wie z. B. Klump‑, Spitz- oder Hackenfüße sind zahlreich 16 17, wobei auch komplette distale Lähmungserscheinungen am Fuß mit vollkommenem Funktionsverlust vorkommen. Die Hüften neigen zur Dislokation, sind oft abduziert und außenrotiert. Zudem sind Flexionskontrakturen an Knie und Hüfte häufiger als Extensionskontrakturen, wobei invasive Interventionen für Extensionskontrakturen komplizierter scheinen 18. Knie- und Hüftflexionskontrakturen von 20 bis 30° sind für das Gehen kritisch 19 20.
Der aktive Bewegungsbereich ist bei einer Arthrogrypose teilweise noch geringer als der passive, jedoch ist die muskuläre Schwäche für die Gehfähigkeit limitierender 21. Im Vergleich zu Gesunden ist der Sauerstoffverbrauch bei Patienten mit AMC höher 22; sie gehen wohl auch deshalb langsamer. Grundsätzlich zeigen Patienten mit AMC zum Teil ein starkes frontales Pendeln des Thorax und des Beckens 23 24 25 26. Dieses ist ggf. mit einer Schwäche der Abduktoren assoziiert 27. Darüber hinaus unterstützt das sogenannte „pelvic hiking“, ein Bewegungsmuster, bei dem das Becken zur Unterstützung in der Schwungphase angehoben wird, die Bodenfreiheit.
Orthesen sind essenziell
Die Behandlung einer Arthrogrypose umfasst u. a. Physiotherapie, Ergotherapie und oftmals auch orthopädische Operationen 28 29. Orthesen sind ein integraler Baustein der Behandlung: Neben einer Verwendung als Nachtlagerungsschienen zur Kontrakturprophylaxe oder zur Quengelung sollen sie auch während des Gehens die Auswirkungen von Deformitäten ausgleichen, postoperative Rezidive verhindern, eine Muskelschwäche ausgleichen und überbelastete Gelenkstrukturen entlasten. Letzteres ist bei AMC essenziell, denn chronische Schmerzen – z. B. durch degenerative Gelenkveränderungen – scheinen bei Erwachsenen häufig zu sein: Im Rahmen einer internationalen Online-Befragung von 177 Erwachsenen mit AMC berichteten 50 bis 60 % der Befragten über Rücken- und Gelenkschmerzen 30. Erwachsene mit AMC sind daher maßgeblich in Mobilität und Teilhabe eingeschränkt 31. Leider sind sowohl der Erfahrungsschatz als auch die Erfolgsaussichten für Gelenkersatz bei AMC limitiert 32 33. Umso mehr sollten Orthesen bereits bei Kindern mit AMC Fehlbelastungen verhindern. Ein häufiges Merkmal von Kindern mit AMC, die auf Orthesen angewiesen sind, ist zudem besonders eine muskuläre Schwäche der Kniestrecker 34. Aufgrund einer gesteigerten Knieflexion sind die Kniestrecker aber oft stark belastet, was die Gehstrecke reduziert. Zugleich ist der plantare Abdruck in der Regel limitiert, teilweise auch aufgehoben. Auch Schwierigkeiten aufgrund von Streckkontrakturen oder schwachen Fußhebern, genügend Bodenfreiheit in der Schwungphase zu kreieren, sind limitierend, da im Falle eines Stolperns Stürze nur schlecht abgefangen werden können.
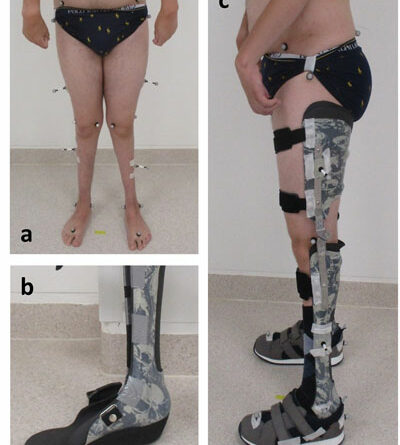
Der Bedarf an orthetischer Unterstützung variiert bereits im Kindesalter; individuelle Maßanfertigungen sind daher die Regel. Das Spektrum reicht von Einlagenversorgungen über AFOs bis hin zu gesperrten KAFOs („knee-ankle foot orthoses“) 35 36 37 38. Zusätzlich werden Schuhzurichtungen verwendet, um vorhandene Konfektions- oder Orthesenschuhe zu optimieren. Der Wunsch, konventionelle Schuhe zu tragen, ist bei Heranwachsenden weit verbreitet. Die Schuhzurichtung erfolgt z. B. über Abrollhilfen oder mittels Schuherhöhungen zum Ausgleich eines Beckenschiefstandes aufgrund anatomischer und funktioneller Beinlängendifferenzen. Auch Keilabsätze, um die Auftrittsfläche zu vergrößern, werden eingesetzt.
Fallbeispiele: orthetische Unterstützung bei AMC
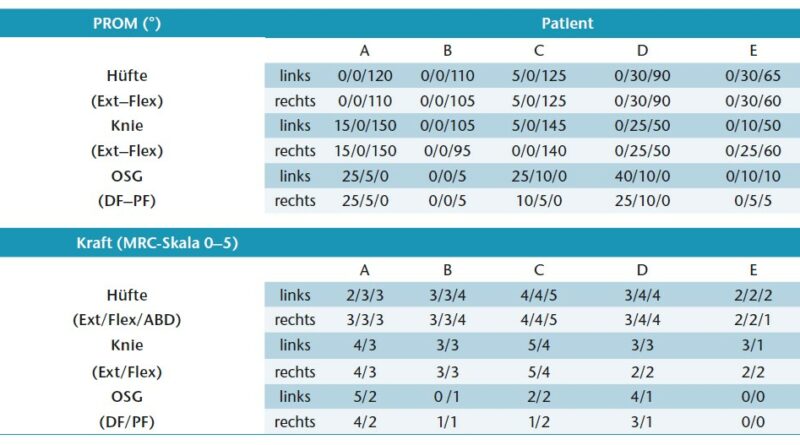
Anhand von fünf Fallbeispielen, die Kinder und Jugendliche mit AMC betreffen, wird im Folgenden das Spektrum der orthetischen Versorgung der unteren Extremität mit AFOs und KAFOs exemplarisch dargestellt. Die Fallbeispiele sind zum einen nach dem Grad der körperlichen Einschränkung (Tab. 1) gereiht, also entsprechend dem Niveau von Gelenkinstabilität, Schwäche und Kontraktur. Die Reihenfolge entspricht zudem der gangbezogenen Mobilität der Patienten – von leicht reduzierter freier Gehstrecke außerhalb des Hauses (Patient/-in A–C) über freie Gehfähigkeit auf kurzen innerhäuslichen Distanzen (Patient D) bis hin zu vollständiger Abhängigkeit von Orthesen für das Gehen (Patientin E).
Zur Routinediagnostik in der Einrichtung der Autoren zählt dabei die Evaluation von Orthesen mittels markerbasierter instrumenteller 3D-Ganganalyse. Somit lassen sich die Effekte bezüglich Gelenkkinetik (Momente und Leistung) und ‑kinematik (Winkel) weiter quantifizieren. In den hier vorgestellten Fällen erfolgten die 3D-Ganganalysen mittels 12 „Vero“-Kameras des Herstellers Vicon (Oxford, Großbritannien) sowie 2 „Optima“-Kraftmessplatten (AMTI, Watertown, MA, USA) mittels der Software „Nexus“ (Vicon). Nachbearbeitung und Analyse erfolgten mittels „Matlab“ (MathWorks, Natick, MA, USA). Dabei wurde berücksichtigt, dass die Funktionalität von Beinorthesen immer mit angezogenen Schuhen geprüft werden sollte und dass das Gehen wann immer möglich auch mit alleinigen Schuhen zu vergleichen ist.
AFOs bei AMC
Patient A
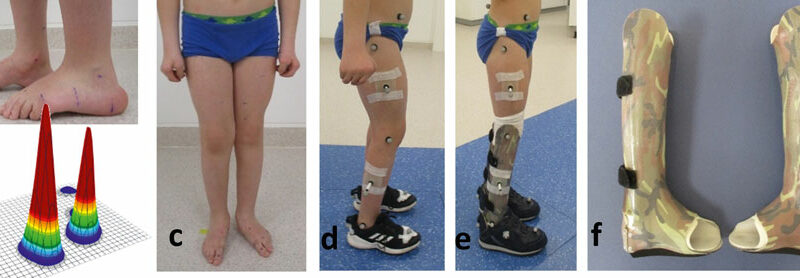
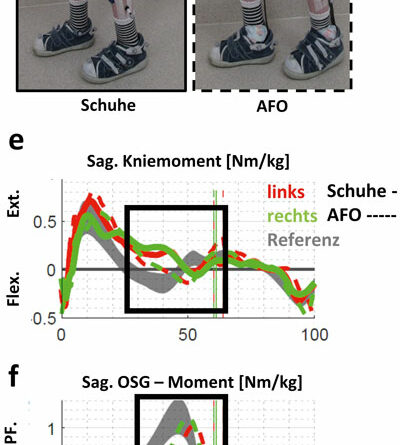
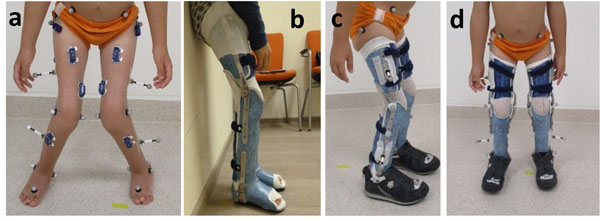
Abbildung 1 zeigt Patient A mit distaler AMC und ausgeprägt instabilen Hackenhohlfüßen (Abb. 1a) nach kongenitalem Talus verticalis. Eine aufgehobene Fußbeweglichkeit nach plantar ist mit einer stark vermehrten Dorsalflexion verbunden. Zudem besteht ein ausgeprägter Valgus der Ferse beidseits bei rigidem unterem Sprunggelenk. Die plantare Druckverteilung (Abb. 1b) visualisiert eine akzentuierte Rückfußbelastung bei fehlendem Lasttransfer in den Vorfuß. Während der Patient noch in leichter Knieflexion steht (Abb. 1d), überstreckt er das Knie beim Gehen (Abb. 2a u. c). Er ist auch passiv deutlich hypermobil im Knie (Tab. 1). Der Vorfuß bleibt hingegen ohne Belastung (Abb. 1b). Anhand der Plantarflexionsmomente der Ganganalyse (Abb. 2d) erkennt man die aufgehobene Kraftentfaltung. Die starre C‑Faserorthese mit vorderer Anlage und dorsalem Sarmiento-Deckel sichert den instabilen Fuß. Der Junge wird dadurch zu einem mobileren Fußgänger; ohne Versorgung konnte er nur kurze Strecken gehen. Ein weiteres Gelenk würde hier nur das Gewicht erhöhen. Durch die leichte keilförmige Unterbauung kommt es zu einem adäquaten Lasttransfer in den Vorfuß. Aufgrund des längeren Hebelarms kann sich nun das Plantarflexionsmoment aufbauen; die Abdruckleistung bleibt allerdings aufgehoben (Abb. 2e). Dazu wären dynamischere Materialien zu verwenden, z. B. innerhalb von Prepreg-Carbon-AFOs mit dorsaler Feder (Abb. 3). Kohlefaserverstärkte Kunststoffe zeichnet neben der hohen Festigkeit und dem niedrigen Gewicht die Fähigkeit zur sogenannten Energierückgabe aus. Eine dorsal gelegene Feder wie bei Patient B in Abbildung 3 wäre ggf. auch für Patient A zu diskutieren; aufgrund der hochgradigen Instabilität des Fußes und der deutlichen sagittalen Überstreckbarkeit des Knies (Tab. 1, Abb. 2c) gehen die Autoren jedoch davon aus, dass diese Defizite für Patient A nicht ausreichend konsolidiert worden wären.
Patientin B
Anders als bei Patient A ist das Knie von Patientin B mit Amyoplasie nicht instabil oder rekurvierbar. Die dorsale Feder (Abb. 3b u. d) hat zum Ziel, die Funktion der Plantarflexoren teilweise zu kompensieren. Zu beachten ist, dass Patientin B einen sehr niedrigen Kraftgrad der Plantarflexoren aufwies (Tab. 1), die höheren sagittalen OSG-Momente beim Gehen mit Schuhen (Abb. 3f) also überwiegend durch passive Kräfte generiert wurden. Mit Orthesen lässt sich aber die aufgenommene Energie im Abdruck zurückgeben (Abb. 3g). Wie die Graphen der 3D-Ganganalyse veranschaulichen, können somit sowohl die Momente der Plantarflexoren (Abb. 3f) als auch deren Gelenkleistung (Abb. 3g) augmentiert werden. Auch die Belastung der Knieextensoren mildert sich (Abb. 3e). Wichtig dabei ist, die Flexibilität der dorsalen Feder durch den manuellen Lagenaufbau so zu kreieren, dass sich die Dorsalextension adäquat kontrollieren lässt. Nachpassungen sind nur sehr eingeschränkt möglich. Aus Sicht der Autoren stellen starke sagittale oder frontale Fuß- bzw. Knieinstabilitäten eine Kontraindikation für eine derartige Versorgung dar. Instabilitäten beeinflussen u. U. die genaue Dosierbarkeit der extern wirkenden Kräfte bei zunehmender Dynamik. Diese sogenannte Posterior-Leaf-Spring-AFOs (hier: Prepreg-Carbon-AFOs mit rückwärtiger Feder) haben zudem keinen definierten Drehpunkt zur anatomischen Achsannäherung.
KAFOs bei AMC
Bei KAFOs (Knie-Sprunggelenk-Fußorthesen) wird zusätzlich das Knie mittels Gelenkführung versorgt. Achs- und Rotationsanomalien erschweren die anatomisch exakte Ausrichtung der Drehachsen.
Patient C
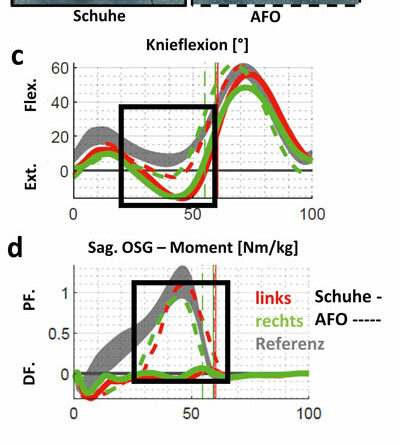
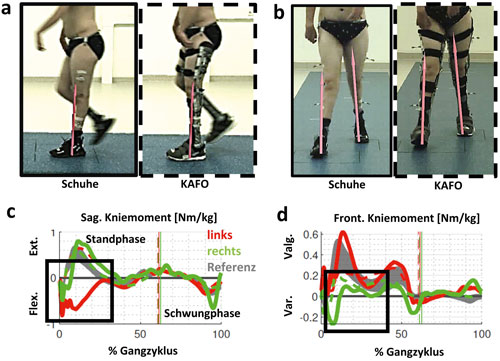
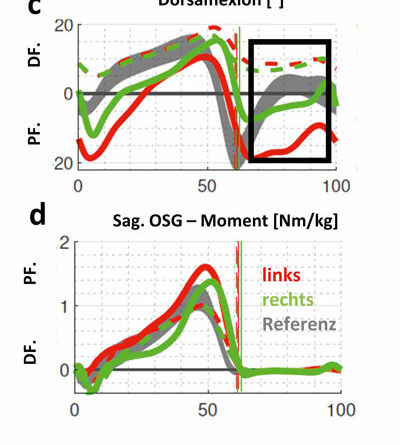
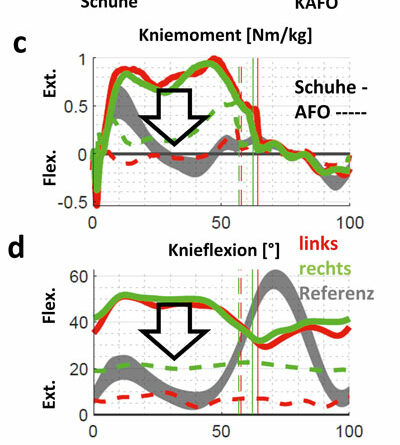
Fallbeispiel C (Abb. 4) betrifft das Genu recurvatum mit zusätzlicher frontaler Achsfehlstellung am Knie. Der funktionelle Fußgänger mit Amyoplasie hat eine passiv freie Knieflexion bei ausgeprägter Fußheberschwäche (Abb. 6a). Klinisch ist die Gelenkbeweglichkeit am OSG deutlich limitiert (Tab. 1). Sein linkes Knie wird daher beim Gehen in Richtung Überstreckung fehlbelastet (Abb. 5c). Der Vektor der Bodenreaktionskraft (roter Pfeil) verläuft nun deutlich anterior zum linken Knie (Abb. 5a) und weit lateral des rechten (Abb. 5b). Dadurch wird links ein starkes inneres Flexionsmoment erzeugt (Abb. 5c); rechts entsteht ein unphysiologisches, extern valgisierendes Drehmoment am Knie (Abb. 5d). Zu beachten ist dabei, dass die dargestellten Ganganalysen mittels eines modifizierten Plug-in-Gait-Marker-Modells absolviert wurden und daher interne Gelenkmomente dargestellt werden. Die Modellierung des Fußes als starres Segment überschätzt dabei die Dorsalflexionsbeweglichkeit des Fußes mit Schuhen unter Belastung in Relation zur passiven Beweglichkeit (Tab. 1). Wie sich visuell zeigte, bog auch der Mittelfuß sagittal etwas auf. Trotz der rigiden Sprunggelenksausrichtung wird in der 3D-Ganganalyse mit KAFO noch eine OSG-Bewegung in der Standphase detektiert (Abb. 6c). Sie ist in diesem Fall jedoch als Artefakt bzw. als Relativbewegung zwischen Schuh und Orthese zu werten. Auffallend ist die Verbesserung der Dorsalflexion im Schwung, da der Fallfuß (Abb. 6c) gehalten wird und sich die Bodenfreiheit steigern lässt (Abb. 6b). Allerdings ist das Plantarflexorenmoment im Abdruck im Vergleich zu Schuhen nun geringfügig reduziert (Abb. 6d) und die Gelenkleistung für den Vortrieb markant limitiert (Abb. 6e). Hier besteht allgemein also noch weiterer Optimierungsbedarf solcher Konstruktionen.
Patient D
Abbildung 7a zeigt Patient D in bilateraler Kauerstellung mit valgischer Knieachse und Knick-Hackenfüßen nach früherem plantarem Release und Achillessehnentenotomie. Der Patient zeigt beidseitig starke passive Beuge- und Streckkontrakturen an Hüfte und Knie (Tab. 1). Die OSG-Beweglichkeit der Hackenfüße weist beidseitig keine Plantarflexion auf. Zudem besteht ein deutlich reduzierter Kraftgrad der Knie- und Hüftstrecker bei aufgehobener Funktion der Plantarflexoren. Die KAFOs aus Acrylharz mit sogenannter Schweizer Gelenksperre (Abb. 7b) verhindern, dass der Patient im Knie einsinkt. Sie werden tagsüber durchgehend getragen; der Patient kann damit mehrere hundert Meter gehen. Mit Schuhen allein sind jeweils nur sehr kurze innerhäusliche Distanzen zurücklegbar. Während der Patient mit Schuhen deutlich in Kauerstellung (vermehrte Knie- und Dorsalflexion) einsinkt (Abb. 8a), schiebt sich der Vektor der Bodenreaktionskraft weit hinter die Drehachse des Knies, wodurch die Strecker des Knies durchgehend hohe Momente leisten müssen (Abb. 8c). Die gesperrte KAFO trägt bilateral also zu einer deutlichen Entlastung bei. Allerdings büßt der Patient damit an Knieflexion in der Schwungphase ein (Abb. 8d).
Patientin E
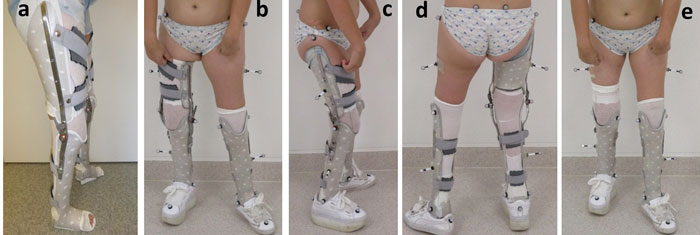
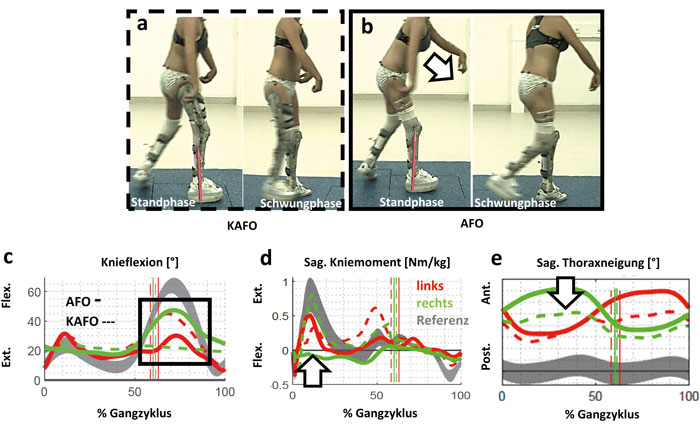
Das abschließende Fallbeispiel E zeigt die stärkste Limitierung der Mobilität (Abb. 9). Die Patientin ist nur mit Schuhen nicht frei gehfähig, jedoch besteht das individuelle Ziel darin, die KAFO abzubauen und ein stabileres und sicheres Gehen ohne Oberhülse zu erreichen. Für die Nacht kann das Gelenk der KAFO mit einem Federgelenk nach Caroli zur weiteren Redression versorgt werden. Klinisch zeigt die Patientin eine ausgeprägte passive Knie- und Hüftflexionskontraktur beidseitig sowie eine stark eingeschränkte Knieflexion (Tab. 1). Distal sind die Füße in leichter Plantarflexion kontrakt – ohne Möglichkeit der Kraftentfaltung. Besonders rechts sind die Strecker des Knies sehr schwach. In der Standphase zeigt die KAFO die deutlich physiologischere Lastaufname in den Momenten (Abb. 10c). Mit alleiniger AFO wird versucht, den Körperschwerpunkt mittels Thoraxneigung (Abb. 10b u. e) vor die Drehachse des Knies zu bringen, da die Kraft der Strecker nicht ausreicht. Dadurch wird das Knie über die gesamte Standphase in Richtung Extension belastet (Abb. 10d), sodass die Kniestrecker entlastet sind. Deshalb war das Gehen mit alleiniger AFO rechts noch deutlich mühsamer. Durch das langsamere Gehen ohne knieübergreifende Versorgung reduziert sich auch auf der Gegenseite die Knieflexion im Schwung. Mit der knieübergreifenden Orthese ist der Patientin allerdings das Anbeugen des rechten Knies aufgrund der gesperrten Flexion nicht möglich (Abb. 10c). Ein Abbau des Oberschenkelteils bzw. eine Steigerung der Freigabe wäre also nur bei weiterer funktioneller Kräftigung kompensierbar.
Befragung zur Mobilität
Im Unterschied zu gesunden Kindern berichten Kinder mit AMC über selbst empfundene Mobilitätsprobleme 39. Sie nehmen ihre eigene körperliche Funktionsfähigkeit als geringer wahr 40. Sowohl bei Kindern als auch bei Erwachsenen kann die Teilnahme an körperlichen Aktivitäten deshalb vermindert sein 41 42.
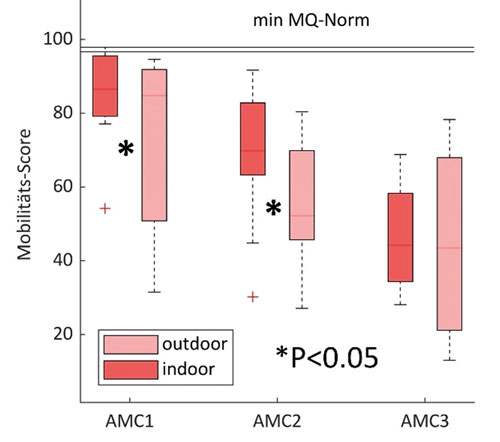
Die Autoren werteten daher die klinische Dokumentation zur Mobilität einer konsekutiven Serie von 22 Kindern (11.2 ± 4.9 Jahre alt) mit Hilfe des MobQues47-Fragebogens 43 zur gangbezogenen Mobilität aus. Dazu wurden die Eltern pädiatrischer Patienten, die zur klinischen Diagnostik im Ganglabor der Schön Klinik Vogtareuth vorgestellt wurden, im Rahmen der Befunderhebung ihres Kindes befragt. Die Kinder wurden zur anschließenden Analyse wie bei Eriksson et al. 44 in 3 Gruppen eingeteilt, der Einfachheit halber mit „AMC 1–3“ bezeichnet (Abb. 11):
- freie Geher ohne Orthesenversorgung (n = 7);
- mit Orthese versorgt, aber grundsätzlich in eingeschränktem Maße ohne Orthese mobil (n = 11; 4 × KAFO, 7 × AFO);
- nicht ohne Orthese gehfähig (n = 4; 3 × KAFO, 1 × AFO).
Mehr Orthese = weniger Mobilität?
Die Mobilität „indoor“ und „outdoor“ sowie zwischen den Gruppen wurde verglichen. Wie bei Eriksson et al. 45 sank auch in der untersuchten Kohorte (n = 22) die Mobilität mit dem Bedarf an orthetischer Unterstützung (Abb. 11). Auf den ersten Blick mag dies logisch erscheinen: Je stärker die Abhängigkeit von Orthesen, desto geringer scheint die Mobilität, was laut Eriksson et al. 46 u. a. auf die Verwendung verriegelter Kniegelenke zurückzuführen ist (vgl. die Patientenbeispiele D u. E). Zusätzlich wurde in der hier vorgestellten Befragung auch zwischen Indoor- und Outdoor-Mobilität unterschieden. Dabei erwies sich, dass die Outdoor-Mobilität bei den Befragten geringer war als die Indoor-Mobilität. Dies galt insbesondere für freie Geher sowie für Kinder und Jugendliche mit AMC, die zwar mit einer Orthese versorgt sind, aber in eingeschränktem Maße auch ohne Orthese mobil wären (vgl. die Patientenbeispiele A–C). Anhand der im Folgenden durchgeführten Detailanalyse lässt sich dies näher erläutern.
Gangbiomechanik und Mobilität
Des Weiteren analysierten die Autoren bei derselben Patientengruppe den statistischen Zusammenhang zwischen der Mobilität und den biomechanischen Kennwerten von Gelenkkinematik und ‑kinetik aus der 3D-Ganganalyse (siehe Tab. 2). Die Analyse erfolgte mittels bivariatem Spearman’schem Rho oder mit Pearson-Korrelationen. Die Auswahl der kinematischen Parameter ist in Tabelle 2 dargestellt. Neben den Minima und Maxima der sagittalen Gelenkkinematik von Hüft‑, Knie- und Oberem Sprunggelenk über den Gangzyklus wurde in der frontalen Gelenkkinematik der ROM („range of motion“) des Thorax und des Beckensegmentes verwendet. Für die Kinetik wurden das maximale Hüftflexormoment, das minimale Knieextensormoment und das maximale Plantarflexormoment am OSG in der Standphase ausgewertet. Die Parameter wurden dabei aus der Ganganalyse mit der Alltagsversorgung extrahiert.
Eine interessante Erkenntnis, die die Autoren daraus ableiten konnten, lautet, dass bei Kindern und Jugendlichen mit AMC das Maß der Mobilität signifikant mit dem Ausmaß der Knieflexion in der Schwungphase zusammenhängt, und zwar sowohl „indoor“ als auch „outdoor“ (Tab. 2). Nicht in der Lage zu sein, die Knie beim Gehen auf Treppen und geneigten Hängen adäquat zu beugen, wurde interessanterweise auch in der Literatur in diesem Zusammenhang als limitierender Faktor genannt 47.
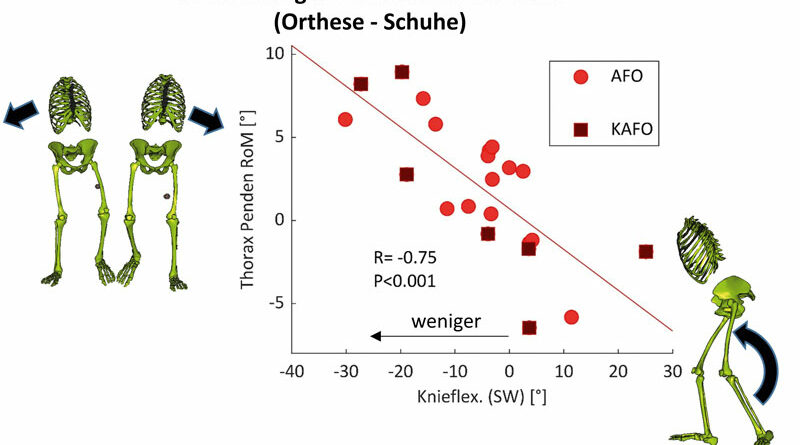
Der Korrelationskoeffizient (eine mathematische Größe zur wechselseitigen Beziehung zweier Variablen) lag dabei bei R = 0,51 und R = 0,63 (draußen wie drinnen), was einen moderaten bis guten statistischen Zusammenhang beschreibt 48. Zudem zeigten z. B. die vertikal unterstützenden Momente der Plantarflexoren einen signifikant positiven Zusammenhang mit mehr Mobilität im Freien (R = 0,40). Ein größeres Pendeln des Thorax schien sich negativ auszuwirken (R = ‑0,43 und R = ‑0,56).
Vergleicht man Kinder mit AMC untereinander, so scheint einer früheren Studie zufolge die Gruppe derer, die beim Gehen auf Orthesen angewiesen sind, mit größeren frontalen Becken- und Oberkörperbewegungen zu gehen als jene Kinder, die zum Gehen nur auf Schuhe zurückgreifen müssen 49. Frontale Pendelbewegungen des Thorax (sogenanntes Duchenne) sind in der Regel zum einen energetisch unökonomisch und führen zum anderen dazu, dass die Einschränkungen von Patienten mit AMC schneller erkannt werden. Eine übermäßige Schrägbewegung des Thorax während des Gehens scheint durch eine verminderte Kraft und Beweglichkeit der Hüfte negativ beeinflusst zu werden 50 und unterstützt die Beckenhebung zur Bodenfreiheit. Eine weitere Erkenntnis, die aus der aktuellen Datenanalyse abgeleitet werden kann, ist in Abbildung 12 dargestellt. Sie zeigt die Veränderungen der maximalen Knieflexion in der Schwungphase gegenüber dem Pendeln des Thorax beim Tragen von Orthesen gegenüber dem Gehen mit Schuhen allein und stellt somit die Effekte der Orthesen dar. Beide Parameter stehen in wechselseitiger Abhängigkeit: Je größer der Verlust an Knieflexion durch die Orthese, desto stärker das Pendeln.
Neben Mobilitätaspekten erfragten Eriksson et al. 51 auch die Zufriedenheit mit Orthesen. Dazu benutzten sie den QUEST-Fragebogen 52. Von Orthesen abhängige Kinder mit AMC waren demnach insbesondere mit dem Orthesengewicht weniger zufrieden. Grundsätzlich führt die Verwendung von Metallkniegelenken zu einem erhöhten Gewicht. Eine Reduktion des Gewichts sollte daher vor allem auch bei der Konstruktion komplexerer Versorgungen angestrebt werden. Ferner geben von Orthesen abhängige Kinder laut Eriksson und Kollegen neben Komfort auch Sicherheit und Benutzerfreundlichkeit als die drei wichtigsten Gütekriterien an 53. Kinder mit AMC, die auch ohne Orthesen gehfähig sind, halten dagegen Benutzerfreundlichkeit, Komfort und Effektivität für essenziell. Insofern liegt es nahe, dass Leichtbau und Stabilität bei größtmöglichem Komfort in der Orthetik vereint werden müssen, um die erlebte Nutzungsqualität zu maximieren.
Fazit
AMC ist zwar selten, aber komplex: Je mehr Gelenke betroffen sind, desto geringer ist die Mobilität und desto größer ist der Bedarf an orthopädietechnischer Unterstützung. Auch schwer betroffene Kinder können durch geeignete Orthesen gehfähig werden. An erster Stelle zielt die Therapie auf die Verbesserung von Mobilität und Selbstversorgung ab 54. Des Weiteren stehen die Förderung des aktiven Muskelgebrauchs und die Vermeidung zusätzlicher Immobilisierung im Vordergrund 55. Wichtiges Ziel ist aber auch die Entlastung überbelasteter Strukturen; außerdem müssen ausgefallene Muskelfunktionen substituiert werden. Die Möglichkeit, physiologische Bewegungsbereiche in vollständigem Ausmaß zu nutzen, ist wesentlich. Die Kombination aus Kontrakturen, Achsdeformität und ausgeprägten Schwächen macht die Versorgung aber anspruchsvoll. Besonders herausfordernd ist, dass Flexions- und Extensionskontrakturen gemeinsam auftreten können, wodurch u. a. die Generierung von genügend Bodenfreiheit erschwert wird. Zudem sind auch frontale oder rekurvierende Kniedeformitäten keine Seltenheit. AFOs kommen hier an ihre Grenzen. Die fünf Fallbeispiele zeigen, wie die biomechanische Effektivität objektiviert werden kann; sie unterstreichen insofern den Stellenwert der 3D-Ganganalyse. Die daraus gewonnenen Erkenntnisse bieten damit sowohl dem Konstrukteur als auch dem Arzt und dem Patienten selbst die Möglichkeit, die Versorgung zu überprüfen. Die Erkenntnis, dass die Mobilität jener Kinder mit AMC, die von Orthesen abhängig sind, grundsätzlich geringer ist, ist nicht weiter erstaunlich. Dennoch sollte sie dazu motivieren, auch komplexere Versorgungen zu optimieren. Stabilität und Leichtbau sollten dabei kein Widerspruch sein; Prepreg-AFOs kommen aus Sicht der Autoren bei starken sagittalen und frontalen Knieinstabilitäten an ihre Grenzen. Dennoch verfolgen Eriksson und Kollegen 56 explorative Ansätze: Die schwedische Arbeitsgruppe zeigte bereits vor einiger Zeit, dass KAFOs in Kombination mit Carbonfedern auch bei AMC denkbar sind.
Orthesen sollten möglichst leicht sein und wenn möglich mit Energierückstellung durch Federn oder Federgelenke arbeiten, so die Auffassung der Autoren, sofern es die Gelenkstabilität zulässt und postoperative Korrekturergebnisse gesichert bleiben. Zukünftig sollten modulare Konzepte entwickelt werden, um z. B. im Rahmen einer Testphase optimale Federkennwerte patientenspezifisch selektieren zu können. Aufgrund der Wichtigkeit einer ausreichenden Knieflexion in der Schwungphase wäre auch über eine gangphasenabhängige Sperrung und Freigabe des Knies bei AMC durch intelligente Systemgelenke nachzudenken.
Für die Autoren:
Dr. phil. Matthias Hösl
MSc Fundamental & Clinical Human
Movement Science
Leitung Gang- und Bewegungsanalyselabor Schön
Klinik Vogtareuth
Kinderorthopädie Schön Klinik Vogtareuth
Krankenhausstraße 20
83569 Vogtareuth
mhoesl@schoen-klinik.de
Begutachteter Beitrag/reviewed paper
Hösl M, Afifi FK, Kröner M, Brosseder S, Roemersberger F, Nader S. Orthesen für die untere Extremität bei Arthrogryposis multiplex congenita: Kann man die Versorgung gehfähiger Kinder und Jugendlicher weiter optimieren? Orthopädie Technik, 2020; 71 (10): 28–38
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 11. Februar 2026
- Dahan-Oliel N, Cachecho S, Barnes D, et al. International multidisciplinary collaboration toward an annotated definition of arthrogryposis multiplex congenita. Am J Med Genet C Semin Med Genet, 2019; 181 (3): 288–299
- Hall JG, Kimber E, van Bosse HJP. Genetics and Classifications. J Pediatr Orthop, 2017; 37 Suppl 1: S4–S8
- Lowry RB, Sibbald B, Bedard T, Hall JG. Prevalence of multiple congenital contractures including arthrogryposis multiplex congenita in Alberta, Canada, and a strategy for classification and coding. Birth Defects Research. Part A, Clinical and Molecular Teratology, 2010; 88 (12): 1057–1061
- Pakkasjärvi N, Ritvanen A, Herva R, Peltonen L, Kestilä M, Ignatius J. Lethal congenital contracture syndrome (LCCS) and other lethal arthrogryposes in Finland – An epidemiological study. American Journal of Medical Genetics Part A, 2006; 140 (17): 1834–1839
- Hall JG, Kimber E, van Bosse HJP. Genetics and Classifications. J Pediatr Orthop, 2017; 37 Suppl 1: S4–S8
- Kimber E. AMC: amyoplasia and distal arthrogryposis. J Child Orthop, 2015; 9 (6): 427–432. doi:10.1007/s11832-015‑0689‑1
- Swinyard CA, Bleck EE. The etiology of arthrogryposis (multiple congenital contracture). Clin Orthop Relat Res, 1985; (194): 15–29
- Amor CJ, Spaeth MC, Chafey DH, Gogola GR. Use of the Pediatric Outcomes Data Collection Instrument to evaluate functional outcomes in arthrogryposis. J Pediatr Orthop, 2011; 31 (3): 293–296
- Steen U, Christensen E, Samargian A. Adults Living With Amyoplasia: Function, Psychosocial Aspects, and the Benefit of AMC Support Groups. J Pediatr Orthop, 2017; 37 Suppl 1: S31–S32
- Lester R. Problems with the upper limb in arthrogryposis. J Child Orthop, 2015; 9 (6): 473–476
- Oishi S, Agranovich O, Zlotolow D, et al. Treatment and outcomes of arthrogryposis in the upper extremity. Am J Med Genet C Semin Med Genet, 2019; 181 (3): 363–371
- Parsch K, Pietrzak S. Arthrogryposis multiplex congenita. Orthopäde, 2007; 36: 281–292
- Dubousset J, Guillaumat M. Long-term outcome for patients with arthrogryposis multiplex congenita. J Child Orthop, 2015; 9 (6): 449–458. doi:10.1007/s11832-015‑0692‑6
- Ho CA, Karol LA. The utility of knee releases in arthrogryposis. J Pediatr Orthop, 2008; 28 (3): 307–313. doi:10.1097/ BPO.0b013e3181653bde
- Bevan WP, Hall JG, Bamshad M, Staheli LT, Jaffe KM, Song K. Arthrogryposis multiplex congenita (amyoplasia): an orthopaedic perspective. J Pediatr Orthop, 2007; 27 (5): 594–600
- Hall JG. Arthrogryposis multiplex congenita: etiology, genetics, classification, diagnostic approach, and general aspects. J Pediatr Orthop B, 1997; 6: 159–166
- Darin N, Kimber E, Kroksmark AK, Tulinius M. Multiple congenital contractures: birth prevalence, etiology, and outcome. J Pediatr, 2002; 140: 61–67
- Murray C, Fixsen JA. Management of knee deformity in classical arthrogryposis multiplex congenita (amyoplasia congenita). J Pediatr Orthop B, 1997; 6 (3): 186–191
- Eamsobhana P, Kaewpornsawan K, Vanitcharoenkul E. Walking ability in patients with arthrogryposis multiplex congenita. Indian J Orthop, 2014; 48 (4): 421–425
- Fassier A, Wicart P, Dubousset J, Seringe R. Arthrogryposis multiplex congenita. Long-term follow-up from birth until skeletal maturity. J Child Orthop, 2009; 3 (5): 383–390
- Kroksmark AK, Kimber E, Jerre R, Beckung E, Tulinius M. Muscle involvement and motor function in amyoplasia. Am J Med Genet A, 2006; 140 (16): 1757–1767
- Eriksson M, Villard L, Bartonek A. Walking, orthoses and physical effort in a Swedish population with arthrogryposis. J Child Orthop, 2014; 8 (4): 305–312. doi:10.1007/s11832-014‑0597‑9
- Eriksson M, Villard L, Bartonek A. Walking, orthoses and physical effort in a Swedish population with arthrogryposis. J Child Orthop, 2014; 8 (4): 305–312. doi:10.1007/s11832-014‑0597‑9
- Stief F, Bohm H, Ebert C, Doderlein L, Meurer A. Effect of compensatory trunk movements on knee and hip joint loading during gait in children with different orthopedic pathologies. Gait Posture, 2014; 39 (3): 859–864
- Eriksson M, Gutierrez-Farewik EM, Broström E, Bartonek A. Gait in children with arthrogryposis multiplex congenita. J Child Orthop, 2010; 4 (1): 21–31
- Eriksson M, Bartonek Å, Pontén E, Gutierrez-Farewik EM. Gait dynamics in the wide spectrum of children with arthrogryposis: a descriptive study. BMC Musculoskelet Disord, 2015; 16: 384
- Stief F, Bohm H, Ebert C, Doderlein L, Meurer A. Effect of compensatory trunk movements on knee and hip joint loading during gait in children with different orthopedic pathologies. Gait Posture, 2014; 39 (3): 859–864
- Oishi S, Agranovich O, Zlotolow D, et al. Treatment and outcomes of arthrogryposis in the upper extremity. Am J Med Genet C Semin Med Genet, 2019; 181 (3): 363–371
- van Bosse HJP, Pontén E, Wada A, et al. Treatment of the Lower Extremity Contracture/Deformities. J Pediatr Orthop, 2017; 37 Suppl 1: S16–S23
- Nouraei H, Sawatzky B, MacGillivray M, Hall J. Long-term functional and mobility outcomes for individuals with arthrogryposis multiplex congenita. Am J Med Genet A, 2017; 173 (5): 1270–1278. doi:10.1002/ ajmg.a.38169
- Cirillo A, Collins J, Sawatzky B, Hamdy R, Dahan-Oliel N. Pain among children and adults living with arthrogryposis multiplex congenita: A scoping review. Am J Med Genet C Semin Med Genet, 2019; 181 (3): 436–453. doi:10.1002/ajmg.c.31725
- Cameron HU. Total joint replacement in multiplex congenita contractures: a case report. Can J Surg, 1998; 41 (3): 245–247
- Fisher KA, Fisher DA. Total hip and knee replacement in a patient with arthrogryposis multiplex congenita. Am J Orthop (Belle Mead NJ), 2014; 43 (4): E79–E82
- Eriksson M, Bartonek Å, Pontén E, Gutierrez-Farewik EM. Gait dynamics in the wide spectrum of children with arthrogryposis: a descriptive study. BMC Musculoskelet Disord, 2015; 16: 384
- Eriksson M, Villard L, Bartonek A. Walking, orthoses and physical effort in a Swedish population with arthrogryposis. J Child Orthop, 2014; 8 (4): 305–312. doi:10.1007/s11832-014‑0597‑9
- Eriksson M, Gutierrez-Farewik EM, Broström E, Bartonek A. Gait in children with arthrogryposis multiplex congenita. J Child Orthop, 2010; 4 (1): 21–31
- Eriksson M, Bartonek Å, Pontén E, Gutierrez-Farewik EM. Gait dynamics in the wide spectrum of children with arthrogryposis: a descriptive study. BMC Musculoskelet Disord, 2015; 16: 384
- Bartonek Å. The use of orthoses and gait analysis in children with AMC. J Child Orthop, 2015; 9 (6): 437–447
- Burström K, Bartonek Å, Broström EW, et al. EQ-5D‑Y as a health- related quality of life measure in children and adolescents with functional disability in Sweden: testing feasibility and validity. Acta Paediatr, 2014; 103 (4): 426–435
- Eriksson M, Jylli L, Villard L, Kroksmark AK, Bartonek Å. Health- related quality of life and orthosis use in a Swedish population with arthrogryposis. Prosthet Orthot Int, 2018; 42 (4): 402–409
- Amor CJ, Spaeth MC, Chafey DH, Gogola GR. Use of the Pediatric Outcomes Data Collection Instrument to evaluate functional outcomes in arthrogryposis. J Pediatr Orthop, 2011; 31 (3): 293–296
- Nouraei H, Sawatzky B, MacGillivray M, Hall J. Long-term functional and mobility outcomes for individuals with arthrogryposis multiplex congenita. Am J Med Genet A, 2017; 173 (5): 1270–1278. doi:10.1002/ ajmg.a.38169
- Roorda LD, Scholtes VA, van der Lee JH, Becher J, Dallmeijer AJ. Measuring mobility limitations in children with cerebral palsy: development, scalability, unidimensionality, and internal consistency of the mobility questionnaire, MobQues47. Arch Phys Med Rehabil, 2010; 91 (8): 1194– 120
- Eriksson M, Jylli L, Villard L, Kroksmark AK, Bartonek Å. Health- related quality of life and orthosis use in a Swedish population with arthrogryposis. Prosthet Orthot Int, 2018; 42 (4): 402–409
- Eriksson M, Jylli L, Villard L, Kroksmark AK, Bartonek Å. Health- related quality of life and orthosis use in a Swedish population with arthrogryposis. Prosthet Orthot Int, 2018; 42 (4): 402–409
- Eriksson M, Jylli L, Villard L, Kroksmark AK, Bartonek Å. Health- related quality of life and orthosis use in a Swedish population with arthrogryposis. Prosthet Orthot Int, 2018; 42 (4): 402–409
- Eriksson M, Jylli L, Villard L, Kroksmark AK, Bartonek Å. Health- related quality of life and orthosis use in a Swedish population with arthrogryposis. Prosthet Orthot Int, 2018; 42 (4): 402–409
- Altman, DG. Practical statistics for medical research. London: Chapman & Hall, 1999
- Eriksson M, Gutierrez-Farewik EM, Broström E, Bartonek A. Gait in children with arthrogryposis multiplex congenita. J Child Orthop, 2010; 4 (1): 21–31
- Böhm H, Dussa CU, Multerer C, Döderlein L. Pathological trunk motion during walking in children with amyoplasia: is it caused by muscular weakness or joint contractures? Res Dev Disabil, 2013; 34 (11): 4286– 4292. doi:10.1016/j.ridd.2013.09.020
- Eriksson M, Jylli L, Villard L, Kroksmark AK, Bartonek Å. Health- related quality of life and orthosis use in a Swedish population with arthrogryposis. Prosthet Orthot Int, 2018; 42 (4): 402–409
- Demers L, Weiss R, Ska B. The Quebec User Evaluation of Satisfaction with Assistive Technology (QUEST 2.0): An overview and recent progress. J Tech Disab, 2002; 14: 101–105
- Eriksson M, Jylli L, Villard L, Kroksmark AK, Bartonek Å. Health- related quality of life and orthosis use in a Swedish population with arthrogryposis. Prosthet Orthot Int, 2018; 42 (4): 402–409
- Eamsobhana P, Kaewpornsawan K, Vanitcharoenkul E. Walking ability in patients with arthrogryposis multiplex congenita. Indian J Orthop, 2014; 48 (4): 421–425
- Kimber E. AMC: amyoplasia and distal arthrogryposis. J Child Orthop, 2015; 9 (6): 427–432. doi:10.1007/s11832-015‑0689‑1
- Burström K, Bartonek Å, Broström EW, et al. EQ-5D‑Y as a health- related quality of life measure in children and adolescents with functional disability in Sweden: testing feasibility and validity. Acta Paediatr, 2014; 103 (4): 426–435

![Bivariate Korrelationen (Spearman’sches Rho oder Pearson-Korrelationen) zwischen der erfragten Mobilität und den Gangparametern (Extrema über den Gangzyklus [Kinematik] und Standphase [Kinetik]) bei Patienten mit AMC; *p < 0.05, **p < 0.01.](https://360-ot.de/wp-content/uploads/2020/09/Tabelle-2-1-800x445.jpg)