Ein selektiver Nerventransfer (“targeted muscle reinnervation”, TMR) erhöht nicht nur die Anzahl intuitiver Steuersignale für eine myoelektrisch gesteuerte Prothese, sondern verringert auch Neuromund Phantomschmerzen. Die Kombination beider Verfahren stellt ein mögliches Konzept innerhalb der Stumpfrevisionschirurgie dar und bietet neue Möglichkeiten, um die Akzeptanzrate geeigneter Patienten auszubauen. Zukünftige Aspekte der Osseointegration einschließlich neuer Therapieoptionen unter Verwendung implantierter Elektroden sind eine vielversprechende Aussicht für die Kombination beider Verfahren. Der Artikel schildert die praktischen Erfahrungen der Autorinnen und Autoren mit der kombinierten Versorgung in der Universitätsmedizin Göttingen.
Einleitung
Seit den achtziger Jahren eröffnet ein wesentlicher Fortschritt innerhalb der Prothesentechnologie neue Versorgungsmöglichkeiten: Myoelektrische Prothesen nutzen Muskelkontraktionen der residuellen Stumpfmuskulatur, um die Prothese zu steuern. Dabei dient die Aktivität des Muskels – ein sogenanntes Elektromyogramm (EMG) – als Steuersignal, das mittels Elektroden auf der Haut gemessen und zur Steuerung der Prothesenfunktion genutzt werden kann 1. Für einen Menschen mit transhumeraler Amputation bedeutet dies, dass die Ellbogenextension und ‑flexion des prothetisch ersetzten Ellenbogengelenks durch Bizeps- und TrizepsKontraktionen gesteuert werden kann.
Um die Rotation des Handgelenks auszulösen, muss der Benutzer dann jedoch eine sogenannte Ko-Kontraktion generieren. Dabei handelt es sich um das gleichzeitige Anspannen beider Muskelgruppen. Weitere Kodierungsmöglichkeiten sind zwei schnell aufeinander folgende Bizepsmuskel-Kontraktionen oder die manuelle Freischaltung des Handgelenks mittels Schalter.
Durch einen solchen Steuerungsmechanismus können Ellenbogen, Handgelenk und Hand jedoch nur nacheinander und nicht gleichzeitig bewegt werden. Somit sind die Ablehnungsraten entsprechender Versorgungen trotz der Fortschritte insgesamt sehr hoch, insbesondere wenn nicht die dominante Hand betroffen ist. Bei Menschen mit transhumeraler Amputation werden Ablehnungsraten von bis zu 57 %, bei Schulterexartikulationen Ablehnungsraten von 60 % beschrieben 2. Die häufigsten Gründe:
- schlechte Funktionalität,
- Schmerzen,
- schlechter Komfort,
- mechanisches Versagen und
- mangelnde Sensibilität.
Zwar sind heute multiartikulierende Hände mit über 30 unterschiedlichen Griffmustern kommerziell erhältlich. Der entwicklungstechnische “Flaschenhals” bleibt jedoch weiterhin der Wunsch nach einer intuitiveren Ansteuerung dieser zahlreichen Griffmuster entsprechend der physiologischen Handfunktion: schnell, präzise und sicher 3.
Selektiver Nerventransfer — “targeted muscle reinnervation” (TMR)
Vielversprechend ist in diesem Zusammenhang eine Technik, die “targeted muscle reinnervation” (TMR), wörtlich übersetzt “gezielte MuskelReinnervation”, genannt wird und die im Folgenden beschrieben wird. Bei der TMR werden die Armnervenstümpfe im Amputationsstumpf durch eine direkte Nervennaht auf die verbleibenden Armmuskeln transferiert. Diese originären Handnerven reinnervieren somit den Oberarmmuskel, auf den sie transferiert wurden, entsprechend ihrer ursprünglichen Handfunktion. Bei der Wahl der Muskeln werden stumpfnahe Muskeln ausgewählt, die nach der Amputation biomechanisch nicht mehr relevant sind. Nachdem sie von den Armnerven reinnerviert wurden, dienen diese Muskeln am Stumpf als “biologische Verstärker” und steuern die Prothese. Die daraus resultierenden Elektromyographiesignale (EMG) können simultan Handgelenk und Hand 4 kontrollieren. Für TMR konnten nicht nur Vorteile bezüglich der Kontrolle und Steuerung der Prothesenfunktion, sondern auch für die Reduktion von Postamputationsschmerzen wie Neurom- und Phantomschmerzen nachgewiesen werden. TMR kann präventiv gegen Neurombildung eingesetzt werden 5 6 7 8.
Osseointegration (OI)
Die übliche Schnittstelle zwischen Stumpf und Prothese ist ein traditionelles Schaftsystem. Damit der Stumpf im Prothesenschaft optimal sitzt, werden individuelle Innenschäfte mit äußeren (Carbon-)Schalen oder Silikonliner eingesetzt. Die Materialeigenschaften der verwendeten Werkstoffe sorgen gleichermaßen für Haftung, Stabilität und Flexibilität; ein optimales Schaftsystem ist für die Prothesenfunktion von größter Bedeutung. Unbequeme, schmerzhafte und instabile Konstruktionen zusammen mit den limitierten Kontrollmechanismen sind verantwortlich für die oben genannten hohen Ablehnungsraten 9.
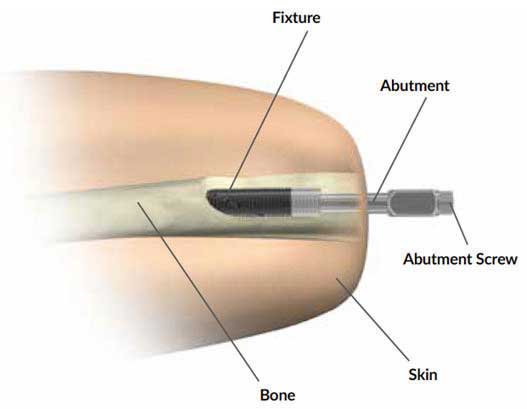
Der Ausdruck “Bionik” beschreibt die Synergie von Biologie und Technik. Bionik innerhalb von Prothesentechnologien konzentriert sich insbesondere auf Mensch-Maschine-Schnittstellen 10. Die Osseointegration (OI) schafft eine direkte Schnittstelle zwischen Implantat und Knochen: Die Architektur intramedullärer Implantate integriert über einwachsende Osteoblasten und Bindegewebe das Implantat in den Knochen und fungiert auf diese Weise als direkte Skelettbefestigung für die Prothese.
Das Prinzip der Osseointegration wurde von Per-Ingvar Brånemark entwickelt, der in den frühen 1960er Jahren osseointegrierte Zahnimplantate fertigte. Sein Sohn, der Orthopäde Rickard Brånemark, Co-Autor dieses Artikels, führte diese Technologie zur Rehabilitation von Amputierten in den 1990er Jahren ein und entwickelte in diesem Zusammenhang das sogenannte OPRA-System (“Osseoanchored Prosthesis for the Rehabilitation of Amputees”) in Schweden 11. Nach dem Erfolg des OPRA-Systems wurden weitere Implantate mit konzeptionell einzigartigen Designs und eigenen operativen Ansätzen entwickelt. Bislang sind drei Systeme kommerziell international erhältlich:
- das bereits erwähnte OPRA-System,
- das OPL-System (“Osseointegration Prosthetic Limb”) aus Australien sowie
- das ILP-System (“Integral Leg Prosthesis”) aus Deutschland 12 13.
Vorteile der Knochenverankerung der Prothesen:
- eine stabilere Fixierung der Prothese am Nutzer
- bei gleichzeitig erhöhter Bewegungsfreiheit und
- gesteigertem Komfort, z. B. durch schnelles An- und Ausziehen, sowie
- eine besserer Körperwahrnehmung, u. a. durch die über den Knochenkontakt entstehende sogenannte Osseoperzeption, die durch die sensible Innervation der Kortikalis entsteht. Sekundär führen diese Effekte zur einer verbesserten Funktionsfähigkeit und einer messbaren Steigerung der Lebensqualität und der Nutzungsdauer der Prothese.
Gegenwärtig liegen zwei Studien mit Langzeitergebnissen zur Osseointegration der unteren ExtremitätIm Knochen verankerte osseointegrierte Implantate für Unterschenkelamputierte: chirurgische Aspekte und Implantatdesign vor 14 15. Die Implantat-Überlebenszeiten nach 5 Jahren betrugen demnach über 90 %; der revisionsfreie Anteil der Patienten mit einer Implatation nach 5 Jahren betrug 45 %. Insgesamt mussten 7 % der Implantate entfernt werden. Oberflächliche Infektionen traten bei etwa 50 %, tiefe Infektionen bei 20 % der Patienten auf.
Neben den Vorteilen – schaftfreie, direkte Prothesenverankerung, Osseoperzeption, Wiederherstellung der originären Kraftvektoren und Reduktion von Kompensationsbewegungen der benachbarten Gelenke – birgt eine Osseointegration allerdings auch Risiken:
Die direkte Knochenverankerung von Exoprothesen hat vor allem für die Anwendung in der unteren Extremität eine breite Akzeptanz gewonnen. Auch für die obere Extremität gilt, dass die Aufrechterhaltung der mechanischen Integrität an der Grenzfläche zwischen Knochen und Implantat für eine sichere klinische Behandlung von entscheidender Bedeutung ist, insbesondere während der Nutzung der Prothese innerhalb des Bewegungsraumes oberhalb von 90° Schulterabduktion. Denn dann treten extrem hohe Axialkräfte, Biege- und Torsionsmomente auf. Ergebnisse biomechanischer Untersuchungen zeigen, dass proximalere (25 %) Amputationshöhen (transhumeral und glenohumeral) signifikant höhere Axialkräfte und Biegemomente aufweisen als distalere Amputationsniveaus. Die berechneten Belastungen liegen im Bereich des Versagens der Implantatfixierung. Periprothetische Frakturen können jedoch auch bei berührungslosen ADLs auftreten (z. B. beim Springen). Die Entwicklung von Überlastschutzgeräten und geeignete postoperative Rehabilitationsprotokolle können diese Risiken jedoch reduzieren.
Amputationen aufgrund vaskulärer Ursachen wie z. B. periphere arterielle Verschlusskrankheit (pAVK) oder Mikroangiopathien wie z. B. beim Diabetes mellitus stellen je nach Herstellerangaben absolute oder relative Kontraindikationen dar, da eine eingeschränkte Perfusion Knochenintegration und Wundheilung kompromittieren kann. Gleiches gilt für Patienten, die Chemotherapeutika oder eine Dauermedikation mit hochdosierten Immunsuppressiva erhalten. Kritisch zu beurteilen sind zudem Erkrankungen aus dem psychiatrischen Formenkreis, eine mangelnde Compliance oder auch Geschäftsunfähigkeit, die eine verlässliche Zusammenarbeit zwischen Patienten, Arzt und Orthopädietechniker gefährden können. Ein im Wachstum befindliches Skelett kann bisher nicht mittels OI versorgt werden. Rauchen stellt eine relative Kontraindikation dar; es sollte für mindestens 3 Wochen vor bis 4 Wochen nach der Intervention eingestellt werden. Ebenso darf kein Anhalt für eine Minderperfusion des Stumpfes wie ein kalter Stumpf, eine verlängerte Rekapillarisierungszeit (> 2 Sekunden) oder Ulzerationen vorliegen.
Kombination von TMR und Osseointegration
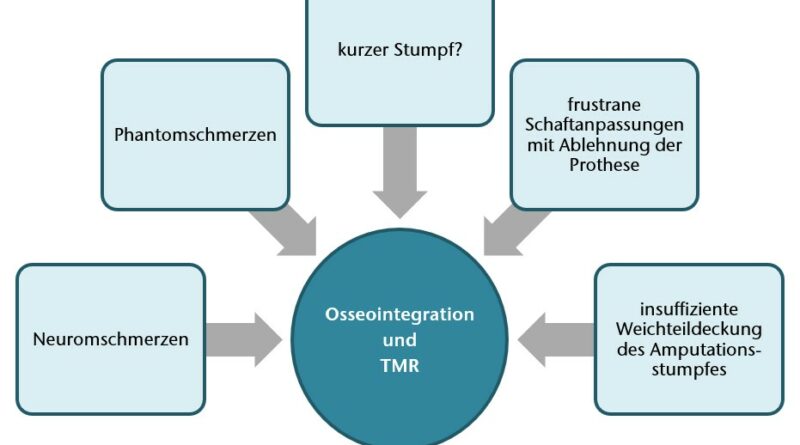
Vor einigen Jahren wurden erstmalig beide innovativen Verfahren kombiniert durchgeführt (März 2015, Dr. Richard McGough, Universität von Pittsburg, Medical Center; Fabrikat des Implantats: Zimmer Biomet; Patient mit transhumeraler Amputation mit vorheriger TMR-Operation) 18. Menschen mit Amputation schildern häufig einem Symptomkomplex von Post-Amputationsschmerzen. Den Hauptanteil stellen schmerzhafte Stumpfneurome dar (bis zu 80 %), aber auch Schmerzen aufgrund von mechanischen Komplikationen mit einem eingeschränkten Tragekomfort gehören zu den Hauptgründen der Konsultation eines Chirurgen oder zur Indikation zu einer chirurgischen Stumpfrevision 19 20.
Im Folgenden beschreiben die Autoren die ersten Erfahrungen mit diesem Kombinationsverfahren in der Universitätsmedizin Göttingen.
Erfahrungsbericht
Rekrutierung der Patienten, Indikationsstellung
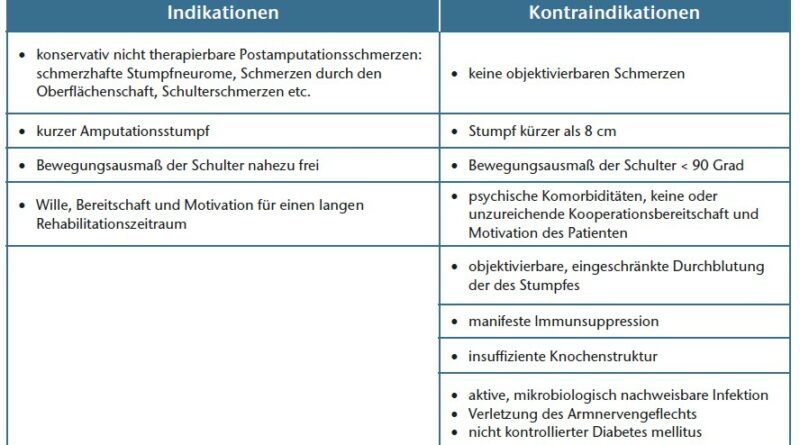
Im Rahmen der Interdisziplinären Spezialsprechstunde für Amputationsmedizin an der Universitätsmedizin Göttingen stellen sich jährlich bis zu 120 Patienten mit Schmerzen am Amputationsstumpf vor. Leiden die Patienten an Phantom- und/oder Neuromschmerzen mit reliablem Hoffmann-Tinel-Zeichen im Bereich der schmerzhaften Stumpfneurome, so ist dies eine mögliche Indikation für einen selektiven Nerventransfer. Ist der Stumpf sehr kurz, bestehen schwierige Hautverhältnisse (etwa bei Meshgraft-Deckungen) oder war die bisherige Schaftversorgung nicht zufriedenstellend und traten Hautirritationen, Probleme durch Schwitzen oder Schmerzen persitierend auf, dann stellt eine Osseoingration als schaftfreie Versorgungsmöglichkeit eine sinnvolle Versorgungsalternative dar.
Ein eingeschränktes Bewegungsausmaß im Schultergelenk und eine proximale Verletzung des Plexus brachialis mit denervierten Armmuskeln sollten ausgeschlossen werden. Dazu wird das Bewegungsausmaß in Grad in Ante-/Retroversion und Abduktion bzw. Elevation sowie der Kraftgrad nach Janda der verbleibenden Armmuskeln und der stumpfnahen Rumpfmuskeln bestimmt (z. B. M. supraspinatus, M. pectoralis major, M. latissmus dorsi, M. biceps und triceps humeri etc.) (Tab. 1).
Präoperative Diagnostik
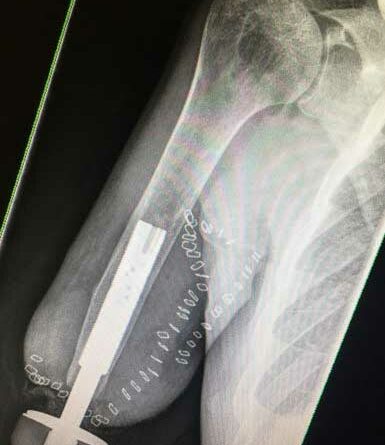
Nach Erläuterung der Vor- und Nachteile beider invasiver Verfahren folgt ein Aufenthalt mit umfassender Diagnostik zur Feststellung der Eignung für das geplante Kombinationsverfahren (Abb. 1) Die Schnittbildgebung (CT Arm/Schulter) sollte in einer Schichtdicke von maximal einem Millimeter erfolgen. Anhand der Schnittbilder wird beurteilt, ob die Kortikalis kräftig genug ist und somit die Knochenqualität am distalen Stumpf für eine erfolgreiche Osseointegration ausreicht. Die Schnittbildgebung dient ebenso der weiteren Auswahl bzw. der Planung des Implantats (Länge, Durchmesser). Sollten vom Unfallmechanismus, bestehender Komorbiditäten oder eines klinischen Untersuchungsbefundes Zweifel bestehen, ob eine begleitende Gefäßverletzung mit eingeschränkter Perfusion des Armes vorliegt, wird die Diagnostik um eine (CT-)Angiographie ergänzt. Bei Verdacht auf Nervenschäden wird eine neurologische Untersuchung inklusive EMG-Messungen und/oder Neurographien präoperativ durchgeführt.
Des Weiteren prüfen Psychologen, ob der Patient Wesen und Tragweite seiner Entscheidung für diesen invasiven Revisionsschritt erfasst hat, und schließen Patienten mit instabilen Persönlichkeitsstörungen aus, die ein erfolgreiches Rehabilitationsziel gefährden könnten.
Implantat und Operation
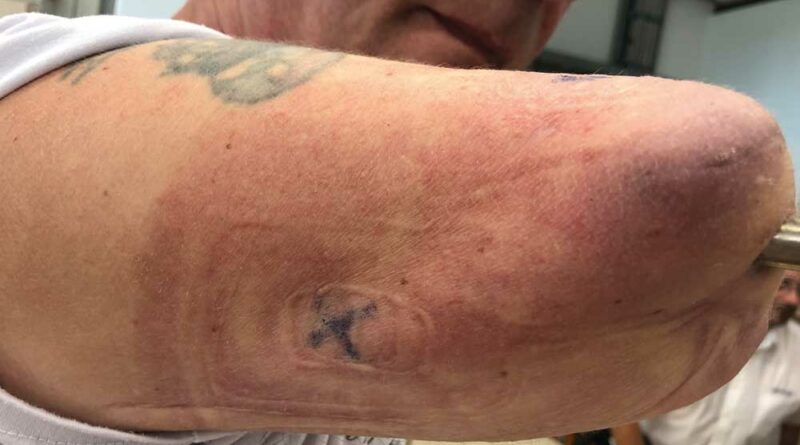
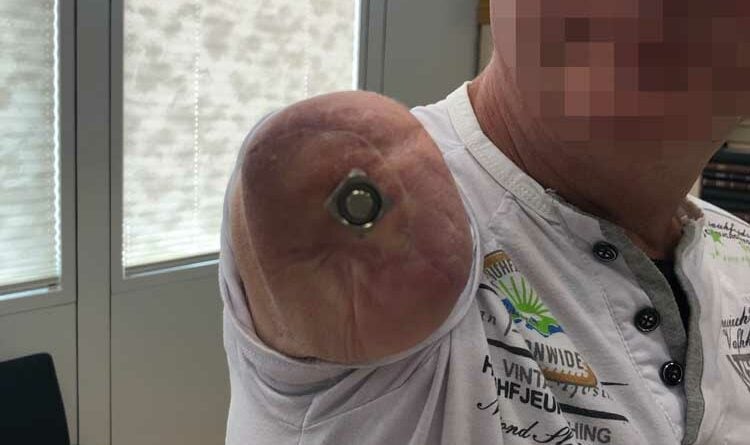
Der Eingriff erfolgt in Vollnarkose und erfordert ein interdisziplinäres Team aus Orthopäden und Plastischen Chirurgen. In der Klinik der Autoren wird das OPRA-Implantat (“Osseoanchored Prosthesis for the Rehabilitation of Amputees”; Fa. Integrum, Schweden) verwendet. In einer Operation wird der intramedulläre Anteil der Prothese implantiert, mit Hilfe eines Schraubsystems verankert und dann der Hautaustritt plastisch konstruiert. Der externe Anteil des Implantats wird ausgeleitet. Der präparierte Hautmantel wird dann inklusive des Hautaustritts vorsichtig umgeschlagen, damit der mikrochirurgische Nerventransfer nach Präparation der Armnervenneurome und Empfängernerven erfolgen kann (Abb. 2a–d).
Eine intraoperative Durchleuchtung dokumentiert den exakten Sitz des Implantats im Markraum. Postoperativ erhalten alle Patienten 3 Monate lang 1000 mg Calcium und 2000 Einheiten Vitamin D, um die Osseointegration zu unterstützen. Auf nichtsteroidale Antirheumatika (Ibuprofen etc.) sollte verzichtet werden, da sie den Prozess beeinträchtigen können.
Rehabilitation
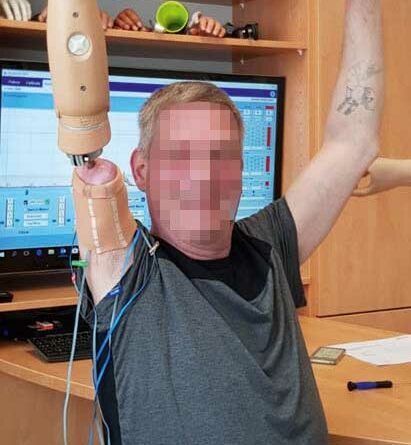
Die Rehabilitation folgt den Herstellerangaben 21 22. Nach abgeschlossener Wundheilung sollte die Schulterbewegung ohne Widerstand und bis 90 Grad Abduktion beübt werden. Nach frühestens 6 Wochen und radiologischer Kontrolle wird dem Patienten gemeinsam mit einem heimatnahen Therapeuten ein sogenanntes Training-Kit mit einer “short training prosthesis” (dt. “kurze Trainingsprothese”) zur stufenweisen Gewichtsaufsteigerung ausgehändigt. Neben Physiotherapie zum Erhalt und Ausbau des Bewegungsausmaßes der Schulter sowie Kräftigung der Rumpf- und Rückenmuskulatur kann die “short training prosthesis” von nun an getragen werden. Das Eigengewicht dieser Trainingsprothese beträgt nur 400 Gramm.
Nach der 6. postoperativen Woche kann der Patient mit einem Auflastungs- und Belastungsprotokoll, das wöchentlich um 50 bis 100 Gramm gesteigert wird, beginnen. Das TrainingKit umfasst Gewichte von 50, 100, 200 und 400 Gramm. Die Auflastung ist beendet, wenn ca. 1300 Gramm erreicht sind (Abb. 3a u. b). Wenn die Schmerzen über 4 von 10 auf der Visuellen Analogskala liegen, sollte eine weitere Auflastung in der Folgewoche entfallen. Nach abgeschlossener Auflastung wird begonnen, die endgültige Prothese anzupassen. Diese wird zunächst nur stundenweise getragen.
Nach abgeschlossener Wundheilung folgt entsprechend dem Rehabilitationsprotokoll ein standardisiertes Trainingsprogramm zum Signaltraining einer konventionellen TMR-Versorgung 23 (Abb. 4).
Ergebnisse
Das Kombinationsverfahren stellt eine schaftfreie Versorgungalternative für amputierte Patienten mit Phantom- und/oder Neuromschmerzen dar, die zudem unter therapieresistenten schaftassoziierten Problemen leiden. Eine umfassende präoperative Diagnostik mit klinischer Untersuchung und apparativer Diagnostik ist obligat, um zu prüfen, ob ein Patient für diese Kombinationsprozedur geeignet ist (Abb. 5). Einschränkungen des aktiven Bewegungsausmaßes des Schultergelenks sollten ausgeschlossen werden und der Knochen eine suffiziente Kortikalisdicke aufweisen.
Patienten mit einer proximalen Verletzung des Plexus brachialis und instabiler Persönlichkeitsstruktur oder Suchterkrankungen sollten von dieser Prozedur ausgeschlossen werden. Ein festes Rehabilitationsprotokoll mit einem interdisziplinären Team, das die Auflastung mit der kurzen Trainingsprothese und die Versorgung mit einer Myoprothese nach eine einem selektiven Nerventransfer (“TMR”) koordiniert, sind elementar für den postoperativen Rehabilitationserfolg.
Diskussion & Fazit
In einem Revisionseingriff können beide Verfahren – TMR und Osseointegration – kombiniert werden. Beide Technologien ergänzen sich. Zum einen wird durch den selektiven Nerventransfer die Anzahl der sonst üblichen Steuersignale ausgebaut. Zum anderen wird durch das direkte Andocken der Prothese das Prothesengewicht nicht flächig über die Oberfläche des Schaftes und des Oberarmstumpfes übertragen, sondern direkt über den physiologischen humeralen Kraftvektor. Dadurch können Stumpfschmerzen durch einen eingeschränkten Schaftkomfort reduziert werden und auch sehr kurze transhumerale Amputationsstümpfe versorgt werden 24. Das Kombinationsverfahren wird gegenwärtig dadurch limitiert, dass die Elektroden zur Detektion der Myosignale weiterhin transkutan am Strumpf, in einem Band, Silikonliner oder als Klebeelektroden fixiert werden müssen.
Ausblick
Das neue System “e‑OPRA” verwendet eine modifizierte Abutmentschraube (implantierter Schraubenanteil), um den Durchgang transkortikaler Drähte zwischen implantierbaren Elektroden (epimysial, auf dem Muskel liegend) und dem Endgerät – der Prothese – zu ermöglichen und das transkutane Elektrodenproblem zu adressieren. Dieses System wird in Europa bereits klinisch eingesetzt und zeigt erste stabile Ergebnisse für eine EMG-Detektion direkt auf dem Muskel 25.
Für die Autoren:
Dr. med. Jennifer Ernst
Fachärztin für Plastische Chirurgie
Universitätsmedizin Göttingen
Klinik für Unfallchirurgie, Orthopädie
und Plastische Chirurgie
Robert-Koch-Straße 40
37075 Göttingen
jennifer.ernst@med.uni-goettingen.de
Prof. Dr. Frank Braatz
Leiter Schwerpunkt Orthobionik
Universitätsmedizin Göttingen
Klinik für Unfallchirurgie, Orthopädie
und Plastische Chirurgie
Professor für Medizinische Orthobionik
Private Hochschule Göttingen (PFH/
ZHT); Robert-Koch-Straße 40
37075 Göttingen
braatz@pfh.de
PD Dr. Gunther Felmerer
Leitender Arzt Plastische und
Ästhetische Chirurgie
Universitätsmedizin Göttingen
Klinik für Unfallchirurgie, Orthopädie
und Plastische Chirurgie
Robert-Koch-Straße 40
37075 Göttingen
gunther.felmerer@med.uni-goettingen.de
Begutachteter Beitrag/reviewed paper
Interdisziplinäre Spezialsprechstunde für Amputationsmedizin Klinik für Unfallchirurgie, Orthopädie und Plastische Chirurgie Universitätsmedizin Göttingen Terminvereinbarung: 0551–39 20401
Ernst J, Andres E, Bötticher J, Jäger L, Helbing R, Oelßner B, Reinelt S, Wüstefeld D, Wittich M, Lehmann W, Branemark R. Braatz F, Felmerer G. Neue Dimensionen in der prothetischen Extremitätenrekonstruktion — TMR meets Osseointegration. Orthopädie Technik, 2020; 71(8): 40–45
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 11. Februar 2026
- Scott RN, Parker P A. Myoelectric prostheses: state of the art. Journal of Medical Engineering & Technology, 1988; 12 (4): 143–151
- Resnik L, Meucci MR, Lieberman-Klinger S, Fantini C, Kelty DL, Disla R, Sasson N. Advanced upper limb prosthetic devices: implications for upper limb prosthetic rehabilitation. Archives of Physical Medicine and Rehabilitation, 2012; 93 (4): 710–717
- Vilarino M, Moon J, Pool KR, Varghese J, Ryan T, Thakor NV, Kaliki R. Outcomes and perception of a conventional and alternative myoelectric control strategy: A study of experienced and new multiarticulating hand users. Journal of Prosthetics and Orthotics, 2015; 27 (2): 53–62
- Kuiken TA, Li G, Lock BA, Lipschutz RD, Miller LA, Stubblefield KA, Englehart KB. Targeted muscle reinnervation for real-time myoelectric control of multifunction artificial arms. JAMA, 2009; 301 (6): 619–628
- Miller LA, StubblefieldKA, Lipschutz RD, Lock BA, Kuiken TA. Improved myoelectric prosthesis control using targeted reinnervation surgery: a case series. IEEE Transactions on Neural Systems and Rehabilitation Engineering, 2008; 16 (1): 46–50
- Souza JM, Cheesborough JE, Ko JH, Cho MS, Kuiken TA, Dumanian GA. Targeted muscle reinnervation: a novel approach to postamputation neuroma pain. Clinical Orthopaedics and Related Research, 2014; 472 (10): 2984–2990
- Hargrove LJ, Miller LA, Turner K, Kuiken T A. Myoelectric pattern recognition outperforms direct control for transhumeral amputees with targeted muscle reinnervation: a randomized clinical trial. Scientific Reports, 2017; 7 (1): 1–9
- Dumanian GA, Potter BK, Mioton LM, Ko JH, Cheesborough JE, Souza JM, Kuiken TA, et al. Targeted muscle reinnervation treats neuroma and phantom pain in major limb amputees: a randomized clinical trial. Annals of Surgery, 2019; 270 (2): 238–246
- Salminger S, Gradischar A, Skiera R, Roche AD, Sturma A, Hofer C, Aszmann OC. Attachment of upper arm prostheses with a subcutaneous osseointegrated implant in transhumeral amputees. Prosthetics and Orthotics International, 2018; 42 (1): 93–100
- Chi A, Smith S, Womack I, Armiger R. The Evolution of Man and Machine – a Review of Current Surgical Techniques and Cutting Technologies After Upper Extremity Amputation. Current Trauma Reports, 2018; 4 (4): 339–347
- Li Y, Brånemark R. Osseointegrated prostheses for rehabilitation following amputation. Der Unfallchirurg, 2017; 120 (4): 285–292
- Hebert JS, Rehani M, Stiegelmar R. Osseointegration for lower-limb amputation: a systematic review of clinical outcomes. JBJS Reviews, 2017; 5 (10): e10
- Thesleff A, Brånemark R, Håkansson B, Ortiz-Catalan M. Biomechanical characterisation of bone-anchored implant systems for amputation limb prostheses: a systematic review. Annals of Biomedical Engineering, 2018; 46 (3), 377–391
- Hebert JS, Rehani M, Stiegelmar R. Osseointegration for lower-limb amputation: a systematic review of clinical outcomes. JBJS Reviews, 2017; 5 (10): e10
- Van de Meent H, Hopman MT, Frölke JP (2013). Walking ability and quality of life in subjects with transfemoral amputation: a comparison of osseointegration with socket prostheses. Archives of Physical Medicine and Rehabilitation, 2013; 94 (11), 2174–2178
- Leijendekkers RA, Staal JB, van Hinte G, Frölke JP, van de Meent H, Atsma F, Hoogeboom TJ. Long-term outcomes following lower extremity press-fit bone-anchored prosthesis surgery: a 5‑year longitudinal study protocol. BMC Musculoskeletal Disorders, 2016; 17 (1): 484
- Brånemark RP, Hagberg K, Kulbacka-Ortiz K, Berlin Ö, Rydevik B. Osseointegrated percutaneous prosthetic system for the treatment of patients with transfemoral amputation: a prospective five-year follow-up of patient-reported outcomes and complications. The Journal of the American Academy of Orthopaedic Surgeons, 2019; 27 (16): e743
- Aman M, Festin C, Sporer ME, Gstoettner C, Prahm C, Bergmeister KD, Aszmann OC. Bionic reconstruction. Wiener Klinische Wochenschrift, 2019; 131 (23–24): 599–607
- Biddiss EA, & Chau, T. T. (2007). Upper limb prosthesis use and abandonment: a survey of the last 25 years. Prosthetics and orthotics international, 31(3), 236–257.
- Østlie, K., Lesjø, I. M., Franklin, R. J., Garfelt, B., Skjeldal, O. H., & Magnus, P. (2012). Prosthesis rejection in acquired major upper-limb amputees: a population-based survey. Disability and Rehabilitation: Assistive Technology, 7(4), 294–303.
- Li Y, Brånemark R. Osseointegrated prostheses for rehabilitation following amputation. Der Unfallchirurg, 2017; 120 (4): 285–292
- Hagberg, K., & Brånemark, R. (2009). One hundred patients treated with osseointegrated transfemoral amputation prostheses–rehabilitation perspective. Journal of Rehabilitation Research & Development, 46(3).
- Stubblefield, K. A., Miller, L. A., Lipschutz, R. D., & Kuiken, T. A. (2009). Occupational therapy protocol for amputees with targeted muscle reinnervation. Journal of rehabilitation research and development, 46(4), 481.
- Drew, A. J., Izykowski, M. T., Bachus, K. N., Henninger, H. B., & Foreman, K. B. (2017). Transhumeral loading during advanced upper extremity activities of daily living. PloS one, 12(12).
- Ortiz-Catalan M, Mastinu E, Sassu P, Aszmann O, Brånemark R. Self-Contained Neuromusculoskeletal Arm Prostheses. New England Journal of Medicine, 2020; 382(18), 1732–1738