Möglichkeiten und Grenzen der aktuellen armprothetischen Versorgung
Eine Amputation und der damit einhergehende Verlust eines Körperteils ist für den Betroffenen ein tiefgreifender Einschnitt ins Leben. Die Rekonstruktion stellt sowohl den Chirurgen als auch den versorgenden Orthopädietechniker vor große Herausforderungen 1. Die Versorgung legt jedoch den Grundstein für die Aktivitäten des täglichen Lebens sowie für die soziale Teilhabe des Betroffenen. Der ständige technische Fortschritt – sowohl in der Medizin- als auch in der Orthopädie-Technik – ist auch an der prothetischen Versorgung der oberen Extremität nicht spurlos vorübergegangen. Die Versorgungen sind mittlerweile deutlich komplexer und technisch anspruchsvoller als noch vor 20 Jahren und bieten dem Anwender einen deutlichen Funktionszugewinn.
Ein wesentlicher Aspekt für die Versorgung amputierter Menschen im Bereich der oberen Extremität ist das Thema Akzeptanz. Denn die Vorstellungen des Patienten und die Möglichkeiten einer prothetischen Versorgung liegen oft weit auseinander. Verschiedene Studien belegen, dass viele Menschen mit einer Amputation im Bereich der oberen Extremität ihre Versorgung selten oder gar nicht nutzen. Als Hauptgründe nennt die von Alex J. Drew und Kollegen im Jahr 2017 veröffentlichte Arbeit „Transhumeral loading during advanced upper extremity activities of daily living“ 2 folgende Aspekte:
- schlechte Passform
- Schmerzen
- fehlender Komfort
- hohes Gewicht
- Einschränkungen in der Bewegung
Diese Effekte träten auf, ohne dass sich andererseits ein deutlicher Funktionszugewinn ergebe. Drew et al. schließen aus diesem Befund, dass sich die Akzeptanz einer Versorgung der oberen Extremität durch Osseointegration in Kombination mit myoelektrischen Passteilen deutlich steigern lasse. Wolf-Dietrich Heintel gelangt in seiner bereits im Jahr 2006 erschienenen Dissertation „Akzeptanz von Armprothesen. Eine retrospektive Studie an 454 Betroffenen: Patienten aus der TO Münster, Versicherte gesetzlicher Unfall- und Krankenversicherungen und der Versorgungsverwaltung“ 3 zu ähnlichen Ergebnissen. Er stellt fest, dass die Akzeptanz einer Versorgung bei einer Armamputation umso höher und damit verbunden die Nutzung umso häufiger sei, je hochwertiger die Versorgung ist. Diese Beobachtung bestätigt sich auch bei dem nachfolgend vorgestellten glenohumeralen Patienten. Bei ihm bestand das Hauptziel der TMR-Operation in der Schmerzbehandlung, also der Entfernung der immer wiederkehrenden Neurome und der dadurch hervorgerufenen Beschwerden. Die prothetische Versorgung war anfangs nur zweitrangig; im Laufe der Zeit entwickelte sie sich jedoch zu einem weiteren Hauptziel.
Targeted Muscle Reinnervation
Durch den Fortschritt der Technik und die erhöhte Akzeptanz myoelektrischer Prothesen ist es heute möglich, dem Patienten einen sowohl technisch als auch optisch hochwertigen Körperteilersatz zu bieten. Die herkömmlichen myoelektrischen Armprothesen, die mit zwei Elektroden gesteuert werden, sind auf dem aktuellen Stand der Technik und haben die Eigenkraftprothesen abgelöst 4. Um bei herkömmlichen myoelektrischen Prothesen zwischen den Funktionen (Hand, Handgelenk und Ellbogengelenk) hin und her zu schalten, bedarf es einer Umschaltbewegung, z. B. einer Ko-Kontraktion. Dies lässt die Prothesenbewegung sehr unphysiologisch wirken.
Für gewöhnlich werden bei Patienten nach einer transhumeralen Amputation die Mm. biceps brachii und triceps brachii für die Ansteuerung der Prothese verwendet, bei Patienten mit einer glenohumeralen Amputation die Mm. pectoralis major sowie latissimus dorsi 5 6. Durch einen selektiven Nerventransfer verbliebener Nervenstümpfe kann eine Erweiterung der Steuerungsmöglichkeit erreicht und somit das beschriebene Problem der Umschaltbewegung beseitigt werden.
Überblick
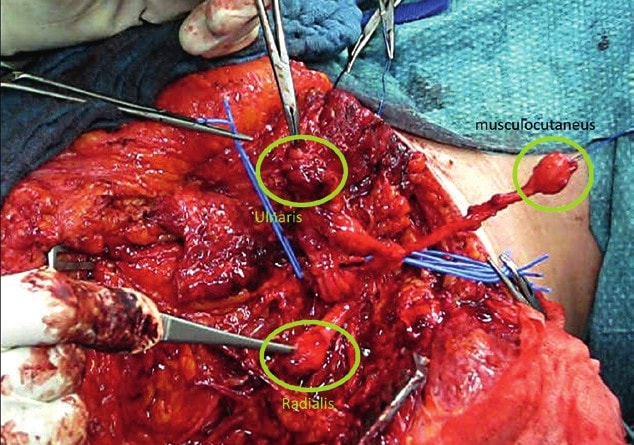
Die von Todd A. Kuiken (Rehabilitation Institute of Chicago) und Gregory A. Dumanian (Northwestern Memorial Hospital Chicago) entwickelte Operationstechnik „Targeted Muscle Reinnervation“, kurz TMR 7, beschreibt einen solchen Nerventransfer. Ziel dieses Transfers ist es, die wesentlichen Armnerven (N. musculocutaneus, N. radialis, N. medianus und N. ulnaris) aus dem proximalen Nervengeflecht freizulegen, um sie an verbliebene Nervenäste stammnaher Muskeln anzuschließen 8 9. Diese Operationstechnik wurde von Oskar Aszmann (Medizinische Universität Wien) modifiziert und in Europa etabliert 10. In Deutschland wird dieses additive operative Verfahren in der Universitätsmedizin Göttingen und in der Berufsgenossenschaftlichen (BG) Klinik Duisburg angeboten.
Operatives Vorgehen
Ziel der Operation ist es, die verbliebenden Nervenstümpfe in maximal möglicher Länge zu erhalten und sie mit den ursprünglichen Nerven der stumpfnahen Muskeln in direkter Nerv-Nerv-Naht zu verbinden. Durch diese Operationsform können die Prothesenträger ihre Prothese intuitiv und simultan im Bereich Hand (Öffnen/Schließen – Pronation/Supination) und Ellbogen (Extension/ Flexion) steuern 11. Um die bestmögliche Ansteuerung zu gewährleisten, kommt es darauf an, die Muskeln möglichst voneinander zu trennen und die Haut über den Zielmuskeln zu entfetten. Auf diese Weise kann später ein sauber getrenntes und starkes Signal gewonnen werden 12.
Die Operation beginnt mit der Identifizierung der einzelnen Nervenstümpfe. Anschließend werden die Nervenäste der Zielmuskulatur dargestellt. Diese Darstellung korreliert stark mit dem Amputationsniveau, da bei einer Amputation im Transhumeralbereich meistens das Caput breve des M. biceps brachii, der M. brachialis und das Caput laterale des M. triceps brachii verwendet werden. Bei einer glenohumeralen Amputation sind diese Muskeln nicht mehr vorhanden, und es werden die drei Anteile des M. pectoralis major – der M. pectoralis minor, der M. latissimus dorsi sowie der M. infraspinatus – als Zielmuskeln genutzt 13 14. In Tabelle 1 ist dargestellt, welche Nerven auf welchen Muskel transferiert werden, und zwar sowohl bei einer TMR-Operation für transhumerale als auch für glenohumerale Stümpfe.
Postoperatives Vorgehen
Die durch die TMR-Operation neu entstandene neuromuskuläre Einheit benötigt einige Wochen, damit eine neue motorische Einheit entsteht (das Nervenwachstum beträgt etwa 1 mm pro Tag) 15. Durch die Denervation sind die Zielmuskeln zunächst nicht ansteuerbar. Nach etwa drei Monaten zeigen sich die ersten Muskelkontraktionen als Zeichen der Reinnervation 16 17. Der Bereich, von dem im späteren Verlauf die myoelektrischen Signale abgenommen werden können, wird mit der Zeit immer größer. Die geeigneten Stellen, die sogenannten Hotspots, verschieben sich anfänglich noch, da der Nerv einen zunehmenden Muskelanteil innerviert. Ist das Einwachsen des Nervs abgeschlossen, kontrahieren die Zielmuskeln unter Aktivität des Spendernervs 18. Der Anwender „denkt“ jetzt an eine Bewegung der amputierten Extremität, die die Prothese dann ausführt. Dazu gilt es eine optimale Elektrodenpositionierung zu erreichen, um das bestmögliche Signal verwenden zu können. Diese Operationstechnik ermöglicht dem Prothesenträger eine deutlich leichtere und nahezu intuitive Steuerung seiner Prothese, die ihm ein hohes Maß an Selbstständigkeit bietet. In Tabelle 2 wird aufgeführt, welcher Nerv welche Aufgabe in der Prothesensteuerung übernehmen soll.
Versorgungsbeispiel eines glenohumeral amputierten Patienten
Der hier vorgestellte Patient wurde im Jahr 2001 amputiert und 2016 in der BG Klinik Duisburg von Dr. med. Martin Räder TMR-operiert. Der Hauptgrund für die TMR-Operation bei diesem Patienten waren sehr starke Neurombeschwerden (Abb. 1). Die anschließende prothetische Versorgung wurde zunächst nur als Bonus erachtet.
Vor der TMR-Operation war der Patient mit einer Zwei-Kanal-Steuerung mit Wippschalter versorgt; er trug seine Prothese jedoch nur sehr selten, da für ihn ein Mehrnutzen nicht erkennbar war. Drei Monate post-OP waren die ersten beiden Signale gut abnehmbar, und es wurde über einen großen Diagnoseschaft bereits mit dem Signaltraining begonnen. Nach weiteren sieben Monaten war das 3. Signal stabil abnehmbar, und es wurde eine Interimsprothese hergestellt, mit der der Patient seine bisherige Versorgung steuern konnte. Der Patient suchte zu diesem Zeitpunkt zweimal pro Woche den Orthopädietechniker auf. Zu Trainingszwecken wurden jeweils zwischen den Zeitpunkten die Elektroden gewechselt, sodass im Wechsel immer zwei unterschiedliche Elektroden genutzt wurden.
Ein Jahr nach der TMR-Operation waren vier Signale konstant abnehmbar, und es wurde eine Oberarmprothese „DynamicArm Plus“ (Ottobock) an den Interimsschaft angebaut. Der Patient konnte jetzt die Prothese im Alltag steuern, die Hand öffnen und schließen sowie den Ellbogen strecken und beugen. Der anfänglich erwähnte große Diagnoseschaft konnte um die neu gewonnenen bzw. leicht verschobenen Hotspots erweitert werden. Der Patient erschien weiterhin zweimal wöchentlich zum Training. Dabei wurden immer wieder Feineinstellungen vorgenommen und weitere Elektrodenpositionen getestet. Durch den minimalen Resthumerus, den er bewegen kann, kam es dabei teilweise zu Elektrodenpositionen, bei denen Hotspots vermutet wurden; jedoch wurde die Elektrode durch die Hautverschiebung manipuliert, und es wurden Elektrodenpositionen vermutet, wo eigentlich keine waren.
14 Monate post-OP konnte das 5. Signal, die Supination, sicher verwendet werden, und es wurde der prothetischen Versorgung eine Rotationseinheit hinzugefügt. Das 6. Signal war bald darauf als Muskelzucken auszumachen, konnte jedoch erst nach weiteren sieben Monaten konstant angesteuert werden. In dieser Zeit wurden fünf Testschäfte angefertigt, und es wurden 16 TMR-Modifikationen vorgenommen. Als definitive Schaftgestaltung wurde ein Ringschaft als Innenschaft gewählt. Der Außenschaft wurde als eine Art Kappe mit einer Distanz zum beweglichen Humerusrest auf diesem Innenschaft angebracht. So kann der Patient seinen Humerus bewegen, ohne dass es dabei zu Fehlsteuerungen durch eventuelle Hautverschiebungen kommt.
Die Phantomschmerzen, die den Patienten seit seiner Amputation begleiten, konnten durch das regelmäßige Tragen der Prothese stark reduziert werden; auch die Position seiner Phantomhand hat sich verändert und schmerzsymptomatisch verbessert. Der Patient steuert mittlerweile seine Prothese mit sechs Elektroden im Alltag (Abb. 2). Aus dem Nebenziel einer prothetischen Versorgung ist mittlerweile ein weiteres Hauptziel geworden.
Vergleich glenohumeraler TMR-Patient mit drei transhumeralen TMR-Patienten
Über den vorgestellten Fall hinaus werden im Unternehmen des Autors drei weitere Patienten versorgt, die ihre Prothese mit mindestens 4 Elektroden steuern. Dabei handelt es sich allerdings um transhumerale Amputationen.
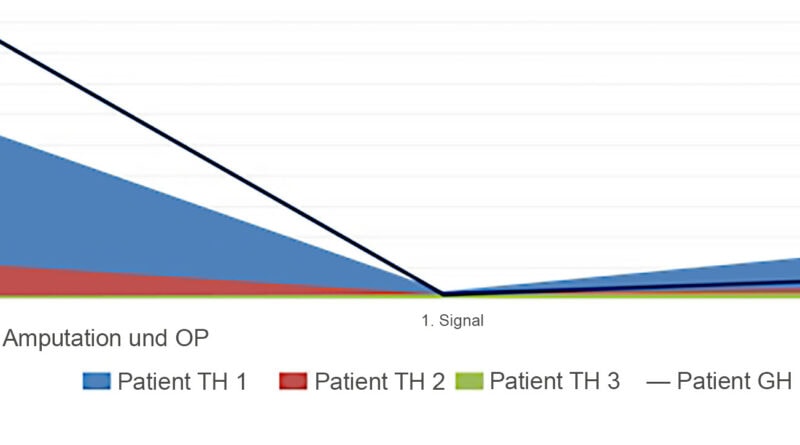
- TH 1 Der erste TH-Patient (Amputation 03/2001, TMR-Operation 09/2010 in Wien = 114 Monate Zeitabstand; in Abb. 3 hellblau gekennzeichnet) steuert seine Prothese seit 2012 mit 6 Elektroden im Alltag bei einer Tragedauer von rund 14 bis 16 Stunden. Er nutzt die Prothese sowohl bei der Arbeit als auch in der Freizeit beim Angeln.
- TH 2 Eine TH-Patientin (Amputation 04/2012, TMR-Operation 03/2014 in Wien = 23 Monate Zeitabstand; in Abb. 3 rot gekennzeichnet) trug vier Jahre lang ihre Versorgung ebenfalls mit 4 Elektroden (die Signale 5 und 6 waren zwar abnehmbar, jedoch war es für die Patientin schwer umsetzbar, alle 6 Signale fein zu trennen). Vor einiger Zeit wurden bei ihr die beiden Signale für Pronation und Supination erneut ausgetestet, und die Patientin kann diese nun auch gezielt steuern. Sie nutzt jetzt ihre Prothese also ebenfalls mit 6 Elektroden.
- TH 3 Ein weiterer TH-Patient (Amputation 03/2014, TMR-Operation 05/2014 in Duisburg = 2 Monate Zeitabstand; in Abb. 3 grün gekennzeichnet) ist mit 4 Elektroden in seiner Versorgung ausgestattet. Es wäre auch ein 5. Signal möglich, jedoch liegen die Hotspots für Rotation und Handöffnen so dicht beieinander, dass es dabei zu einem sogenannten Crosstalk kommt und eine exakte Trennung der Funktionen nicht möglich ist.
Vergleicht man im Diagramm in Abbildung 3 die Dauer der Innervationen bei den transhumeralen Patienten, ist zu erkennen, dass das Signal 5 umso schneller zu lokalisieren ist, je kürzer die Dauer zwischen Amputation und TMR-Operation ist. Zieht man einen Vergleich zwischen den transhumeral versorgten Patienten und dem oben vorgestellten glenohumeralen Patienten (Dauer zwischen OP und TMR 180 Monate; in Abb. 3 mit einer dunkelblauen Linie gekennzeichnet), ist Abbildung 3 zu entnehmen, dass bei ihm das 5. Signal schneller (um 20 Monate) lokalisierbar war als bei dem transhumeral langzeitamputierten Patienten (Patient TH 1, OP bis TMR: 114 Monate). Es lässt sich vermuten, dass dies auf die kürzere Innervationsdistanz des genutzten Nervs zum Zielmuskel zurückzuführen ist.
Fazit
Versorgungen nach TMR-Operationen sind mittlerweile Stand der Technik. Nach Ansicht des Autors ist zumindest eine Tendenz erkennbar, dass bei Patienten mit TH-Amputation die Signalerschließung von der Dauer zwischen Amputation und TMR-Operation abhängt. Aufgrund der geringen Anzahl an Patienten ist dies jedoch lediglich eine naheliegende Vermutung, die es in weiteren Studien zu evaluieren gilt. Zudem gibt es bei dem vorgestellten glenohumeralen Patienten eine etwas größere Zeitspanne bis zur Verwendung des 5. Signals im Vergleich zu den transhumeral amputierten Patienten, bei denen (mit Ausnahme von Patient TH 1) die Zeitspanne zwischen Amputation und Operation wesentlich geringer war.
Alle vier Patienten hatten deutliche Vorteile bei der Steuerung der Prothese im Alltag. Die Ansteuerung einer Prothese nach TMR-Operation wirkt deutlich physiologischer als eine Zwei-Elektroden-Steuerung. Um ein bestmögliches Versorgungsergebnis zu erhalten, so die Erfahrung des Autors, ist eine enge Zusammenarbeit im interdisziplinären Team unabdingbar.
Der Autor:
Ralf-Thomas Münch M. Sc., OTM
Münch + Hahn GmbH & Co. KG
August-Bebel-Platz 18
47169 Duisburg
rtm@muench-ot.de
Begutachteter Beitrag/reviewed paper
Münch R T. Versorgungsbeispiel eines glenohumeralen TMR-Patienten im Vergleich mit drei transhumeralen TMR-Patienten. Orthopädie Technik. 2020; 71 (3): 58–62
| glenohumeral | Pars clavicularis M. pectoralis | Pars sternocostalis M. pectoralis majoris | Pars abdominalis M. pectoralis majoris | M. pectoralis minor | M. latissimus Dorsi | M. infraspinatus/ supraspinatus |
| N. musculocutaneus | X | |||||
| N. medianus (Medialstrang) | X | X | ||||
| N. medianus (Lateralstrang) | X | X | ||||
| N. ulnaris | X | |||||
| N. radialis | X | |||||
| R. profundus N. radialis | X |
| transhumeral | M. brachialis | Caput breve M. bicipitis | Caput laterale M. tricipitis |
| N. medianus | X | ||
| N. ulnaris | X | ||
| R. prof. N. radialis | X |
| Transferierter Nerv | Erwartete Prothesenfunktion |
|---|---|
| Ramus profundus N. radialis | Hand öffnen / Supination |
| N. radialis | Ellenbogenstreckung |
| N. ulnaris | Hand schließen |
| N. medianus (Medial– / Lateralstrang) | Hand schließen / Pronation |
| N. musculocutaneos | Ellenbogenbeugung |
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- iOrt – Entwicklung einer überwachenden Orthese mit neuartigem optischen Sensorsystem — 11. Februar 2026
- Braatz F, Ernst J, Andres E, Felmerer G. Was gibt es Neues in der (myoelektrischen) Prothetik? In: Jähne J, Königsrainer A, Schröder W, Südkamp NP. Was gibt es Neues in der Chirurgie? Jahresband 2015: Berichte zur chirurgischen Weiter- und Fortbildung. Heidelberg : ecomed Verlagsgesellschaft, 2015: 285–290
- Drew AJ, Izykowski MT, Bachus KN, Henninger HB, Foreman KB. Transhumeral loading during advanced upper extremity activities of daily living. PLoS One, 2017;12 (12): e0189418. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5736202/ (Zugriff am 28.01.2020)
- Heintel W‑D. Akzeptanz von Armprothesen. Eine retrospektive Studie an 454 Betroffenen: Patienten aus der TO Münster, Versicherte gesetzlicher Unfall- und Krankenversicherungen und der Versorgungsverwaltung. Dissertation, Universität Münster, 2006
- Greitemann B, Brückner L, Schäfer M, Baumgartner R. Amputation und Prothesenversorgung. Indikationsstellung – operative Technik – Nachbehandlung – Funktionstraining. 4., vollständig überarbeitete Auflage. Stuttgart, New York: Thieme Verlag, 2016: 496–500
- Greitemann B, Brückner L, Schäfer M, Baumgartner R. Amputation und Prothesenversorgung. Indikationsstellung – operative Technik – Nachbehandlung – Funktionstraining. 4., vollständig überarbeitete Auflage. Stuttgart, New York: Thieme Verlag, 2016: 496–500
- Sturma A et al. Proximale Amputationen des Armes: Technische, chirurgische und handtherapeutische Möglichkeiten. Zeitschrift für Handtherapie, 2018; 21 (1): 18–25
- Braatz F, Ernst J, Andres E, Felmerer G. Was gibt es Neues in der (myoelektrischen) Prothetik? In: Jähne J, Königsrainer A, Schröder W, Südkamp NP. Was gibt es Neues in der Chirurgie? Jahresband 2015: Berichte zur chirurgischen Weiter- und Fortbildung. Heidelberg : ecomed Verlagsgesellschaft, 2015: 285–290
- Braatz F, Ernst J, Andres E, Felmerer G. Was gibt es Neues in der (myoelektrischen) Prothetik? In: Jähne J, Königsrainer A, Schröder W, Südkamp NP. Was gibt es Neues in der Chirurgie? Jahresband 2015: Berichte zur chirurgischen Weiter- und Fortbildung. Heidelberg : ecomed Verlagsgesellschaft, 2015: 285–290
- Sturma A et al. Proximale Amputationen des Armes: Technische, chirurgische und handtherapeutische Möglichkeiten. Zeitschrift für Handtherapie, 2018; 21 (1): 18–25
- Braatz F, Ernst J, Andres E, Felmerer G. Was gibt es Neues in der (myoelektrischen) Prothetik? In: Jähne J, Königsrainer A, Schröder W, Südkamp NP. Was gibt es Neues in der Chirurgie? Jahresband 2015: Berichte zur chirurgischen Weiter- und Fortbildung. Heidelberg : ecomed Verlagsgesellschaft, 2015: 285–290
- Kuiken T et al. Targeted Muscle Reinnervation for Real-Time Myoelectric Control of Multifunction Artificial Arms. JAMA, 2009; 301 (6): 619–628. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3036162/ [author’s manuscript] (Zugriff am 28.01.2020)
- Greitemann B, Brückner L, Schäfer M, Baumgartner R. Amputation und Prothesenversorgung. Indikationsstellung – operative Technik – Nachbehandlung – Funktionstraining. 4., vollständig überarbeitete Auflage. Stuttgart, New York: Thieme Verlag, 2016: 496–500
- Greitemann B, Brückner L, Schäfer M, Baumgartner R. Amputation und Prothesenversorgung. Indikationsstellung – operative Technik – Nachbehandlung – Funktionstraining. 4., vollständig überarbeitete Auflage. Stuttgart, New York: Thieme Verlag, 2016: 496–500
- Sturma A et al. Proximale Amputationen des Armes: Technische, chirurgische und handtherapeutische Möglichkeiten. Zeitschrift für Handtherapie, 2018; 21 (1): 18–25
- Aszmann OC, Hruby LA. Bionische Rekonstruktion. Wiederherstellung an der Grenze zwischen Mensch und Maschine. Wien: Manz, 2018: 69
- Greitemann B, Brückner L, Schäfer M, Baumgartner R. Amputation und Prothesenversorgung. Indikationsstellung – operative Technik – Nachbehandlung – Funktionstraining. 4., vollständig überarbeitete Auflage. Stuttgart, New York: Thieme Verlag, 2016: 496–500
- Sturma A et al. Proximale Amputationen des Armes: Technische, chirurgische und handtherapeutische Möglichkeiten. Zeitschrift für Handtherapie, 2018; 21 (1): 18–25
- Greitemann B, Brückner L, Schäfer M, Baumgartner R. Amputation und Prothesenversorgung. Indikationsstellung – operative Technik – Nachbehandlung – Funktionstraining. 4., vollständig überarbeitete Auflage. Stuttgart, New York: Thieme Verlag, 2016: 496–500