Einleitung
Da das Kniegelenk am häufigsten von einer Arthrose betroffen ist, dient es als Grundlage für Leit- und Richtlinien verschiedener Gesellschaften. Hierzu zählen die European League Against Rheumatism (EULAR) 1, das American College of Rheumatology (ACR) 2, die Osteoarthritis Research Society International (OARSI) 3 4 5 6 sowie das National Institute for Health and Clinical Excellence (NICE) in Großbritannien 7 8.
Eine weitere Organisation stellt die European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) dar. In dieser Gesellschaft werden verschiedene Arbeitsgruppen zusammengefasst, die Disease-Management-Programme erarbeiten 9 10. Die Arbeitsgruppen haben es sich zur Aufgabe gemacht, die verschiedenen internationalen Guidelines und Empfehlungen auf die europäischen Versorgungsrealitäten zu beziehen. Dies beruht auf der Erkenntnis, dass die Guidelines in der Regel auf RCT („randomized controlled trials“) basieren, ohne die Versorgungsrealität in Europa mit einfließen zu lassen. Die von der ESCEO erarbeiteten Empfehlungen entstanden aus der Adaptation globaler 11 12 13 und kontinentaler Leitlinien 14 unter Hinzuziehung einiger nationaler Leitlinien in Zusammenschau mit den aktuellen europäischen Leitlinien 15. Alle Leit- und Richtlinien zeigen, dass ein sektorübergreifendes Management der Arthrose unter Leitung von O & U der Weg für die Zukunft sein wird. Im Folgenden wird ein möglicher Behandlungspfad für das nichtpharmakologische und das pharmakologische Arthrosemanagement aufgezeigt; vgl. zur Orientierung Abbildung 1.
Basisbehandlung
Grundlage jedweder Arthrosetherapie ist die Basisbehandlung, die im Folgenden skizziert wird:
- Patienteninformation und Patientenschulung mit dem Ziel, den Patienten über die Art der Erkrankung und mögliche Behandlungsmaßnahmen zu informieren. Soweit notwendig sollte der Behandler den Lebensstil des Patienten dahingehend beeinflussen, dass es nicht zu einer Progression der Erkrankung kommt. Die EULAR hat hierzu entsprechende Empfehlungen für das nichtpharmakologische Management von Hüft- und Kniearthrose (Patienteninformation, Schulung, Lebensstiländerung) gegeben 16.
- Gewichtsverlust bei übergewichtigen Patienten. Bei einem Gewichtsverlust von wenigstens 5 % innerhalb von 6 Monaten ist eine messbare Verbesserung der klinischen Symptomatik und der Gelenkfunktion zu erwarten 17. Messier et al. 18 wiesen bei einem Gewichtsverlust von 10 % eine signifikante Verbesserung der klinischen Symptome nach. Ebenso fand sich eine Verbesserung der Qualität und der Dicke des medialen femoralen Gelenkkompartiment-Knorpels 19.
- Übungsprogramme. Patientenschulung soll insbesondere über Übungsprogramme sowie sportliche Aktivität informieren 20. Beides hat einen positiven Effekt auf Schmerz und Funktion in unterschiedlichen Modellen (individuell, Gruppentraining, Home Exercises) 21. Die genaue Dosierung des Trainings sowie die langfristigen Empfehlungen sind aufgrund der Studienlage noch unklar. Dennoch empfehlen alle Experten eine langsame Zunahme der Intensität und der Dauer der entsprechenden Übungsprogramme im zeitlichen Verlauf 22. Es gibt keine Evidenz, dass Wassergymnastik hinsichtlich Schmerz und Funktion effektiv ist 23. Quadrizeps-Kräftigungsprogramme sowie Trainingsprogramme für die untere Extremität gemeinsam mit aerobem Training wie beispielsweise Walken sind in der Literatur am besten dokumentiert 24. Die meisten Autoren empfehlen ein gemischtes Programm, das Muskelkräftigung, Verbesserung der aeroben Kapazität sowie Verbesserung der Flexibilität und der Beweglichkeit umfasst 25. Auch für Tai Chi gibt es eine positive Empfehlung 26.
Arthrosetherapie-Algorithmus zusätzlich zum Basistraining
Oft ist die Basistherapie alleine nicht ausreichend, um die Symptome und die Funktion zu verbessern oder gar die Progression der Arthrose zu verlangsamen. Hier gilt es immer, im Rahmen des gesamten Arthrosemanagements eine multimodale und interdisziplinäre Therapie zu wählen, die individuell auf den Patienten zugeschnitten ist. Hierzu zählen nichtpharmakologische sowie pharmakologische Therapiemaßnahmen, auf die im Folgenden eingegangen wird.
Stufe 1: Hintergrundbehandlung
Während der Hintergrundbehandlung ist die individuelle Basistherapie kontinuierlich fortzuführen. Parallel hierzu können pharmakologische und nichtpharmakologische Therapieverfahren kombiniert werden.
Stufe 1a: Nichtpharmakologische Hintergrundbehandlung
Primär wird evaluiert, inwieweit spezifische physiotherapeutische Maßnahmen angezeigt sind. Varus- und Valgus-Malalignement stellen einen Risikofaktor für die Kniearthrose dar. Hierbei besteht die Indikation zu Schuhranderhöhungen, Pufferabsätzen oder Braces 27 28. Es kann auch sinnvoll sein, Braces mit Fußorthesen und entsprechendem Schuhwerk zu kombinieren 29. Verschiedene Studien zeigen, dass bei einer medialen Gonarthrose eine laterale Schuhaußenranderhöhung eine Verbesserung ergibt 30.
Es gibt dagegen keine ausreichende Evidenz, inwieweit Braces oder andere Schutzvorrichtungen die Progression der Arthrose verlangsamen. In den EULAR-Richtlinien finden sich beispielsweise keine positiven Empfehlungen für Schuhzurichtungen bei der Kniearthrose, da durchaus auch negative Effekte auftreten können. Ein entsprechendes Schuhwerk (schockabsorbierende Sohlen, Fußgewölbeunterstützungen), eine Pronationskontrolle sowie die Vermeidung hochhackiger Schuhe werden jedoch empfohlen 31. Ideale Patienten für Bracing sind jüngere Patienten, die körperlich aktiv sind, kein relevantes Übergewicht haben und nur eine unikompartimentelle symptomatische tibiofemorale Arthrose mit entsprechendem Malalignement aufweisen, das durch Varus- oder Valgusstress im Rahmen der klinischen oder radiologischen Untersuchung korrigierbar ist. Wärmebehandlungen und Ultraschall zeigen bei einigen Studien eine gewisse Effektivität 32. Bei randomisierten Studien fehlt jedoch der Nachweis einer Evidenz beim Vergleich Ultraschall versus Placebotherapie 33. Das Gleiche gilt für die manuelle Therapie in Kombination mit einer Bewegungstherapie sowie ein Patella-Taping. Balneotherapie und Akupunktur zeigen in Metaanalysen die höchste Evidenz unter allen physikalischen Therapiemaßnahmen 34. Der direkte Vergleich zwischen Akupunktur und Scheinakupunktur zeigt dagegen nur eine geringe Überlegenheit der Verum-Akupunktur 35. Die Evidenz der TENS (transkutane elektrische Nervenstimulation) ist gering, was sicherlich an der geringen Anzahl von Studien liegt 36. In einer größeren randomisierten Studie konnte für TENS jedoch nachgewiesen werden, dass dadurch die Analgetika-Medikation reduziert werden konnte 37. In den ACR-Guidelines 38 findet sich eine Empfehlung dahingehend, dass TENS und Akupunktur als nichtpharmakologische Alternativen zur Operation angezeigt sind, wenn eine Operation kontraindiziert ist oder der Patient diese nicht durchführen lassen möchte.
Stufe 1b: Pharmakologische Hintergrundbehandlung
Paracetamol in einer Dosis von nicht mehr als 3 Gramm pro Tag wird in den meisten Guidelines generell als initiale pharmakologische Behandlung empfohlen. Der Grund dafür besteht nicht so sehr in der Effektivität der Schmerztherapie, sondern eher in der relativen Sicherheit der Medikation und der Preissituation. Im Rahmen einer Metaanalyse 39 wurde festgestellt, dass die allermeisten klinischen Studien hinsichtlich dieser Frage keine längere Studiendauer als 6 Monate aufwiesen. In einer placebokontrollierten Studie wurde eine Effektivität für Paracetamol in einem Verlauf von mehr als 6 Monaten hinsichtlich der Funktion, aber nicht hinsichtlich des Schmerzes festgestellt 40. So zeigen Metaanalysen eine Effektgröße von weniger als 0,20, wie sie in den OARSI-Guidelines dargestellt werden. Gleichzeitig zeigen sich zunehmend auch negative Effekte von Paracetamol – insbesondere Leberenzymerhöhungen 41. Ein sicherer und sinnvollerer Weg wäre die Verwendung von SYSA-DOAs („symptomatic slow-acting drugs for osteoarthritis“) in Kombination mit Paracetamol als kurzzeitiges Analgetikum. Im Bereich der SYSADOAs findet sich unter anderem Glucosaminsulfat, das deutlich von anderen Präparationen wie beispielsweise Glucosaminchlorid zu differenzieren ist. In einem LiteraturReview 42 zeigt sich, dass der generelle Vorteil von Glucosamin-Zubereitungen durch die große Heterogenität der verschiedenen Firmenzubereitungen negativ beeinflusst wird. In hochrangigen kontrollierten Studien mit patentierten Cristalin-Glucosaminsulfat-Präparaten zeigt sich eine Überlegenheit gegenüber Placebo bei der Behandlung der Schmerz- und Funktionseinschränkungen 43. Diese Studien 44 45 46 sind durchweg Langzeitstudien zwischen 6 Monaten und 3 Jahren bei der Behandlung von Patienten mit mildem bis moderatem Schmerz. Die kalkulierte Effektgröße beträgt 0,27 (95-%-Konfidenzintervall: 0,12–0,43) für den Schmerz und 0,33 (95-%-Konfidenzintervall: 0,17–0,48) für die Funktion 47. Hierbei handelt es sich in etwa um dieselbe Effektgröße, wie sie mit NSAIDs erreicht werden kann 48. In den ACR-Leitlinien finden sich keine Empfehlungen für Glucosamine, da diese nicht als verschreibungspflichtige Medikamente in den USA zu erhalten sind, sondern nur als Nahrungsmittelergänzungspräparate gelistet sind, die im Rahmen der FDA nicht getestet werden 49. Im Rahmen einer vom NIH (National Institute of Health) finanzierten Studie zeigten sich keine positiven Effekte von Glucosaminhydrochlorid 50. Vergleichbare Ergebnisse hatten auch andere Studien, die Glucosaminhydrochlorid untersuchten 51 52. Dieses Glucosaminhydrochlorid hat offensichtlich eine andere Pharmakokinetik als die in Europa verwendeten Glucosaminsulfat-Präparate, die in einer Dosierung von 1500 mg täglich in Europa empfohlen werden 53. Die lange Anwendung von Glucosaminsulfat hat eventuell auch einen günstigen Einfluss auf die Knorpelstrukturen efn_note]Reginster JY, Deroisy R, Rovati LC, Lee RL, Lejeune E, Bruyere O, et al. Long-term effects of glucosamine sulphate on osteoarthritis progression: a randomised, placebo-controlled clinical trial. Lancet, 2001; 357: 251–256 [/efn_note] 54. Chondroitinsulfat scheint vergleichbare Effekte hinsichtlich der Gelenkstruktur bei milder bis moderater Arthrose zu haben 555657 Wildi LM, Raynauld JP, Martel-Pelletier J, Beaulieu A, Bessette L, Morin F, et al. Chondroitin sulphate reduces both cartilage volume loss and bone marrow lesions in knee osteoarthritis patients starting as early as 6 months after initiation of therapy: a randomised, double-blind, placebo-controlled pilot study using MRI. Ann Rheum Dis, 2011; 70: 982–989[38], soweit ein Chondroitin‑4,6‑Sulfat verwendet wird. Für Chondroitinsulfat ist die Literatur durchaus etwas widersprüchlich 58. Es gibt hier Effektgrößen hinsichtlich Schmerz in Metaanalysen, die von 0,3 (0,00–0,27) bis 0,75 (0,50–0,99) reichen 59. Hochberg et al. 60 verglichen die Effektivität und die Sicherheit einer Therapie mit Chondroitinsulfat 400 mg dreimal täglich und Glucosaminhydrochlorid 500 mg dreimal täglich im Gegensatz zu 200 mg Celecoxib täglich für einen Zeitraum von 6 Wochen. Die Studie wurde in Frankreich, Deutschland, Polen und Spanien durchgeführt. Insgesamt wurden 606 Patienten mit einem Kellgren-Lawrence-Kniearthrose-Grad II–III mit moderatem bis starkem Schmerz (WOMAC-Score ≥ 301) behandelt. Die Patienten wurden randomisiert in die Studie eingeschlossen. Primäre Zielgröße war der im WOMAC-Score dokumentierte Schmerz im Vergleich zur Baseline nach 6 Monaten. Sekundäre Outcome-Parameter waren WOMAC-Funktion und Steifheit, die VAS für Schmerz, das Vorhandensein von Schwellung oder Gelenkerguss, die Rescue-Medikation sowie die OMERACT-OARSI-Kriterien (OMERACT-OARSI = Outcome-Measures in Rheumatology Clinical Trials and Osteoarthritis Research Society International) und EuroQuol-5D. Die Ergebnisse zeigten eine Änderung im WOMAC-Schmerzparameter von – 185 (50,1 %) bei der Chondroitin-Glucosamin-Gruppe und von –186,8 (50,2 %) bei der Celecoxib-Gruppe. Die Ergebnisse waren vergleichbar in beiden Gruppen. Die Autoren schlussfolgern, dass Glucosamin und Chondroitin-Sulfat vergleichbare Effekte gegenüber Celecoxib bezüglich der Schmerzreduktion, der Stiffness, der funktionellen Einschränkung, der Gelenkschwellung und des Gelenkergusses bei Patienten mit einer Kniearthrose im Langzeitverlauf von 6 Monaten haben.
Die Evidenz anderer SYSADOAs, beispielsweise „avocado-soybean unsaponifiables“ (ASU) und Diacerein, ist kaum gegeben 6162. Hinsichtlich des Produktes Diacerein hat die EMA (European Medicines Agency) ein Re-Assessment bezüglich des Risk-Benefit-Effektes empfohlen 63.
Strontiumranelat (SR), das üblicherweise bei der Behandlung der postmenopausalen Osteoporose sowie bei der Osteoporose von Männern Anwendung findet, scheint ebenfalls einen Effekt auf den subchondralen Knochen und auf den Gelenkknorpel zu haben und könnte somit positiv hinsichtlich der Arthroseprogression im Sinne eines „disease-modifying agent in osteoarthritis“ (DIMOAD) sein. Eine placebokontrollierte 3‑Jahres-Studie zeigte, dass SR eher zu einem Rückgang der radiologischen Progression bei Kniearthrose führt und es gleichzeitig zu einer Verbesserung der Symptome kommt 64. Das Medikament wurde im Rahmen der Studie gut vertragen; die EMA hat aufgrund des dabei zutage tretenden vaskulären Risikos im Rahmen der Osteoporose-Behandlung das Medikament jedoch zurückgezogen 65.Sofern trotz SYSADOAs und Paracetamol klinische Symptome bestehen, können auch topische nichtsteroidale Antirheumatika Anwendung finden. Der Effekt der topischen nichtsteroidalen Antirheumatika wurde im Rahmen einer randomisierten Untersuchung im Jahr 2004 evaluiert 66. Es zeigt sich eine moderate Effektgröße bei der Verbesserung des Schmerzes 67; leider ist die Heterogenität – eventuell aufgrund der unterschiedlichen topischen Produkte – jedoch groß.
Randomisierte Studien zeigen, dass es prinzipiell keinen Unterschied zwischen der topischen und der oralen Anwendung nichtsteroidaler Antirheumatika gibt. Hierbei zeichnen sich die topischen Anwendungen durch eine höhere gastrointestinale Sicherheit aus; sie gehen jedoch mit einer höheren Rate an Hautreaktionen einher 686970. Die meisten Studien hatten eine Dauer von weniger als 12 Wochen, was die Anwendung topischer nichtsteroidaler Antirheumatika somit lediglich als Bedarfs‑, jedoch nicht als Dauermedikation klassifiziert. Nur in einer Studie fand sich eine Anwendung von über einem Jahr. Diese Studie war jedoch nicht randomisiert, nicht kontrolliert und auch nicht verblindet 71. Topische hyperämisierende Präparate mit Salicylatanteil zeigten keinen Effekt im Vergleich zum Placebo, jedoch eine erhöhte lokale adverse Hautreaktion 72. Es gibt auch keinen spezifischen Grund, topisches Capsaicin anstelle topischer nichtsteroidaler Antirheumatika zu empfehlen 73.
Stufe 2: Fortgeschrittenes medikamentöses Management bei persistierend symptomatischen Patienten
Primär sollten Patienten mit leichtem bis moderatem Schmerz mit der Basistherapie und den Stufe-1-Behandlungsstrategien therapiert werden. Wenn dies nicht ausreicht oder Patienten mit moderaten bis starken Schmerzen vorhanden sind, sollte pharmakologisch zu oralen nichtsteroidalen Antirheumatika gegriffen werden. Wichtig ist hierbei zu bedenken, dass es sich immer nur um kurzfristige Behandlungszyklen handeln soll. Orale nichtselektive COX-2-Hemmer führen zu einer besseren Schmerzreduktion als Paracetamol 74. Mit einer Effektivgröße für den Schmerz von 0,29 (0,22–0,35) findet sich der doppelte Effekt im Vergleich zu Paracetamol 75. Die Patienten zeigen auch selber eine höhere Präferenz für NSAIDs im Vergleich zu Paracetamol 76. Systematische Reviews zeigen keinen klaren Unterschied zwischen Glucosamisulfaten und oralen nichtsteroidalen Antirheumatika für Schmerz und Funktion 77, mit einer höheren Sicherheit für die SYSADOAs (78. Der eindeutige Vorteil der NSAIDs ist jedoch der raschere Wirkungseintritt. Dennoch sollte man im Gesamtkonzept bedenken, dass die Verwendung von SYSADOAs wahrscheinlich die Notwendigkeit der NSAID-Einnahme reduziert79. Systematische Reviews zeigen keinen deutlichen Unterschied in der Effektivität selektiver COX-2-Hemmer, teilselektiver oder nichtselektiver nichtsteroidaler Antirheumatika80. Die Auswahl des Präparates sollte dementsprechend auf das patientenspezifische Sicherheitsprofil ausgerichtet sein, insbesondere auf die Komorbiditäten, die Komedikation und die allgemeine medizinische Situation des Patienten.
Bei klinisch relevanten Kontraindikationen für NSAIDs gehört die intraartikuläre Therapie zum Therapiemanagement. Die Rolle der intraartikulären Hyaluronsäureinjektion wird nach wie vor kontrovers diskutiert, jedoch zeigen die meisten Metaanalysen einen signifikanten Vorteil 81. Metaanalysen zeigen eine Effektgröße von 0,34 (0,22–0,46), was aufgrund der hohen Heterogenität der Studien und insbesondere der verwendeten Präparate teilweise schwierig zu interpretieren ist. Die intraartikuläre Anwendung von Hyaluronsäure ist relativ sicher, auch wenn es immer wieder Einzelberichte über pseudoseptische Reaktionen gibt. Gleichzeitig ist darauf hinzuweisen, dass die intraartikuläre Hyaluronsäureinjektion eine deutlich länger anhaltende Schmerzkontrolle erlaubt als die intraartikuläre Glucokortikoidinjektion 82 und sie durchaus in der Lage ist, einen Gelenkersatz hinauszuzögern 83. Hinsichtlich der Schmerzreduktion finden sich vergleichbare Effekte wie bei der oralen NSAIDs-Anwendung 84. Die intraartikuläre Hyaluronsäureapplikation stellt durchaus eine geeignete Alternative zur nichtsteroidalen Anwendung dar, insbesondere bei älteren Patienten und bei entsprechenden Risikopatienten. Die intraartikuläre Injektion von Corticosteroiden hat einen raschen Wirkeintritt und eine Wirkdauer von etwa 1 bis 3 Monaten8586. Es gilt jedoch zu bedenken, dass die intraartikuläre Kortikoidinjektion die Rate periprothetischer Infektionen erhöht, sofern die Kortikoidinjektion innerhalb weniger Monate vor der Prothesenimplantation erfolgte.
Stufe 3: Letzte pharmakologische Versuche vor der Operation
Falls es gilt, nichtoperable Patienten zu behandeln oder Patienten für eine kurze Zeit bis zur Operation zu begleiten, kann die kurzzeitige Anwendung schwacher Opioide sinnvoll sein. Der Effekt von Tramadol in der Schmerzreduktion und der Verbesserung der Gelenkfunktion bei der Kniearthrose ist gering, aber signifikant 88. Opioide bei der Behandlung von Arthrosepatienten haben eine signifikante Komorbidität und sollten nur in Extremsituationen Anwendung finden89. Die Kombination von Tramadol und Paracetamol scheint effektiv zu sein, wenn sie mit einem NSAID kombiniert wird, soweit das NSAID alleine keine ausreichende Schmerzreduktion erlaubt90. Hierbei gilt es jedoch, wieder an die Nebenwirkungen sowie die Komedikation zu denken91. Antidepressiva können bei chronischen Schmerzsyndromen die Schmerzneurotransmitter (z. B. Serotonin und Neuroepinephrin) zentral beeinflussen. Hierbei gilt es zu bedenken, dass auch eine zentrale Sensibilisierung beim chronischen Arthroseschmerzpatienten eine Rolle spielt92.
Stufe 4: End-Stage-Erkrankungsmanagement und Operation
Arthroskopische Verfahren sind ein Bestandteil der arthroskopischen Knorpeltherapie93. Im Jahre 2002 wurde die Effektivität der Arthroskopie im Rahmen der sogenannten Moseley-Studie sehr in Frage gestellt94. In dieser Untersuchung zeigt sich kein signifikanter Unterschied zwischen Patienten mit einer arthroskopischen Gelenklavage und einem arthroskopischen Débridement sowie einer sogenannten Sham-Operation. Es lag eine prospektiv randomisierte Studie vor, und die Behandlungsgruppen waren durchaus vergleichbar. Der Nachuntersuchungszeitraum betrug zwei Jahre.
Andere Autoren konnten jedoch durchaus eine schmerzreduzierende Wirkung der Gelenklavage bei Arthrose in einem vergleichbaren prospektiven randomisierten Studiendesign nachweisen. In der Literatur wurde hinsichtlich der Moseley-Studie auch auf gravierende Mängel hingewiesen, was die Validität der Aussagen der Autoren in Frage stellt. Die Arbeit von Ravaud et al.95 weist eine deutlich bessere Standardisierung von Patienten und therapeutischem Management auf. Eine weitere prospektiv randomisierte Studie verglich die Effekte der Gelenklavage mit 300 ml im Vergleich zur diagnostischen Arthroskopie ohne Verwendung einer Spülflüssigkeit. Diese Arbeitsgruppe konnte zeigen, dass Patienten, bei denen intraartikuläre Kristalle nachgewiesen wurden, einen schmerzreduzierten Effekt von 300 ml Spülflüssigkeit haben.
Auch die Studie von Kirkley et al.96 scheint weniger methodologische Probleme als die Moseley-Studie aufzuweisen. Dabei wurden Patienten mit einer Arthrose im Kellgren-Lawrence-Stadium II und III entweder intensiv physiotherapeutisch behandelt oder erhielten die gleiche Physiotherapie mit vorausgehender Arthroskopie. Die Arbeit war prospektiv randomisiert angelegt. Es zeigte sich ein kurzfristiger Effekt der Arthroskopie mit einen verbesserten WOMAC-Score nach drei Monaten, wobei hier insbesondere der Effekt der Physiotherapie positiv unterstrichen wurde. In beiden Therapiegruppen zeigte sich eine signifikante WOMAC-Verbesserung im Untersuchungszeitraum.
In der Summe zeigt eine Vielzahl von Untersuchungen eine Symptomreduktion und eine Funktionsverbesserung bei Arthrosepatienten, die jedoch stadien- und altersabhängig sind. Jüngere Patienten und frühere Stadien profitieren demnach mehr als ältere Patienten und fortgeschrittene Stadien. Auch eine Achsdeviation und eine Gelenkkontraktion sind wichtige negative Prognosefaktoren. Bei Patienten mit geraden Beinachsen zeigen sich bessere Ergebnisse nach arthroskopischer Gonarthrosetherapien. Vergleichbares gilt für Patienten mit bereits vorhandenen Gelenkkontrakturen. Ein Alter von über 60 Jahren stellt ebenfalls einen negativen Vorhersagefaktor dar. Eine kurze Anamnese, die Abwesenheit von Osteophyten, fehlendes Übergewicht und ein gut erhaltener Gelenkspalt gelten als günstige Vorhersagefaktoren für die Arthroskopie bei Gonarthrose.
Fazit
Insgesamt kann man somit festhalten, dass der Stellenwert der Arthroskopie bei der Gonarthrose in allen Frühstadien der Erkrankung hoch ist. Ein symptomlindernder Einfluss wird bei vielen Fallserien bestätigt. Neben dem allgemeinen Effekt der Lavage und des Débridements kommt es insbesondere dann zu einer Funktionsverbesserung, wenn mechanische Faktoren wie Meniskus- oder Knorpelpathologien vorliegen.
Die Umstellungsosteotomie ist bei entsprechender Indikation anerkannt97. Die Literatur ist sich einig, dass der totale Gelenkersatz eine sehr kosteneffektive und sinnvolle Maßnahme ist, wenn vorhergehende Maßnahmen versagen98. Der Gelenkersatz ist sehr effektiv hinsichtlich des Schmerzmanagements und hat eine gute Kosten-Nutzen-Relation, sofern die Patienten sorgfältig selektiert wurden, eine adäquate Patienteninformation erfolgte, die Operation unter guten anästhesiologischen und operativen Bedingungen durchgeführt wurde und die Rehabilitation ebenfalls sinnvoll gewählt wurde 99. Hierbei gilt es insbesondere zu berücksichtigen, dass die Überlebensrate der Endoprothesen nach 10 Jahren in etwa die 90-%-Marke erreicht und dass die Anzahl der Patienten, die keinen Gewinn von einer Knieendoprothese haben, soweit sie präoperativ realistische Erwartungen hatten, bei etwa 20 % liegt 100. Der unikompartimentelle Kniegelenkersatz ist ebenfalls als sinnvolles Verfahren geeignet und geht mit geringeren Komplikationen einher101.
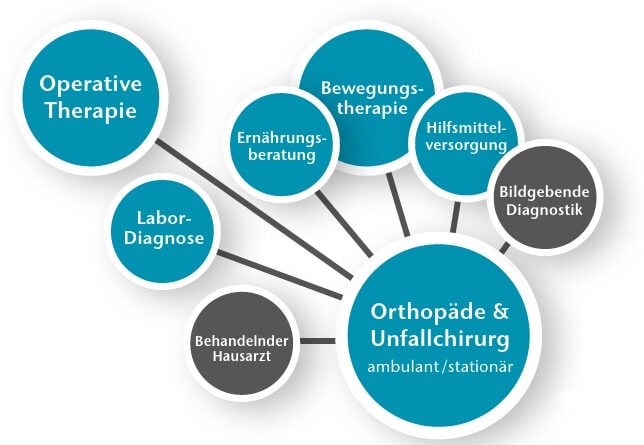
Die obigen Ausführungen machen deutlich, dass auch und insbesondere jenseits des Regelleistungsvolumens erhebliche Maßnahmen notwendig sind, um die Progression einer Arthrose zu verlangsamen. Diese Anforderungen stellen den Therapeuten dabei meist vor im Rahmen des Praxisalltags nicht zu meisternde Probleme. Hierzu zählt u. a. die Aufklärung über die Notwendigkeit zur Anpassung des Lebenswandels. Dieser umfasst eine adäquate Ernährung, ein individuelles Bewegungstraining, eine orthopädietechnische Versorgung und eine kontinuierliche Weiterbetreuung einschließlich einer Anpassung der eingeleiteten Maßnahmen bis hin zur Entscheidung, wann eine operative Maßnahme sinnvoll und zu indizieren ist. In diesem Gesamtsystem hat der Spezialist für Knorpel und Gelenke – der Orthopäde/Unfallchirurg – die entscheidende Gatekeeper-Funktion (Abb. 2).
Der Autor:
Prof. Dr. med. Dr. h. c. Jörg Jerosch
Chefarzt Klinik für Orthopädie,
Unfallchirurgie und Sportmedizin
Johanna-Etienne-Krankenhaus GmbH
Am Hasenberg 46
41462 Neuss
j.jerosch@ak-neuss.de
Begutachteter Beitrag/reviewed paper
Jerosch J. Sektorübergreifende Zusammenarbeit beim Arthrosemanagement unter Leitung von O & U. Orthopädie Technik. 2016; 67 (1): 42–47
- Dynamische Hüftabduktions-Lagerungsorthese zur Behandlung pathologisch veränderter Hüften bei neuromuskulären Erkrankungen in der Kinderorthopädie — 5. Juni 2025
- Ein neuronal gesteuertes Exoskelett in der Therapie von Patientinnen und Patienten mit Querschnittlähmung — 5. Juni 2025
- Digitale Wunddokumentation: Warum Papier keine Option mehr ist — 5. Juni 2025
- Jordan KM, Arden NK, Doherty M, Bannwarth B, Bijlsma JW, Dieppe P, et al. EULAR recommendations 2003: an evidence based approach to the management of knee osteoarthritis: report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann Rheum Dis, 2003; 62: 1145–1155
- Hochberg MC, Altman RD, April KT, Benkhalti M, Guyatt G, McGowan J, et al. American College of Rheumatology 2012 recommendations for the use of non-pharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip and knee. Arthritis Care Res, 2012; 64: 465–474 [review]
- Zhang W, Moskowitz RW, Nuki G, Abrasom S, Altman RD, Arden N, et al. OARSI recommendations for the management of hip and knee osteoarthritis. Part I: critical appraisal of existing treatment guidelines and systematic review of current research evidence. Osteoarthritis Cartilage, 2007; 15: 981‑1000
- Zhang W, Moskowitz RW, Nuki G, Abrasom S, Altman RD, Arden N, et al. OARSI recommendations for the management of hip and knee osteoarthritis. Part II: OARSI evidence-based, expert consensus guidelines. Osteoarthritis Cartilage, 2008; 16:137–162
- Zhang W, Moskowitz RW, Nuki G, Abrasom S, Altman RD, Arden N, et al. OARSI recommendations for the management of hip and knee osteoarthritis. Part III: changes in evidence following systematic cumulative update of research published through January 2009. Osteoarthritis Cartilage, 2010; 18: 476–499
- McAlindon TE, Bannuru RR, Sullivan MC, Arden NK, Berenbaum F, Bierma-Zeinstra SM, et al. OARSI guidelines for the nonsurgical management of knee osteoarthritis. Osteoarthritis Cartilage, 2014; 22: 363–388
- National Collaborating Centre for Chronic Conditions. Osteoarthritis: National clinical guidelines for care and management in adults. London: Royal College of Physicians, 2008
- NICE – National Institute for Health and Care Excellence. Osteoarthritis: care and management. Clinical Guideline CG177, 2014. http://www.nice.org.uk/guidance/cg177/resources/osteoarthritis-care-and-management-35109757272517 (Zugriff am 09.12.2015)
- Bruyère O, Burlet N, Delmas PD, Rizzoli R, Cooper C, Reginster JY. Evaluation of Symptomatic Slow-Acting Drugs in Osteoarthritis using the GRADE system. BMC Musculoskelet Disord, 2008; 9: 165
- Hiligsmann M, Cooper C, Arden N, Boers M, Branco JC, Luisa Brandi M, et al. Health economics in the field of osteoarthritis: an expert’s consensus paper from the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). Semin Arthritis Rheum, 2013; 43: 303–313
- Zhang W, Moskowitz RW, Nuki G, Abrasom S, Altman RD, Arden N, et al. OARSI recommendations for the management of hip and knee osteoarthritis. Part II: OARSI evidence-based, expert consensus guidelines. Osteoarthritis Cartilage, 2008; 16:137–162
- Zhang W, Moskowitz RW, Nuki G, Abrasom S, Altman RD, Arden N, et al. OARSI recommendations for the management of hip and knee osteoarthritis. Part III: changes in evidence following systematic cumulative update of research published through January 2009. Osteoarthritis Cartilage, 2010; 18: 476–499
- McAlindon TE, Bannuru RR, Sullivan MC, Arden NK, Berenbaum F, Bierma-Zeinstra SM, et al. OARSI guidelines for the nonsurgical management of knee osteoarthritis. Osteoarthritis Cartilage, 2014; 22: 363–388
- Hochberg MC, Altman RD, April KT, Benkhalti M, Guyatt G, McGowan J, et al. American College of Rheumatology 2012 recommendations for the use of non-pharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip and knee. Arthritis Care Res, 2012; 64: 465–474 [review]
- Jordan KM, Arden NK, Doherty M, Bannwarth B, Bijlsma JW, Dieppe P, et al. EULAR recommendations 2003: an evidence based approach to the management of knee osteoarthritis: report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann Rheum Dis, 2003; 62: 1145–1155
- Fernandes L, Hagen KB, Bijlsma JW, Andreeassen O, Christensen P, Conaghan PG, et al. EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis. Ann Rheum Dis, 2013; 72: 1125–1135
- Christensen R, Bartels EM, Astrup A, Bliddal H. Effect of weight reduction in obese patients with knee osteoarthritis: a systematic review and meta-analysis. Ann Rheum Dis, 2007; 66: 433–439
- Messier SP, Mihalko SL, Legault C, Miller GD, Nicklas BJ, DeVita P, et al. Effects of intensive diet and exercise on knee joint loads, inflammation and clinical outcomes among overweight an obese adults with knee osteoarthritis: the IDEA randomized clinical trial. J Am Med Assoc, 2013; 310: 1263–1273
- Anandacoomarasamy A, Leibman S, Smith G, Caterson I, Giuffre B, Fransen M, et al. Weight loss in obese people has structure-modifying effects on medial but not on lateral knee articular cartilage. Ann Rheum Dis, 2012; 71: 26–32
- Fernandes L, Hagen KB, Bijlsma JW, Andreeassen O, Christensen P, Conaghan PG, et al. EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis. Ann Rheum Dis, 2013; 72: 1125–1135
- Fransen M, McConnell S. Exercise for osteoarthritis of the knee. Cochrane Database Syst Rev, 2008; 4: CD004376
- Fernandes L, Hagen KB, Bijlsma JW, Andreeassen O, Christensen P, Conaghan PG, et al. EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis. Ann Rheum Dis, 2013; 72: 1125–1135
- Bartels EM, Lund H, Hagen KB, Dagfinrud H, Christensen R, Danneskiold-SamsØe B. Aquatic exercise for the treatment of knee and hip osteoarthritis. Cochrane Database Syst Rev, 2007; 4: CD005523
- Fransen M, McConnell S. Exercise for osteoarthritis of the knee. Cochrane Database Syst Rev, 2008; 4: CD004376
- Fernandes L, Hagen KB, Bijlsma JW, Andreeassen O, Christensen P, Conaghan PG, et al. EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis. Ann Rheum Dis, 2013; 72: 1125–1135
- Kang JW, Lee MS, Posadzki P, Ernst E. Tai chi for the treatment of osteoarthritis: a systematic review and meta-analysis. BMJ Open, 2011; 1: e000035 [PubMed PMID: 22021734. Pubmed Central PMCID: PMC3191392. Epub 2011/10/25].
- Segal NA. Bracing and orthoses: a review of efficacy and mechanical effects for tibiofemoral osteoarthritis. PM R, 2012; 4 (Suppl. 5): S89-96
- Raja K, Dewan N. Efficacy of knee braces and foot orthoses in conservative management of knee osteoarthritis: a systematic review. Am J Phys Med Rehabil, 2011; 90: 247–262
- Hunter D, Gross KD, McCree P, Li L, Hirko K, Harvey WF. Realignment treatment for medial tibiofemoral osteoarthritis: randomised trial. Ann Rheum Dis, 2012; 71: 1658–1665
- Segal NA. Bracing and orthoses: a review of efficacy and mechanical effects for tibiofemoral osteoarthritis. PM R, 2012; 4 (Suppl. 5): S89-96
- Fernandes L, Hagen KB, Bijlsma JW, Andreeassen O, Christensen P, Conaghan PG, et al. EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis. Ann Rheum Dis, 2013; 72: 1125–1135
- Loyola-Sanchez A, Richardson J, Macintyre NJ. Efficacy of ultrasound therapy for the management of knee osteoarthritis: a systematic review with meta-analysis. Osteoarthritis Cartilage, 2010; 18: 1117–1126
- Cakir S, Hepguler S, Ozturk C, Korkmaz M, Isleten B, Atamaz FC. Efficacy of therapeutic ultrasound for the management of knee osteoarthritis: a randomized, controlled, and doubleblind study. Am J Phys Med Rehabil, 2013; 93: 405–412
- Corbett MS, Rice SJ, Madurasinghe V, Slack R, Fayter DA, Harden M, et al. Acupuncture and other physical treatments for the relief of pain due to osteoarthritis of the knee: network meta-analysis. Osteoarthritis Cartilage, 2013; 21: 1290–1298
- Vickers AJ, Cronin AM, Maschino AC, Lewith G, MacPherson H, Foster NE, et al. Acupuncture for chronic pain: individual patient data meta-analysis. Arch Intern Med, 2012; 172: 1444–1453
- Rutjes AW, Nuesch E, Sterchi R, Kalichman L, Hendriks E, Osiri M, et al. Transcutaneous electrostimulation for osteoarthritis of the knee. Cochrane Database Syst Rev, 2009; 4: CD002823
- Atamaz FC, Durmaz B, Baydar M, Demircioglu OY, Iyiyapici A, Kuran B, et al. Comparison of the efficacy of transcutaneous electrical nerve stimulation, interferential currents, and shortwave diathermy in knee osteoarthritis: a double-blind, randomized, controlled, multicenter study. Arch Phys Med Rehabil, 2012; 93: 748–756
- Hochberg MC, Altman RD, April KT, Benkhalti M, Guyatt G, McGowan J, et al. American College of Rheumatology 2012 recommendations for the use of non-pharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip and knee. Arthritis Care Res, 2012; 64: 465–474 [review]
- Bannuru RR, Dasi UR, McAlindon TE, Reassessing the role of acetaminophen in osteoarthritis: systematic review and meta-analysis. Osteoarthritis Cartilage, 2010; 18 (Suppl. 2): S250
- Herrero-Beaumont G, Ivorra JA, Del Carmen Trabado M, Blanco FJ, Benito P, Martín-Mola E, et al. Glucosamine sulphate in the treatment of knee osteoarthritis symptoms: a randomized, double-blind, placebo-controlled study using acetaminophen as a side comparator. Arthritis Rheum, 2007; 56: 555–567
- Zhang W, Moskowitz RW, Nuki G, Abrasom S, Altman RD, Arden N, et al. OARSI recommendations for the management of hip and knee osteoarthritis. Part III: changes in evidence following systematic cumulative update of research published through January 2009. Osteoarthritis Cartilage, 2010; 18: 476–499
- Towheed TE, Maxwell L, Anastassiades TP, Shea B, Houpt J, Robinson V, et al. Glucosamine therapy for treating osteoarthritis. Cochrane Database Syst Rev, 2009; 1: CD002946
- Towheed TE, Maxwell L, Anastassiades TP, Shea B, Houpt J, Robinson V, et al. Glucosamine therapy for treating osteoarthritis. Cochrane Database Syst Rev, 2009; 1: CD002946
- Herrero-Beaumont G, Ivorra JA, Del Carmen Trabado M, Blanco FJ, Benito P, Martín-Mola E, et al. Glucosamine sulphate in the treatment of knee osteoarthritis symptoms: a randomized, double-blind, placebo-controlled study using acetaminophen as a side comparator. Arthritis Rheum, 2007; 56: 555–567
- Reginster JY, Deroisy R, Rovati LC, Lee RL, Lejeune E, Bruyere O, et al. Long-term effects of glucosamine sulphate on osteoarthritis progression: a randomised, placebo-controlled clinical trial. Lancet, 2001; 357: 251–256
- Pavelká K, Gatterová j, Olejarová M, Machacek S, Giacovelli G, Rovati LC. Glucosamine sulphate use and delay of progression of knee osteoarthritis: a 3‑year, randomized, placebocontrolled, double-blind study. Arch Intern Med, 2002; 162: 2113–2123
- Reginster JY.The efficacy of glucosamine sulphate in osteoarthritis: financial and nonfinancial conflict of interest. Arthritis Rheum, 2007; 56: 210510
- Bjordal JM, Klovning A, Lyjunggren AE, Slordal L. Shortterm efficacy of pharmacotherapeutic interventions in osteoarthritic knee pain: a meta-analysis of randomised placebo-controlled trials. Eur J Pain, 2007; 11: 125–138
- Hochberg MC, Altman RD, April KT, Benkhalti M, Guyatt G, McGowan J, et al. American College of Rheumatology 2012 recommendations for the use of non-pharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip and knee. Arthritis Care Res, 2012; 64: 465–474 [review]
- Clegg DO, Reda DJ, Harris CL, Klein MA, O’Dell JR, Hooper MM, et al. Glucosamine, chondroitin sulfate, and the two in combination for painful knee osteoarthritis. N Engl J Med, 2006; 354: 795–808
- Zhang W, Moskowitz RW, Nuki G, Abrasom S, Altman RD, Arden N, et al. OARSI recommendations for the management of hip and knee osteoarthritis. Part III: changes in evidence following systematic cumulative update of research published through January 2009. Osteoarthritis Cartilage, 2010; 18: 476–499
- National Collaborating Centre for Chronic Conditions. Osteoarthritis: National clinical guidelines for care and management in adults. London: Royal College of Physicians, 2008
- Altman RD. Glucosamine therapy for knee osteoarthritis: pharmacokinetic considerations. Expert Rev Clin Pharmacol, 2009; 2: 359–371
- Pavelká K, Gatterová j, Olejarová M, Machacek S, Giacovelli G, Rovati LC. Glucosamine sulphate use and delay of progression of knee osteoarthritis: a 3‑year, randomized, placebocontrolled, double-blind study. Arch Intern Med, 2002; 162: 2113–2123
- Hochberg MC, Zhan M, Langenberg P. The rate of decline of joint space width in patients with osteoarthritis of the knee: a systematic review and meta-analysis of randomized placebocontrolled trials of chondroitin sulphate. Curr Med Res Opin, 2008; 24: 3029–3035
- Kahan A, Uebelhart D, De Vathaire F, Delmas PD, Reginster JY. Long-term effects of chondroitins 4 and 6 sulfate on knee osteoarthritis: the study on osteoarthritis progression prevention, a two-year, randomized, double-blind, placebo-controlled trial. Arthritis Rheum, 2009; 60: 524–533
- Kahan A, Uebelhart D, De Vathaire F, Delmas PD, Reginster JY. Long-term effects of chondroitins 4 and 6 sulfate on knee osteoarthritis: the study on osteoarthritis progression prevention, a two-year, randomized, double-blind, placebo-controlled trial. Arthritis Rheum, 2009; 60: 524–533
- Reichenbach S, Sterchi R, Scherer M, Trelle S, Burgi E, Burgi U. et al. Meta-analysis: chondroitin for osteoarthritis of the knee or hip. Ann Intern Med, 2007; 146: 580–590
- McAlindon TE, Bannuru RR, Sullivan MC, Arden NK, Berenbaum F, Bierma-Zeinstra SM, et al. OARSI guidelines for the nonsurgical management of knee osteoarthritis. Osteoarthritis Cartilage, 2014; 22: 363–388
- Hochberg MC, Martel-Pelletier J, Monfort J, et al. on behalf of the MOVES Investigation Group. Combined chondroitin sulfate and glucosamine for painful knee osteoarthritis: a multicentre, randomised, doubleblind, non inferiority trial versus celecoxib. Ann Rheum Dis, February 13, 2015 [Epub ahead of print]. http://ard.bmj.com/content/early/2015/02/13/annrheumdis-2014–206792.full.pdf+html (Zugriff am 09.12.2015]
- Christensen R, Bartels EM, Astrup A, Bliddal H. Symptomatic efficacy of avocado-soybean unsaponifiables (ASU) in osteoarthritis (OA) patients: a meta-analysis of randomized controlled trials. Osteoarthritis Cartilage, 2008; 16: 399–408
- Bartels EM, Bliddal H, Schondorff PK, Altmann RD, Zhang W, Christensen R. Symptomatic efficacy and safety of diacerein in the treatment of osteoarthritis: a meta-analysis of randomized placebo-controlled trials. Osteoarthritis Cartilage, 2010; 18: 289–296
- The European Medicines Agency. Meeting highlights from the Pharmacovigilance Risk Assessment Committee (PRAC), 2–5 December 2013. http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/news/2013/12/news_detail_001985.jsp&mid=WC0b01ac058004d5c1 (Zugriff am 09.12.2015)
- Reginster JY, Badurski J, Bellamy N, Bensen W, Chapurlat R, Chevalier X, et al. Efficacy and safety of strontium ranelate in the treatment of knee osteoarthritis; results of a double-blind, randomised placebo-controlled trial. Ann Rheum Dis, 2013; 72:179–186
- The European Medicines Agency. European Medicines Agency recommends that Protelos/Osseor remain available but with further restrictions. 21 February 2014. http://www.ema.europa.eu/docs/en_GB/document_library/Press_release/2014/02/WC500161971.pdf (Zugriff am 09.12.2015)
- Lin J, Zhang W, Jones A, Doherty M. Efficacy of topical nonsteroidal anti-inflammatory drugs in the treatment of osteoarthritis: meta-analysis of randomised controlled trials. Br Med J, 2004; 329: 324–326
- National Collaborating Centre for Chronic Conditions. Osteoarthritis: National clinical guidelines for care and management in adults. London: Royal College of Physicians, 2008
- Tugwell PS, Wells GA, Shainhouse JZ. Equivalence study of a topical diclofenac solution (pennsaid) compared with oral diclofenac in symptomatic treatment of osteoarthritis of the knee: a randomized controlled trial. J Rheumatol, 2004; 31: 2002–2012
- Simon LS, Grierson LM, Naseer Z, Bookman AA, Zev Shainhouse J. Efficacy and safety of topical diclofenac containing dimethyl sulfoxide (DMSO) compared with those of tropical placebo, DMSO vehicle and oral diclofenac for knee osteoarthritis. Pain, 2009; 143 (3): 238–245
- Chou R, McDonagh MS, Nakamoto E, Griffin J. Analgesics for osteoarthritis: An update of the 2006 comparative effectiveness review. Rockville (MD): Agency for Healthcare Research and Quality (US), 2011
- Underwood M, Ashby D, Cross P, Hennessy E, Letley L, Martin J, et al. TOIB study team. Advice to use topical or oral ibuprofen for chronic knee pain in older people: randomised controlled trial and patient preference study. Br Med J, 2008; 336: 138–142
- Matthews P, Derry S, Moore RA, McQuay HJ. Topical rubefacients for acute and chronic pain in adults. Cochrane Database Syst Rev, 2009; 8: CD007403.
- Chou R, McDonagh MS, Nakamoto E, Griffin J. Analgesics for osteoarthritis: An update of the 2006 comparative effectiveness review. Rockville (MD): Agency for Healthcare Research and Quality (US), 2011
- Zhang W, Jonas A, Doherty M. Does paracetamol (acetaminophen) reduce the pain of osteoarthritis? A meta-analysis of randomised controlled trials. Ann Rheum Dis, 2004; 63: 901–907
- Zhang W, Jonas A, Doherty M. Does paracetamol (acetaminophen) reduce the pain of osteoarthritis? A meta-analysis of randomised controlled trials. Ann Rheum Dis, 2004; 63: 901–907
- Pincus T, Koch G, Lei H, Mangal B, Sokka T, Moskowitz R, et al. Patient preference for Placebo, Acetaminophe (paracetamol) or Celecoxib Efficacy Studies (PACES): two randomised, double blind, placebo controlled, crossover clinical trials in patiehts with knee or hip osteoarthrtitis. Ann Rheum Dis, 2004; 63: 931–939
- Chou R, McDonagh MS, Nakamoto E, Griffin J. Analgesics for osteoarthritis: An update of the 2006 comparative effectiveness review. Rockville (MD): Agency for Healthcare Research and Quality (US), 2011
- Towheed TE, Maxwell L, Anastassiades TP, Shea B, Houpt J, Robinson V, et al. Glucosamine therapy for treating osteoarthritis. Cochrane Database Syst Rev, 2009; 1: CD002946
- Lagnaoui R, Baumevielle M, Bégaud B, Pouyanne P, Maurice G, Depont F, et al. Less use of NSAIDs in long-term than in recent chondroitin sulphate users in osteoarthritis: a pharmacy-based observational study in France. Therapie, 2006; 61: 341–346
- Chou R, McDonagh MS, Nakamoto E, Griffin J. Analgesics for osteoarthritis: An update of the 2006 comparative effectiveness review. Rockville (MD): Agency for Healthcare Research and Quality (US), 2011
- Zhang W, Moskowitz RW, Nuki G, Abrasom S, Altman RD, Arden N, et al. OARSI recommendations for the management of hip and knee osteoarthritis. Part II: OARSI evidence-based, expert consensus guidelines. Osteoarthritis Cartilage, 2008; 16:137–162
- Bannuru RR, Natov NS, Obadan IE, Price LL, Schmid CH, McAlindon TE. Therapeutic trajectory of hyaluronic acid versus corticosteroids in the treatment of knee osteoarthritis: a systematic review and meta-analysis. Arthritis Rheum, 2009; 61: 1704–1711
- Abbott T, Altmann RD, Dirnef R, Fredericson M, Vad V, Vitanzo P Jr., et al. Do hyaluronic acid injections delay total knee replacement surgery? Arthritis Rheum, 2013; 65: S910-S911
- Bannuru RR, Vaysbrot EE, Sullivan MC, McAlindon TE. Relative efficacy of hyaloronic acid in comparison with NSAIDs for knee osteoarthritis: a systematic review and meta-analysis. Semin Arthritis Rheum, 2013; 43: 593–599
- Bannuru RR, Natov NS, Obadan IE, Price LL, Schmid CH, McAlindon TE. Therapeutic trajectory of hyaluronic acid versus corticosteroids in the treatment of knee osteoarthritis: a systematic review and meta-analysis. Arthritis Rheum, 2009; 61: 1704–1711
- Bellamy N, Campbell J, Robinson V, Gee T, Bourne R, Wells G. Intraarticular corticosteroid for treatment of osteoarthritis of the knee. Cochrane Database Syst Rev, 2006; 2: CD005328 [review]
- Cepeda MS, Camargo F, Zea C, Valencia L. Tramadol for osteoarthritis: a systematic review and metaanalysis. J Rheumatol, 2007; 34: 543–555[/efn_note. Hierbei ist jedoch zu bedenken, dass die unerwünschten Wirkungen deutlich höher sind als bei einem Placebo und somit bei vielen Patienten diese Therapie nicht fortgeführt werden kann 87Cepeda MS, Camargo F, Zea C, Valencia L. Tramadol for osteoarthritis: a systematic review and metaanalysis. J Rheumatol, 2007; 34: 543–555
- Emkey R, Rosenthal N, Wu SC, Jordan D, Kamin M, CAPSS-114 Study Group. Efficacy and safety of tramadol/acetaminophen tablets (Ultracet) as add-on therapy for osteoarthritis pain in subjects receiving a COX‑2 nonsteroidal anti-inflammatory drug: a multicenter, randomized, double-blind, placebo-controlled trial. J Rheumatol, 2004; 31: 150–156
- Altman RD. Pain relief in osteoarthritis: the rationale for combination therapy. J Rheumatol, 2004; 31: 5–7
- Solomon DH, Rassen JA, Glynn RJ, Lee J, Levin R, Schneeweiss S. The comparative safety of analgesics in older adults with arthritis. Arch Intern Med, 2010; 170: 1968–1976
- Arendt-Nielsen L, Nie H, Laursen MB, Laursen BS, Madeleine P, Simonsen OH, et al. Sensitization in patients with painful knee osteoarthritis. Pain, 2010; 149: 573–581
- Laupattarakasem W, Laopaiboon M, Laupattarakasem P, Sumananont C. Arthroscopic debridement for knee osteoarthritis. Cochrane Database Syst Rev, 2008; 1: CD005118
- Moseley JB, O’Malley K, Petersen NJ, et al. A controlled trial of arthroscopic surgery for osteoarthritis of the knee. N Engl J Med, 2002; 347: 81–88
- Ravaud P, Moulinier L, Giraudeau B, et al. Effects of joint lavage and steroid injection in patients with osteoarthritis of the knee: results of a multicenter, randomized, controlled trial. Arthritis Rheum, 1999; 42: 475–482
- Kirkley A, Birmingham TB, Litchfield RB, et al. A randomized trial of arthroscopic surgery for osteoarthritis of the knee. N Eng J Med, 2008; 359: 1097–1107
- Brouwer RW, Raaij van TM, Bierma-Zeinstra SM, Verhagen AP, Jakma TS, Verhaar JA. Osteotomy for treating knee osteoarthritis. Cochrane Database Syst Rev, 2007; 3: CD004019
- Ethgen O, Bruyere O, Richy F, Dardennes C, Reginster J‑Y. Health-related quality of life in total hip and total knee arthroplasty: a qualitative and systematic review of the literature. J Bone JOnt Surg Am, 2004; 86‑A: 963–974
- NICE – National Institute for Health and Care Excellence. Osteoarthritis: care and management. Clinical Guideline CG177, 2014. http://www.nice.org.uk/guidance/cg177/resources/osteoarthritis-care-and-management-35109757272517 (Zugriff am 09.12.2015)
- NICE – National Institute for Health and Care Excellence. Osteoarthritis: care and management. Clinical Guideline CG177, 2014. http://www.nice.org.uk/guidance/cg177/resources/osteoarthritis-care-and-management-35109757272517 (Zugriff am 09.12.2015)
- Griffin T, Rowden N, Morgan D, Atkinson RR, Woodruff P, Maddern G. Unicompartmental knee arthroplasty for the treatment of unicompartmental osteoarthritis: a systematic study. ANZ J Surg, 2007; 77: 214–221