Phantomempfinden, Stumpfschmerzen und Phantomschmerz
Nach der Amputation eines Körperteils, insbesondere von Extremitäten, können drei verschiedene Phänomene auftreten: 1. Phantomempfinden, 2. Stumpfschmerzen, 3. Phantomschmerz 1. Diese drei Phänomene bedingen sich mitunter gegenseitig 2. Ihre Differenzierung ist daher essenziell für eine gezielte Therapie:
1. Phantomempfinden beschreibt das Empfinden amputierter Körperteile. Diese „Phantomempfindungen“ treten in der Regel sofort nach der Amputation oder Tage oder sogar Wochen danach verzögert auf. Diese Empfindungen haben eine variable Dauer 34. Phantomempfinden ist selten ein klinisches Problem, denn definitionsgemäß ist es nicht schmerzhaft und tritt nahezu regelhaft auf 56. Die Aufklärung der Patienten über die Möglichkeit dieser Empfindungen ist sehr wichtig, vor allem bei Kindern, um daraus erwachsende Ängste überwinden zu können 7.
2. Stumpfschmerzen sind zunächst ein akuter nozizeptiver Schmerz (ein Schmerz, der über Schmerzrezeptoren vermittelt wird), der unmittelbar nach der Amputation auftritt und in der Regel nach einigen Wochen, wenn die Wunde am Amputationsstumpf geheilt ist, abnimmt 8. Infektionen oder Wunddehiszenzen können diese postoperativen Schmerzen prolongieren. In einigen Fällen können Stumpfschmerzen allerdings über die Phase der Wundheilung hinaus über Monate oder Jahre persistieren.
3. Phantomschmerzen treten normalerweise innerhalb der ersten Woche nach einer Amputation auf. Sie können sich aber auch Monate oder Jahre danach entwickeln 910. Phantomschmerzen können unterschiedliche Qualitäten haben; Beispiele sind eine „elektrische“, „einschießende“, „brennende“ oder „krampfende“ Schmerzqualität 11. Charakteristischerweise sind Phantomschmerzen im distalen Bereich des Phantomgliedes lokalisiert. Einige betroffene Amputierte berichten einen konstanten Schmerz unterschiedlicher Intensität; andere erleben intermittierende Episoden hochintensiver Schmerzen in einer täglichen, wöchentlichen oder weniger häufigen Frequenz. Die Dauer der Symptome ist unvorhersehbar. Wenn der Phantomschmerz länger als sechs Monate bestehen bleibt, ist die Prognose für spontane Verbesserung schlecht 1213. Periphere, spinale und supraspinale Mechanismen werden für die Entstehung dieser Schmerzqualität verantwortlich gemacht 14.
Inzidenzen
50 bis 80 % der Amputierten leiden unter Phantomschmerzen 1516; 25 % der Betroffenen leiden 15 Stunden am Tag daran, 20 % für mindestens eine Stunde täglich 17. Bei 12 % der Amputierten tritt dieser Schmerz unmittelbar nach der Amputation auf, bei 2 % in einem Intervall von drei Wochen 18 . 13 bis 71 % der Amputierten leiden unter Stumpfschmerzen 19. Stumpfschmerzen wurden bei 66 % der Patienten mit Phantomschmerzen und bei 50 % der Patienten ohne Phantomschmerzen festgestellt 20. Langzeitstumpfschmerzen sind negativ prognostisch für das Auftreten langfristiger Phantomschmerzen 21. Es konnte gezeigt werden, dass Stumpfschmerzen, die in der ersten postoperativen Woche auftraten, mit dem Auftreten von Phantomschmerzen in der ersten postoperativen Woche korrelieren 22. Der Prävention von Stumpfschmerzen kommt somit ein bedeutender Stellenwert zu 23.
Interdisziplinäre Therapie des Stumpfschmerzes
Die Behandlung anhaltender Stumpfschmerzen kann sehr schwierig sein 2425: Die davon betroffenen Patienten haben neben dem gravierenden Ereignis der Amputation häufig eine frustrane medizinische und orthopädietechnische Historie erlebt. Die adäquate Behandlung und das Management der Stumpfschmerzen hängen vor allem von ihrer Ursache ab 26. Entsprechend ist zunächst eine präzise Diagnostik unter Einbeziehung der Physio- und Ergotherapeuten, der Rehabilitationseinrichtung und des versorgenden Orthopädie-Technikers für den Therapieerfolg grundlegend.
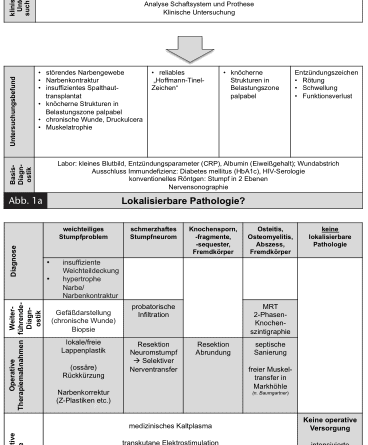
Der überwiegende Anteil der Amputierten schildert empfindliche Stellen am Stumpf. In manchen Fällen von Stumpfschmerzen ist es möglich, sie nicht-invasiv durch konservative Therapiemaßnahmen (Desensibilisierung bei schmerzhaften Stumpfneuromen), die Optimierung von Prothesenpassteilen und die Anpassung innovativer Schafttechnologien zu lösen. In der Vergangenheit zeigten explorative chirurgische Eingriffe – das heißt Operationen, die hauptsächlich durchgeführt wurden, um die Ursache der Beschwerden zu ermitteln – keine zufriedenstellendenpostoperativen Ergebnisse 2728. Chirurgische Revisionen sind daher den Stumpfschmerzen vorbehalten, bei denen eine Pathologie identifizierbar und lokalisierbar ist. Dies sind zum Beispiel Knochenfragmente, Knochensequester, Hautläsionen, insuffizienter Weichteilmantel, Narbengewebe, abgerutschte Muskelschlingen, schmerzhafte Neurome, Osteomyelitis oder Abszesse 293031.
Die Abbildungen 1a und b zeigen den an der Universitätsmedizin Göttingen etablierten interdisziplinären Diagnostik- und Therapiepfad zur Behandlung therapierefraktärer Stumpfschmerzen.
Team der interdisziplinären Sprechstunde
Die interdisziplinäre Sprechstunde umfasst Chirurgen, Neurologen, Orthopädie-Techniker, spezialisierte Physiotherapeuten und Ergotherapeuten. Im Versorgungsraum Göttingen handelt es sich dabei um ein festes Team. Für Patienten außerhalb des Versorgungsraums werden die behandelnden Techniker und Therapeuten mit zum Konsultationstermin in die Sprechstunde eingeladen. Diese interdisziplinäre Arbeitsweise hat deutliche Vorteile gezeigt, da das komplexe Krankheitsbild der Stumpfschmerzen auf diese Weise multimodal behandelt werden kann.
Die Patienten werden aufgefordert, ihre bisherigen prothetischen Versorgungen und Schaftsysteme in die Sprechstunde mitzubringen. Mittels einer initialen Anamnese, einer klinischen Untersuchung des Stumpfes, einer Inspektion und Untersuchung der prothetischen Versorgung sowie einer Basisdiagnostik gilt es zunächst den Stumpfschmerz von Phantomempfinden oder Phantomschmerzen abzugrenzen oder Mischformen zu identifizieren. Diese Differenzierung ist elementar, da Phantomschmerzen vor allem medikamentös oder durch therapeutische Maßnahmen wie Spiegeltherapie, nicht aber durch chirurgische Eingriffe erfolgreich behandelt werden können. Zudem ergeben sich aus der Anamnese und der klinischen Untersuchung Hinweise, ob die zugrundeliegende Pathologie des Stumpfschmerzes weichteiliger, neuraler, knöcherner oder entzündlicher Ätiologie ist. Es können auch Mischformen vorliegen.
Weichteilige Pathologien
Häufig führen Narben zu Schmerzen am Stumpf 32 . Eingezogene oder hypertrophe Narben können den Tragekomfort der Prothese trotz innovativer Schafttechnologien einschränken. Gelenkübergreifende Narben können zu Bewegungseinschränkungen durch sogenannte Narbenkontrakturen führen. Eine Resektion des Narbengewebes oder multiple Z‑Plastiken entfernen das störende, schmerzhafte und bewegungslimitierende Gewebe.
Bei traumatischen Amputationen ist der Stumpf häufig mit Spalthaut gedeckt. Es fehlt das abpolsternde subkutane Fettgewebe, das zugleich auch Gleitlager ist. Bei muskulär sehr atrophen Amputationsstümpfen können knöcherne Strukturen in der Belastungszone palpabel sein und führen aufgrund des fehlenden Weichteilpolsters ebenfalls zu Druckstellen und Schmerzen. Dies kann auch bei dislozierten Muskelschlingen auftreten. Lokale oder freie (Muskel-)Lappenplastiken können in solchen Fällen eine nachhaltige Lösung bieten. Bei Inaktivitätsatrophien aufgrund längerer Bettlägerigkeit kann transkutane Elektrostimulation neben Physiotherapie helfen, die Muskulatur wieder aufzubauen.
Ein komplexes Problem stellen chronische Wunden dar. Hier gilt es Risikofaktoren zu identifizieren. Eine unzureichende Durchblutung, ein unerkannter oder insuffizient eingestellter Diabetes mellitus, Nikotinabusus, Polyneuropathien, Immundefizienzen, Allergien gegen Schaftmaterialien oder ein Eiweißmangel sollten ausgeschlossen werden 33.
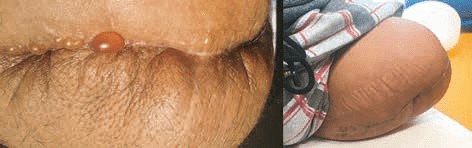
Bei klinischen und laborchemischen Entzündungszeichen (Rötung, Schwellung) sollte ein Wundabstrich mit kalkulierter Antibiotikatherapie erfolgen. In diesem Fall sollte eine Osteomyelitis oder ein Abszess gleichermaßen durch weiterführende bildgebende Diagnostik (MRT, 2‑Phasen-Knochenszintigraphie) ausgeschlossen werden. Die komplexe chirurgische Sanierung einer Osteomyelitis erfolgt in Kooperation mit den Chirurgen der Orthopädie, z. B. durch intramedulläre muskuläre Lappenplastiken (Technik nach Baumgartner) (Abb. 2a u. b). Eine nichtinvasive Therapieoption bei infizierten Wunden und Mikrozirkulationsstörungen, wie sie häufig bei Diabetikern auf treten, bietet die Behandlung mit medizinischem Kaltplasma („di_CAP PlasmaDerm®“). Über eine antimikrobielle und durchblutungssteigernde Wirkung kann der Heilungsverlauf chronischer Wunden positiv beeinflusst werden 34. Sofern keine der oben genannten Risikofaktoren identifiziert werden konnten, sollte über eine Biopsie eine maligne Grunderkrankung wie z. B. ein Plattenepithelkarzinom ausgeschlossen werden.
Ossäre Pathologien
Druckschmerzen ohne sichtbare Druckstellen können mit scharfen Knochenfragmenten am Stumpfende oder Fremdkörpern assoziiert sein. Röntgenbilder oder zusätzliche feinschichtige CT-Aufnahmen lokalisieren diese Pathologien. Eine chirurgische Resektion ermöglicht eine nachhaltige Endbelastung.
Neurale Pathologien
Neurome sind eine reaktive Gewebsneubildung, die entweder posttraumatisch aus regenerierenden Axonen, Schwann-Zellen und perineuralem Hüllgewebe der neu gebildeten Nervenfaszikel besteht oder aufgrund von Druckbelastungen als Fibrose des perineuralen Hüllgewebes entstehen kann 35 . Narbiges Gewebe aus der Umgebung oder eine oberflächliche Lokalisation der Nervenstümpfe in einer Belastungszone können durch unverhältnismäßige Druckbelastungen zu Neuromschmerzen führen. Der Schmerz wird von den Betroffenen als „einschießend“, „ausstrahlend“ und „elektrisch“ beschrieben. Charakteristisch ist ebenso, dass multiple Schaftsysteme, ein angepasster Prothesenaufbau und multimodale medikamentöse Therapieregime zu keiner Schmerzlinderung führen. Neuromschmerzen sind akribisch von Phantomschmerzen abzugrenzen, da Neurome chirurgisch, Phantomschmerzen dahingegen medikamentös oder durch therapeutische Maßnahmen wie Spiegeltherapie behandelt werden 363738.
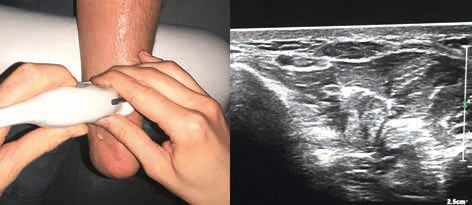
Klinisch imponieren die traumatischen Neurome durch ein „HoffmannTinel-Zeichen“. Dieser durch Beklopfen auslösbare Schmerz mikroanatomischer bulböser Enden regenerierender Axone wird auch „Hoffmann’sches Klopfzeichen“ genannt. Das „Hoffmann-Tinel-Zeichen“ beschreibt die abnorme Irritierbarkeit von Nervenfasern mit unzureichender Bemarkung der Axone 39. Der durch den mechanischen Stimulus provozierbare Schmerz wird charakteristischerweise als „elektrischer, ausstrahlender“ Impuls ins entsprechende ehemalige nervale Versorgungsgebiet projiziert. Dies ist vor allem an den Verletzungsstellen der Fall 40. Das „Hoffmann-Tinel-Zeichen“ ist ein einfacher, aber reliabler klinischer Test. Der oben beschriebene schmerzhafte Punkt wird dabei am Stumpf markiert.
Die Entwicklung neuer Ultraschallsysteme mit Multifrequenzlinearschallköpfen von 12 bis 18 MHz und die Einführung verbesserter Bildverarbeitung ermöglichen eine nicht-invasiv, dynamische, kontrastmittelfreie und zugleich kostengünstige Darstellung sowohl großkalibriger peripherer Nerven als auch kleiner sensibler Nervenendäste bis auf die Faszikelebene 41. Daher wächst der Stellenwert dieser ul traschallbasierten Bildgebung gegenüber der Hochfeld-Magnetresonanz-Neurographie stetig. Diese neue Technologie ermöglicht erstmalig die Echtzeit-Lokalisation schmerzhafter kleinster sensibler Stumpfneurome (Abb. 3a u. b).
Die aktuelle AWMF-Leitlinie „Versorgung peripherer Nervenverletzungen“ 42 schildert zahlreiche chirurgische und nicht-chirurgisch Techniken zur Therapie schmerzhafter Neurome mit unterschiedlicher Evidenz. Bei Versagen konservativer Maßnahmen (z. B. Desensibilisierung) stellt eine Operation eine Behandlungsoption dar, wobei nach der oben genannten Leitlinie keine Empfehlung für eine spezielle Technik gegeben werden kann – die Auswahl muss individuell erfolgen. Es besteht die Möglichkeit der Verlagerung des Nervenstumpfes in die Muskulatur 43, einer End-zu-Seit-Neurorrhaphie 44, der Verlagerung in eine Vene sowie des Versenkens des Neuroms bzw. Nervenendes im Knochen 45. Weitere chirurgische Verfahren sind die Abkapselung des Nervenendes durch Epineurial-Sleeve-Technik 46(Silastic-Kappen, Silikon-Tubes), die mikrochirurgische Applikation destruierender Agenzien („molecular neurosurgery“) oder eine Bedeckung durch Fettlappen 47.
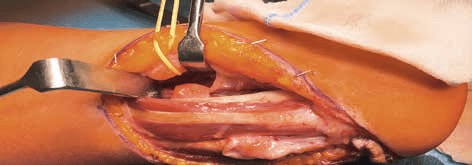
Aufgrund positiver Erfahrungen im Bereich des selektiven Nerventransfers zur Steuerung myoelektrischer Prothesen („Targeted Muscle Reinnervation; TMR“) 4849 führen die Verfasser diesen selektiven Nerventransfer auch bei schmerzhaften Stumpfneuromen durch. Die direkte Nerv-Nerv-Koaptation erfolgt sowohl bei sensorischen als auch bei motorischen Nerven. In einem initialen Patientenkollektiv von 15 transhumeral und glenohumeral Amputierten konnte der Neuromschmerz nach einem selektiven Nerventransfer (TMR) nachhaltig reduziert werden 50. Intraoperativ werden die Neurome dazu bis auf gesunde Faszikelstrukturen zurückgekürzt und durch eine mikrochirurgische Nervennaht mit benachbarten Nerven in direkter Endzu-End-Nervennaht koaptiert (Abb. 4). Eine weitere Möglichkeit besteht darin, den Nervenstumpf auf das Epimysium benachbarter, aber oberflächenferner Muskeln, die sich außerhalb der Belastungszone befinden, zu koaptieren. Die Nervennaht sollte drei Wochen postoperativ nicht belastet werden. Im Patientenkollektiv der Autoren konnten zuvor nicht prothetisch versorgbare Patienten mit lokalisierbaren schmerzhaften Stumpfneuromen nach diesem Eingriff schließlich erfolgreich prothetisch versorgt werden, da auf diese Weise eine ausreichende Belastbarkeit des Stumpfes hergestellt werden konnte.
Insgesamt führt jedoch nicht jede Nervendurchtrennung zwangsläufig zu einer Neurombildung 51. Da das Behandlungsergebnis bei einem schmerzhaften Neurom insgesamt nach aktueller Literaturlage zumeist unbefriedigend ist, kommt der Prävention der Neuromentstehung im Rahmen der Amputation eine besondere Bedeutung zu 525354.
Schlussfolgerungen
Die Manifestationsformen von „Schmerzen am Stumpf” sind ebenso heterogen wie deren Ätiologie. Eine erfolgreiche Schmerzreduktion erfordert einen geeigneten Therapiealgorithmus und ein interdisziplinäres Behandlungskonzept. Chirurgische Revisionen des Stumpfes führen dann zu einer nachhaltigen Schmerzreduktion, wenn es eine nachweisbare Pathologie gibt. Bei schmerzhaften Amputationsneuromen bieten hochauflösendes Nervenultraschall und selektive Nerventransfers neue Diagnostik- und Therapieoptionen, chronische Wunden im Stumpfbereich können durch innovative, nichtinvasive plasmabasierte Wundheilverfahren erfolgreich behandelt werden.
Für die Autoren:
Dr. med. Jennifer Ernst
Universitätsmedizin Göttingen
Klinik für Unfallchirurgie, Orthopädie
und Plastische Chirurgie
Robert-Koch-Str. 40
37075 Göttingen
jennifer.ernst@med.uni-goettingen.de
Begutachteter Beitrag/reviewed paper
Ernst J., Liebetanz D., Halsband C., Wüstefeld D., Andres E., Siegel J., Stinus H., Braatz F., Burchhardt H., Schilling A. F., Lehmann W., Felmerer G. Moderne Stumpfchirurgie: (plastisch-)chirurgische Therapieoptionen bei lokalisierbaren Stumpfschmerzen. Orthopädie Technik, 2017; 68 (11): 32–36
- Dynamische Unterschenkelorthese in Prepreg-Technik nach Hafkemeyer – Konstruktionsmerkmale, Indikationen, Variationsmöglichkeiten — 3. April 2024
- Bringt die Stand- und Schwungphasenkontrolle einen Vorteil bei KAFO-Trägern? Ergebnisse einer internationalen randomisiert-kontrollierten Studie — 3. April 2024
- Dynamische CDS-Knieredressionsorthesen bei Kindern und Jugendlichen mit Cerebralparese GMFCS-Level II–III — 3. April 2024
- Flor H. Phantom-limb pain: characteristics, causes, and treatment. The Lancet Neurology, 2002; 1 (3): 182–189
- Nikolajsen L, Ilkjaer S, Krøner K, Christensen JH, Jensen TS. The influence of preamputation pain on postamputation stump and phantom pain. Pain, 1997; 72 (3): 393–405
- Flor H. Phantom-limb pain: characteristics, causes, and treatment. The Lancet Neurology, 2002; 1 (3): 182–189
- Jackson MA, Simpson KH. Pain after amputation. Continuing Education in Anaesthesia, Critical Care & Pain, 2004; 4 (1): 20–23
- Flor H. Phantom-limb pain: characteristics, causes, and treatment. The Lancet Neurology, 2002; 1 (3): 182–189
- Jackson MA, Simpson KH. Pain after amputation. Continuing Education in Anaesthesia, Critical Care & Pain, 2004; 4 (1): 20–23
- Jackson MA, Simpson KH. Pain after amputation. Continuing Education in Anaesthesia, Critical Care & Pain, 2004; 4 (1): 20–23
- Jackson MA, Simpson KH. Pain after amputation. Continuing Education in Anaesthesia, Critical Care & Pain, 2004; 4 (1): 20–23
- Flor H. Phantom-limb pain: characteristics, causes, and treatment. The Lancet Neurology, 2002; 1 (3): 182–189
- Nikolajsen L, Ilkjaer S, Krøner K, Christensen JH, Jensen TS. The influence of preamputation pain on postamputation stump and phantom pain. Pain, 1997; 72 (3): 393–405
- Kooijman CM, Dijkstra PU, Geertzen JH, Elzinga A, van der Schans CP. Phantom pain and phantom sensations in upper limb amputees: an epidemiological study. Pain, 2000; 87 (1): 33–41
- Flor H. Phantom-limb pain: characteristics, causes, and treatment. The Lancet Neurology, 2002; 1 (3): 182–189
- Kooijman CM, Dijkstra PU, Geertzen JH, Elzinga A, van der Schans CP. Phantom pain and phantom sensations in upper limb amputees: an epidemiological study. Pain, 2000; 87 (1): 33–41
- Flor H. Phantom-limb pain: characteristics, causes, and treatment. The Lancet Neurology, 2002; 1 (3): 182–189
- Flor H. Phantom-limb pain: characteristics, causes, and treatment. The Lancet Neurology, 2002; 1 (3): 182–189
- Jensen TS, Nikolajsen L. Phantom pain and other phenomena after amputation. In: Wall P, Melzack R (eds). The Textbook of Pain. London: Churchill Livingstone, 1999
- Sherman RA, Sherman CJ, Parker L. Chronic phantom and stump pain among American veterans: Results of a survey. Pain, 1984; 18: 83–95
- Carlen PL, Wall PD, Nadvorna H, Steinbach T. Phantom limbs and related phenomena in recent traumatic amputations. Neurology, 1978; 28 (3), 211–217
- Wartan SW, Hamann W, Wedley JR, McColl I. Phantom pain and sensation among British veteran amputees. British Journal of Anaesthesia, 1997; 78: 652–659
- Sherman RA, Sherman CJ, Parker L. Chronic phantom and stump pain among American veterans: Results of a survey. Pain, 1984; 18: 83–95
- Sherman RA, Sherman CJ, Parker L. Chronic phantom and stump pain among American veterans: Results of a survey. Pain, 1984; 18: 83–95
- Nikolajsen L, Ilkjaer S, Krøner K, Christensen JH, Jensen TS. The influence of preamputation pain on postamputation stump and phantom pain. Pain, 1997; 72 (3): 393–405
- Jahangiri M, Bradley JWP, Jayatunga AP, Dark CH. Prevention of phantom pain after major lower limb amputation by epidural infusion of diamorphine, clonidine and bupivacaine. Annals of the Royal College of Surgeons of England, 1994; 76: 324–326
- Jackson MA, Simpson KH. Pain after amputation. Continuing Education in Anaesthesia, Critical Care & Pain, 2004; 4 (1): 20–23
- Macrae WA. Chronic pain after surgery. British Journal of Anaesthesia, 2001; 87 (1): 88–98
- Jackson MA, Simpson KH. Pain after amputation. Continuing Education in Anaesthesia, Critical Care & Pain, 2004; 4 (1): 20–23
- Sherman RA, Sherman CJ, Parker L. Chronic phantom and stump pain among American veterans: Results of a survey. Pain, 1984; 18: 83–95
- Macrae WA. Chronic pain after surgery. British Journal of Anaesthesia, 2001; 87 (1): 88–98
- Jackson MA, Simpson KH. Pain after amputation. Continuing Education in Anaesthesia, Critical Care & Pain, 2004; 4 (1): 20–23
- Sherman RA, Sherman CJ, Parker L. Chronic phantom and stump pain among American veterans: Results of a survey. Pain, 1984; 18: 83–95
- Macrae WA. Chronic pain after surgery. British Journal of Anaesthesia, 2001; 87 (1): 88–98
- Carlen PL, Wall PD, Nadvorna H, Steinbach T. Phantom limbs and related phenomena in recent traumatic amputations. Neurology, 1978; 28 (3), 211–217
- S3-Leitlinie „Lokaltherapie chronischer Wunden bei Patienten mit den Risiken periphere arterielle Verschlusskrankheit, Diabetes mellitus, chronisch venöse Insuffizienz“ (AWMF-Leitlinienregister Nr. 091/001), Stand: 12.06.2012, gültig bis 11.06.2017. http://www. awmf.org/uploads/tx_szleitlinien/091–001l_S3_Lokaltherapie_ chronischer_Wunden_2012-ungueltig.pdf (Zugriff am 04.10.2017)
- Heuer K, Hoffmanns MA, Demir E, et al. The topical use of non-thermal dielectric barrier discharge (DBD): Nitric oxide related effects on human skin. Nitric Oxide, 2015; 44: 52–60
- Carlen PL, Wall PD, Nadvorna H, Steinbach T. Phantom limbs and related phenomena in recent traumatic amputations. Neurology, 1978; 28 (3), 211–217
- Jackson MA, Simpson KH. Pain after amputation. Continuing Education in Anaesthesia, Critical Care & Pain, 2004; 4 (1): 20–23
- Macrae WA. Chronic pain after surgery. British Journal of Anaesthesia, 2001; 87 (1): 88–98
- Flor H, Nikolajsen L, Jensen TS. Phantom limb pain: a case of maladaptive CNS plasticity? Nature Reviews Neuroscience, 2006; 7 (11): 873–881
- Hoffmann P. Ueber eine Methode, den Erfolg einer Nervennaht zu beurteilen. Medizinische Klinik, 1915; 11: 359–360
- S3-Leitlinie „Versorgung peripherer Nervenverletzungen“ (AWMF-Leitlinienregister Nr. 005/010). Stand: 30.06.2013, gültig bis 30.06.2018. http://www.awmf.org/uploads/tx_szleitlinien/005–010l_S3_Versorgung_peripherer_Nervenverletzungen_2013-06.pdf (Zugriff am 04.10.2017)
- Wessig C, Bendszus M, Reiners K et al. Läsionen peripherer Nerven: MR-Neurographie als innovative Ergänzung zur Elektrodiagnostik. Klinische Neurophysiologie, 2011; 42 : 231–238
- S3-Leitlinie „Versorgung peripherer Nervenverletzungen“ (AWMF-Leitlinienregister Nr. 005/010). Stand: 30.06.2013, gültig bis 30.06.2018. http://www.awmf.org/uploads/tx_szleitlinien/005–010l_S3_Versorgung_peripherer_Nervenverletzungen_2013-06.pdf (Zugriff am 04.10.2017)
- Hazari A, Elliot D. Treatment of end-neuromas, neuromas-incontinuity and scarred nerves of the digits by proximal relocation. Journal of Hand Surgery, 2004; 29 (4): 338–350
- Aszmann OC, Moser V, Frey M. Die Behandlung chronisch schmerzhafter Neurome mittels End-zu-Seit Neurorraphie [Treatment of painful neuromas via end-to-side neurorraphy]. Handchirurgie, Mikrochirurgie, Plastische Chirurgie, 2010; 42 (4): 225–232
- Balcin H, Erba P, Wettstein R, Schaefer DJ, Pierer G, Kalbermatten DF. A comparative study of two methods of surgical treatment for painful neuroma. Bone & Joint Journal, 2009; 91 (6): 803–808
- Balcin H, Erba P, Wettstein R, Schaefer DJ, Pierer G, Kalbermatten DF. A comparative study of two methods of surgical treatment for painful neuroma. Bone & Joint Journal, 2009; 91 (6): 803–808
- S3-Leitlinie „Versorgung peripherer Nervenverletzungen“ (AWMF-Leitlinienregister Nr. 005/010). Stand: 30.06.2013, gültig bis 30.06.2018. http://www.awmf.org/uploads/tx_szleitlinien/005–010l_S3_Versorgung_peripherer_Nervenverletzungen_2013-06.pdf (Zugriff am 04.10.2017)
- Kuiken TA, Miller LA, Lipschutz RD, Lock BA, Stubblefield K, Marasco PD, Zhou P, Dumanian GA. Targeted reinnervation for enhanced prosthetic arm function in a woman with a proximal amputation: a case study. The Lancet, 2007; 369 (9559): 371–380
- Aszmann OC, Dietl H, Frey M. Selektive Nerventransfers zur verbesserten Steuerung myoelektrischer Armprothesen [Selective nerve transfers to improve the control of myoelectrical arm prostheses]. Handchirurgie, Mikrochirurgie, Plastische Chirurgie, 2008; 40 (1): 60–65
- Souza JM, Cheesborough JE, Ko JH, Cho MS, Kuiken, TA, Dumanian GA. Targeted muscle reinnervation: a novel approach to postamputation neuroma pain. Clinical Orthopaedics and Related Research, 2014; 472 (10): 2984–2990
- Lundborg G, Rosen B, Dahlin L, Holmberg J, Rosén I. Tubular repair of the median or ulnar nerve in the human forearm: a 5‑year follow-up. Journal of Hand Surgery, 2004; 29 (2): 100–107
- Wessig C, Bendszus M, Reiners K et al. Läsionen peripherer Nerven: MR-Neurographie als innovative Ergänzung zur Elektrodiagnostik . Klinische Neurophysiologie, 2011; 42 : 231–238
- Lundborg G, Rosen B, Dahlin L, Holmberg J, Rosén I. Tubular repair of the median or ulnar nerve in the human forearm: a 5‑year follow-up. Journal of Hand Surgery, 2004; 29 (2): 100–107
- Birch R. The peripheral neuroma. In: Green DP, Hotchkiss RN, Pederson WC, Wolfe S (eds). Green’s Operative Hand Surgery. 5th edition. New York: Churchill Livingstone, 1102–1111