Einleitung
Das Lymphödem ist in unbehandeltem Zustand eine fortschreitende chronische Erkrankung als Folge einer angeborenen (primären) oder erworbenen (sekundären) Schädigung des Lymphdrainagesystems. Die Lymphflüssigkeit wird normalerweise durch eine Art Klappenöffnung in den Lymphkapillaren aufgenommen. Diese Klappen sind mit einem Netzwerk an Filamenten mit dem umliegenden Gewebe verbunden und werden unter anderem durch Scherkräfte und Bewegung geöffnet. Durch die Schädigung von Lymphkapillaren, Lymphkollektoren und Lymphknoten kommt es zu einem Ungleichgewicht zwischen der anfallenden Lymphe im Gewebe (der sogenannten Lymphlast) und dem Abtransport zurück in die Venenwinkel. Es gibt mehrere Formen von Lymphödemen:
- Dazu zählt etwa die Hochvolumeninsuffizienz. Der Begriff verweist darauf, dass die „lymphpflichtige Last“, also die Lymphflüssigkeit, die der Körper abtransportieren muss, höher ist als die Lymphtransportkapazität. Dabei ist das Lymphsystem als solches gesund – es ist relativ gesehen zu viel Lymphflüssigkeit da, die nicht abtransportiert werden kann; es liegt also eine lymphodynamische Insuffizienz vor. Diese Ödemform ist eiweißarm und kann z. B. aufgrund von Herzerkrankungen auftreten.
- Davon zu unterscheiden ist die Niedrigvolumeninsuffizienz, bei der die Transportkapazität gestört ist. In der Folge kommt es zu einem Stau in den Lymphbahnen mit einem eiweißreichen Ödem. Die dadurch entstehende Vermehrung und Veränderung der interstitiellen Gewebsflüssigkeit (das Lymphödem) führt im Verlauf der Erkrankung zu einer Zunahme von Binde- und Fettgewebe sowie zu Veränderungen der extrazellulären Matrix. Hauptursache hierfür ist ein dauerhafter Entzündungsreiz 1. Eine irreversible Fibrosierung des Gewebes sowie eine Zunahme an Umfang, Gewicht und Spannungsgefühl sind die Folge 2 (Abb. 1).
- Die in Deutschland am häufigsten auftretende Form ist das erworbene sekundäre Lymphödem infolge einer Störung des Lymphgefäßsystems durch Tumorerkrankungen mit nachfolgenden Operationen und Bestrahlungen. Hier sind insbesondere die Brusttumorerkrankung der Frau sowie der Hodentumor des Mannes zu nennen. Auch Unfälle, Infektionen und Parasiten können die Ursache sein. Weltweit am häufigsten wird das sekundäre Lymphödem durch die Filariose verursacht, eine parasitische Wurmerkrankung, die bis zu 200 Millionen Menschen infiziert hat 3.
- Bei der selteneren angeborenen (primären) Form des Lymphödems ist das Lymphgefäßsystem nicht oder insuffizient anatomisch angelegt. Es gibt sogenannte hypoplastische (Noonan) oder Hyperplasie-Formen. Ein komplettes Fehlen bezeichnet man als Atresie; die Betroffenen sind häufig nicht lebensfähig.
Diagnostik
Der Diagnostik des Lymphödems kommt eine entscheidende Bedeutung zu. Es gibt eine Vielzahl von Ödemarten, die differenzialdiagnostisch nur in einem interdisziplinären Team sicher zugeordnet werden können. Eine Zusammenarbeit mit den Kollegen der Plastischen Chirurgie, der Inneren Medizin, der Gefäßchirurgie, der Radiologie, der Dermatologie und der Onkologie ist daher zwingend. Basis einer professionellen Diagnostik ist die klinische Untersuchung mit einer standardisierten Dokumentationsform. Neben Ödemcharakteristika, Stadieneinteilung, Hautfarbe und ‑beschaffenheit sowie Narben wird auch das sogenannte Stemmer-Zeichen dokumentiert. Eine Labordiagnostik kann ggf. dazugehören (z. B. ProteinElektrophorese, T3/T4).
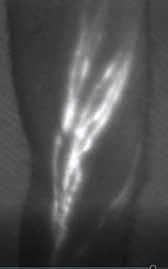
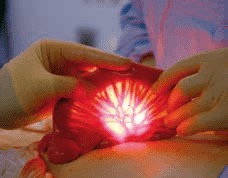
Im Rahmen der im Mai 2017 verabschiedeten sogenannten S2k-Leitlinie der AWMF 4 wird neben der Stadieneinteilung und der Basisdiagnostik auch die erweiterte apparative Diagnostik aufgeführt. Dazu gehören unter anderem Ultraschalluntersuchung, Lymph-Szintigraphie und MRT-Lymphographie. Aus Sicht der Autoren kommt der sogenannten indocyaningrün-(ICG-)gestützten Fluoreszenzlymphographie (ICG-Lymphographie) eine Schlüsselrolle zu 5678. Diese Untersuchungsmethode steht allerdings erst in wenigen Zentren in Deutschland zur Verfügung. Für die Untersuchung wird eine kleine Menge (0,1–0,3 ml) des grünen Farbstoffs unter die Haut injiziert. Dieser wird in wenigen Minuten von den Lymphbahnen aufgenommen. Über ein spezielles Infrarot-Laser-Kamerasystem wird der Farbstoff zum Leuchten angeregt und das funktionelle Lymphnetzwerk sichtbar gemacht 9 (Abb. 2).
Die ICG-Lymphographie ermöglicht es als einzige Untersuchungsmethode, „live“ die Lymphkollektoren sichtbar zu machen und eine exakte Stadieneinteilung nach Yamamoto vorzunehmen 10. Das anatomische „Mapping“ ist von großer Bedeutung. Diese genaue Beurteilung ist unabdingbar, um eine Entscheidung treffen zu können, welche operativen Therapie optionen zur Verfügung stehen.
Therapieoptionen
In den vergangenen Jahrzehnten war für viele Patienten die konservative Therapie die einzige Behandlungsmöglichkeit. Deutschland ist hier weltweit trotz des permanenten Kostendrucks aufgrund der hohen Standardisierung führend. Neue, innovative Therapieoptionen haben sich insbesondere international (in den USA, Taiwan und Japan) in den vergangenen fünf bis zehn Jahren in der Klinik behauptet und etabliert. In Deutschland gibt es dagegen weiterhin zu wenige spezialisierte Zentren, um international Anschluss zu finden. Hierzu gehören Lymphovenöse Anastomosen (LVA) 11, körpereigene Lymphknotentransplantationen (LNTx) 12 und spezielle Liposuktionstechniken 13. Eine dritte Therapieoption ist die medikamentöse Behandlung des dauerhaften Entzündungsreizes („chronic inflammation“) 141516.
Die Zukunft einer modernen Behandlung des Lymphödems liegt im professionellen Zusammenspiel zwischen konservativen, operativen und medikamentösen Behandlungsmöglichkeiten. Diese werden im Folgenden genauer erörtert.
Konservative Therapie
Das Fundament eines modernen, ganzheitlichen Therapieansatzes bildet die konservative Therapie. Die sogenannte Komplexe Physikalische Entstauungstherapie (KPE 1/2) besteht aus vier gleichberechtigten Säulen:
-
-
- manuelle Lymphdrainage,
- flachgestrickte Kompressionswäsche mindestens der Klasse 2,
- spezielle Bewegungstherapie und
- intensive Hautpflege.
-
Eine konsequente Umsetzung der KPE ist die Basis einer erfolgreichen operativen und/oder medikamentösen Behandlung. Einige Autoren sehen in der psychologischen Unterstützung der betroffenen Patienten eine wichtige zusätzliche 5. Säule.
Operative Therapie
Die operativen Behandlungsmöglichkeiten werden unterteilt in einen wiederherstellenden (rekonstruktiven) und einen symptomreduzierenden (resezierenden) Ansatz. Die wiederherstellenden Verfahren haben zum Ziel, die anfallende Lymphlast zu senken bzw. das kompromittierte Lymphnetzwerk zu verbessern. Hierzu gehören die „Lymphovenösen Anastomosen“ (LVA) sowie die „Freie Lymphknotentransplantation“ (LNTx). Beide Verfahren setzen eine hohe (super-)mikrochirurgische Expertise voraus. Daher sollten diese Verfahren nur in spezialisierten mikrochirurgischen Zentren durchgeführt werden.
Lymphovenöse Anastomosen (LVA)
Das Prinzip der Lymphovenösen Anas tomosen (LVA) stellt sich wie folgt dar: Die anfallende Lymphlast im Gewebe z. B. des Armes oder Beines wird reduziert, indem ein funktionierender abtransportierender Lymphkollektor noch vor der Lymphbahn-Blockade supermikrochirurgisch (Gefäßdurchmesser kleiner als 0,7 mm) an eine Vene angeschlossen wird. Somit kann die Lymphe noch direkt „vor Ort“ im Bereich der Arme bzw. der Beine in die Vene abgeleitet werden.
Hiervon zu unterscheiden ist eine weitere Technik, die den Lymphkollektor lediglich in eine Vene legt, jedoch nicht supermikrochirurgisch anschließt (sogenannte Technik nach Campisi/„Octopus-Naht“). Voraussetzung dafür ist ein intaktes Venensystem zum Abtransport sowie vorhandene funktionale Lymphkollektoren. Letztere können nur mittels der ICG-Lymphangiographie bestimmt werden. Das Vorhandensein eines solchen Systems (z. B. Fluobeam/Fluoptics) ist obligat. Prinzipiell gilt: Je höher die Anzahl durchgeführter Abflüsse bzw. LVAs, desto höher ist der Effekt bzw. die Verringerung des Lymphödems. Ein weiterer wichtiger Faktor ist das Lymphödemstadium: Ist das Lymphödem bereits weit fortgeschritten und weist es eine ausgeprägte Fibrosierung des betroffenen Körperteils auf, können entweder keine oder nur wenige intakte Lymphkollektoren ermittelt werden. Die Ergebnisse sind somit in einem frühen Stadium weitaus besser als in einem fortgeschrittenen Stadium. Einige Autoren (etwa Koshima et al.) verwenden die LVA-Technik bereits als Prophylaxe vor einer Lymphödementstehung. Dieses Vorgehen ist vielversprechend, wird aber durch die aktuelle Leitlinie zumindest in Deutschland nicht unterstützt.
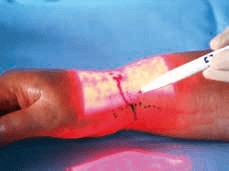
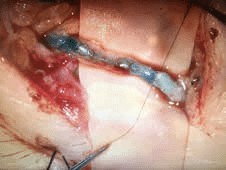
Vor einer Operation werden vorhandene Lymphkollektoren und subkutane Venen in der Nähe auf der Haut markiert (Abb. 3). Über dem jeweiligen Lymphkollektor wird ein 2 bis 4 cm kleiner Hautschnitt durchgeführt und die Lymphkollektoren unter dem Mikroskop mit 20- bis 40-facher Vergrößerung dargestellt. Um eine verbesserte Sichtbarkeit der Lymphkollektoren zu erreichen, können optional kleine Mengen eines Blaufarbstoffes („Patentblau V“) unter die Haut appliziert werden. Der jeweilige Lymphkollektor sollte nach Eröffnung eine gute Lymphförderungsrate aufweisen, bevor er mit einem dünnen Nahtmaterial (Naht 12.0) an die benachbarte Vene zum Abfluss supermikrochirurgisch angeschlossen wird (Abb. 4). Noch während der Operation wird mittels ICG-Lymphangiographie die Anastomosennaht überprüft und der korrekte Abfluss über die Vene sichergestellt. Hautnaht und Verband beenden die Operation. Die Operationszeit beträgt längstens ca. 3 Stunden mit einem stationären Aufenthalt von ca. 2 bis 4 Tagen. Nach 14 Tagen werden die Fäden ambulant entfernt. Die Fortführung der KPE erfolgt nach dem Fadenzug. Alle Patienten werden fest in einem Nachbehandlungsregime betreut.
Freie körpereigene Lymphknotentransplantation (LNTx)
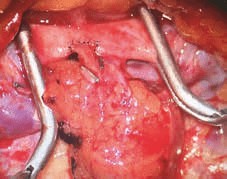
Freie körpereigene Lymphknotentransplantationen (LNTx) stellen die zweite Methode des rekonstruktiven Ansatzes dar. Körpereigene Lymphknoten werden dabei komplett mit eigener Blutversorgung (Arterie und Vene) aus einer gesunden Region entnommen, in die erkrankte Lymphödemregiontransplantiertunddort mikrochirurgisch angeschlossen. Die gut durchbluteten transplantierten Lymphknoten verbinden sich mit dem Lymphnetzwerk vor Ort (Abb. 5), agieren als eigene „Pumpstation“ und fördern die Lymphe aus dem betroffenen Bein oder Arm ab.
Die Auswahl der Entnahmeregion der Lymphknoten ist sehr wichtig. Die etablierten Regionen zur Entnahme von Lymphknoten sind die Leistenregion, die Kinnregion, oberhalb des Schlüsselbeins, seitlich an der Brustkorbwand und das Abdomen. Jede Entnahmeregion hat ihre Besonderheiten und sollte daher genau abgewogen werden. Das Risiko der Entstehung eines Lymphödems in der Entnahmeregion kann mit der richtigen Entnahmetechnik und insbesondere mit dem sogenannten Reverse Mapping stark minimiert werden 17. Bei dieser Technik werden mit Hilfe der ICG-Lymphographie sowie von Patentblau-V- und Radionukleotid-Tracern die unterschiedlichen Abflusswege der Lymphbahnen bzw. Lymphknoten bestimmt. Somit können die zu entnehmenden Lymphknoten von den wichtigen Abflussbahnen separiert und geschont werden.
Die Ergebnisse der LNTx sind wie bei der LVA-Technik davon abhängig, wie weit fortgeschritten das Lymph ödemstadium ist – eine bereits bestehende Fibrosierung kann auch durch eine Lymphknotentransplantation nicht rückgängig gemacht werden. Prinzipiell gilt: Je mehr Lymphknoten transplantiert werden und je geringradiger das Lymphödemstadium ist, desto besser sind die Ergebnisse. Es zeichnet sich ab, dass die unterschiedlichen Entnahmeregionen eine unterschiedliche Quantität und Qualität der Lymphknotenpakete aufweisen. Zukünftige Studien müssen den Beweis erbringen, welche Anzahl an Lymphknoten effektiv ist und welche Entnahmestellen anderen überlegen sind 18.
Bei neuen, modernen Ansätzen werden doppelte oder Mehrfach-Lymphknotentransplantationen durchgeführt, die an unterschiedliche Regionen des lymphödematösen Armes oder Beines transplantiert werden. Ziel ist eine möglichst umfassende Abdeckung der betroffenen Regionen, da ein einzelnes Lymphknotentransplantat nicht ein komplettes Bein oder einen Arm zu drainieren vermag.
Neues Verfahren
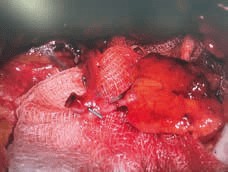
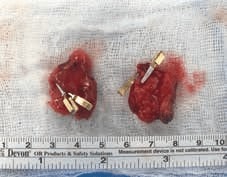
Eine spezielle Kombination einer neuen Entnahmetechnik nach Skoracki et al. 19 und der doppelten Lymphknotentransplantation wurde vom Medizinerteam der Autoren weltweit zum ersten Mal in Deutschland durchgeführt. Dabei werden über einen 3 cm kleinen Schnitt oberhalb des Nabels aus dem Bereich des Mesenteriums (Region, in der die Blutgefäße und Lymphknoten für den Dünndarm enthalten sind) mehrere Lymphknotentransplantate entnommen, ohne die Durchblutung des Dünndarms zu gefährden. Hierzu werden die Lymphknotenpakete via Diaphanoskopie und haptisch identifiziert und die versorgenden Arterien und Venen markiert (Abb. 6 u. 7). Die Empfängerregion wird vorbereitet, indem eventuelle Verwachsungen und Vernarbungen gelöst und die Empfängergefäße (Arterie und Vene) freipräpariert werden. Nach dem mikrochirurgischen Anschluss zeigen sich die Lymphknoten rosig und gut durchblutet (Abb. 8). Hautnaht und Verband beenden die Operation. Die Operationszeit beträgt ca. 4 bis 6 Stunden mit einem stationären Aufenthalt von ca. 4 bis 7 Tagen. Nach 14 Tagen werden die Fäden ambulant entfernt. Die Fortführung der KPE erfolgt nach dem Fadenzug. Alle Patienten sind fest in einem Nachbehandlungsregime betreut.
Evaluation der Ergebnisse
Eine korrekte Evaluation der Ergebnisse bedarf der standardisierten Dokumentation mehrerer Zielparameter: Allgemein unterscheidet man qualitative von quantitativ messbaren Parametern. Zu den qualitativen Messparametern zählen Lymphszintigraphie, ICG-Lymphangiographie, MRT und Ultraschall. Zu den quantitativen Messwerten zählen Umfangsmessungen, Volumetrie, Perometer, Tonometrie und Bioimpedanz. Eine besondere Bedeutung kommt den validierten Lebensqualitätsfragebögen zu. Diese geben die Ergebnisse nach einer Behandlung als „realen Benefit“ für den Patienten wieder. Die am häufigsten verwendeten Fragebögen sind der LymQoL- und der ICF-Fragebogen 20. In einer großen Studie wurden insgesamt 124 Patienten mit einem sekundären Lymphödem bei Zustand nach Brusttumorbehandlung untersucht. Dabei konnte eine Verbesserung des Lymphödems bei allen Patienten erreicht werden. Es zeigte sich, dass die transplantierten Lymphknoten noch vor den Lymphovenösen Anastomosen und der KPE die besten Ergebnisse erzielen konnten 21.
Im Behandlungskollektiv der Autoren konnten bisher alle Patienten von einer Behandlung profitieren. Insbesondere die LymQoL-Daten sprechen eine eindeutige Sprache. Deren Ergebnisse decken sich mit denen aus der vorhandenen Literatur: Die transplantierten Lymphknoten bieten das größere Verbesserungspotenzial, insbesondere bei Mehrfach-Transplantationen. Die Bandbreite der Verbesserung ist allerdings – abhängig vom Ausgangsstadium – groß: Ungefähr 10 % der Patienten benötigen nach dem operativen Eingriff keine weiteren manuellen Lymphdrainagen und keine Kompressionswäscheversorgung. Die Mehrheit führt eine weitere KPE durch.
Es sollte nicht unerwähnt bleiben, dass jeder einzelne operative Eingriff seine spezifischen Risiken hat. Jeder Patient wird daher intensiv über die jeweiligen Risiken aufgeklärt. Im Patientenkollektiv der Autoren gab es bisher nur eine geringe Komplikationsrate. Zu den Komplikationen zählen z. B. Wundinfektionen, Wundserome und Nachblutungen.
Medikamentöse Therapie
Die dritte Säule der Behandlungsoptionen betrifft die medikamentöse Beeinflussung der „chronic inflammation“. Hierbei ist ein Forscherteam um B. Mehrara (Memorial Sloan Kettering Cancer Center, New York) führend 22232425. Ziel ist eine Abschwächung der chronischen Reizung, die Fibrosierungen und weitere negative Gewebeeffekte zur Folge haben.
Fazit
Eine erfolgreiche Lymphödembehandlung besteht aus drei Säulen: konservativer, operativer und medikamentöser Therapie. Ziel der Behandlung ist eine vollständige und dauerhafte Entfernung der Lymphflüssigkeit aus dem interstitiellen Gewebe, um die desaströsen Gewebeveränderungen zu verhindern oder sogar gänzlich aufzuhalten. Bis sich die antiinflammatorische medikamentöse Therapie etabliert hat, ist die operative Therapie der bisher erfolgversprechendste Ansatz seit Jahren. Dabei haben sich insbesondere die Verfahren der Lymphovenösen Anastomosen (LVA) und der freien körpereigenen Lymphknotentransplantation (LNTx) bewährt. Die Lymphchirurgie ist sicher und reliabel durchführbar und führt in fast allen Fällen zu einer messbaren Verbesserung des Lymphödems.
Für die Autoren:
Priv.-Doz. Dr. med. Holger Engel
Klinik für Plastisch-rekonstruktive, Ästhetische und Handchirurgie Klinikum Kassel
Mönchebergstraße 41–43,
34125 Kassel
mail@holgerengel.de
Begutachteter Beitrag/reviewed paper
Engel H., Giessler G. A. Neue Therapieansätze beim Lymphödem. Orthopädie Technik, 2017; 68 (11): 44–48
- Dynamische Unterschenkelorthese in Prepreg-Technik nach Hafkemeyer – Konstruktionsmerkmale, Indikationen, Variationsmöglichkeiten — 3. April 2024
- Bringt die Stand- und Schwungphasenkontrolle einen Vorteil bei KAFO-Trägern? Ergebnisse einer internationalen randomisiert-kontrollierten Studie — 3. April 2024
- Dynamische CDS-Knieredressionsorthesen bei Kindern und Jugendlichen mit Cerebralparese GMFCS-Level II–III — 3. April 2024
- Hespe GE, Nores GG, Huang JJ, et al. Pathophysiology of lymphedema – Is there a chance for medication treatment? J Surg Oncol, 2017; 115 (1): 96–98
- Ly CL, Kataru RP, Mehrara BJ. Inflammatory Manifesta tions of Lymphedema. Int J Mol Sci, 2017; 18 (1): 171
- Rebollo MP, Bockarie MJ. Can Lymphatic Filariasis Be Eliminated by 2020? Trends Parasitol, 2017; 33 (2): 83–92
- S2k-Leitlinie Diagnostik und Therapie der Lymphöde me (AWMF-Leitlinienregister Nr. 058/001). Stand: Mai 2017. http://www.awmf.org/uploads/tx_szleitlinien/058–001l_S2k_Diagnostik_und_Therapie_der_Lymphoedeme_2017-05.pdf (Zugriff am 28.09.2017)
- Xiong L, Gazyakan E, Yang W, et al. Indocyanine green fluorescence-guided sentinel node biopsy: a meta-analysis on detection rate and diagnostic performance. Eur J Surg Oncol, 2014; 40 (7): 843–849
- Xiong L, Engel H, Gazyakan E, et al. Current techniques for lymphatic imaging: State of the art and future perspectives. Eur J Surg Oncol, 2014; 40 (3): 270–276
- Hirche C, Engel H, Kolios L, et al. An experimental study to evaluate the Fluobeam 800 imaging system for fluorescence-guided lymphatic imaging and sentinel node biopsy. Surg Innov, 2013; 20 (5): 516–523
- Hirche C, Engel H, Hirche Z, et al. Real-time lymphography by indocyanine green fluorescence: improved navigation for regional lymph node staging. Ann Plast Surg, 2014; 73 (6): 701–705
- Hirche C, Engel H, Kolios L, et al. An experimental study to evaluate the Fluobeam 800 imaging system for fluorescence-guided lymphatic imaging and sentinel node biopsy. Surg Innov, 2013; 20 (5): 516–523
- Yamamoto T, Narushima M, Doi K, et al. Characteristic indocyanine green lymphography findings in lower extremity lymphedema: the generation of a novel lymphedema severity staging system using dermal backflow patterns. Plast Reconstr Surg, 2011; 127 (5): 1979–1986
- Torrisi JS, Joseph WJ, Ghanta S, et al. Lymphaticovenous bypass decreases pathologic skin changes in upper extremity breast cancer-related lymphedema. Lymphat Res Biol, 2015; 13 (1): 46–53
- Engel H, Lin CY, Huang JJ, et al. Outcomes of Lymphedema Microsurgery for Breast Cancer-related Lymphedema With or Without Microvascular Breast Reconstruction. Ann Surg, 2017. doi: 10.1097/SLA.0000000000002322
- Brorson H. Liposuction in Lymphedema Treatment. J Reconstr Microsurg, 2016; 32 (1): 56–65
- Hespe GE, Nores GG, Huang JJ, et al. Pathophysiology of lymphedema – Is there a chance for medication treatment? J Surg Oncol, 2017; 115 (1): 96–98
- Ghanta S, Cuzzone DA, Torrisi JS, et al. Regulation of inflammation and fibrosis by macrophages in lymphedema. Am J Physiol Heart Circ Physiol, 2015; 308 (9): H1065–H1077
- Gardenier JC, Kataru RP, Hespe GE, et al. Topical tacrolimus for the treatment of secondary lymphedema. Nat Commun, 2017; 8: 14345
- Dayan JH, Dayan E, Smith ML. Reverse lymphatic mapping: a new technique for maximizing safety in vascularized lymph node transfer. Plast Reconstr Surg, 2015; 135 (1): 277–285
- Engel H, Lin CY, Huang JJ, et al. Outcomes of Lymphedema Microsurgery for Breast Cancer-related Lymphedema With or Without Microvascular Breast Reconstruction. Ann Surg, 2017. doi: 10.1097/SLA.0000000000002322
- Garza R 3rd, Skoracki R, Hock K, et al. A comprehensive overview on the surgical management of secondary lymphedema of the upper and lower extremities related to prior oncologic therapies. BMC Cancer, 2017; 17 (1): 468
- Patel KM, Lin CY, Cheng MH. A Prospective Evaluation of Lymphedema-Specific Quality-of-Life Outcomes Following Vascularized Lymph Node Transfer. Ann Surg Oncol, 2015; 22 (7): 2424–2430
- Engel H, Lin CY, Huang JJ, et al. Outcomes of Lymphedema Microsurgery for Breast Cancer-related Lymphedema With or Without Microvascular Breast Reconstruction. Ann Surg, 2017. doi: 10.1097/SLA.0000000000002322
- Hespe GE, Nores GG, Huang JJ, et al. Pathophysiology of lymphedema – Is there a chance for medication treatment? J Surg Oncol, 2017; 115 (1): 96–98
- Ly CL, Kataru RP, Mehrara BJ. Inflammatory Manifesta tions of Lymphedema. Int J Mol Sci, 2017; 18 (1): 171
- Ghanta S, Cuzzone DA, Torrisi JS, et al. Regulation of inflammation and fibrosis by macrophages in lymphedema. Am J Physiol Heart Circ Physiol, 2015; 308 (9): H1065–H1077
- Gardenier JC, Kataru RP, Hespe GE, et al. Topical tacrolimus for the treatment of secondary lymphedema. Nat Commun, 2017; 8: 14345