Einleitung
Nach einem Trauma oder einer Operation ist es stets das Ziel einer physiotherapeutischen Behandlung, die entsprechende Funktion sowohl auf der Struktur- als auch auf der Aktivitätsebene zu verbessern. Grundvoraussetzung dafür ist das Wiedererlangen der funktionellen Integrität auf Gewebeebene. Dies geschieht vornehmlich durch eine Operation oder eine Ruhigstellung der betroffenen Strukturen (Gewebe/Gelenke). In der physiotherapeutischen Nachbehandlung werden sogenannte funktionelle Reize gesetzt mit der Absicht, die betroffene Struktur auf Zellebene inklusive der extrazellulären Matrix positiv zu beeinflussen. Lassen nach einem Trauma oder einer Operation die orthopädischen Limitierungen des Bewegungsausmaßes und der Belastbarkeit des betroffenen Gewebes eine funktionelle Reizgebung zu, besteht ein Verständnis der funktionellen Ausrichtung der betroffenen Gewebe analog zur bekannten Gewebephysiologie und Wundheilungsphysiologie 12. Kann aber durch einen „Fixateur externe“ oder eine zirkuläre Gipsanlage nur bedingt oder gar nicht funktionell gereizt werden, stellt sich unweigerlich die Frage: „Wie viel funktioneller (mechanischer) Reizgebung bedarf es, damit auf Zellebene (also im Gewebe) Vorgänge in Aktion treten, die das Gewebe sich an den äußeren Reiz anpassen lassen und somit zu einer Verbesserung der Beweglichkeit und der Funktion führen?“ Es ist bekannt, dass, wenn keine mechanischen Reize von außen appliziert werden, keine funktionelle Ausrichtung stattfindet, und dass, wenn zu viele mechanische Reize von außen wirken, das Gewebe mit einer Überlastungsreaktion (Zellschaden und erneute Entzündungsreaktion) reagiert34567. Beides endet in einer potenziellen Bewegungseinschränkung der betroffenen Strukturen. Aber welche Dosierung der Reize ist während der Wundheilungsphasen adäquat in Bezug auf eine funktionelle Reizgebung auf Zellebene? Und kann eine begleitende Quengeltherapie die Beweglichkeitsverbesserung unterstützen?
Im Folgenden werden in diesem Zusammenhang die unten genannten Aspekte diskutiert und auf ihre Einsetzbarkeit im klinischen Alltag bei Anwendung der Quengeltherapie untersucht:
– Mechanotransduktion
– funktionelle Ausrichtung
– Wundheilungszeiten und Turnover
- Zeiten spezifischer Gewebe
– Anstieg des ersten und zweiten Bindegewebswiderstands (R1 und R2)
Mechanotransduktion
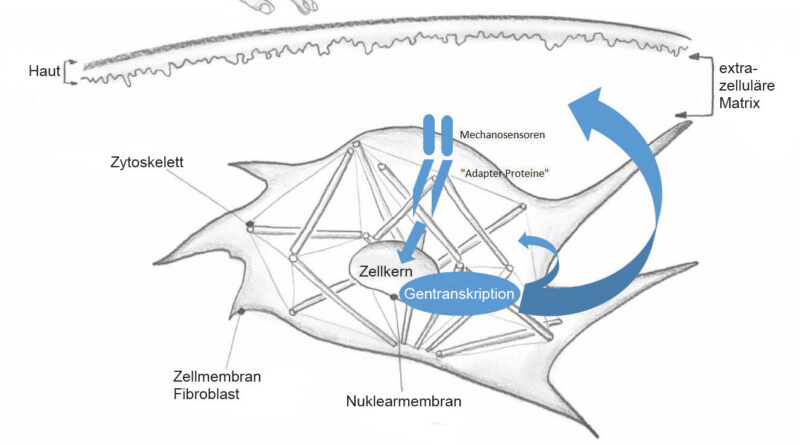
Unter dem Begriff „Mechanotransduktion“ versteht man die Reaktion im Innern einer Zelle auf einen mechanisch applizierten Reiz von außen. Bei adäquater Reizung reagiert die Zelle mit einer Gentranskription und beeinflusst somit auch die extrazelluläre Matrix und schlussendlich die Trophik (Qualität) des betroffenen Gewebes 8910111213. Bouffard et al. (2008) 14 konnten durch eine 20- bis 30-prozentige Gewebedehnung während 10 Minuten täglich einen verminderten Anstieg sowohl von TGF beta 1 als auch des Typ-1-Prokollagens nach einer Gewebeverletzung beobachten. Bei TGF beta 1 handelt es sich um ein lokales Zytokin, das im Zusammenhang mit der Wundheilung und der Fibrosierung von Gewebe förderlich wirkt. Eine zu hohe Aktivität von TGF beta 1 führt zu einer überdurchschnittlichen Fibrosierung und somit einer tendenziellen Restriktion von Narbengewebe151617. Bouffard et al. (2008) 18 sehen in der Gewebedehnung während der Wundheilung durch diese „mechanische“ Hemmung einen positiven Effekt in Bezug auf eine verminderte Kollagensynthese. Balestrini et al. (2009) 19 konnten bei täglicher 5‑prozentiger Gewebedehnung über jeweils einige Stunden einen positiven Effekt bezüglich der Dehnfähigkeit der extrazellulären Matrix nachweisen 20. Sie fanden aber auch heraus, dass ein zu starker und zu lange andauernder Dehnreiz zu einer vermehrten Kollagensynthese und somit zu einer vermehrten Restriktion von Gewebe führte 21. In einem Review von Andalib et al. (2016) 22 wurden ausgewählte Studien bezüglich Mechanotransduktion zusammengefasst. In diesem Review wurden unter anderem auch die verwendeten mechanischen Testkräfte auf die Zellen erwähnt. Dabei ergab sich, dass alle Zellen mit einer Kraft von 0.00002 N bis 0.00058 N mechanisch stimuliert wurden; alle in das Review inkludierten Studien konnten einen mechanotransduktorischen Effekt nachweisen 23. Aus diesen Erkenntnissen geht hervor, dass Zellen sehr mechanosensitiv sind und es für eine Zellreaktion auf einen mechanischen Stimulus nur minimaler Kräfte bedarf. In Abbildung 1 ist der mechanotransduktorische Vorgang schematisch dargestellt. Durch einen mechanischen Stimulus von außen werden hier am Beispiel eines Fibroblasten an dessen Zellmembran die Mechanosensoren stimuliert. Diese wiederum aktivieren sogenannte Adapterproteine, die sich auf der Zellkernmembran (Nuklearmembran) befinden. Diese Adapterproteine leiten den mechanischen Reiz auf das Zytoskelett und stimulieren die Skelettstruktur so, dass die Zelle mit einer Gentranskription reagiert und somit veränderte (angepasste) Vorgänge und Produkte an die extrazelluläre Matrix weitergibt. Eine Zellantwort auf einen mechanischen Reiz ist somit erfolgt 2425 .
Funktionelle Ausrichtung
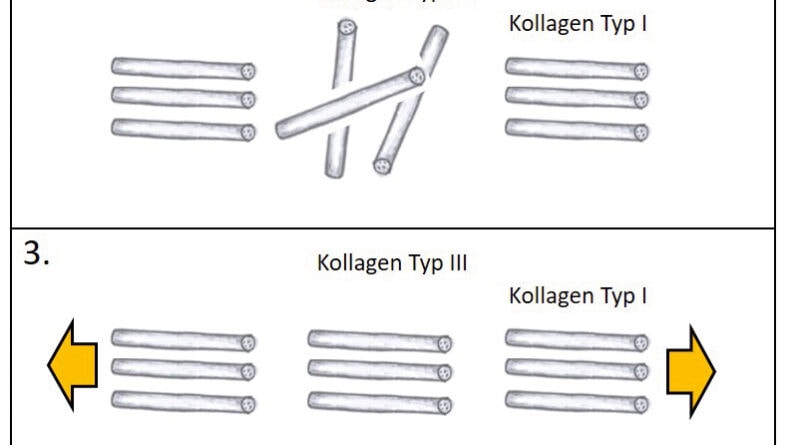
Unter dem Begriff „funktionelle Ausrichtung“ versteht man die gebrauchsadaptierte Ausrichtung der extrazellulären Bestandteile wie Kollagen, Elastin etc. durch die Mechanotransduktionseigenschaften jeder einzelnen Zelle. Je früher nach einem Trauma oder nach einer Operation eine funktionelle Reizsetzung stattfindet, desto weniger Umbauprozesse finden in der Remodulierungsphase statt. Grund dafür ist, dass sich das unspezifische Kollagen Typ III während der Proliferationsphase bei adäquatem mechanischem Stimulus funktionell ausrichtet 26. Wird dieses unspezifische Kollagen Typ III in der Remodulierungsphase allmählich von den spezifischen Kollagentypen I und II ersetzt, wäre eine schon funktionelle Ausrichtung des Kollagens Typ III von Vorteil. In der Remodulierungsphase werden die definitiven Kollagentypen jeweils in gleicher Ausrichtung wie das unspezifische Kollagen Typ III angeordnet. Im nachfolgenden Belastungs- oder Trainingsaufbau resultiert die bereits funktionelle Ausrichtung in einer weniger ausgeprägten Umbauphase. In Abbildung 2 werden die kollagene Ausrichtung und die mechanische Reizsetzung bezüglich der Dosierung erläutert. Wird nicht mechanisch gereizt, fehlt die funktionelle Ausrichtung – wird zu viel gereizt (Amplitude), entsteht eine potenzielle Zellschädigung mit einer erneuten Entzündungsreaktion und daraus folgender Bewegungseinschränkung 2728.
Wundheilungszeiten und Turnover-Zeiten spezifischer Gewebe
Aus der Literatur ist bekannt, dass nicht jedes Gewebe mit einer gleich heftigen und gleich langen Entzündungsreaktion reagiert. Es gibt sogar Gewebearten, die praktisch keine Entzündungsreaktionen zeigen können. Dies sind vor allem Gewebearten, die nur über Diffusion vital erhalten werden. Als klassisches Beispiel ist das intrinsische Sehnengewebe bekannt, das vornehmlich mit der Achillodynie in Verbindung gebracht wird. Allgemein lässt sich feststellen, dass gut durchblutetes Gewebe gegenüber weniger gut vaskularisiertem Gewebe eine heftigere Entzündungsreaktion und kürzere Wundheilungsphasen aufweist. Tabelle 1 stellt die verschiedenen Wundheilungszeiten nach de Moree (2001) einander gegenüber. Bezüglich der manuellen Dosierung ergibt sich daraus die folgende Konsequenz: Je länger die Proliferationsphase des betroffenen Gewebes dauert, desto länger ist auch das unspezifische und provisorische Kollagen Typ III im Gewebe aktiv; somit sollte auch länger und vorsichtiger manuell dosiert werden 29. Die Turnover-Zeiten beschreiben den vollständigen Zyklus des Aufund Abbaus einer Gewebestruktur auf Zellebene (extrazellulärer Raum). In Tabelle 2 ist eine Auswahl von spezifischem Gewebe aufgelistet. Durch ein Trauma oder eine Operation wird die Integrität des betroffenen Gewebes zerstört. Zumeist findet danach eine gewisse Entlastungsphase (Fraktur, Sehnennaht etc.) statt. Nach dieser Entlastungsphase wird wieder sukzessive belastet und bewegt. Gerade bezüglich der Gelenke sollte man den Turnover-Zeiten von Synovialflüssigkeit, Hyaluronsäure und Glykosaminoglykanen Rechnung tragen und diese beim Belastungsaufbau berücksichtigen. Durch die lange Entlastungsphase haben sich die gerade erwähnten Strukturen der „Nichtbelastung“ angepasst. Die Glykosaminoglykanketten haben sich vermindert und vermögen somit weniger H2O im Knorpel zu binden. Das hat zur Folge, dass der Knorpel „weich“ wird (da Kollagen Typ II immer noch in genau gleicher Menge vorhanden ist). Wird nun der Belastungsaufbau forciert, läuft man Gefahr, dass die Knorpelstruktur zur Adaptation zu wenig Zeit hat und mit einer Gewebeschädigung reagiert. Lässt man dagegen dem kontinuierlichen Belastungsaufbau 2 bis 3 Wochen Zeit, ist das Risiko einer Gewebeschädigung deutlich geringer. Auch durch eine begleitende adäquat dosierte Quengeltherapie kann in der Entlastungsphase diesem physiologischen Abbau entgegengewirkt werden.
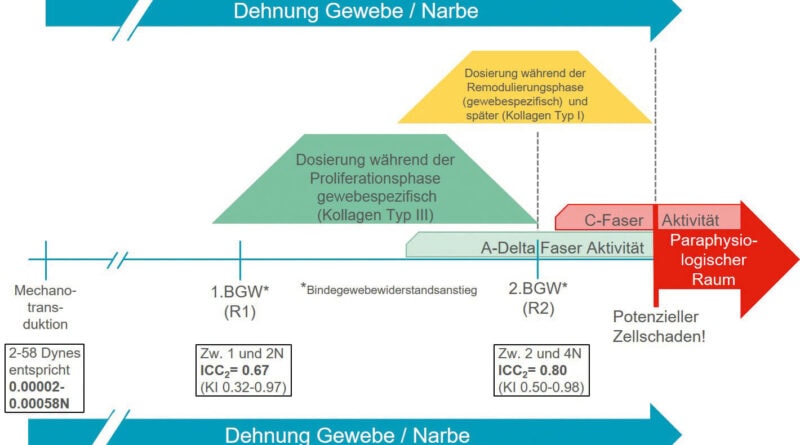
Anstieg des ersten und zweiten Bindegewebswiderstands (R1 und R2)
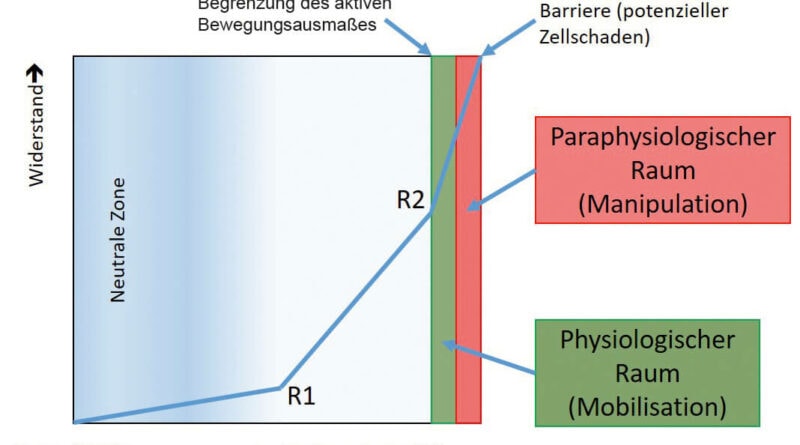
Grundsätzlich muss zwischen Bewegungsquantität und Bewegungsqualität unterschieden werden. Die Bewegungsquantität ist das physikalisch objektiv messbare Ausmaß der Bewegung. Im Unterschied dazu umfasst Bewegungsqualität unter anderem den Bewegungsfluss, die Dynamik sowie Rhythmus und Bewegungsharmonie. Dabei handelt es sich um Qualitäten, die während der Bewegung subjektiv spürbar sind. Um die Quantität und die Qualität einer Bewegung einwandfrei beurteilen zu können, benötigt der Therapeut zunächst theoretisches Wissen: Welche Quantität und Qualität sind bei einem Gelenk oder Gewebe im unverletzten Zustand zu erwarten? Zusätzlich sind jedoch auch reiche praktische Erfahrung und Fingerspitzengefühl erforderlich. In der Regel verhält sich ein gesundes Gelenk oder Gewebe immer gleich: Es besitzt innerhalb seines Bewegungsausmaßes eine kleinere oder größere „neutrale Zone“. Am Ende des Bewegungsausschlags besteht ein „physiologischer Raum“, an den sich ein „paraphysiologischer Raum“ anschließt (Abb. 3). Die „neutrale Zone“ liegt gewöhnlich in der Mitte des Bewegungsausmaßes und zeichnet sich an ihrem Ende durch einen sehr geringen Widerstandsanstieg (R1) aus. Beim zweiten deutlichen Bindegewebswiderstand (R2) beginnt der „physiologische Raum“. Der Therapeut mobilisiert das Gewebe (Gelenk) passiv mehr oder weniger weit in diesen Bereich hinein – je nach Intensität der manuellen Gradeinteilung (Dosierung) und der aktuell herrschenden Wundheilungsphase. Der „paraphysiologische Raum“ ist nur durch eine Impulsmobilisation (Manipulation) zu erreichen. Die anatomische Barriere ist nach einem Trauma oder nach einer Operation nach vorne versetzt. Grund dafür ist der Kollagentyp III, der in der Proliferationsphase vorherrscht. Er ist für die Integrität der verletzten Struktur verantwortlich und bewirkt, dass sich rasch wasserlösliche „Crosslinks“ bilden. Der provisorische Kollagentyp III hält mechanischen Scher- und Beschleunigungskräften nur schlecht stand. Vor allem in der Proliferationsphase ist daher schnell eine Überdosierung möglich. Mikrotraumatische Verletzungen lösen jeweils neue Entzündungsphasen aus, was zu einer erhöhten Restriktion des Gewebes führen kann und somit in einer Bewegungseinschränkung resultiert.
Klinische Konklusion auf Gewebeebene
Die bis jetzt erläuterten Umstände lassen keinen klaren Schluss bezüglich der absolut richtigen Dosierung der Reizsetzung zu. Wenn man aber die einzelnen Aspekte zusammenführt und sie im Zusammenhang beurteilt, kann man sich an den Bereich einer adäquaten und funktionellen Dosierung herantasten. Die Tatsache, dass mechanotransduktorische Zellanworten schon durch minimale Kräfte (bis 0.00058 N) eingeleitet werden, zeigt, dass eine funktionelle Ausrichtung des Gewebes wahrscheinlich schon bei sehr sanften manualtherapeutischen Interventionen stattfindet. Die empirisch bekannten Bindegewebswiderstände R1 und R2 liegen (am Rücken) im Bereich von R1 = 1–2 N und R2 = 2–4 N (Koller 2018a u. b) 3031. Somit ist anzunehmen, dass manuelle Interventionen im Bereich von R1 wahrscheinlich genügend Reiz für das Gewebe darstellen, damit eine mechanotransduktorische Antwort der Zelle und somit eine funktionelle Ausrichtung der extrazellulären Masche trix entsteht. Die Gefahr einer Überdosierung in der Proliferations- und Remodulierungsphase scheint doch höher als keine funktionelle Ausrichtung zu sein. Klinische Erfahrungen bei muskuloskelettal betroffenen Patienten (außer bei großflächigen Narben nach tiefdermalen Defekten) zeigten in der Rehaklinik Bellikon, dass in der Proliferationsphase bei manualtherapeutischen Interventionen lediglich bis zum zweiten Bindegewebswiderstand (also R2) deutlich weniger Rückfälle aufgrund von Überbelastungen (Zellschaden) zu beobachten sind. In der gleichen Zeit konnte auch eine verbesserte Mobilität und Gelenkbeweglichkeit beobachtet werden. In der Proliferationsphase scheint R2 ein wichtiger Anhaltspunkt für eine wundheilungsadaptierte Dosierung zu sein. Koller (2018b) erzielte in einer Pilotstudie bezüglich der Intertesterreliabilität zur Erkennung von R1 und R2 entsprechende Resultate. Der erste Bindegewebswiderstand (R1) konnte mit einer moderaten Intertesterreliabilität (ICC2 = 0.67) und der zweite Bindegewebswiderstand mit einer guten Intertesterreliabilität (ICC2 = 0.80) erkannt werden 32. Vor allem die gute Reliabilität von R2 scheint bezüglich einer adäquaten Dosierung in der Proliferationsphase wichtig zu sein. Somit kann die in Abbildung 4 grafisch dargestellte klinische Konklusion bezüglich einer adäquaten Dosierung formuliert werden: Manualtherapeutische und funktionell ausgerichtete Interventionen sollten in der Proliferationsphase bis an den zweiten Bindegewebswiderstand (R2) heran dosiert werden. Wie lange mit dieser Dosierung behandelt werden kann, hängt direkt von der Proliferationsphase und den Turnover-Zeiten der betroffenen Strukturen ab. In der gewebespezifischen Remodulierungsphase sollte zunehmend in den zweiten Bindegewebswiderstand (R2) hinein behandelt werden, und zwar aufgrund der funktionellen Reizgebung bezüglich Belastbarkeit und Festigkeit der betroffenen Strukturen im Sinne einer Angleichung an die alltagsrelevanten Aktivitäten inklusive Sport. Zu beachten sind dabei aber auch die Schmerzäußerungen des Patienten, die eine zusätzliche, aber niemals eine alleinige Hilfe in Bezug auf die aktuelle Dosierung darstellen.
Klinischer Übertrag für eine begleitende Therapie mit Quengelschienen
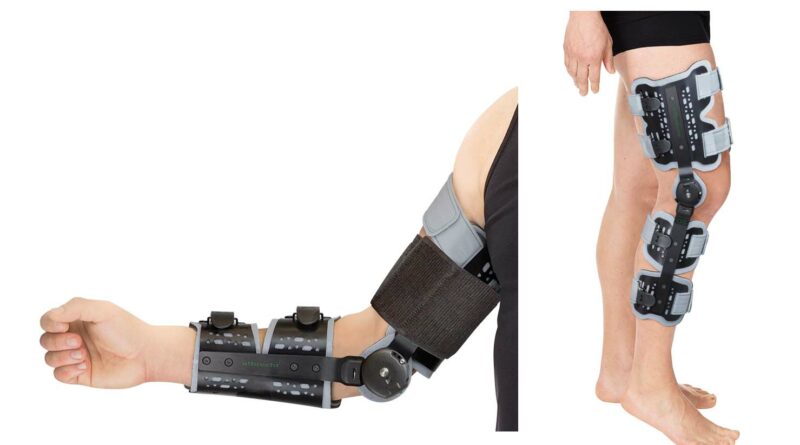
Balestrini et al. (2009) konnten bei täglicher 5‑prozentiger Gewebedehnung über jeweils einige Stunden einen positiven Effekt bezüglich der Dehnfähigkeit der extrazellulären Matrix nachweisen 33. Andalib et al. (2016) wiesen nach, dass schon minimale Kräfte für eine funktionelle Ausrichtung der extrazellulären Matrix ausreichen34, und Koller (2018b) konnte die Intertesterreliabilität von R2 mit einem ICC2- Wert mit 0.80 erheben 35. Diese Fakten sind die aktuellen Grundlagen für eine wirksame Quengeltherapie. Zusätzlich muss eine dynamisch progressive und gut dosierbare Quengelschiene verwendet werden. Als Beispiel für gut dosierbare Quengelschienen sind in Abbildung 5 je eine CDS®-Knie- und Ellbogenorthese der Firma Albrecht GmbH abgebildet.
Quengelung während der Wundheilungsphasen
Die Quengelung während der Wundheilungsphasen wird selten angewendet und muss zuvor mit dem behandelnden Arzt abgesprochen werden. Zumeist ist der Konflikt mit bestehenden postoperativen Beschränkungen so groß, dass die Gefahr einer Überdosierung und somit einer erneuten Entzündungsreaktion realistisch sein kann. Die Entscheidungskompetenz über eine Durchführung dieser Therapie liegt somit stets beim behandelnden Arzt oder Operateur. Mit einer Quengelung während der Wundheilungsphasen wird versucht, das Gewebe im Heilungsprozess funktionell zu unterstützen. Funktionelle Kräfte werden dabei im Sinne der Mechanotransduktion auf das Gewebe (Fibroblasten, Osteoblasten, Chondroblasten) übertragen. Das Gewebe adaptiert sich somit ohne zusätzliche Entzündungsreaktion. Um den zweiten Bindegewebswiderstand (R2) bei der Einstellung der Quengelschiene ermitteln zu können, sollte der Orthopädietechniker vor der Anpassung der Schiene das betroffene Gelenk des Patienten bis an R2 heran bewegen und den Patienten bitten, sich das hierbei empfundene Gefühl (Druck) zu merken. Danach sollte der Orthopädietechniker die Schiene anpassen und so einstellen, dass der Patient dasselbe Gefühl (Druck) verspürt, wie es zuvor manuell ausgelöst wurde. Biomechanisch gesehen treten passiv vermehrte Hebelwirkungen erst dann auf, wenn in den zweiten Bindegewebswiderstand gleichsam „hineingedrückt“ wird. Bei vornehmlich entzündlichen Krankheitsbildern wie Arthritis, Arthrofibrosen oder bakteriellen Infekten gilt die Quengeltherapie als kontraindiziert. In solchen Fällen soll sollte das therapeutische Vorgehen eine schmerzadaptierte Physiotherapie bzw. Bewegungstherapie kombiniert mit milden physikalischen Maßnahmen beinhalten.
Quengelung in der Proliferationsphase
Ist eine Quengeltherapie in den Wundheilungsphasen indiziert, müssen gewisse Voraussetzungen bestehen:
- Quengelung immer erst ab der Proliferationsphase (gewebespezifisch).
- Es sollten keine offensichtlichen Entzündungszeichen vorherrschend sein (vor allem keine Rötung, keine Schwellung, keine Erwärmung und keine Ruheschmerzen).
- Die biomechanischen Gegebenheiten und die Stabilität der entsprechenden Operationstechnik müssen vom Arzt, vom Therapeuten und vom Orthopädietechniker gemeinsam besprochen worden sein und im Einklang stehen.
- Der Schmerz des Patienten darf nicht vor dem zweiten Bindegewebswiderstand auftreten. Wird das betroffene Gelenk endgradig bewegt, muss der erste Bindegewebswiderstand symptomfrei bis zum zweiten Bindegewebswiderstand durchlaufen werden können.
- Am zweiten Bindegewebswiderstand angelangt, dürfen epikritizusche Schmerzeigenschaften auftreten (Aδ-Faseraktivität wie Spannen, Ziehen, Stechen, Brennen).
- Die auftretenden Schmerzen müssen klar extraartikulär (also in den Weichteilregionen) lokalisiert werden können. Typische intraartikuläre Schmerzlokalisationen, bei denen mechanische Inkongruenzen vermutet werden können, gelten als kontraindiziert.
Dosierung in der Proliferationsphase:
– 3- bis 5‑mal täglich 5 bis 15 Minuten konstante Quengelung am zweiten Bindegewebswiderstand. Kein Nachstellen (Nachziehen), ansonsten beginnen Hebelwirkungen auf die Fraktur und die operative Versorgung zu wirken.
– Nach dem Lösen sollte nicht direkt in die entgegengesetzte Bewegungsrichtung mobilisiert oder bewegt werden. Die dabei entstandenen Symptome sollten nach spätestens 60 Minuten wieder abklingen. Halten die durch die Quengelung entstandenen Symptome länger an, muss weniger lang oder weniger intensiv gequengelt werden.
– In der Proliferationsphase darf lediglich bis an den zweiten Bindegewebswiderstand heran dosiert werden. Ein Nachstellen während der Quengelung ist aus Sicht des Autors kontraindiziert.
Quengelung in der Remodulierungsphase
Ist eine Quengeltherapie in den Wundheilungsphasen indiziert, müssen gewisse Voraussetzungen bestehen:
- Quengelung immer erst ab der Remodulierungsphase (gewebespezifisch).
- Es sollten keine offensichtlichen Entzündungszeichen vorherrschend sein (vor allem keine Rötung, keine Schwellung, keine Erwärmung und keine Ruheschmerzen).
- Die biomechanischen Gegebenheiten und die Stabilität der entsprechenden Operationstechnik müssen vom Arzt, vom Therapeuten und vom Orthopädietechniker gemeinsam besprochen worden sein und im Einklang stehen.
- Der Schmerz des Patienten darf nicht am zweiten Bindegewebs-widerstand auftreten. Wird das betroffene Gelenk endgradig bewegt, muss der erste Bindegewebswiderstand symptomfrei bis in den zweiten Bindegewebswiderstand durchlaufen werden können.
- Im zweiten Bindegewebswiderstand angelangt, dürfen epikritische Schmerzeigenschaften auftreten (Aδ-Faseraktivität wie Spannen, Ziehen, Stechen, Brennen).
- Die auftretenden Schmerzen müssen klar extraartikulär (also in den Weichteilregionen) lokalisiert werden können. Typische intraartikuläre Schmerzlokalisationen, bei denen mechanische Inkongruenzen vermutet werden können, gelten als kontraindiziert.
Dosierung in der Remodulierungsphase:
– 3- bis 5‑mal täglich 5 bis 15 Minuten konstante Quengelung im zweiten Bindegewebswiderstand. Kein Nachstellen (Nachziehen), ansonsten beginnen Hebelwirkungen auf die Fraktur und die operative Versorgung zu wirken.
– Nach dem Lösen sollte nicht direkt in die entgegengesetzte Bewegungsrichtung mobilisiert oder bewegt werden. Die dabei entstandenen Symptome müssen nach spätestens 60 Minuten wieder abklingen. Halten die durch die Quengelung entstandenen Symptome länger an, muss weniger lange oder weniger intensiv gequengelt werden.
– In der Remodulierungsphase darf in den zweiten Bindegewebswiderstand hinein dosiert werden. Ein Nachstellen während der Quengelung ist kontraindiziert. Ausnahme: Bei erfolgter Röntgenkontrolle (i. d. R. 6–8 Wochen postoperativ) mit Bestätigung einer Konsolidierung und einem damit einhergehenden Belastungsaufbau kann vorsichtig während der Quengelung weiter in den zweiten Bindegewebswiderstand hinein nachgestellt werden (eine Freigabe durch den behandelnden Arzt vorausgesetzt).
Quengelung außerhalb der klassischen Wundheilungsphasen
Eine Quengelung außerhalb der klassischen Wundheilungsphase geht zumeist mit einer „Traumatisierung“ verklebter Gewebe einher. Es entsteht somit eine neue Entzündungsreaktion. Diese Traumatisierung ist je nach Dosierung mehr oder weniger ausgeprägt. Bereits durch starken mechanischen Stress auf das Gewebe werden ohne Zellschaden proinflammatorische Stoffe ausgeschüttet. Kommt es zu einer „Zerreißung“ von Gewebeschichten (z. B. verklebte Gewebeschichten), entsteht eine klassische physiologische Entzündungsreaktion. Voraussetzung für ein gutes Gelingen ist eine konsequente Weiterführung der Quengelung und stetiges Bewegen im neu gewonnenen Bewegungsausmaß. Wenn dies nicht umgesetzt wird oder werden kann, werden die gelösten Gleitschichten schnell wieder verkleben. Bei einer zu festen Schonhaltung (durch Fehlverhalten) kann dies sogar zu einer erheblich größeren Einschränkung als vor der Quengelung führen. I
st eine Quengeltherapie außerhalb der Wundheilungsphasen indiziert, müssen gewisse Voraussetzungen erfüllt sein:
- Es sollten keine offensichtlichen Entzündungszeichen vorherrschend sein (vor allem keine Rötung, keine Schwellung, keine Erwärmung und keine Ruheschmerzen).
- Die biomechanischen Gegebenheiten und die Stabilität der entsprechenden Operationstechnik müssen vom Arzt, vom Therapeuten und vom Orthopädietechniker gemeinsam besprochen worden sein und im Einklang stehen.
- Der Schmerz des Patienten darf nicht am zweiten Bindegewebswiderstand auftreten. Wird das betroffene Gelenk endgradig bewegt, muss der erste Bindegewebswiderstand symptomfrei bis in den zweiten Bindegewebswiderstand hinein durchlaufen werden können.
- Im zweiten Bindegewebswiderstand angelangt, dürfen epikritische Schmerzeigenschaften auftreten (Aδ-Faseraktivität wie Spannen, Ziehen, Stechen, Brennen).
- Die auftretenden Schmerzen müssen klar extraartikulär (also in den Weichteilregionen) lokalisiert werden können. Typische intraartikuläre Schmerzlokalisationen, bei denen mechanische Inkongruenzen vermutet werden können, gelten als kontraindiziert.
Dosierung außerhalb der klassischen Wundheilungsphasen:
3- bis 5‑mal täglich 15 bis 20 Minuten konstante Quengelung im zweiten Bindegewebswiderstand. Stetiges Nachstellen (Nachziehen) ist erwünscht und darf nur unter vorheriger Patientenedukation und der Einwilligung des Patienten erfolgen. Der Patient befindet sich während der Quengelung in einem schmerzhaften Zustand. Die subjektive Schmerzangabe des Patienten sollte mit der Quengelintensität so gewählt werden, dass der Patient die Quengelung während 15 bis 20 Minuten ertragen kann. Zu schnelle und zu heftige Steigerungen verschlechtern tendenziell das Resultat, da zumeist ein vorzeitiger Abbruch durch den Patienten wegen unerträglicher Schmerzen provoziert wird. Nach dem Lösen sollte nicht direkt in die entgegengesetzte Bewegungsrichtung mobilisiert oder bewegt werden. Die dabei entstandenen Symptome müssen nach spätestens 120 Minuten wieder rückläufig sein. Ein gewisser Entzündungsschmerz (Ruheschmerz) ist zu erwarten. Dieser Ruheschmerz darf aber die Intensität nach NRS 3–4/10 (NRS = Numeric Rating Scale) nicht überschreiten. Halten die durch die Quengelung entstandenen Symptome länger an, muss weniger lang oder weniger intensiv gequengelt werden. Außerhalb der klassischen Wundheilungsphasen darf in den zweiten Bindegewebswiderstand hinein dosiert werden. Ein Nachstellen während der Quengelung ist ausdrücklich erwünscht. Ein konsequentes und stetiges aktives Durchbewegen des neu gewonnenen Bewegungsausmaßes ist Voraussetzung für eine erhaltende Beweglichkeitsverbesserung des betroffenen Gelenkes.
Klinisches Fallbeispiel
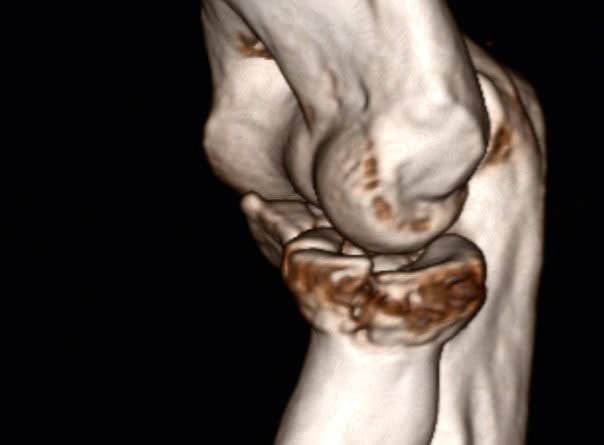
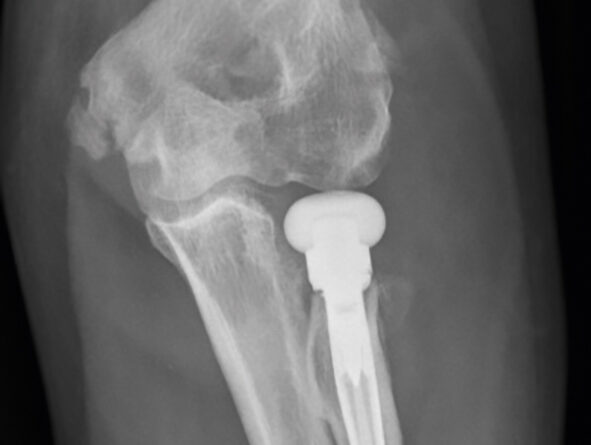
Ein 55-jähriger Bauarbeiter stürzte im Juli 2019 von einem Gerüst. Dabei zog er sich unter anderem eine multifragmentäre Radiusköpfchenfraktur und eine Spitzenfraktur des Processus coronoideus links zu (Abb. 6a). Eine operative Indikation war somit gegeben. Aufgrund der präoperativen Labordiagnostik wurde eine hyperglykämische Stoffwechsellage diagnostiziert, die prioritär behandelt werden musste. Während des konservativen Verlaufes entwickelte sich eine massive Bewegungseinschränkung und zunehmend Schmerzen beim Bewegen. Die initial geplante Operation wurde schlussendlich im Dezember durchgeführt. Es wurde eine Arthrolyse durchgeführt und das frakturierte Radiusköpfchen durch eine endoprothetische Versorgung ersetzt (Abb. 6b). Im ambulanten Setting erhielt der Patient wöchentlich dreimal Physiotherapie und 8 Wochen postoperativ eine statische Quengelschiene. Anfang März 2020 trat der Patient in die stationäre Rehabilitation durch den Autor ein. Die Schmerzsituation hatte sich deutlich verbessert, aber es hatte sich eine hartnäckige Bewegungseinschränkung vor allem in Ellbogenflexion manifestiert. Die aktive Beweglichkeit im Ellbogen links belief sich bei Eintritt bezüglich Flexion/Extension auf 80/10/0, bezüglich Pronation/Supination auf 80/0/80 (aus 70° Ellbogenflexion), passiv in Flexion/Extension auf 85/10/0, bezüglich Pronation/Supination auf 85/0/85. Das Endgefühl in Ellbogenflexion war fest-elastisch (eher kapsulär), und der Patient berichtete über gelegentliche Parästhesien in der linken Hand. Die statische Quengelschiene versuchte er in der Nacht in endgradiger Flexion zu tragen. Der Patient stellte sie jeweils so stark ein, dass er sie nur jeweils 1 Stunde lang tragen konnte und sie dann schmerzbedingt wieder abziehen musste. Die vermehrten Schmerzen zogen sich jeweils bis zum nächsten Morgen hin. Im stationären Rehabilitationsaufenthalt wurde mit 3 bis 4 Physiotherapiesitzungen pro Woche und täglich begleitenden medizinischen Trainingstherapien gestartet. Die statische wurde durch eine dynamische Quengelschiene ersetzte und die Dosierung „Quengelung in der Remodulierungsphase“ angewendet. Somit konnte der Patient die Schiene nachts 3 bis 4 Stunden lang tragen, bis es für ihn unangenehm wurde. Die morgendlichen zusätzlichen Schmerzen blieben ab dem zweiten Tag aus. Nach 3 Wochen belief sich die aktive Flexion auf 90°, die passive auf 95°. Zusätzlich wurde versucht, den nach der manuellen Mobilisation auftretenden „Jojo-Effekt“ bis zur nächsten Therapiesitzung mit einer einstündigen Quengeltherapie mit derselben Dosierung zu minimieren. Nach weiteren 2 Wochen konnten bei der Austrittsuntersuchung folgende Werte erhoben werden: aktiv bei Flexion/Extension 95/10/0 bzw. bei Pronation/Supination 85/0/80 (aus 90° Ellbogenflexion), passiv bei Flexion/ Extension 100/5/0 bzw. bei Pronation/ Supination 85/0/85 (Abb. 6c). Dies ist ein erfreulicher Fortschritt und zeigt aus der klinischen Erfahrung des Autors heraus, dass eine wundheilungsphasenadaptierte Dosierung im Einsatz mit Quengelschienen eine effektvolle Unterstützung der Manuellen Therapie darstellt. Dieses stationäre Setting wurde nun in die ambulante Nachbehandlung übertragen.
Fazit
Um die richtigen Vorgänge auf zellulärer Ebene in Gang setzen zu können, ist eine adäquate manuelle Dosierung und Quengeleinstellung Grundvoraussetzung. Eine Überforderung endet zwangsläufig in einer zellulären Beschädigung und löst eine erneute Entzündungsreaktion mit allen Kardinalsymptomen aus. Die Unterforderung wird mit der Bildung von Crosslinks und herabgesetzter Dehnund Belastbarkeit quittiert. Beides endet in einer Bewegungseinschränkung. Eine adäquate an die Wundheilungs- und Turnover-Zeiten adaptierte Dosierung führt langsam, aber stetig zur gewünschten Bewegungsverbesserung. Als grundlegende Dosierungshilfe dienen die beiden Bindegewebswiderstände. Sie erlauben es, entsprechend der Wundheilungsphase die adäquate Dosierung der dynamischen Quengelschiene einzustellen. Führen die Quengelmaßnahmen über Wochen nicht zum gewünschten Erfolg, sind Überlegungen zu möglichen operativen Indikationen in Betracht zu ziehen.
Der Autor:
Thomas Koller, Physiotherapeut
MAS Muskuloskelettale Physiotherapie
(ZHAW)
Rehaklinik Bellikon
CH-5454 Bellikon
thomas.koller@rehabellikon.ch
Begutachteter Beitrag/reviewed paper
Koller T. Unterstützende Therapie mit Quengelschienen – gewebephysiologische und wundheilungsspezifische Überlegungen zur Dosierung. Orthopädie Technik, 2020; 71 (6): 27–34
| Entzündungsphase | Proliferationsphase | Remodulierungsphase |
|
|---|---|---|---|
| Kapsel-Bindegewebe/Faszien | 0.–3. Tag bis 5. Tag | 3.–5. Tag bis 6. Woche | ab 6. Woche |
| Meniskus | 0.–5. Tag | 5. Tag bis 10. Woche | ab 10. Woche |
| Discus intervertebralis | 0.–5. Tag | 5. Tag bis 3. Woche | ab 3. Woche |
| Sehnengewebe | |||
| extrinsisch | 0.–3. Tag bis 5. Tag | 3.–5. Tag bis 4. Woche | ab 4. Woche |
| intrinsisch | nur bedingt | 9. bis 12. Woche | ab 9. bis 12. Woche |
| Knochen | 0.–3. Tag bis 5. Tag | 3.–5. Tag bis 3. Woche | ab 4. Woche bis 8.–12. Woche |
| Sehnen-Knochen-Übergang | 0.–5. Tag | 5. Tag bis 6. Woche | ab 4. bis 6. Woche |
| Muskelgewebe | 0.–4. Tag | 4. Tag bis 3. Woche | ab 3. Woche |
| Struktur/Gewebe | Turnover-Zeit |
|---|---|
| Kollagen Typ I (z. B. Bandstrukturen, Sehnen, Faszien etc.) | 300–500 Tage |
| Kollagen Typ I (Haut) | 150 Tage |
| Kollagen Typ II (z. B. Knorpelgewebe) | 50–100 Jahre (im Labor) |
| Kollagen Typ III (unspezifisch in der Proliferationsphase) | 30 Tage |
| Synovialflüssigkeit | 9–14 Tage |
| Kapselgewebe | 14–21 Tage |
| Hyaluronsäure | 2–4 Tage |
| Matrix (EZM) | 2–9 Tage |
| Glykosaminoglykane | 7–10 Tage |
| Knochengewebe | 6–12 Wochen |
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Ein engagierter Leistungssportler mit Hemiparese und der Einsatz sensomotorischer Fußorthesen (SMFO) — 12. Februar 2026
- Van den Berg F (Hrsg.). Angewandte Physiologie. 1. Das Bindegewebe des Bewegungsapparates verstehen und
beeinflussen. 3., überarb. Aufl. Stuttgart, New York: Thieme, 2011 - Koller T. Physiotherapeutische Diagnostik. Hypothesengeleitet und klinisch relevant entscheiden. Stuttgart: Thieme, 2017
- Andalib M et al. Biomimetic substrate control of cellular mechanotransduction. Biomaterials Research, 2016;
20 (1): 11. doi: 10.1186/s40824-016‑0059‑1 - Balestrini JL et al. Magnitude and Duration of Stretch Modulate Fibroblast Remodeling. Journal of Biomechanical Engineering, 2009; 131 (5): 051005–1. doi: 10.1115/1.3049527
- Bouffard NA et al. Tissue stretch decreases soluble TGF-beta1 and type‑1 procollagen in mouse subcutaneous connective tissue: evidence from ex vivo and in vivo models. Journal of Cellular Physiology, 2008; 214 (2): 389–395
- Koller T. Physiologische Grundlagen manueller Mobilisation von Narben und Bindegewebe sowie Dosierung bei
Patienten mit großflächigen Brandverletzungen. Manuelle Therapie, 2016; 20: 237–241 - Koller T et al. Physiotherapeutische Werkzeuge zur funktionellen Mobilisation von Narben und Bindegewebe und Dosierung bei grossflächigen Narbenplatten. Manuelle Therapie, 2017; 21 (05): 238–243
- Andalib M et al. Biomimetic substrate control of cellular mechanotransduction. Biomaterials Research, 2016;
20 (1): 11. doi: 10.1186/s40824-016‑0059‑1 - Balestrini JL et al. Magnitude and Duration of Stretch Modulate Fibroblast Remodeling. Journal of Biomechanical Engineering, 2009; 131 (5): 051005–1. doi: 10.1115/1.3049527
- Bouffard NA et al. Tissue stretch decreases soluble TGF-beta1 and type‑1 procollagen in mouse subcutaneous connective tissue: evidence from ex vivo and in vivo models. Journal of Cellular Physiology, 2008; 214 (2): 389–395
- Eckes B et al. Cell-Matrix Interactions in Dermal Reapair and Scarring. Fibrogenesis Tissue Repair, 2010; 3: 4.
https://fibrogenesis.biomedcentral.com/articles/10.1186/1755–1536‑3–4 (Zugriff am 21.04.2020) - Huang C et al. Mechanotherapy: Revisiting Physical Therapy and Recruiting Mechanobiology for a New Era in Medicine. Trends in Molecular Medicine, 2013; 19 (9): 555–564
- Khan KM, Scott A. Mechanotherapy: How Physical Therapists’ Prescription of Exercise Promotes Tissue Repair. British Journal of Sports Medicine, 2009; 43 (4): 247–252
- Bouffard NA et al. Tissue stretch decreases soluble TGF-beta1 and type‑1 procollagen in mouse subcutaneous connective tissue: evidence from ex vivo and in vivo models. Journal of Cellular Physiology, 2008; 214 (2): 389–395
- Kapp H. Regulation der Wundheilung durch Wachstumsfaktoren und Zytokine. Hartmann WundForum,
2006; 1: 8–14 - Lindahl GE et al. Activation of fibroblast procollagen alpha 1(I) transcription by mechanical strain is transforming
growth factor-beta-dependent and involves increased binding of CCAAT-binding factor (CBF/NF‑Y) at the proximal promoter. Journal of Biological Chemistry, 2002; 227 (8): 6153–6161 - Wipff P‑J et al. Myofibroblast contraction activates latent TGF-β1 from the extracellular matrix. Journal of Cell Biology, 2007; 179 (6): 1311–1323
- Bouffard NA et al. Tissue stretch decreases soluble TGF-beta1 and type‑1 procollagen in mouse subcutaneous connectivetissue: evidence from ex vivo and in vivo models. Journal of Cellular Physiology, 2008; 214 (2): 389–395
- Balestrini JL et al. Magnitude and Duration of Stretch Modulate Fibroblast Remodeling. Journal of Biomechanical Engineering, 2009; 131 (5): 051005–1. doi: 10.1115/1.3049527
- Balestrini JL et al. Magnitude and Duration of Stretch Modulate Fibroblast Remodeling. Journal of Biomechanical Engineering, 2009; 131 (5): 051005–1. doi: 10.1115/1.3049527
- Balestrini JL et al. Magnitude and Duration of Stretch Modulate Fibroblast Remodeling. Journal of Biomechanical
Engineering, 2009; 131 (5): 051005–1. doi: 10.1115/1.3049527 - Andalib M et al. Biomimetic substrate control of cellular mechanotransduction. Biomaterials Research, 2016; 20 (1): 11. doi: 10.1186/s40824-016‑0059‑1
- Andalib M et al. Biomimetic substrate control of cellular mechanotransduction. Biomaterials Research, 2016; 20 (1): 11. doi: 10.1186/s40824-016‑0059‑1
- Bouffard NA et al. Tissue stretch decreases soluble TGF-beta1 and type‑1 procollagen in mouse subcutaneous connective tissue: evidence from ex vivo and in vivo models. Journal of Cellular Physiology, 2008; 214 (2): 389–395 [6] Koller T. Physiologische Grundlagen manueller Mobilisation von Narben und Bindegewebe sowie Dosierung bei
- Langevin HM et al. Fibroblast cytoskeletal remodeling contributes to connective tissue tension. J Cell Physiol, 2011; 226 (5): 1166–1175. doi:10.1002/jcp.22442
- Van den Berg F (Hrsg.). Angewandte Physiologie. 1. Das Bindegewebe des Bewegungsapparates verstehen und beeinflussen. 3., überarb. Aufl. Stuttgart, New York: Thieme, 2011
- Koller T. Physiotherapeutische Diagnostik. Hypothesengeleitet und klinisch relevant entscheiden. Stuttgart: Thieme, 2017
- Koller T. Physiologische Grundlagen manueller Mobilisation von Narben und Bindegewebe sowie Dosierung bei
Patienten mit großflächigen Brandverletzungen. Manuelle Therapie, 2016; 20: 237–241 - Koller T. Physiotherapeutische Diagnostik. Hypothesengeleitet und klinisch relevant entscheiden. Stuttgart: Thieme, 2017
- Koller T (2018a). Manualtherapeutische Bestimmung der Anstiege des Bindegewebewiderstands bei Narben und Narbenplatten. Pilotstudie. manuelletherapie, 2018; 21: 81–87. doi: 10.1055/a‑0585–1624
- Koller T (2018b). Intertester-Reliabilität und Kriteriumsvalidität bei der Bestimmung der Haut- und Bindegewebewiderstände im physiologischen Gewebe. manuelletherapie, 2019; 23 (04): 177–183
- Koller T (2018b). Intertester-Reliabilität und Kriteriumsvalidität bei der Bestimmung der Haut- und Bindegewebewiderstände im physiologischen Gewebe. manuelletherapie, 2019; 23 (04): 177–183
- Balestrini JL et al. Magnitude and Duration of Stretch Modulate Fibroblast Remodeling. Journal of Biomechanical
Engineering, 2009; 131 (5): 051005–1. doi: 10.1115/1.3049527 - Andalib M et al. Biomimetic substrate control of cellular mechanotransduction. Biomaterials Research, 2016; 20 (1): 11. doi: 10.1186/s40824-016‑0059‑1
- Koller T (2018b). Intertester-Reliabilität und Kriteriumsvalidität bei der Bestimmung der Haut- und Bindegewebewiderstände
im physiologischen Gewebe. manuelletherapie, 2019; 23 (04): 177–183