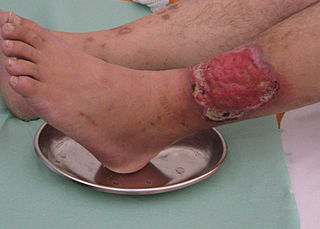
Hintergrund
Das Ulcus cruris (UC) gehört neben dem Dekubitus und dem diabetischen Fußulcus zu den häufigsten chronischen Wunden 1 2. Ursächlich für das Ulcus cruris ist eine chronische Gefäßerkrankung. Die schwerste Form der Grunderkrankung ist die chronische venöse Insuffizienz (CVI) und die periphere arterielle Verschlusskrankheit (pAVK). Je nach Grunderkrankung wird das Ulcus cruris am häufigsten in ein venöses, arterielles oder gemischtes Ulcus cruris unterteilt. Unter einem Ulcus cruris venosum, woran mit 37 bis 80 % die Mehrheit der Ulcus-cruris-Patienten erkrankt, versteht man einen Substanzdefekt im pathologisch veränderten Gewebe des Unterschenkels infolge der CVI 3. Durch die CVI kommt es zur Störung der Makro- und Mikrozirkulation und langfristig zu einer Störung des Venensystems der unteren Extremitäten, gefolgt von einer Erhöhung des Blutvolumens in den Venen. Diese schädigt durch erhöhten Druck in den Gefäßen die Endgefäße der Haut und bewirkt eine chronisch entzündliche Reaktion sowie eine Veränderung der Haut, was schließlich zur Wundentstehung führt 4. Bei ca. 3 % der Patienten mit einer chronischen venösen Insuffizienz entwickelt sich ein Ulcus cruris venosum 5.
Patienten mit einem Ulcus cruris, unabhängig von der Ätiologie, sind in ihrer Lebensqualität sehr eingeschränkt 6 7 8 9 10 11 und benötigen einen hohen pflegerischen sowie medizinischen Aufwand. Somit nehmen diese Patienten verstärkt Gesundheitsleistungen in Anspruch 12 13 14 15 16. Aufgrund des demografischen Wandels und der damit einhergehenden zunehmenden Zahl an Gefäßerkrankungen bei älteren Menschen 17 18 muss mit einem weiteren Zuwachs dieser Erkrankung gerechnet werden.
Erkrankungshäufigkeit
In Deutschland litten im Jahr 2012 zwischen 0,3 und 0,6 % der Menschen unter einem Ulcus cruris 19 20. Das bedeutet, dass bei etwa 520.000 Menschen eine Wunde diagnostiziert und bei ca. 210.000 Personen die diagnostizierte Wunde mit einem wundspezifischen Verbandmittel behandelt wurde, somit ein florides (aktives) Ulcus cruris vorlag. Von den 210.000 floriden Ulcera litten knapp 74.000 Personen unter einem venösen, 25.000 unter einem arteriellen und 8.000 Personen unter einem gemischten Ulcus cruris. Da diese Studie auf Abrechnungsdaten der gesetzlichen Krankenversicherung (GKV) basiert, wurde bei der Mehrheit der Versicherten ein nicht näher bezeichnetes Ulcus cruris kodiert (110.000 Personen). Über einen Zeitraum von fünf Jahren zeigte sich eine annähernd lineare jährliche Erhöhung der floriden Prävalenz um 0,1 % (von 0,2 % auf 0,3 %). In einer Kohorte von Versicherten einer gesetzlichen Krankenversicherung aus dem Jahr 2010 erkrankten 350.000 Personen neu an einem Ulcus cruris über einen Beobachtungszeitraum von drei Jahren (Inzidenz) 21.
Die Prävalenz des venösen Ulcus cruris kann unter Berücksichtigung der gemischten Ulcera und unter Annahme eines Anteils von 70 % unter den Versicherten mit einem nicht näher bezeichneten Ulcus cruris auf 160.000 Personen in Deutschland geschätzt werden 22. Damit liegt die vorgefundene floride Erkrankungshäufigkeit des venösen Ulcus cruris im Jahr 2012 im Vergleich zur Bonner Venenstudie mit 80.000 Personen aus dem Jahr 2003 deutlich höher 23.
Im Durchschnitt leiden mehr Frauen (61 %) als Männer unter einem Ulcus cruris. Zudem steigt die Wahrscheinlichkeit, an einer Ulzeration zu erkranken, mit höherem Lebensalter an. Der Geschlechtsunterschied lässt sich vor allem in den höheren Altersgruppen ab 80 Jahren feststellen.
Kosten
Die Kosten der Versorgung von Menschen mit UC, unabhängig von der Ätiologie, liegen im Durchschnitt pro Patient und Jahr aus Kostenträgersicht der gesetzlichen Krankenversicherung (GKV) zwischen 8.000 und 10.000 Euro 24 25. Trotz der unterschiedlichen Gesundheitssysteme können international ähnliche Kostenanteile identifiziert werden. Laut einer Studie in den USA entstehen bei Patienten mit einem Ulcus cruris venosum Gesamtkosten in Höhe von 9.000 US-Dollar 26. Die höchsten Kosten entfallen mit knapp 50 % auf die stationäre Versorgung. Im Durchschnitt liegt die Verweildauer bei einem Ulcus cruris jeglicher Genese mit 25,4 Tagen deutlich über der mittleren Verweildauer von 7,7 Tagen 27 28. Die Kosten für Ressourcenverbräuche wie wundrelevante Arzneimittel und Wundprodukte belaufen sich auf 2.000 und 3.000 Euro 29 30 31. Wundauflagen nehmen dabei den größten Anteil an den Ressourcenverbräuchen ein. Bei Gesamtkosten im Mittel von 9.000 Euro pro Patient und Jahr und bei einer vorgefundenen Prävalenz von 0,3 % (210.000 Patienten) entstehen somit geschätzte Gesamtkosten für die Behandlung des Ulcus cruris aus Sicht der GKV von etwa 2 Milliarden Euro pro Jahr.
Versorgungssituation
Vor dem Hintergrund der hohen Krankheitslast und des hohen pflegerischen sowie medizinischen Aufwands kommt einer leitliniengerechten, qualifizierten und zeitgerechten Versorgung von Patienten mit einem Ulcus cruris eine hohe Bedeutung zu. Die Versorgung und der Heilungsverlauf von Patienten mit chronischen Wunden unterscheiden sich je nach Ätiologie 32 und zeichnen sich durch eine hohe Komplexität und mehrere parallel anzuwendende Therapien aus 33. Die Behandlungsstrategien reichen von der Diagnostik über lokale Therapieverfahren bis hin zu operativen, physikalischen sowie systemischen Verfahren. Die Erkrankungshäufigkeit, die Behandlungszeit sowie das Wiederauftreten einer Ulzeration können durch eine frühzeitige leitliniengerechte Behandlung verringert werden. Auch patientenseitig trägt eine adäquate Versorgung zur Verbesserung der Lebensqualität bei.
Viele kontrollierte Studien zeigen, dass die Kompressionstherapie die Heilungszeit verkürzt und Rezidive reduziert 34 35 36. Daher stellt die Kompressionstherapie bei Patienten mit einem Ulcus cruris eine wichtige Säule der kausalen Behandlung dar. Eine Kompression (in der Regel in Form von medizinischen Kompressionsstrümpfen, MKS) sollte, wenn keine chirurgische Wiederherstellung des Venensystems möglich ist, dauerhaft zur Rezidivprophylaxe getragen werden 37.
Eine Studie auf der Basis von GKV-Routinedaten zeigt, dass die Versorgung von Patienten mit einem Ulcus cruris venosum in Deutschland defizitär ist 38. Dabei erhalten knapp 60 % der Versicherten mit einem inzidenten floriden venösen Ulcus jeweils ein Jahr vor und nach Wundbeginn eine Kompressionstherapie. Ähnliche Verteilungen konnten ebenfalls in einer bundesweiten Befragung bei Patienten mit einem Ulcus cruris venosum gezeigt werden 39. Hier gaben 31 % der befragten Patienten an, keine Kompressionstherapie zu erhalten, obwohl die Wunde im Mittel bereits seit über einem Jahr bestand. Auch in anderen europäischen Ländern konnten diese Versorgungsdefizite aufgezeigt werden 40 41 42.
Regional zeigten sich in Deutschland einige Versorgungsdisparitäten 43. Der Anteil der Patienten mit Kompressionstherapie ist mit 33 % im Saarland am geringsten. In Bremen und Hamburg wurde hingegen die Hälfte der betroffenen Versicherten mit einer Kompressionstherapie versorgt. Diese Ergebnisse spiegeln sich ebenfalls in den Zahlen einer Studie bei Wundversorgern im Raum Hamburg wider 44.
Nach etwa drei bis vier Wochen, bei normalem Verlauf und nach Beendigung der Entstauungsphase, sollte die Kompressionsbandagierung auf Ulcus-Strumpfsysteme umgestellt werden. Diese Umstellung wird empfohlen, da Strümpfe den Druck besser halten, weniger verrutschen sowie auftragen und somit zur Steigerung der Lebensqualität des Patienten beitragen. Dennoch werden Kompressionsbinden durchschnittlich 41 Wochen lang getragen 45. Somit werden sie zehnmal länger getragen als im optimalen Behandlungsverlauf vorgesehen.
Anhand von GKV-Routinedaten konnte gezeigt werden, dass bei 32 % der Versicherten medizinische Kompressionstrümpfe (MKS) und bei 14 % der Versicherten Verbände mit Kurzzugbinden verordnet werden 46. Mehrkomponentensysteme dagegen wurden bei nur 2 % der Versicherten verordnet. Dieser mangelnde Wissenstand der Anwender (Ärzte, Pflegefachkräfte und medizinische Fachangestellte) über Mehrkomponentensysteme zeigte sich auch in einer bundesweiten Erhebung im Rahmen einer Fortbildung zur Kompressionstherapie 47. 85 bis 90 % der Teilnehmer kannten die verschiedenen Kompressionsmaterialien wie Mehrkomponentensysteme, Ulcus-Strumpfsysteme und das Prinzip der Unterpolsterung nicht. Diese Erkenntnisse konnten in einer bundesweiten Patientenbefragung zur Versorgungspraxis bestätigt werden 48 : Nur ein geringer Teil der Patienten gab an, bei einer Kompressionsbandagierung eine Unterpolsterung zu erhalten.
Trotz guter wissenschaftlicher Datenlage deutet der geringe Verordnungsanteil an Mehrkomponentensystemen darauf hin, dass diese Systeme, obwohl sie seit dem Jahr 2000 in Deutschland verfügbar sind, vielen Anwendern noch nicht bekannt sind oder deren Nutzen nicht hinreichend gegenwärtig ist. Dieser geringe Verordnungsanteil kann ggf. auch darauf zurückgeführt werden, dass Verordner die Einmalmaterialien als kostspieliger empfinden.
Neben der geringen Verordnungszahl ist besonders der defizitäre Wissenstand über Materialien, Verbandsysteme und das praktische Anlegen einer Kompressionsbandagierung innerhalb einer bestimmten Druckwertspanne (50–60 mmHg) zu erkennen. Ein hoher Kompressionsdruck beim phlebologischen Kompressionsverband wird empfohlen 49 50. Jedoch weisen Kompressionswicklungen mit Kurzzugbinden innerhalb kurzer Zeit einen erheblichen Druckabfall auf 51 52. Dabei ist ein hoher Kompressionsdruck dazu geeignet, die Drucküberlastung im Venensystem zu reduzieren 53. Etwa 10 % der Teilnehmer konnten den zu erreichenden Druckbereich anlegen 54. Auch in dieser Studie konnte ein signifikanter Druckabfall (6,7 mmHg) nach viermaliger Dorsalflexion durch Nachgeben des Bindematerials oder Verrutschen der Binden festgestellt werden.
Fazit
Durch eine leitliniengerechte Behandlung, die unter anderem ein adäquates Wundmanagement beinhaltet, können Prävalenz und Inzidenz, die Rezidivrate sowie die Behandlungszeit des Ulcus cruris verkürzt und Folgekosten verringert werden 55 56. Ferner kann dies erheblich zur Verbesserung der Lebensqualität beitragen und die gesamte Wundversorgung positiv beeinflussen.
Trotz der wissenschaftlich gut belegten Wirksamkeit besteht bis heute in Deutschland eine Unter- oder auch Fehlversorgung der Patienten mit einem Ulcus cruris venosum mit Blick auf eine leitliniengerechte medizinische Kompressionstherapie. Neben der mangelnden Umsetzung gibt es zudem ein großes Defizit beim Wissen und dem richtigen Umgang mit der Kompressionstherapie in Deutschland. Es besteht daher weiterer Handlungsbedarf, um die leitliniengerechte Kompressionstherapie besser in der täglichen Praxis zu etablieren. Eine Wissenssteigerung über Material und Umgang sowohl bei den Behandlern als auch bei den Patienten kann die Abheilungszeiten verkürzen, Kosten einsparen und die Lebensqualität steigern.
Um kurzfristig eine Steigerung der Effizienz und der Kostenstruktur bei gleichzeitig hoher Leistung und eine Qualitätssteigerung unseres Gesundheitssystems zu erreichen, wie es bereits im Jahr 2000 im Sachverständigenrat gefordert wurde (Sachverständigenrat für die Konzertierte Aktion im Gesundheitswesen 57), legen die Ergebnisse nahe, dass es einer Überwindung dieser defizitären Versorgungssituation bedarf. Dieses Ziel kann jedoch nur erreicht werden, wenn die Hindernisse fehlender Leitlinienimplementierung erkannt und Strategien entwickelt werden, um diese zielgerichtet zu überwinden. Gründe für eine fehlende Implementierung von medizinischen Leitlinien sind zum Beispiel fehlendes Wissen über den Leitlinieninhalt, das Fehlen einer verständlichen und praxisorientierten Empfehlung für den Behandelnden oder unzureichende Vergütungsstrukturen 58 59. Eine standardisierte Schulung aller beteiligten Versorger über die Effizienz und Anwendung der Kompressionstherapie wäre vor diesem Hintergrund erstrebenswert. Eine optimierte Patientenaufklärung, beispielsweise in Form von spezifischen Patientenbroschüren, für die Unterstützung der Patientenedukation ist hierfür eine sinnvolle Ergänzung.
Die Autorin:
Dr. P. H. Kristina Heyer, M. Sc.
Competenzzentum Versorgungsforschung in der Dermatologie (CVderm), Institut für Versorgungsforschung in der Dermatologie und bei Pflegeberufen (IVDP), Universitätsklinikum
Hamburg-Eppendorf (UKE)
Martinistraße 52, 20246 Hamburg
k.heyer@uke.de
Begutachteter Beitrag/reviewed paper
Heyer K. Erkrankungshäufigkeit und Versorgungssituation von Patienten mit Ulcus cruris in Deutschland – aktueller Stand der Forschung. Orthopädie Technik, 2016; 67 (12): 38–41
- Easypreg – ein Faserverbundwerkstoff zum Tiefziehen — 9. März 2026
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Deutsche Gesellschaft für Wundheilung und Wundbehandlung e. V. S3-Leitlinie „Lokaltherapie chronischer Wunden bei Patienten mit den Risiken periphere arterielle Verschlusskrankheit, Diabetes mellitus, chronische venöse Insuffizienz“ (AWMF-Leitlinienregister Nr. 091/001). Stand: 12.06.2012 (verlängert bis 11.06.2017). http://www.awmf.org/uploads/tx_szleitlinien/091–001l_S3_Lokaltherapie_chronischer_Wunden_2012-verlaengert.pdf (Zugriff am 27.10.2016)
- Körber A, Klode J, Al-Benna S, Wax C, Schadendorf D, Steinstraesser L, Dissemond J. Etiology of chronic leg ulcers in 31,619 patients in Germany analyzed by an expert survey. J Dtsch Dermatol Ges, 2011; 9 (2): 116–121
- Deutsche Gesellschaft für Phlebologie e. V. S3-Leitlinie „Diagnostik und Therapie des Ulcus cruris venosum“ (AWMF-Leitlinienregister Nr. 037/009). Stand: 01.08.2008 (in Überarbeitung), gültig bis 01.08.2013. http://www.awmf.org/uploads/tx_szleitlinien/037–009l_S3_Diagnostik_und_Therapie_des_Ulcus_cruris_venosum_abgelaufen. pdf (Zugriff am 27.10.2016)
- Deutsche Gesellschaft für Phlebologie e. V. S3-Leitlinie „Diagnostik und Therapie des Ulcus cruris venosum“ (AWMF-Leitlinienregister Nr. 037/009). Stand: 01.08.2008 (in Überarbeitung), gültig bis 01.08.2013. http://www.awmf.org/uploads/tx_szleitlinien/037–009l_S3_Diagnostik_und_Therapie_des_Ulcus_cruris_venosum_abgelaufen. pdf (Zugriff am 27.10.2016)
- Protz K. Moderne Wundversorgung: Praxiswissen, Standards und Dokumentation. 7. Auflage. München: Urban und Fischer, 2014
- Augustin M, Herberger K, Rustenbach SJ, Schäfer I, Zschocke I, Blome C. Quality of life evaluation in wounds: validation of the Freiburg Life Quality Assessment-wound module, a disease-specific instrument. Int Wound J, 2010; 7 (6): 493–501
- Augustin M, Rustenbach SJ, Debus S, Grams L, Munter KC, Tigges W, Schafer E, Herberger K. Quality of care in chronic leg ulcer in the community: introduction of quality indicators und a scoring system. Dermatology 2011; 222 (4): 321–329
- Augustin M, Brocatti LK, Rustenbach SJ, Schafer I, Herberger K. Cost-of-illness of leg ulcers in the community. Int Wound J, 2014; 11 (3): 283–292
- Herberger K, Rustenbach SJ, Grams L, Munter KC, Schafer E, Augustin M. Quality-of-care for leg ulcers in the metropolitan area of Hamburg‑a community-based study. JEADV, 2012; 26 (4): 495–502
- Herberger K, Rustenbach SJ, Haartje O, Blome C, Franzke N, Schafer I, Radtke M, Augustin M. Quality of life und satisfaction of patients with leg ulcers-results of a community-based study. VASA 2011; 40 (2): 131–138
- Hopman WM, Vandenkerkhof EG, Carley ME, Kuhnke JL, Harrison MB. Factors associated with health-related quality of life in chronic leg ulceration. Qual Life Res, 2014; 23 (6): 1833–1840
- Augustin M, Brocatti LK, Rustenbach SJ, Schafer I, Herberger K. Cost-of-illness of leg ulcers in the community. Int Wound J, 2014; 11 (3): 283–292
- Herberger K, Rustenbach SJ, Grams L, Munter KC, Schafer E, Augustin M. Quality-of-care for leg ulcers in the metropolitan area of Hamburg‑a community-based study. JEADV, 2012; 26 (4): 495–502
- Herberger K, Rustenbach SJ, Haartje O, Blome C, Franzke N, Schafer I, Radtke M, Augustin M. Quality of life und satisfaction of patients with leg ulcers-results of a community-based study. VASA 2011; 40 (2): 131–138
- Hopman WM, Vandenkerkhof EG, Carley ME, Kuhnke JL, Harrison MB. Factors associated with health-related quality of life in chronic leg ulceration. Qual Life Res, 2014; 23 (6): 1833–1840
- Purwins S, Herberger K, Debus ES, Rustenbach SJ, Pelzer P, Rabe E, Schafer E, Stadler R, Augustin M. Cost-of-illness of chronic leg ulcers in Germany. Int Wound J, 2010; 7 (2): 97–102
- Rabe E, Pannier F, Bromen K, Schuldt K, Stang A, Poncar CH, Wittenhorst M, Bock E, Weber S, Jöckel KH. Bonner Venenstudie der Deutschen Gesellschaft für Phlebologie. Epidemiologische Untersuchung zur Frage der Häufigkeit und Ausprägung von chronischen Venenkrankheiten in der städtischen und ländlichen Wohnbevölkerung. Phlebologie, 2003; 32: 1–14
- Rabe E, Bauersachs RM, Pannier F, List SM. Venenerkrankungen der Beine (Gesundheitsberichterstattung des Bundes, Heft 44). Berlin: Robert-Koch-Institut, 2009. edoc.rki.de/documents/rki_fv/ren4T3cctjHcA/PDF/253bKE5YVJxo_25.pdf (Zugriff am 27.10.2016)
- Heyer K. Versorgungsepidemiologie des Ulcus cruris in Deutschland – Erkrankungshäufigkeit, Versorgungsqualität und Prädiktoren der Wundheilung. Berlin, Heidelberg, New York: Springer, 2016
- Heyer K, Herberger K, Protz K, Glaeske G, Augustin M. Epidemiology of chronic wounds in Germany: Analysis of statutory health insurance data. Wound Repair Regen, 2016; 24 (2): 434–442
- Heyer K. Versorgungsepidemiologie des Ulcus cruris in Deutschland – Erkrankungshäufigkeit, Versorgungsqualität und Prädiktoren der Wundheilung. Berlin, Heidelberg, New York: Springer, 2016
- Heyer K. Versorgungsepidemiologie des Ulcus cruris in Deutschland – Erkrankungshäufigkeit, Versorgungsqualität und Prädiktoren der Wundheilung. Berlin, Heidelberg, New York: Springer, 2016
- Rabe E, Pannier F, Bromen K, Schuldt K, Stang A, Poncar CH, Wittenhorst M, Bock E, Weber S, Jöckel KH. Bonner Venenstudie der Deutschen Gesellschaft für Phlebologie. Epidemiologische Untersuchung zur Frage der Häufigkeit und Ausprägung von chronischen Venenkrankheiten in der städtischen und ländlichen Wohnbevölkerung. Phlebologie, 2003; 32: 1–14
- Augustin M, Brocatti LK, Rustenbach SJ, Schafer I, Herberger K. Cost-of-illness of leg ulcers in the community. Int Wound J, 2014; 11 (3): 283–292
- Purwins S, Herberger K, Debus ES, Rustenbach SJ, Pelzer P, Rabe E, Schafer E, Stadler R, Augustin M. Cost-of-illness of chronic leg ulcers in Germany. Int Wound J, 2010; 7 (2): 97–102
- Olin JW, Beusterien KM, Childs MB, Seavey C, McHugh L, Griffiths RI. Medical costs of treating venous stasis ulcers: evidence from a retrospective cohort study. Vasc Med, 1999; 4 (1): 1–7
- Läuchli S, Bayard I, Hafner J, Hunziker T, Mayer D, French L. Healing times und the need for hospitalization for leg ulcers of different etiologies. Hautarzt, 2014; 64 (12): 917–922
- Statistisches Bundesamt. Gesundheit: Grunddaten der Krankenhäuser. https://www.destatis.de/DE/Publikationen/Thematisch/Gesundheit/Krankenhaeuser/GrunddatenKrankenhaeuser.html (Zugriff am 23.07.2015)
- Augustin M, Brocatti LK, Rustenbach SJ, Schafer I, Herberger K. Cost-of-illness of leg ulcers in the community. Int Wound J, 2014; 11 (3): 283–292
- Purwins S, Herberger K, Debus ES, Rustenbach SJ, Pelzer P, Rabe E, Schafer E, Stadler R, Augustin M. Cost-of-illness of chronic leg ulcers in Germany. Int Wound J, 2010; 7 (2): 97–102
- Müller-Bühl U, Leutgeb R, Bungartz J, Szecsenyi J, Laux G. Expenditure of chronic venous leg ulcer management in German primary care: results from a population-based study. Int Wound Journal, 2013; 10 (1): 52–56
- Läuchli S, Bayard I, Hafner J, Hunziker T, Mayer D, French L. Healing times und the need for hospitalization for leg ulcers of different etiologies. Hautarzt, 2014; 64 (12): 917–922
- Augustin M, Debus S. Moderne Wundversorgung: Im Spannungsfeld zwischen Qualitätsanspruch, Zuständigkeit und Sparzwang. 1. Auflage. Wiesbaden: mph-Verlag, 2009
- Reich-Schupke S, Stücker M. Moderne Kompressionstherapie: Ein praktischer Leitfaden. Köln: Viavital Verlag GmbH, 2013
- Heinen MM, van Achterberg T, op Reimer WS, van de Kerkhof PCM, Laat E. Venous leg ulcer patients: a review of the literature on lifestyle und pain-related interventions. J Clin Nurs, 2004; 13 (3): 355–366
- Nelson EA, Bell-Syer SEM. Compression for preventing recurrence of venous ulcers. Cochrane Database Syst Rev, 2012; 8: CD002303
- Protz K. Moderne Wundversorgung: Praxiswissen, Standards und Dokumentation. 7. Auflage. München: Urban und Fischer, 2014
- Heyer K, Protz K, Glaeske G, Augustin M. Epidemiology and use of compression treatment in venous leg ulcers: Nationwide claims data analysis in Germany. Int Wound J, 2016 [Epub ahead of print]. doi: 10.1111/iwj.12605
- Protz K, Heyer K, Stücker M, Dörler M, Hampel-Kalthoff C, Augustin M. Kompressionstherapie – Kenntnisse und Anwendungspraxis – Eine deutschlandweite Erhebung des Wissensstands zur Kompressionstherapie und der von Anwendern im Praxistest erreichten Druckwerte. J Dtsch Dermatol Ges, 2015 (angenommen)
- Srinivasaiah N, Dugdall H, Barrett S, Drew PJ. A point prevalence survey of wounds in north-east England. J Wound Care, 2007; 16 (10): 413–416, 418–419
- Chaby G, Senet P, Ganry O, Caudron A, Thuillier D, Debure C, Meaume S, Truchetet F, Combemale P, Skowron F, Joly P, Lok C. Prognostic factors associated with healing of venous leg ulcers: a multicentre, prospective, cohort study. Br J Dermatol, 2013; 169 (5): 1106–1113
- Rabe E, Hertel S, Bock E, Hoffmann B, Jockel KH, Pannier F. Therapy with compression stockings in Germany – results from the Bonn Vein Studies. J Dtsch Dermatol Ges, 2013; 11 (3): 257–261
- Heyer K, Protz K, Glaeske G, Augustin M. Epidemiology and use of compression treatment in venous leg ulcers: Nationwide claims data analysis in Germany. Int Wound J, 2016 [Epub ahead of print]. doi: 10.1111/iwj.12605
- Herberger K, Rustenbach SJ, Grams L, Munter KC, Schafer E, Augustin M. Quality-of-care for leg ulcers in the metropolitan area of Hamburg‑a community-based study. JEADV, 2012; 26 (4): 495–502
- Protz K. Moderne Wundversorgung: Praxiswissen, Standards und Dokumentation. 7. Auflage. München: Urban und Fischer, 2014
- Heyer K, Protz K, Glaeske G, Augustin M. Epidemiology and use of compression treatment in venous leg ulcers: Nationwide claims data analysis in Germany. Int Wound J, 2016 [Epub ahead of print]. doi: 10.1111/iwj.12605
- Protz K, Heyer K, Dorler M, Stuecker M, Hampel-Kalthoff C, Augustin M. Compression therapy: scientific background and practical applications. J Dtsch Dermatol Ges, 2014; 12 (9): 794–801
- Protz K, Heyer K, Stücker M, Dörler M, Hampel-Kalthoff C, Augustin M. Kompressionstherapie – Kenntnisse und Anwendungspraxis – Eine deutschlandweite Erhebung des Wissensstands zur Kompressionstherapie und der von Anwendern im Praxistest erreichten Druckwerte. J Dtsch Dermatol Ges, 2015 (angenommen)
- Deutsche Gesellschaft für Phlebologie e. V. S3-Leitlinie „Diagnostik und Therapie des Ulcus cruris venosum“ (AWMF-Leitlinienregister Nr. 037/009). Stand: 01.08.2008 (in Überarbeitung), gültig bis 01.08.2013. http://www.awmf.org/uploads/tx_szleitlinien/037–009l_S3_Diagnostik_und_Therapie_des_Ulcus_cruris_venosum_abgelaufen. pdf (Zugriff am 27.10.2016)
- Robson MC, Cooper DM, Aslam R, Gould LJ, Harding KG, Margolis DJ, Ochs DE, Serena TE, Snyder RJ, Steed DL, Thomas DR, Wiersma-Bryant L. Guidelines for the treatment of venous leg ulcers. Wound Repair Regen, 2006; 14 (6): 649–662
- Robson MC, Cooper DM, Aslam R, Gould LJ, Harding KG, Margolis DJ, Ochs DE, Serena TE, Snyder RJ, Steed DL, Thomas DR, Wiersma-Bryant L. Guidelines for the treatment of venous leg ulcers. Wound Repair Regen, 2006; 14 (6): 649–662
- Keller A, Müller ML, Calow T, Kern IK, Schumann H. Bandage pressure measurement and training: simple interventions to improve efficiency in compression bandaging. Int Wound J, 2009; 6 (5): 324–330
- Jünger M, Ladwig A, Bohbot S, Haase H. Comparison of interface pressures of three compression bandaging systems used on healthy volunteers. J Wound Care 2009; 18 (11): 476–480
- Protz K, Heyer K, Stücker M, Dörler M, Hampel-Kalthoff C, Augustin M. Kompressionstherapie – Kenntnisse und Anwendungspraxis – Eine deutschlandweite Erhebung des Wissensstands zur Kompressionstherapie und der von Anwendern im Praxistest erreichten Druckwerte. J Dtsch Dermatol Ges, 2015 (angenommen)
- Augustin M, Brocatti LK, Rustenbach SJ, Schafer I, Herberger K. Cost-of-illness of leg ulcers in the community. Int Wound J, 2014; 11 (3): 283–292
- McGuckin M, Waterman R, Brooks J, Cherry G, Porten L, Hurley S, Kerstein MD. Validation of venous leg ulcer guidelines in the United States and United Kingdom. Am J Surg, 2002; 183 (2): 132–137
- Sachverständigenrat für die Konzertierte Aktion im Gesundheitswesen (SVR Gesundheit). Bedarfsgerechtigkeit und Wirtschaftlichkeit. Gutachten 2000/2001. http://www.svr-gesundheit.de/index. php?id=18 (Zugriff am 06.04.2014)
- Grol R, Grimshaw J. From best evidence to best practice: effective implementation of change in patients’ care. Lancet 2003; 362 (9391): 1225–1230
- Wollny A, Rieger MA, Wilm S. Inadequate reimbursement and the patients themselves may inhibit the implementation of guidelines. Evaluation of the venous leg ulcer guideline of the German Society of Phlebology (DGP) in general and phlebology practices. Z Evid Fortbild Qual Gesundhwes, 2009; 103 (7): 431–437