Einleitung
Aufgrund bedeutender Weiterentwicklungen im Bereich der Prothesenpassteile und der Erarbeitung wissenschaftlich fundierter Vorschriften für den Prothesenaufbau 1 2 ist es heute möglich, Beinamputierte mit funktionell hochwertigen Prothesen zu versorgen. Neben den Passteileigenschaften und dem Prothesenaufbau beeinflusst bekanntermaßen die Stumpfkonstitution die funktionelle Leistungsfähigkeit des Oberschenkelamputierten. Ein bedeutsamer Faktor ist hierbei die Stumpflänge, da eine zunehmende Verkürzung des Stumpfsegmentes mit dem zunehmenden funktionellen Ausfall von Muskelgruppen korreliert, was zu typischen muskulären Ungleichgewichtszuständen führt, die in der Literatur ausführlich beschrieben sind u. a. 3. Neben diesem muskelphysiologischen Problem stellt eine abnehmende Stumpflänge ebenfalls eine zunehmende Herausforderung an eine fachgerechte Schaftversorgung dar. Insbesondere kommt es bei kurzen Stümpfen durch die verminderte Weichteiloberfläche zu einer Reduzierung der Kontaktfläche zwischen Stumpf und Schaft, wodurch sich die Möglichkeiten der Kraftübertragung und damit der aktiven Steuerung der Prothese verringern.
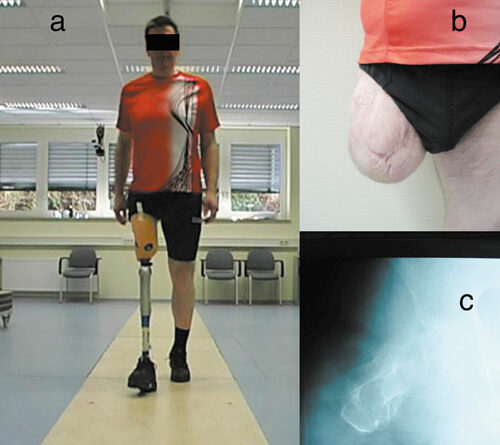
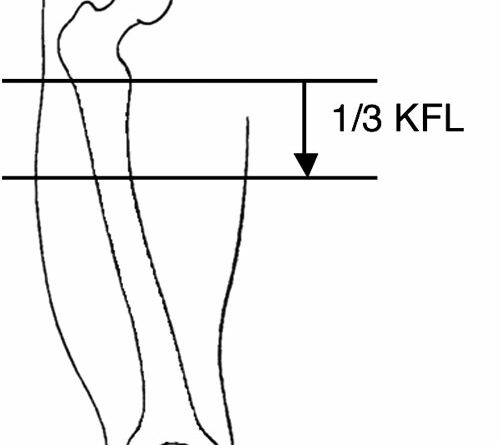
Im Allgemeinen wird davon ausgegangen, dass die beschriebenen Probleme ab einer Stumpflänge, die weniger als etwa ein Drittel der Länge des natürlichen Oberschenkelsegmentes beträgt, bei der Versorgung besonders berücksichtigt werden müssen 4 5. Außer vereinzelten Berichten zu möglichen Wechselwirkungen zwischen Stumpflänge und Eigenschaften der Prothesenkniegelenke 6 sind in der internationalen Literatur jedoch kaum Hinweise zu finden, wie sich die muskelphysiologischen Ungleichgewichte, die geänderten Hebelverhältnisse kurzer transfemoraler Stümpfe sowie die Besonderheiten der Schaftgestaltung auf biomechanische und metabolische Parameter des Gehens auswirken. Da die Kenntnis entsprechender Zusammenhänge weitere Optimierungsmöglichkeiten der Versorgungsqualität erwarten lässt, wird mit der vorliegenden Studie ein Beitrag zur Reduzierung dieses Defizits geleistet. Zu diesem Zweck wird eine Gruppe Oberschenkelamputierter mit kurzem transfemoralem Stumpf (Abb. 1) beim ebenerdigen Gehen in drei verschiedenen Geschwindigkeitsbereichen ganganalytisch untersucht. Zusätzlich werden metabolische Parameter des Gehens mit Hilfe eines Laufband-Tests ermittelt. Zur Selektion kurzer transfemoraler Stumpflängen wird die Definition der Bundesfachschule für Orthopädie-Technik (BUFA-Konvention) genutzt 7. Nach dieser sind femorale Stumpflängen, die kleiner als 33 % der Länge des kontralateralen Oberschenkelsegmentes sind, als „kurz“ zu deklarieren (Abb. 2).
Methoden
Patienten
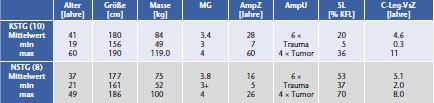
Insgesamt wurden 10 Oberschenkelamputierte (7 m, 3 w), deren Stumpflänge nach der subjektiven Einschätzung der versorgenden Orthopädie-Techniker gemäß 8 als „kurz“ einzuschätzen ist, untersucht. Dabei sind 9 der 10 Patienten im Alltag mit dem C‑Leg-Kniegelenksystem (Ottobock) versorgt. Ein Patient nutzt das 3R80-Kniegelenk (Ottobock), verfügt aber aus umfangreichen Tests über Erfahrungen mit dem C‑Leg. Zum Vergleich wurden die Daten einer anderen Patientengruppe (n = 8, 6 m, 2 w) mit mittleren bis langen Prothesenstümpfen, die alle aktive Nutzer des C‑Leg sind, herangezogen. Diese Gruppe hatte in einer vorhergehenden Untersuchung eine identische Testreihe absolviert 9. Die wichtigsten Patientendaten sind in Tabelle 1 zusammengefasst (Probandengruppe mit kurzem Stumpf: KSTG, Probandengruppe mit mittlerem bis langem Stumpf: NSTG).
Bestimmung der Stumpflängen
Bei allen Amputierten wurde die Länge des Oberschenkelstumpfes gemäß BUFA-Konvention als Distanz zwischen Tuber ossis ischii und Femurende im Stehen bestimmt. Hier bei kam ein spezieller Stumpflängen-Messschieber zur Anwendung, dessen anatomisch geformtes Ende direkt unter dem Tuber ossis ischii und der Schieber selbst am Femurende zu platzieren ist 10. Diese Länge wird prozentual zur mit der gleichen Messmethode bestimmten Länge des Oberschenkels der kontralateralen Seite angegeben (Distanz Tuber ossis ischii – Kniespalt). Die aus den Messungen resultierenden mittleren Stumpflängen sind ebenfalls in Tabelle 1 aufgelistet; mit einer Ausnahme entsprechen alle Stumpflängen gemäß BUFA-Konvention exakt der Zuordnung zu den Gruppen KSTG und NSTG.
Messtechnik
Prothesenaufbau
Der Prothesenaufbau wird mit Hilfe des Statik-Messgerätes L.A.S.A.R. Posture (Otto Bock, Duderstadt) objektiviert. Vor der Messung erfolgten in Einzelfällen geringfügige Korrekturen durch einen Meister für Orthopädie-Technik, sodass die Aufbauparameter für alle Amputierten der Gruppen KSTG und NSTG weitgehend den Vorgaben des Herstellers der Kniegelenke entsprachen.
Ganganalyse
Während der ebenerdigen Ganganalyse wurden die Bodenreaktionskräfte mit zwei Kraftmessplatten (Kistler, Winterthur, Schweiz; Messfrequenz 1 kHz) und die Kinematik der Bewegung mit einem optoelektronischen 6‑Kamera-System (Vicon Peak, Oxford, Großbritannien; Messfrequenz 120 Hz) erfasst. Dabei erfolgte die Verwendung eines Satzes von 17 passiven Markern, der in einer früheren Arbeit ausführlich beschrieben worden ist 11. Mit Hilfe der 3‑D-Koordinaten der Marker sind alle wichtigen kinematischen Größen bestimmbar. Durch die Synchronisierung beider Systeme ist es möglich, die an den großen Gelenken der unteren Extremität wirkenden externen Momente zu berechnen 12.
Metabolischer Energieverbrauch
Der metabolische Energieverbrauch wurde während eines standardisierten Tests auf einem Laufband (Enraf-Nonius, Rotterdam, Niederlande) mit dem System MetaMax 3B (Cortex, Leipzig) ermittelt. Dieses System bestimmt aus sensorischen Informationen (den Volumina der inspiratorischen und expiratorischen Atemluft sowie den Konzentrationen von O2 und CO2) den auf das Körpergewicht normierten Sauerstoffverbrauch pro Zeiteinheit („O2_Rate“), der unter definierten Versuchsbedingungen direkt mit dem metabolischen Energieverbrauch korreliert. Diese Sauerstoffverbrauchsrate kann weiter auf die Gehgeschwindigkeit normiert werden. Diesen normierten Wert, der interindividuelle Vergleiche unabhängig von der Geschwindigkeit gestattet, bezeichnet man als „Sauerstoffkosten“ („O2_Kosten“). Interpretierbar ist dies mit der konsumierten Sauerstoffmenge pro zurückgelegter Wegeinheit.
Versuchsdurchführung
Nachdem zu Beginn der ca. dreistündigen Messsitzung jeder Patient über Inhalt und Ablauf der Untersuchung informiert worden war, erfolgte zunächst die Erfassung des Prothesenaufbaus sowie dessen eventuelle Korrektur mit Hilfe des Gerätes L.A.S.A.R. Posture. Die konkreten den Aufbau beschreibenden Kennwerte können in einer früheren Arbeit nachgelesen werden 13. Anschließend absolvierten die Patienten eine ca. 20-minütige Gewöhnungsphase an das Gehen auf dem Laufband. Währenddessen erfolgte die individuelle Festlegung der Geschwindigkeiten für den Test zur Messung des Sauerstoffverbrauchs.
Nach einer ca. 15-minütigen Erholungsphase wurden nachfolgend die ebenerdigen Ganganalysen zur Ermittlung der biomechanischen Parameter durchgeführt. Dabei erhielten die Patienten die Anweisung, nacheinander jeweils 8 bis 12 Teilversuche in selbstgewählter mittlerer, verringerter und erhöhter Gehgeschwindigkeit zu absolvieren. Abschließend wurde der Sauerstoffverbrauch während des Gehens auf dem Laufband gemessen. Hierzu gingen die Patienten entsprechend den Festlegungen der Eingewöhnungsphase nacheinander jeweils 5 Minuten in mittlerer (2.5 … 3.8 km/h), um 20 % verringerter (2.0 … 3.0 km/h) und um 20 % erhöhter (3.0 … 4.6 km/h) Gehgeschwindigkeit.
Datenaufbereitung
Aus den Einzelversuchen der ebenerdigen Ganganalyse wurden für jeden biomechanischen Parameter gangzyklusnormierte Mittelwerte gebildet. Aus diesen individuellen Verläufen erfolgte nachfolgend die Bildung der Gruppenmittel für KSTG und NSTG. Bezüglich der metabolischen Parameter wurden für diese individuelle Mittelwerte in der jeweiligen letzten Minute der fünfminütigen Testabschnitte (Phase des „steady state“) berechnet, welche ebenfalls die Grundlage für Gruppenmittelwerte zum Vergleich von KSTG und NSTG darstellten. Ausgezeichnete Peaks der biomechanischen Größen, die gemittelten Zeit-Distanz-Parameter und die metabolischen Gruppenmittelwerte wurden mit dem U‑Test (Mann/Whitney) hinsichtlich statistisch signifikanter Differenzen zwischen KSTG und NSTG geprüft.
Um zu testen, ob eine direkte Abhängigkeit der Stumpflänge von den in dieser Studie erhobenen biomechanischen und metabolischen Parametern besteht, wurden die Korrelationskoeffizienten der jeweiligen linearen Regression bei Berücksichtigung aller Werte der Gruppen KSTG und NSTG bestimmt.
Resultate
Zeit-Distanz-Parameter
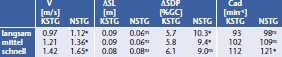
Die Gehgeschwindigkeit von KSTG ist im Gruppenmittel in allen drei untersuchten Geschwindigkeitsbereichen niedriger als bei NSTG. Die Differenzen, die signifikant sind, betragen 0.15 m/s (niedrige und mittlere Geschwindigkeit) sowie 0.23 m/s (hohe Geschwindigkeit; Tab. 2).
Hinsichtlich der Kadenz wurden bei KSTG durchgängig niedrigere Werte gemessen, wobei hier nur die Differenz der Mittelwerte bei der hohen Geschwindigkeit signifikant ist (Tab. 2).
Die Asymmetrie der Schrittlängen, also die Differenz der Werte für Prothesen- und kontralaterale Seite, ist für KSTG im Vergleich mit NSTG um 0.03 m (niedrige und mittlere Geschwindigkeit) und um 0.02 m (hohe Geschwindigkeit) in der Tendenz, aber ohne statistischen Nachweis, erhöht (Tab. 2). Prinzipiell ergeben sich diese unterschiedlichen Relationen beider Gruppen aus deutlich verkürzten Schrittlängen für die prothesenseitigen Schritte bei KSTG. Die Asymmetrie der Dauer der Standphase ist für KSTG mit größer werdender Geschwindigkeit zunehmend erhöht, wobei hier die Differenzen zu NSTG bei niedriger und mittlerer Geschwindigkeit signifikant sind. Dieser Effekt wird hauptsächlich durch deutlich verlängerte Standphasenzeiten der kontralateralen Extremität bei KSTG verursacht.
Bodenreaktionskraft
Die prinzipielle Struktur der Vertikal- und Horizontalkomponente der Bodenreaktionskraft ist für beide untersuchten Gruppen in Abbildung 3 a, b anhand der mittleren Gehgeschwindigkeit exemplarisch dargestellt. Die Maximalwerte der prothetischen Extremität sind im Vergleich mit der kontralateralen Seite in der bekannten Art und Weise für beide Gruppen verringert. Die quantitative Analyse ausgezeichneter Maximalwerte zeigt für KSTG im Vergleich mit NSTG bei der Vertikalkomponente die Tendenz von mit steigender Geschwindigkeit zunehmend verringerten Maxima und verzögerten Kraftanstiegen, was jedoch statistisch nicht signifikant ist. Die prothesenseitigen Horizontalkräfte weisen für die Bremskräfte im ersten Teil der Standphase reduzierte Werte für KSTG auf. Dieser Effekt nimmt mit steigender Geschwindigkeit zu und ist für die mittlere und hohe Geschwindigkeit signifikant. Die Horizontalkraftmaxima (Beschleunigungskräfte im zweiten Teil der Standphase) sind für KSTG ohne statistischen Beleg tendenziell reduziert.
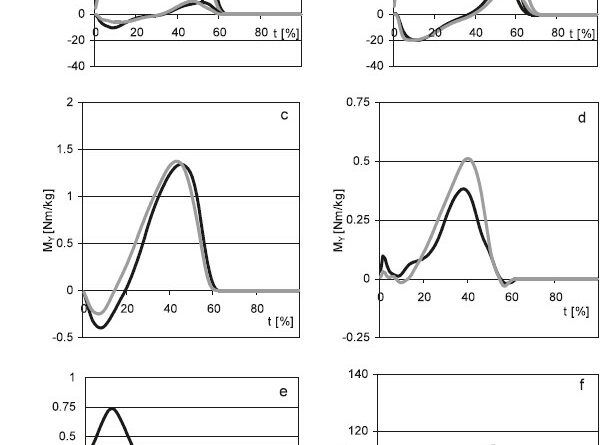
Biomechanische Charakteristik des Knöchel und Kniegelenks
Bei den prothesenseitigen Charakteristiken des Knöchelgelenks sind das initiale plantarflektierende Moment (lokales Minimum bei ca. 10 % Gangzyklus) und die initiale Plantarflexion des Prothesenfußes für KSTG signifikant verringert, wobei sich diese Differenzen bei steigender Gehgeschwindigkeit vergrößern (Abb. 3c). Für alle anderen biomechanischen Parameter sind im Gruppenvergleich keine signifikanten Unterschiede nachweisbar. Am kontralateralen OSG sind das dorsalextendierende Moment (Maximum bei ca. 40 % Gangzyklus) sowie Dorsalextension und finale Plantarflexion für NSTG tendenziell, aber ohne signifikanten Beleg vergrößert. Alle anderen biomechanischen Parameter des Knöchelmoments zeigen keine auffälligen Differenzen.
Am Prothesenkniegelenk von KSTG wirken ohne systematische Geschwindigkeitsabhängigkeit in der zweiten Standphasenhälfte höhere Extensionsmomente, wobei nur die Differenz von 0.12 Nm/kg bei der mittleren Geschwindigkeit signifikant ist (Abb. 3d, rechts). Dieser Effekt ist ohne klare Geschwindigkeitsabhängigkeit.
Biomechanische Charakteristik des Hüftgelenks
Die in Abb. 3e, f für die mittlere Geschwindigkeit dargestellten mittleren Hüftmomente und Flexions-Extensionswinkel des Oberschenkelsegmentes veranschaulichen typische prothesenseitige Differenzen zwischen beiden untersuchten Gruppen.
Die Maxima der Momente im ersten Standphasenteil sind für KSTG drastisch und signifikant reduziert. Die Unterschiede steigen von einer 50-prozentigen Reduktion bei geringer Geschwindigkeit auf eine Verringerung um 53 % bei hoher Geschwindigkeit. Die Minima im letzten Abschnitt der Standphase sind für KSTG ebenfalls reduziert, wobei hier die Differenzen mit steigender Geschwindigkeit abnehmen. Diese Unterschiede sind für die geringe und mittlere Geschwindigkeit signifikant.
Aus der kinematischen Analyse folgt, dass das Stumpfsegment von KSTG bis zur maximalen Extension einen durchgängig signifikant größeren Extensionswinkel aufweist. Diese Unterschiede sind geschwindigkeitsunabhängig und nehmen von etwa 7° bei Standphasenbeginn auf etwa 4° zum Zeitpunkt der maximalen Extension ab.
Metabolischer Energieverbrauch
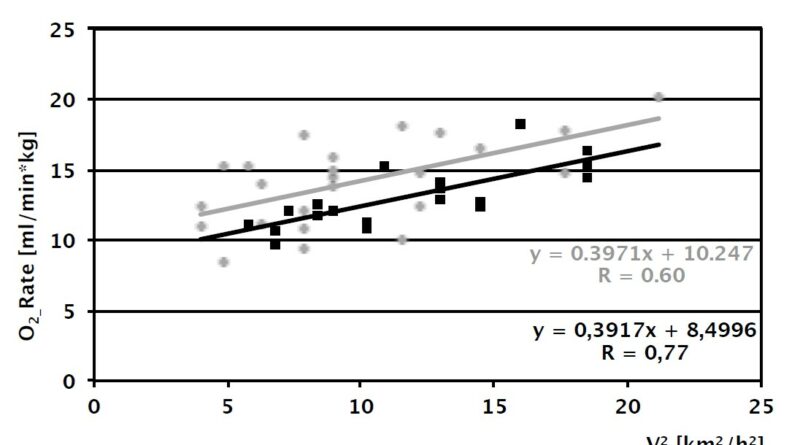
Die in den drei Geschwindigkeitsbereichen ermittelten Sauerstoffverbrauchsraten weisen für beide Gruppen die bekannte lineare Abhängigkeit vom Quadrat der Gehgeschwindigkeit auf 14 (Abb. 4a). Aus dem Verlauf der Regressionsgeraden folgt, dass KSTG im für Amputierte relevanten Geschwindigkeitsbereich zwischen 2 und 5 km/h einen um etwa 15 % erhöhten Verbrauch aufweist. Die berechneten Sauerstoffkosten zeigen erhöhte mittlere Werte für KSTG in allen drei Geschwindigkeitsbereichen (0.314 vs. 0.255 ml/kg*m für die niedrige, 0.279 vs. 0.231 ml/kg*m für die mittlere sowie 0.262 vs. 0.220 ml/ kg*m für die hohe Geschwindigkeit). Diese Differenzen der Gruppenmittel sind nicht signifikant, erscheinen jedoch eindeutig in der Tendenz.
Einfluss der Stumpflänge auf biomechanische und metabolische Parameter
Bezüglich der biomechanischen Parameter ist für die Gesamtgruppe für die prothesenseitigen Kennwerte des Hüftgelenkes eine klare Stumpflängenabhängigkeit nachweisbar. Das in der ersten Standphasenhälfte extern wirkende Flexionsmoment steigt mit der Stumpflänge an. Die Oberschenkelsegmentwinkel nehmen mit zunehmender Stumpflänge systematisch ab. Für alle anderen biomechanischen Parameter ist keine direkte Stumpflängenabhängigkeit nachweisbar.
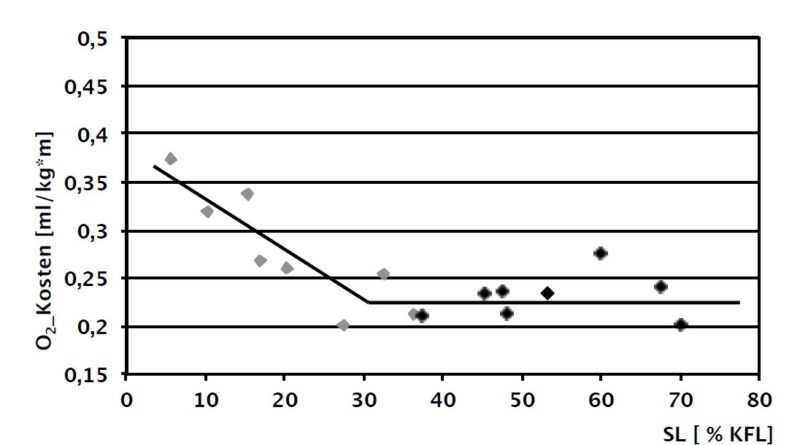
Der Test der Stumpflängenabhängigkeit der metabolischen Größen zeigt eine bei den mechanischen Parametern nicht beobachtete Spezifik. Demnach steigen die Sauerstoffkosten mit abnehmender Stumpflänge an, jedoch ergeben sich beim Test der Einzelgruppen KSTG und NSTG höhere Korrelationskoeffizienten für KSTG im Vergleich mit der Gesamtgruppe. Dagegen ist für NSTG keine Stumpflängenabhängigkeit feststellbar. Auf der Basis dessen ist in Abbildung 4 b die Regressionsgerade für KSTG und die Mittelwertsgerade für NSTG exemplarisch für die mittlere Geschwindigkeit angegeben. Der Schnittpunkt zwischen beiden Geraden wurde jeweils bei einer Stumpflänge von 30.3 % (geringe Geschwindigkeit), 30.2 % (mittlere Geschwindigkeit) und 32.0 % (hohe Geschwindigkeit) identifiziert.
Diskussion
Die in dieser Studie untersuchte oberschenkelamputierte Patientengruppe mit einer mittleren Stumpflänge von 20 % der femoralen Vergleichslänge der kontralateralen Seite weist hinsichtlich der anthropometrischen Daten, des Mobilitätsgrades und der biomechanischen Bewertung des Prothesenaufbaus große Übereinstimmungen mit den Daten der Vergleichsgruppe (mittlere Stumpflänge 53 % der femoralen Vergleichslänge der kontralateralen Seite) auf. Somit erscheint es gerechtfertigt, die Gruppenmittelwerte ohne Berücksichtigung dieser wichtigen Randbedingungen zu diskutieren.
Die ganganalytischen Daten belegen, dass die anatomisch-physiologischen Besonderheiten kurzer transfemoraler Stümpfe wichtige Parameter des Ganges Oberschenkelamputierter in charakteristischer Weise verändern. Auffälligstes kinematisches Merkmal ist die gestrecktere Positionierung des prothesenseitigen Oberschenkelsegmentes. Ein Erklärungsansatz für diesen Befund kann in der mit abnehmender Stumpflänge größer werdenden Femurrelativbewegung im Weichteilmantel gesehen werden. Diese erhöht die Stumpf-Schaft-Pseudarthrose und erschwert somit die Möglichkeiten der aktiven Steuerung des Prothesensystems mit Hilfe des Stumpfes. Eine wesentliche Auswirkung dessen ist die ebenfalls gemessene deutlich reduzierte prothesenseitige Schrittlänge, die in unmittelbarem Zusammenhang mit der gestreckteren Positionierung des Oberschenkelsegmentes bei Standphasenbeginn zu sehen ist. Die in dieser Weise geänderte Motorik scheint des Weiteren zu der gemessenen Verringerung der bremsenden Horizontalkraft nach Standphasenbeginn, zur verminderten initialen Plantarflexion des Prothesenfußes und zur Verringerung des initial wirkenden plantarflektierenden Drehmomentes am prothesenseitigen Knöchelgelenk zu führen. Diese stumpflängenspezifischen Modifikationen erscheinen in ihrer Gesamtheit als zweckmäßig, um bei den reduzierten Möglichkeiten der Stumpfsteuerung ausgeprägte Knieflexionsmomente, die erhöhte muskuläre Kompensationen erfordern würden, vermeiden zu können.
Die bei KSTG gemessene drastische Reduktion des extern wirksamen Hüftmoments, welches sowohl das Flexionsmoment im ersten Standphasenteil als auch das Extensionsmoment im zweiten Standphasenteil betrifft, beträgt teilweise über 50 %. Zu dieser Reduktion tragen die oben diskutierten verschlechterten Möglichkeiten der Stumpfsteuerung sowie die amputationsbedingt verringerten Muskelfunktionen bei. Die Reduktion des Momentes aufgrund verringerter Muskelfunktionen scheint dabei beim initialen extern wirkenden Flexionsmoment relativ groß zu sein. Der hier wichtigste Muskel des zu erzeugenden kompensatorischen Extensionsmoments, der M. gluteus maximus, strahlt in den Tractus iliotibialis ein, setzt großflächig an der Tuberositas glutae an 15 16 und wird somit bei den meisten Amputierten von KSTG nur eingeschränkt zur Wirkung kommen können. Für die Reduktion des externen Extensionsmomentes hingegen scheint eine verminderte Muskelfunktion eine nur untergeordnete Rolle zu spielen, da der kompensatorisch wirkende Hüftflexor M. iliopsas in den meisten Fällen in seiner Funktion durch die Amputation auch bei KSTG nicht beeinträchtigt ist.
Die mit Hilfe der Einzelwerte beider Gruppen durchgeführten Korrelationsrechnungen zeigen zudem, dass die kinematischen Charakteristiken des Oberschenkelsegmentes und das in der ersten Standphasenhälfte wirkende Hüftmoment eine prinzipielle Stumpflängenabhängigkeit aufweisen. Dieser Befund korreliert mit MRT-Untersuchungen zu morphologischen Muskeleigenschaften, wonach die Atrophie der nach einer Amputation funktionell verbliebenen Muskulatur mit abnehmender Stumpflänge prinzipiell signifikant zunimmt 17. Diese Atrophie wird u. a. den sich mit abnehmender Stumpflänge verschlechternden Bedingungen für die Möglichkeiten der Kraftübertragung vom Stumpf auf den Schaft zugeschrieben 18 und trägt somit vermutlich ebenfalls zu der hier für die Phase der Lastübernahme und die nachfolgende Einbeinstandphase nachgewiesenen Veränderung der Motorik bei.
Die prothesenseitigen biomechanischen Charakteristiken von Knie- und Knöchelgelenk belegen, dass die Stumpflänge für die von den Amputierten in dieser Untersuchung benutzten Passteilkonfiguration ohne jegliche Relevanz ist, was bereits in einer früheren Arbeit im Detail nachgewiesen wurde 19. Die in der zweiten Standphasenhälfte ausnahmslos wirkenden prothesenseitigen Knieextensionsmomente bedingen eine in dieser Phase vollständig extendierte Gelenkposition. Des Weiteren weist das Maximum des extern wirkenden dorsalextendierenden Knöchelmoments von KSTG im Vergleich mit NSTG geschwindigkeitsunabhängig keine signifikante Reduktion auf. Aus konstruktiver Sicht ist das simultane Auftreten der Knieextension mit dem Erreichen eines individuell einstellbaren dorsalextendierenden Knöchelmoments die Bedingung für eine optimale Funktion des Kniepassteils C‑Leg, insbesondere für den knieinternen Umschaltprozess vom Standphasen- in den Schwungphasenmodus 20. Somit können frühere Aussagen, wonach die Funktion des Prothesenkniegelenks C‑Leg bei der Versorgung von Kurzstümpfen nur eingeschränkt gegeben ist 21, nicht bestätigt werden.
Die Ergebnisse der metabolischen Energieverbrauchsmessung erweitern das bisher bekannte Wissen zu dieser physiologischen Charakteristik des Ganges Beinamputierter. Allgemein anerkannt ist, dass der Energieverbrauch mit zunehmendem Amputationsniveau systematisch ansteigt 22. Aus einer detaillierten Literaturanalyse folgt dabei, dass man im Mittel bei Unterschenkelamputierten von einem ca. 25-prozentigen und bei Oberschenkelamputierten von einem ca. 60- bis 65-prozentigen Mehrverbrauch im Vergleich mit Nichtamputierten ausgehen muss 23. Untersuchungen zur Stumpflängenabhängigkeit des Energieverbrauchs existieren nach Kenntnis der Autoren nur für Unterschenkelamputierte und erbrachten keine 24 oder nur schwache 25 Hinweise auf Korrelationen zwischen beiden Größen.
Die Ergebnisse der vorliegenden Studie belegen, dass es bei Oberschenkelamputierten offenbar eine „kritische“ Stumpflänge gibt, unterhalb derer mit einem systematischen Anstieg des Energieverbrauchs gerechnet werden muss. Der für diese Stumpflänge ermittelte Wert von ca. 30 % der kontralateralen transfemoralen Länge bestätigt die in dieser Studie genutzte Konvention zur Klassifikation von kurzen transfemoralen Stümpfen 26 aus energetischer Sicht und zeigt, dass die beschriebenen muskelphysiologischen, mechanischen und orthopädietechnischen Probleme der Versorgung von kurzen transfemoralen Stümpfen vermutlich erhebliche kompensatorische Aktivitäten der Patienten erfordern. Die detaillierte Analyse derartiger Kompensationsbewegungen sollte Gegenstand weiterführender Untersuchungen sein.
Für die Autoren:
Dr. Thomas Schmalz
Otto Bock HealthCare GmbH
Max-Näder-Str. 15
37115 Duderstadt
thomas.schmalz@ottobock.de
Begutachteter Beitrag/reviewed paper
Schmalz T, Bellmann M, Braun J, Blumentritt S. Einfluss der Stumpflänge Oberschenkelamputierter auf biomechanische und metabolische Gangparameter. Orthopädie Technik, 2015; 66 (3): 34–40
- Easypreg – ein Faserverbundwerkstoff zum Tiefziehen — 9. März 2026
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Ottobock Healthcare GmbH. Instruction for alignment of transfemoral prostheses, order number 646F219=GB/3, 2008
- Blumentritt S. A new biomechanical method for determination of static prosthetic alignment. Prothet Orthot Int, 1997; 21: 107–113
- Baumgartner R, Botta P. Amputation und Prothesenversorgung der unteren Extremität. Stuttgart: Enke, 2007
- Scheibe G. Zur Bewertung von Kurzstümpfen. Arch Orthop Unfall Chir, 1970; 68: 261–269
- Gottschalk F. Transfemoral amputation. Clin Orthop Rel Res, 1991; 361: 15–22
- Veltmann U, Wühr J, Linkemeyer L, Wetz H. C‑Leg and Rheo-Knee: Are they interchangeable? In: 12th World Congress of the International Society of Prosthetics and Orthotics a Abstracts. Vancouver, Canada, 2007: 285
- Leitlinie: Trans-Femoral Prothesen. Dortmund: Bundesfachschule für Orthopädietechnik, 2003
- Leitlinie: Trans-Femoral Prothesen. Dortmund: Bundesfachschule für Orthopädietechnik, 2003
- Bellmann M, Blumentritt S, Schmalz T. Comparative biomechanical analysis of current microprocessor-controlled prosthetic knee joints. Arch Phys Med Rehabil, 2010; 91: 644–652
- Braun J. Biomechanische Untersuchungen zur Indikation des Kniegelenksystems C‑Leg bei der prothetischen Versorgung Amputierter mit kurzen transfemoralen Stümpfen. Thesis, University of Applied Sciences Münster, 2008
- Schmalz T, Blumentritt S, Drewitz H, Freslier M. The influence of sole wedges on frontal plane knee kinetics, in isolation and in combination with representative rigid and semi-rigid ankle-foot-orthoses. Clinical Biomechanics, 2006; 21 (6): 631–639
- Schmalz T, Blumentritt S, Drewitz H, Freslier M. The influence of sole wedges on frontal plane knee kinetics, in isolation and in combination with representative rigid and semi-rigid ankle-foot-orthoses. Clinical Biomechanics, 2006; 21 (6): 631–639
- Blumentritt S, Braun J, Bellmann M, Schmalz T. Zur Indikation des Kniegelenksystems C‑Leg bei der prothetischen Versorgung Amputierter mit kurzen transfemoralen Stümpfen. Med Orth Tech, 2009; 129 (5): 61–74
- Schmalz T, Blumentritt S, Jarasch R. Energy expenditure and biomechanical characteristics of lower limb amputee gait: The influence of prosthetic alignment and different prosthetic components. Gait Posture, 2002; 16: 255–263
- Putz R, Pabst R. Sobotta, Atlas der Anatomie des Menschen. Band 2. 22. Auflage. München: Urban & Fischer, 2006
- Schiebler T. Anatomie. 9. Auflage. Stuttgart: Springer, 2007
- Jaegers S, Arendzen J, De Jongh H. Changes in hip muscles after above-knee amputation. Clin Orthop Rel Res, 1995; 319: 276–284
- Jaegers S, Arendzen J, De Jongh H. Changes in hip muscles after above-knee amputation. Clin Orthop Rel Res, 1995; 319: 276–284
- Blumentritt S, Braun J, Bellmann M, Schmalz T. Zur Indikation des Kniegelenksystems C‑Leg bei der prothetischen Versorgung Amputierter mit kurzen transfemoralen Stümpfen. Med Orth Tech, 2009; 129 (5): 61–74
- Blumentritt S, Braun J, Bellmann M, Schmalz T. Zur Indikation des Kniegelenksystems C‑Leg bei der prothetischen Versorgung Amputierter mit kurzen transfemoralen Stümpfen. Med Orth Tech, 2009; 129 (5): 61–74
- Veltmann U, Wühr J, Linkemeyer L, Wetz H. C‑Leg and Rheo-Knee: Are they interchangeable? In: 12th World Congress of the International Society of Prosthetics and Orthotics a Abstracts. Vancouver, Canada, 2007: 285
- Waters R, Mulroy S. The energy expenditure of normal and pathological gait. Gait and Posture, 1999 (9): 207–231
- Schmalz T, Blumentritt S, Jarasch R. Energy expenditure and biomechanical characteristics of lower limb amputee gait: The influence of prosthetic alignment and different prosthetic components. Gait Posture, 2002; 16: 255–263
- Gonzales E, Corcoran P, Reyes R. Energy expenditure in below-knee amputees: correlation with stump length. Arch Phys Med Rehabil, 1974; 55: 111–119
- Gailey R, Wenger M, Raya M, Kirk N, Erbs K, Spyropoulos P, Nash M. Energy expenditure of trans-tibial amputees during ambulation at self-selected pace. Prosthet Orthot Int,1994; 18: 84–91
- Veltmann U, Wühr J, Linkemeyer L, Wetz H. C‑Leg and Rheo-Knee: Are they interchangeable? In: 12th World Congress of the International Society of Prosthetics and Orthotics a Abstracts. Vancouver, Canada, 2007: 285