Zusätzlich war die Indikation für die Operation, möglichst schmerzhafte Nervennarben durch die Umleitung der Nerven positiv zu beeinflussen. Das Studienergebnis hat gezeigt: Aufgrund der neuronalen Verbindung fühlt der Patient mittels einer Rückmeldeelektronik an der Sohle des Prothesenfußes und erkennt so die Beschaffenheit des Bodens sowie Hindernisse besser. Der wiederhergestellte Informationstransfer trägt auch zur natürlicheren Integration der Prothese in das Körperbild des Patienten bei und hat zum Verschwinden der jahrelangen Schmerzen geführt.
Fallbeschreibung
Der Patient W. R. (54) stand bis zum Jahr 2007 mitten im Berufsleben. Der Diplompädagoge hatte gerade Unterricht in einem Gymnasium, als er plötzlich auftretende Wahrnehmungsstörungen verspürte. Nachdem diese rasant zunahmen, war ihm klar, dass es sich um einen Notfall handelte und er so rasch als möglich in ein Krankenhaus gebracht werden musste. Dass sein entschlossenes Handeln richtig war und es sich sogar um einen Wettlauf mit der Zeit handelte, wurde dem 54-Jährigen im Krankenhaus bestätigt: Die Bildgebung zeigte eine Hirnblutung von bereits 3 × 3 cm Raumforderung. Nach der intensivmedizinischen Versorgung wurde der Patient in ein anderes Krankenhaus verlegt und dort weiterbehandelt. Nach mehreren Operationen besserte sich sein Zustand relativ schnell. Der Genesungsverlauf erfuhr jedoch eine dramatische Wende, als sich vor der Entlassung eine Thrombose im Beinbereich festsetzte. Die Behandlung des Blutgerinnsels erwies sich als äußerst schwierig und forderte am Ende ihren Preis: die Amputation des rechten Unterschenkels. Nach einer Standard-Prothesenversorgung folgten intensive Therapien in verschiedenen Reha-Kliniken.
„Besonders schlimm waren für mich die Schmerzen. Zuerst verspürte ich sie, sobald ich die Prothese anlegte. Später wurden sie stärker und ließen auch dann nicht mehr nach, nachdem ich die Prothese am Abend ablegte. Zum Schluss hatte ich starke Schmerzen auch in der Nacht.“
Zur Schmerztherapie wurden dem Patienten zuletzt täglich intravenös Opiate verabreicht. Ausgedehnte Schlafstörungen – nur ca. 2 bis 3 Stunden Schlaf täglich – machten die Ausübung seines Berufes unmöglich. Doch die Hoffnung auf ein beschwerdefreies Leben ohne starke Schmerzmittel gab der Patient nie auf. In diesem Zusammenhang nutzte er auch alternative Methoden wie etwa Spiegeltherapie, Elektrostimulation oder Autogenes Training. Er schien darauf allerdings nicht anzusprechen, sodass er sich nach weiteren Möglichkeiten erkundigte und bei einem Gruppentreffen der Selbsthilfegruppe „Leben mit Amputation“ von einem Forschungsprojekt an der Fachhochschule Oberösterreich und der Universitätsklinik Innsbruck erfuhr. In diesem Projekt werden bei Menschen mit Gliedmaßen-Amputationen abgetrennte Nervenenden chirurgisch umgelagert und in eine Interaktion mit modernen bionischen Prothesen eingebunden. Nach mehreren Gesprächen und medizinischen Voruntersuchungen am Universitätsklinikum Innsbruck entschied sich der Schmerzpatient schließlich für die Teilnahme am Forschungsprojekt.
„Jetzt bin ich wieder mobil und komme ganz ohne Schmerztherapie aus. Mein nächstes Ziel ist es, wieder eine Arbeit zu finden“, schildert der Patient seine Situation heute.
Chirurgische Umlagerung von Nervenstümpfen
Über motorische Nervenbahnen werden einerseits Informationen von der „Schaltzentrale“ Gehirn zum Körper geleitet, andererseits leiten sensorische Nervenbahnen Informationen vom Körper zum Gehirn. Der somatische Anteil des sensorischen Nervensystems nimmt Informationen wie zum Beispiel Berührungen, Temperaturempfindungen oder Schmerzreize von der Umwelt auf und leitet sie an das Gehirn, den Ort der bewussten Wahrnehmung, weiter.
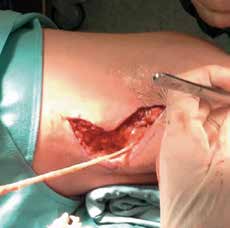
Bei Menschen mit Gliedmaßen-Amputationen sind somatosensorische Nerven abgetrennt. Obwohl die im Körper verbleibenden Nervenreste intakt sind, nehmen sie keine Informationen mehr auf. Am Nervenende bildet sich eine häufig schmerzhafte Nervennarbe („Neurom“). Innerhalb der kortikalen Repräsentanz des betroffenen Gliedes kommt es durch das Fehlen der sensorischen Information zu einer Art Überkompensation mit im Gehirn autonom generierten Signalen, die zu Phantomschmerzen führen können 1 2 3 4 5. Beim Patienten bestand die Indikation für die Operation, schmerzhafte Nervennarben (Neurome) durch die operative Freilegung und Umleitung von Hautnerven möglichst positiv zu beeinflussen (Abb. 1). Bereits in der UltraschallBildgebung zeigte sich, dass ein Neurom im Bereich des N. peroneus vorhanden war und ein Eingriff am N. suralis zur Umleitung sinnvoll erschien.
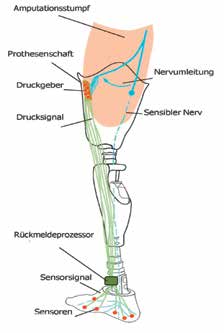
Neben der Behandlung des Neuroms mittels besserer Weichteildeckung für den N. suralis, der im Unterschenkel in der Rinne zwischen den Köpfen des Musculus gastrocnemius nach kaudal verläuft, wurde eine Umlagerung und Reinnervation geplant („Targeted Sensory Reinnervation“) und durchgeführt. Da dieser Nerv den lateralen Fußrand und die Ferse sensibel versorgt, ist er für die Interaktion, in diesem Fall für die Aufnahme sensorischer Informationen aus der Fußprothese, geeignet. Grundsätzliche Erfahrungen mit der Umlagerung motorischer Nervenenden an der oberen Extremität zur verbesserten Ansteuerung von Armprothesen bestehen bereits seit etwa einem Jahrzehnt 6 7. Die Umlagerung sensorischer Nervenenden an der oberen Extremität für Fühlfunktionen an Handprothesen wird ebenso versucht 8 9. Umlagerungserfahrungen hinsichtlich sensorischer Nervenenden im Beinbereich für die Interaktion mit bionischen Beinprothesen liegen hingegen nicht vor. Daher mussten in der präoperativen Planung Fragen über die konkrete Durchführung der Nervenumlagerung immer wieder abgewogen und Entscheidungen unter Berücksichtigung versorgungstechnischer Aspekte erst während der Operation getroffen werden. Für die Reinnervation eines Hautareales im Amputationsstumpf wurde der N. saphenus verwendet. Aufgrund seines Versorgungsgebiets – die Haut an der medialen Seite des Unterschenkels – ist dieser Nerv aus versorgungstechnischer Hinsicht für die Aufnahme sensorischer Informationen aus der Fußprothese geeignet. Zudem spricht auch sein Durchmesser für seine Verwendung, da er mit dem des N. suralis vergleichbar ist und so gut mit dem distalen Anteil des N. saphenus verbunden werden kann (Abb. 2).
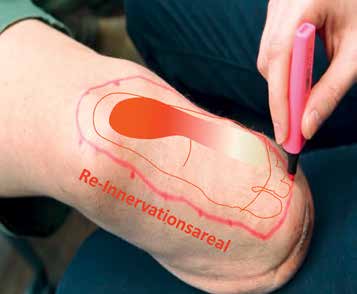
Die Reinnervation setzte beim Patienten erwartungsgemäß etwa fünf Monate postoperativ im Fersenbereich ein (Abb. 3). Das aufgrund der Durchtrennung des N. saphenus taube mediale Areal des Unterschenkels – das Reinnervationsareal – wird nun nicht mehr vom N. saphenus, sondern zunehmend vom ursprünglich den Fußbereich versorgenden N. suralis versorgt. Daher spürt der Patient im Reinnervationsareal zunehmend Bereiche des Fußes und nicht mehr des medialen Unterschenkels. Grund für die nicht sofort nach der OP einsetzende Reinnervation ist der Regenerationsweg von ca. 15 cm, den der N. suralis zurücklegen muss, um bei seiner natürlichen Regenerationsrate von ca. 1 mm pro Tag das Reinnervationsareal zu erreichen. Das neu geschaffene sensible Fußareal am medialen Unterschenkel kann so zur Aufnahme sensorischer Informationen aus der Fußprothese herangezogen werden. Die in den Nervenenden erzeugten elektrischen Signale (Aktionspotenziale) werden sodann wie bei einem natürlichen Fuß zum Gehirn geleitet. Sie stellen reale Informationen des Fußes dar, die nicht mehr von autonom generierten Signalen kompensiert werden müssen.
Sensorische Rückmeldung von der Fußprothese
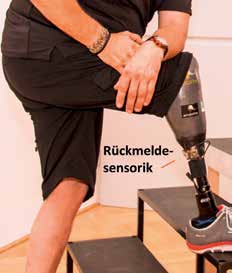
Ohne sensorische Rückmeldung wird der Bodenkontakt durch die Übertragung der Körperlast am Amputationsstumpf wahrgenommen. Hindernisse oder Unebenheiten wie zum Beispiel Bordsteinkanten werden auf diese Weise eher spät erkannt. Insbesondere ältere Menschen berichten oft von einer Unsicherheit und latenten Angst zu stürzen. Sie sind daher gezwungen, ihre Prothese im Blickfeld zu behalten, um sich bei jedem Schritt ein Bild von den Bodenverhältnissen zu machen, noch bevor sie ihr Körpergewicht auf die Prothese verlagern. Es kann angenommen werden, dass eine sensorische Rückmeldung in Anlehnung an den natürlichen Fuß auch ohne erhöhte visuelle Aufmerksamkeit zu einer verbesserten Trittsicherheit führt. Zu diesem Zweck messen Sensoren an der Prothesensohle den Bodenkontakt bzw. die Abrollbewegung. Die Sensorsignale werden sodann zum Eingang eines Rückmeldeprozessors geleitet, der an seinem Ausgang wiederum Aktoren (künstliche Reizgeber) ansteuert. Die Aktoren können Kraft- oder Vibrationsgeber sein, welche die Sensorsignale wiedergeben und damit den Bodenkontakt und die Abrollbewegung der Fußprothese möglichst authentisch auf das Reinnervationsareal übertragen. Damit empfängt der Prothesenträger im Gehirn Informationen des Prothesenfußes: Er fühlt durch den umgelagerten sensiblen Fußnerv den Bodenkontakt sowie die Abrollbewegung im Bereich des natürlichen Fußes (Abb. 4).
Technische Realisierung der sensorischen Rückmeldung
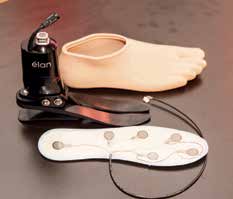
Zur Aufnahme der Sensorinformationen von der Fußprothese wurde eine Sensorsohle konstruiert, die zwischen Prothesenschuh und Fußprothese eingelegt werden kann (die Sensorsohle ist unabhängig von der verwendeten Prothese und dem Prothesenschuh). Nicht nur, um die technische Lösung möglichst einfach zu halten, sondern auch, um die Rückmeldungen des Patienten gut zuordnen zu können, wurde die Sensorzahl nach dem Prinzip „So wenige wie möglich, so viele wie nötig“ festgelegt. Eine Gruppe, bestehend aus 30 beinamputierten Menschen der Selbsthilfegruppe „Leben mit Amputation“ im Alter von 30 bis 60 Jahren, einigte sich auf insgesamt sechs Sensoren. Dabei wurde ein Sensor im Fersenbereich und fünf Sensoren randständig entlang der Sensorsohle platziert (Abb. 5).
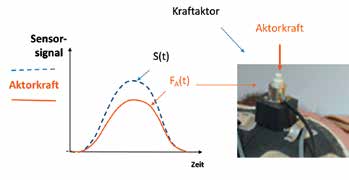
Beim Gehen auf ebenem Boden registriert der Fersensensor den Fersenkontakt. Das führt zur Wahrnehmung des wichtigen Erstkontakts der Prothese am Boden, während die anderen Sensoren der Reihe nach zum Zehenbereich ansprechen und damit die Abrollbewegung detektieren. Mit ihrer randständigen Platzierung sollen vor allem Hindernisse im Innen- und Außenbereich der Fußprothese gut erkannt werden (auch beim natürlichen Fuß können Hindernisse am Innen- oder Außenrand leicht zum Knicken oder Abrutschen des Fußes und somit zu Stürzen führen). Als Sensoren (Reizaufnehmer) wurden FSR-Kraftsensoren (FSR = „force sensitive resistor“) gewählt, deren Empfindlichkeit mittels eines einstellbaren Verstärkers unabhängig voneinander eingestellt und so dem Körpergewicht angepasst werden kann. Die Sensorsignale werden zum Eingang eines Rückmeldeprozessors geleitet, der an seinem Ausgang sechs Aktoren (Reizgeber) ansteuert. Die Aktoren können Kraftgeber oder Vibrationsgeber sein, welche die sensorischen Informationen möglichst authentisch auf das Reinnervationsareal übertragen. Kraftgeber applizieren auf der Haut des Reinnervationsareals eine Kraft, die proportional dem Sensorsignal ist (Abb. 6a). Dabei wird die Ist-Kraft laufend gemessen und mittels einer Regelstrecke der Soll-Kraft, die mit dem Sensorsignal identisch ist, nachgeführt. Die Aktorenkräfte können etwa von bürstenlosen Gleichstrom-Motoren erzeugt werden, die einen Anker bewegen.
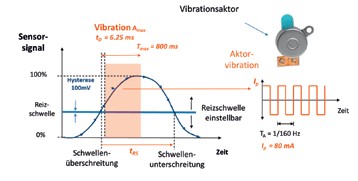
Vibrationsgeber hingegen applizieren eine Vibration mit einer konstanten Amplitude Amax und mit einer maximalen Dauer Tmax, die einstellbar ist und im konkreten Fall auf Tmax = 800 ms eingestellt wurde (Abb. 6b). Die Vibration wird gestartet, sobald das Sensorsignal die voreingestellte Reizschwelle überschreitet, und ausgeschaltet, sobald das Sensorsignal die Reizschwelle unterschreitet. Ist die Zeitspanne zwischen der Reizschwellenüberschreitung und der Reizschwellenunterschreitung tRS größer als Tmax (tRS > Tmax ), wird die Vibration nach Ablauf von Tmax abgeschaltet. Dadurch wird die Dauer der Vibration auf Tmax beschränkt und sichergestellt, dass es zu keiner Dauervibration, etwa beim Stehen, kommt. Jeder Sensor liefert eine maximale Sensorspannung von 5 V. Die Reizschwellen wurden alle auf ca. 20 % der Maximalspannung, d. h. auf ca. 1 V eingestellt. Die Hysterese beträgt 100 mV. Als Vibroaktoren wurden keine Motoren mit exzentrischer Masse, sondern Vibroschwinger verwendet. Das Funktionsprinzip der Vibroschwinger ist dem eines Lautsprechers ähnlich: Um einen topfförmigen Dauermagneten befindet sich eine Spule, die federnd mit einem Anker befestigt ist (bei einem Lautsprecher ist die Spule federnd an der Lautsprechermembran befestigt). Wird die Spule von einem elektrischen Strom durchflossen, übt das Magnetfeld des Topfmagneten eine Kraft auf die Spule und damit auf den Anker aus.
Bei dem gewählten mittelwertfreien, biphasischen Spitzenwert des rechteckförmigen Anregungsstromes von Ip = ±80 mA und einer Frequenz von 160 Hz erzeugt der Anker eine gleichgeartete Vibration mit einer Grundfrequenz von 160 Hz. Als Verzögerung tD („time delay“) kann eine Periode 1/160 Hz = 6,25 ms angegeben werden, die jedoch vom Patienten nicht wahrgenommen wird. Während der Kraftaktor im Labortest ein Beispiel für die Rückmeldung demonstriert, wird der Vibroaktor auch im Alltag des Prothesenträgers angewendet.
Vibroaktoren, die zum Beispiel in Smartphones verwendet werden, wurden bevorzugt, da sie nicht nur kostengünstig, sondern auch einfach in ihrer Handhabung sind. Im Schaft der Prothese wurden entsprechend der Anzahl der sechs Sensoren auch sechs Vibroaktoren integriert. Die Vibration wird auf diese Weise nicht direkt auf der Hautoberfläche des Reinnervationsareals, sondern auf der Oberfläche des darüberliegenden Silikonliners appliziert. Der Patient kann das ihm vertraute An- und Ablegen des Silikonliners ebenso beibehalten wie das ihm vertraute An- und Ablegen der Prothese (Abb. 7). Die miniaturisierte Rückmeldesensorik kann zum Beispiel an der Außenseite der Prothesen unterhalb des Schaftes angebracht werden. Damit ist das gesamte Rückmeldesystem, das heißt die Sensorsohle, die Rückmeldesensorik und die Aktorik, so angebaut, dass sowohl die Prothese als auch die Prothesenpassteile nicht verändert werden müssen und prinzipiell für den Anbau in jedem Prothesenaufbau geeignet sind (Abb. 8).
Der Einfluss der sensitiven Beinprothese auf die Trittsicherheit, auf die Schmerzsituation und vor allem auf die Integration der Prothese ins Körperbild des Prothesenträgers orientiert sich in erster Linie an dessen Aussagen. Dass der hier vorgestellte Patient seit der Nervenumleitung und der Versorgung mit der Rückmeldesensorik keine Opiate mehr zur Schmerzbehandlung benötigt, mag vielleicht auch auf eine gewisse Erwartungshaltung zurückzuführen sein („Ich wirke in einem Forschungsprojekt mit, das mich überzeugt – das wird meine Situation verbessern“). Aussagekräftige Daten, die den Einfluss der sensitiven Beinprothese quantitativ erfassen, müssten in der Alltagsumgebung des Patienten noch erhoben werden. Daten über die Bewegungsanalyse oder die Aktivität könnten zum Beispiel aus Langzeitmessungen stammen, in denen das Rückmeldesystem zufällig und in unerwarteten Situationen deaktiviert und aktiviert wird. Auch das Wissen über die Erfassung der Messdaten sollte sich der Kenntnis des Probanden entziehen, um psychologische Komponenten auszuschließen.
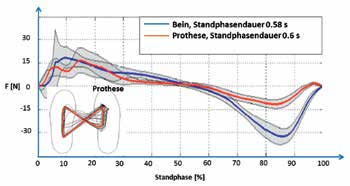
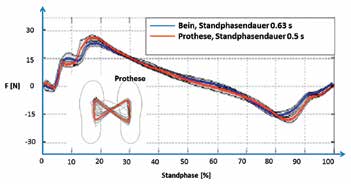
Zur Beurteilung des Einflusses des Rückmeldesystems auf Bodenreaktionskräfte ging der Proband zuerst mit dem linken Fuß (dem gesunden Fuß) und dann mit dem rechten Fuß (der Prothese) jeweils zehnmal mit einer Geschwindigkeit von ca. 1 m/s über eine Kraftmessplatte, wobei die Standphase eines jeden Schrittes auf der Kraftmessplatte erfolgte. In beiden Fällen wurde der Proband ersucht, auf maximale Gangsymmetrie zu achten. Gemessen und in Echtzeit für den Probanden sichtbar am Monitor dargestellt wurde jeweils die Bodenreaktionskraft in Gangrichtung bei a) eingeschaltetem und b) ausgeschaltetem Rückmeldesystem. Der Vergleich der beiden Messungen zeigt, dass bei eingeschalteter Rückmeldesensorik die Bodenreaktionskräfte deutlich symmetrischer ausfallen (Abb. 9a u. 9b).
Diskussion
Die Auswahl des Ortes und die Anzahl an Sensoren in der Schuhsohle basierten im konkreten Fall auf einer Benutzerbefragung. Freilich kann in zukünftigen Studien etwa durch An- bzw. Abschalten von Sensoren gezeigt werden, ob dieses oder ein anderes Sensorlayout ein Optimum darstellt. Dasselbe gilt für die Auswahl des Ortes und die Anzahl der Aktoren im Prothesenschaft. Vermutlich gibt es aber gar keine Lösung, die für alle Prothesenträger dasselbe einheitliche Optimum darstellt. Vielmehr ist davon auszugehen, dass jede Versorgung individuell unter Berücksichtigung der konkret durchgeführten Nervenumleitung, des sich daraus ergebenden Reinnervationserfolgs sowie unter Berücksichtigung der kognitiven Fähigkeiten des Prothesenträgers in einem gesonderten Schritt optimiert werden muss. Diskussionen über den wissenschaftlichen Nachweis des Nutzens einer sensitiven Beinprothese auf der Grundlage einer einzigen Fallstudie mögen im Moment noch ihre Berechtigung haben. Die Fallstudie war jedoch ein erfolgreicher Schritt, um zumindest einem Menschen ein beschwerdefreieres und sorgloseres Leben zu ermöglichen. Das sollte demonstrieren, wie Lösungen im interdisziplinären Team entstehen können, das von einem ganzheitlichen Verständnis für Problemstellungen ausgeht. Und das Ergebnis zeigt auch auf, dass die gezielte Nutzung abgetrennter Nervenanteile für die Kommunikation mit der Prothese zu einer neuen Qualität führen kann: Bionische Prothesen (sensitive, gedankengesteuerte, phantomgesteuerte Prothesen usw.) stellen ein vielversprechendes Potenzial in der modernen Prothesenforschung und Prothesenversorgung dar. So wird zum Beispiel zu diskutieren sein, ob gegebenenfalls Vorbereitungen für die gezielte Nutzung abgetrennter Nervenanteile, wie die Reinnervation von sensorischen und motorischen Nervenanteilen, nicht bereits zum Zeitpunkt der Amputation getroffen werden sollten, damit sich Hersteller in der Zukunft auf spezielles Zubehör und Passteile konzentrieren können, die den ganzheitlicheren Bedürfnissen von Menschen mit Amputationen besser gerecht werden.
Für die Autoren:
OA Dr. Eva Maria Baur
Universitätsklinik für Plastische, Rekonstruktive und Ästhetische Chirurgie
Anichstraße 35
A‑6020 Innsbruck
baur@baur-fromberg.de
Begutachteter Beitrag/reviewed paper
Baur EM, Bauer T, Egger H, Salzmann S, Haslwanter T. Ein neuer Ansatz für eine sensitive Beinprothese – eine Fallstudie. Orthopädie Technik, 2016; 67 (7): 62–66
- Easypreg – ein Faserverbundwerkstoff zum Tiefziehen — 9. März 2026
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Mücke M, Cuhls H, Radbruch L, Weigl T, Rolke R. Evidence of heterosynaptic LTD in the human nociceptive system: superficial skin neuromodulation using a matrix electrode reduces deep pain sensitivity. PLoS One, 2014; 9 (9): e107718
- Bartusch SL, Sanders BJ, D’Alessio JG, Jernigan JR. Clonazepam for the treatment of lancinating phantom limb pain. Clin J Pain, 1996; 12 (1): 59–62
- Carlton SM, Hargett GL. Treatment with the NMDA-antagonist memantine attenuates nociceptive responses to mechanical stimulation in neuropathic rats. Neurosci Lett, 1995; 198 (2), 115–118.
- Winter-Barnstedt C. Phantomschmerz nach Extremitätenamputation: Diagnostik und Biofeedback Behandlung. Dissertation, Fakultät für Sozial- und Verhaltenswissenschaften der Ruprecht-Karls-Universität Heidelberg, 2001
- Fritzsche K. Phantomschmerz: Prothetik und neue medikamentöse Behandlung. Dissertation, Fakultät für Sozial- und Verhaltenswissenschaften der Ruprecht-Karls-Universität Heidelberg, 2001
- Kuiken TA, Dumanian GA, Lipschutz RD, Miller LA, Stubblefield KA. The use of targeted muscle reinnervation for improved myoelectric prosthesis control in a bilateral shoulder disarticulation amputee.Prosthet Orthot Int, 2004; 28: 245–253
- Miller LA, Stubblefield KA, Lipschutz RD, Lock BA, Kuiken TA. Improved myoelectric prosthesis control using targeted reinnervation surgery: a case series. IEEE Trans Neural Syst Rehabil Eng, 2008; 16 (1): 46–50
- Kuiken TA, Marasco PD, Lock BA, Harden RN, Dewald JP. Redirection of cutaneous sensation from the hand to the chest skin of human amputees with targeted reinnervation. Proc Natl Acad Sci USA, 2007; 104 (50): 20061–20066
- Egger H. Die gedankengesteuerte und die fühlende Armprothese. Orthopädie Technik, 2010; 61 (3): 156–161