Einleitung
„Brustkrebs ist die häufigste Krebserkrankung bei Frauen. Über 70.000 Mal im Jahr stellen Ärztinnen und Ärzte aktuell die Diagnose ‚Mammakarzinom‘ bei einer Frau, über 17.000 Frauen sterben jährlich daran. Wenn auch die häufigste, so ist Brustkrebs in der Regel nicht die gefährlichste Krebsart bei Frauen. Rechtzeitig erkannt und behandelt, sind die meisten Erkrankungen heilbar.“ 1 Zwischen 10 und 12 von 100 Frauen in Deutschland erkranken im Laufe ihres Lebens an einem bösartigen Tumor der Brustdrüse 2. Bei 5 bis 10 % der Patientinnen lässt die Familienanamnese auf eine erbliche Form mit autosomal dominantem Erbgang schließen. In 30 bis 50 % dieser familiären Fälle werden Mutationen in den BRCA1- oder BRCA2-Genen gefunden 3. Frauen mit einer Mutation im BRCA1-Gen haben eine lebenslange Wahrscheinlichkeit von 70 bis 80 %, an Brustkrebs zu erkranken 4.
Je früher die Diagnose gestellt werden kann, umso höher sind die Heilungschancen. Neben Selbstabtasten der Brust ist ein Vorsorgeprogramm, das sogenannte Mamma-Screening, in Deutschland etabliert. Frauen ab 50 Jahren bis einschließlich 69 Jahren werden zu einer kostenlosen Mammographie wohnortnah eingeladen. Auffällige Befunde werden den Patientinnen mitgeteilt, eine weiterführende Diagnostik wird empfohlen bzw. eingeleitet 5.
Die Rolle axillärer Lymphknoten bei Brustkrebs
Die axillären Lymphknoten stellen Filterstationen der ableitenden Lymphbahnen der Brustdrüse dar. Sie reagieren mit Vergrößerung und Schwellung bei Entzündungen, Verletzungen und tumorösen Prozessen. In der Lymphflüssigkeit transportierte Zellen bleiben in den Filtern stecken und werden dort entweder vom Immunsystem unschädlich gemacht oder zurückgehalten, um nicht sofort in den großen Blutkreislauf zu gelangen 6.
Der Wächterlymphknoten (Sentinellymphknoten)
Dank langjähriger Forschung liegt die Erkenntnis vor, dass beim Mammakarzinom ein sogenannter Wächterlymphknoten – der Lymphknoten, der als Erster die oben genannte Funktion erfüllt – aufgefunden und untersucht werden kann. Ist dieser Lymphknoten beim invasiven Karzinom tumorfrei, so sind die nachgeschalteten Lymphknoten in der Achselhöhle als nicht befallen zu werten.
Lymphknotenstationen
Diese nachgeschalteten Lymphknoten werden anatomisch in verschiedene Lymphknotenstationen, sogenannte Level, eingeteilt. Nur Level I und II werden zur Diagnostik operativ angegangen. Ob Lymphknoten befallen sind, ist für die Einteilung des Tumorstadiums und der daraus resultierenden Therapie wichtig. Kein Lymphknotenbefall bedeutet, dass die Erkrankung sich nur auf die Brustdrüse beschränkt, positive Lymphknoten belegen eine systemische Ausbreitung 7.
Untersuchung der axillären Lymphknoten
Nach Sicherung der Diagnose aufgrund einer Gewebeentnahme (Biopsie) ist die Diagnostik der Lymphknoten der nächste Untersuchungsschritt. Individuell auf das Erkrankungsstadium und die geplante Therapie abgestimmt, kommt eine Gewebeprobe aus dem betroffenen Lymphknoten, eine operative Entnahme des Sentinellymphknotens vor oder während der Tumorentfernung oder eine Entfernung mehrerer Lymphknoten aus den besagten Leveln in Frage. Dies wird im sogenannten Tumorboard oder der Tumorkonferenz in der Expertenrunde des behandelnden Brustzentrums für jede Patientin vor Therapiebeginn empfohlen.
Auffinden des Wächterlymphknotens
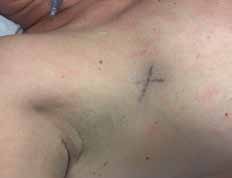
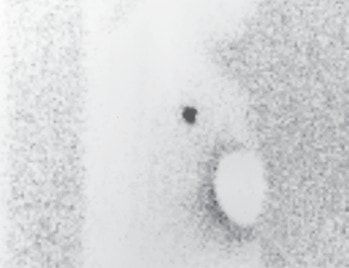
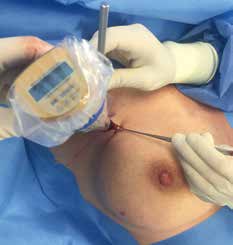
Vor der geplanten Operation wird der Sentinellymphknoten vom Facharzt für Nuklearmedizin markiert. Um den Tumor herum beziehungsweise subareolär quadrantenadaptiert wird eine radioaktiv angereicherte Flüssigkeit, die Tracersubstanz, gespritzt. Standardisiert werden dazu 40 MBq Tc-99m-Nanokolloid injiziert. Die Flüssigkeit verteilt sich in den Lymphgefäßen und wird zu den Lymphknoten transportiert, überwiegend in die axillären Lymphknoten. Dieses Abfließen der Flüssigkeit wird sequenziell über ca. 60 Minuten untersucht. Der Lymphknoten, der als Erster diese Substanz anreichert und speichert, ist der Sentinel. Mit einer Gammasonde kann die Lage des Lymphknotens detektiert und entsprechend auf der Haut markiert werden (Abb. 1). Die Dokumentation erfolgt mit einem Ausdruck des anreichernden Lymphknotens am sogenannten Hintergrund-Phantombild in zwei Ebenen (Abb. 2). Der Operateur verfügt über eine sterile Gammasonde, mit der er vor der OP und während des Eingriffs die Lage des Lymphknotens überprüfen kann.
Lymphödem
Unter einem Lymphödem versteht man die Ansammlung von Lymphflüssigkeit außerhalb der Lymphgefäße im Gewebe. Dies entsteht durch den Rückstau dieser Flüssigkeit in die Zwischenzellräume. Die Ursachen hierfür können entweder in einem gestörten Lymphabfluss oder einer gesteigerten Produktion von Lymphflüssigkeit liegen. Bei besonders schweren Krankheitsbildern liegen beide Störungen gleichzeitig vor. Die Folgen davon sind Schwellungen mit oft erheblicher Umfangsvermehrung, Bewegungseinschränkungen und Hautveränderungen mit Verhärtungen des Bindegewebes.
Man unterscheidet zwei Arten von Lymphödemen: das primäre und das sekundäre. Das primäre Lymphödem wird durch angeborene Fehlbildungen oder Nichtanlage von Lymphgefäßen oder ‑knoten verursacht. Das Lymphsystem ist entweder über- oder unterentwickelt, Lymphgefäße können zu schmal, verklebt oder erheblich erweitert sein. Meist sind diese Fehlentwicklungen von Geburt an sichtbar, selten erst ab der Pubertät.
Das sekundäre Lymphödem ist eine erworbene Erkrankung. Meistens sind Tumore oder die Folgen von Operationen an Lymphknoten oder eine Bestrahlung der Lymphabflusswege als Ursachen zu finden. Weitere Auslöser für ein sekundäres Lymphödem können schwere Weichteilzerstörungen oder Strangulationsfolgen nach Unfällen, Entzündungen oder Parasitenbefall sein. Immobilität und Übergewicht können eine erhebliche Einschränkung des Lymphabflusses darstellen. Erstes Anzeichen einer Lymphödembildung ist eine schmerzlose und teigige Schwellung der betroffenen Extremität, die sich durch Hochlagern wieder zurückbildet. Im weiteren Krankheitsverlauf bleibt das Ödem bestehen, die Konturen des betroffenen Arms verstreichen, die Hautfalten über den Gelenken sind vertieft. Neben einem erheblichen Schweregefühl kann die Beweglichkeit eingeschränkt sein.
Je nach Schweregrad wird das Lymphödem in 4 Stadien unterteilt: vom Stadium 0, das klinisch keine Beschwerden verursacht und nicht offensichtlich ist, bis zum Stadium III, das zu einer bis zur Unförmigkeit auftretenden bleibenden Schwellung mit Bewegungseinschränkungen und schweren Hautveränderungen führen kann 8 9.
Gewebeschonende Entfernung von Lymphknoten
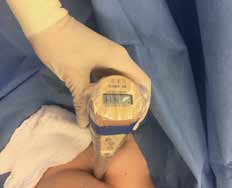
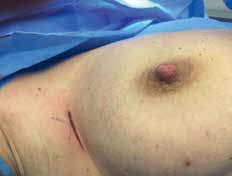
Bei der Entnahme eines Sentinellymphknotens sollte die Hautinzision in den Hautspaltlinien direkt über der Hautmarkierung erfolgen. Vorher wird mit der sterilen Gammasonde die Lage nochmals überprüft (Abb. 3 u. 4). Die Gammasonde ortet sowohl in Form von angezeigten Counts als auch akustisch – als schnelles Ticken – den markierten Lymphknoten.
Die Länge des Hautschnittes sollte dabei so lang wie nötig und so kurz wie möglich sein. Schnittführungen, die die vordere Axillarfalte überschreiten, sollten vermieden werden, da hierbei das erhöhte Risiko einer Narbenkontraktur mit Bewegungseinschränkung des Armes eingegangen wird. Das direkte Vorpräparieren bis auf die axilläre Faszie sollte gewebeschonend unter bipolarer Koagulation von Gefäßen erfolgen.
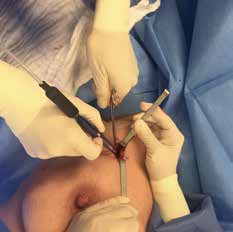
Im operativen Setting der Verfasserin trägt der Operateur stets eine Lupenbrille mit Stirnlampe zur besseren Identifizierung der Nervengefäßbündel und der Lymphknoten. Die axilläre Faszie, die das subkutane Fettgewebe vom axillären Fettgewebe anatomisch trennt, wird dann inzidiert und stumpf gespalten. Das axilläre Fettgewebe unterscheidet sich hinsichtlich der helleren Gelbfärbung und der Größe der Fettläppchen deutlich vom subkutanen Fettgewebe. Der Sentinellymphknoten wird erneut mit der Gammasonde geortet; ein entsprechender Tastbefund weist den Weg zum Ziellymphknoten (Abb. 5). Dieser wird angeklemmt, unter Koagulation der feinen zuführenden Blut- und Lymphgefäße mit der bipolaren Pinzette freipräpariert und entfernt (Abb. 6 u. 7).
Bereits bei der Entnahme eines einzelnen Lymphknotens müssen sämtliche Nervengefäßbündel, die durchaus am oder um den Lymphknoten liegen, unter sorgfältiger Schonung abpräpariert werden. In erster Linie müssen dickere interkostobrachiale Nerven und die lateralen thorakalen Gefäße geschont werden.
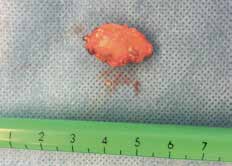
Extrakorporal wird mit der Gammasonde nochmals geprüft, ob es sich um den markierten Lymphknoten handelt. Sämtliche Messwerte des Sentinellymphknotens – vor Inzision der Haut, nach Eröffnen der axillären Faszie, in situ und extrakorporal nach der Entfernung – werden dokumentiert. Wurden mehrere Lymphknoten markiert, so werden diese in gleicher Art und Weise entfernt. Der Sentinellymphknoten wird steril verpackt und gekühlt zur histopathologischen Schnellschnittuntersuchung weitergeleitet.
In der Zwischenzeit wird eine erneute Wundinspektion und gezielte Blutstillung mit der bipolaren Koagulationspinzette durchgeführt. Ist histopathologisch im Schnellschnitt kein Tumorbefall des Sentinellymphknotens nachgewiesen, wird der Eingriff abgeschlossen. Es erfolgt der schichtweise Wundverschluss.
Auf ein Einlegen einer Wunddrainage wird in der Regel verzichtet. Ist die Inzision der axillären Faszie länger als einen Zentimeter, so wird diese mit einer Vicrylnaht verschlossen. Das Corium wird mit Monocryl-Einzelknopfnähten adaptiert; eine fortlaufende Intrakutannaht mit resorbierbarem oder nicht resorbierbarem Nahtmaterial vervollständigt den Wundverschluss. Eine gefaltete sterile Kompresse wird mit einem Pflasterverband über der Naht fixiert.
Wird der Sentinellymphknoten im Rahmen einer Mastektomie entfernt, so kann in den meisten Fällen die Entfernung über den Mastektomiezugang – ohne zusätzliche Inzision in der Axilla – erfolgen. Nach subkutanem Auslösen der Brustdüse oder nach einer Ablatio ist der Zugang zur Axilla und zur axillären Faszie einfach und sehr übersichtlich.
Auch hier wird die Sentinellage mit der Gammasonde verifiziert, die axilläre Faszie eröffnet, der Lymphknoten mit der Gammasonde aufgesucht, getastet und wie oben beschrieben entfernt. Ist der Sentinellymphknoten befallen, so müssen gemäß den S3-Leitlinien noch mehrere Lymphknoten aus Level I und II entfernt und untersucht werden, jedoch nicht mehr als insgesamt 10 Lymphknoten.
Entfernung von Lymphknoten aus Level I und II
Das Aufsuchen der axillären Faszie, deren Inzision und Spaltung erfolgen in gleicher Weise wie bei der Sentinellymphknotenentnahme. Die Inzision sollte jedoch zur besseren Übersicht und wegen des breiteren Zugangs länger und weiter axillawärts gewählt werden. Die anatomische Begrenzung der Level ist kranial die Vena axillaris, lateral und ventral die axilläre Faszie, medial die Thoraxwand und dorsal das thorakodorsale Nervengefäßbündel. Die Präparation der Lymphknoten, die in das axilläre Fettgewebe eingebettet sind, erfolgt am übersichtlichsten von kranial nach kaudal und von dorsal nach ventral.
Hierzu wird stumpf das Fettgewebe von der V. axillaris abgeschoben und die Vene dargestellt. Einzelne sicht- und tastbare Lymphknoten werden wie oben beschrieben freipräpariert und entfernt. Die Präparation wird nach kaudal, lateral und entlang der Thoraxwand fortgesetzt. Wichtig ist, nur die geforderte Zahl zu entnehmen.
Jeder weitere entfernte Lymphknoten erhöht das Risiko einer Verletzung und Unterbrechung der Lymphabflusswege unter Ausbildung eines sekundären Lymphödems. Auch hier müssen wichtige Nerven- und Gefäßstrukturen dargestellt und geschont werden. In erster Linie sind dies die thorakodorsalen Gefäße, die die Blut- und Nervenversorgung des Musculus latissimus dorsi darstellen. Sie verlaufen auf der Ventralseite des Musculus latissimus dorsi und gehen von der Arteria und Vena axillaris ab. Die Verletzung einer der beiden Venen oder der Arterie zerstört die axiale Blutversorgung des Musculus latissimus dorsi und macht eine gestielte Musculus-latissimus-dorsi-Lappenplastik zur Brustrekonstruktion oder Haut-Weichteildeckung der Thoraxwand unmöglich.
Die aus dem Interkostalraum entspringenden und subkutan in die Haut einstrahlenden interkostobrachialen Nerven müssen in gleicher Weise präpariert und erhalten werden. Sie versorgen sensibel die Haut des lateralen, medialen und dorsalen Oberarms. Die Durchtrennung oder Verletzung dieser Nerven zieht eine erhebliche Einschränkung der Sensibilität des Oberarmes nach sich, was neben einer dauerhaften Gefühllosigkeit auch eine Dysästhesie im Versorgungsgebiet nach sich zieht.
Liegt eine ausgedehnte Metastasierung in der Axilla vor, so sollten nur die großen Lymphknotenmetastasen in Level I und II entfernt werden. In diesen Fällen kann die Präparation der interkostobrachialen Nerven schwierig oder gar unmöglich sein. Die Entnahme weiterer Lymphknoten steigert nur das Risiko eines sekundären Lymphödems des Armes ohne positive Auswirkung auf die Prognose oder die weitere Therapie.
Nach der sorgfältigen bipolaren Blutstillung wird die axilläre Faszie mit Einzelnähten adaptiert und darüber eine Drainage mit axillärer subkutaner Ausleitung gelegt. Eine Drainage direkt in der Axilla in unmittelbarer Lage zu den Nerven und Gefäßnervenbündeln zieht neben Schmerzen manchmal auch eine gesteigerte Lymphproduktion mit Ausbildung einer Lymphozele nach sich und sollte deshalb vermieden werden. Sind mehr als 3 Lymphknoten mit Tumorzellen befallen, so wird eine Bestrahlung der Axilla und der ableitenden Lymphwege empfohlen.
Sekundäres Armlymphödem trotz gewebeschonender Entnahme der axillären Lymphknoten
Abhängig vom Ausmaß des Befalls der axillären Lymphknoten und des Tumorstadiums in den Lymphknoten können postoperativ im Wundheilungsverlauf Störungen des Lymphabflusses der Thoraxwand auftreten. Infektionen und eine verzögerte Wundheilung unter Ausbildung eines Seroms leisten einer Induration Vorschub. Eine Bestrahlung der Lymphabflusswege führt oft zu einer starken Vernarbung und strahleninduzierten Fibrosierung der axillären Lymphbahnen und Lymphknoten. Daraus resultiert ein sekundäres Armlymphödem, das zeitlebens behandlungsbedürftig ist 10 11.
Schlussfolgerung
Die Morbidität der Axilla nach diagnostischer Entnahme axillärer Lymphknoten kann durch gewebeschonende operative Verfahren reduziert werden. Die Diagnose- und Indikationsstellung für die Entnahme des Sentinellymphknotens und für die Axilladissektion müssen gesichert sein. Wenig invasive Verfahren zur Lymphknotendiagnostik wie die Lymphknotenbiopsie oder aussagekräftige nichtinvasive Untersuchungsverfahren sollten vorangetrieben werden.
Eine operative Behandlung zur Verbesserung des sekundären Armlymphödems besteht in der mikrochirurgischen Transplantation von Lymphknoten in die betroffene Axilla. Erfolgversprechende postoperative Ergebnisse liegen bereits vor 12.
Die Autorin:
Dr. Irene Richter-Heine
Fachärztin für Plastische, Ästhetische und
Rekonstruktive Chirurgie
Maximilianstraße 38 – 40, 80539 München
richter-heine@heitmann-fansa.de
Begutachteter Beitrag/reviewed paper
Richter-Heine I. Neue chirurgische Therapiekonzepte in der Mammachirurgie zur Verhinderung sekundärer Armlymphödeme. Orthopädie Technik, 2016; 67 (10): 46–49
- Deutsche Krebsgesellschaft e. V. Brustkrebs/Mammakarzinom. https://www.krebsgesell schaft.de/basis-informationen-krebs/krebsarten/brustkrebs.html (Zugriff am 31.08.2016)
- Medizin-Aspekte. Brustkrebs: Inzidenz, Mortalität, Überlebensraten, Prävalenz. http://www.archiv.medizin-aspekte.de/brustkrebs/brustkrebs-brustdrüse_8856.html (Zugriff am 08.09.2016)
- Universitätsmedizin Mainz. Erblicher Brust- und Eierstockkrebs. https://www.unimedizin-mainz.de/humangenetik/krankenversorgung/diagnostik-von-erblichen-tumorerkrankungen/erblicher-brust-und-eierstockkrebs.html (Zugriff am 08.09.2016)
- Konsortium Familiärer Brustkrebs. Mutationen, Erbgänge und Erkrankungsrisiken. http://www.konsortium-familiaerer-brustkrebs.de/medien/Downloads/mutationen_erbgaenge_erkrankungsrisiken.pdf (Zugriff am 08.09.2016)
- Leitlinienprogramm Onkologie der AWMF, Deutschen Krebsgesellschaft e. V. und Deutschen Krebshilfe e. V. (Hrsg.). Interdisziplinäre S3-Leitlinie für die Diagnostik, Therapie und Nachsorge des Mammakarzinoms (AWMF-Register-Nummer: 032 – 045OL). Langversion 3.0, Aktualisierung 2012. Stand: 02.07.2012 (in Überarbeitung), gültig bis 30.06.2017. Kapitel 4.4.5: 87–88. http://www.awmf.org/uploads/tx_szleitlinien/032–045OL_l_S3__Brustkrebs_Mammakarzinom_Diagnostik_Therapie_Nachsorge_2012-07.pdf (Zugriff am 31.08.2016)
- Medizin kompakt. Lymphknoten (Nodus lymphaticus). http://www.medizin-kompakt.de/anatomie/lymphdystem/lymphknoten-seite‑1. Lymphe. http://www.medizin-kompakt.de/anatomie/lymphdystem/lymphe-seite‑1. Lymphgefäße. http://www.medizin-kompakt.de/anatomie/lymphsystem/lymphgefaesse-seite‑1 (Zugriff am 08.09.2016)
- Deutsches Krebsforschungszentrum – Krebsinformationsdienst. Lymphödeme: Vorbeugen und Anzeichen erkennen. Risikofaktoren, Symptome, Untersuchungsverfahren. Stand: 05.08.2011. http://www.krebsinformationsdienst.de/leben/lymphoedem/lymphoedem-symptome.php (Zugriff am 31.08..2016)
- Deutsches Krebsforschungszentrum – Krebsinformationsdienst. Lymphödeme: Vorbeugen und Anzeichen erkennen. Risikofaktoren, Symptome, Untersuchungsverfahren. Stand: 05.08.2011. http://www.krebsinformationsdienst.de/leben/lymphoedem/lymphoedem-symptome.php (Zugriff am 31.08..2016)
- Bruns F, Hadamitzky C, Büntzel J. Lymphödem: Klinische Symptomatik und Stadieneinteilung. Letzte Änderung: 14.09.2012. In: Link H, Bokemeyer C, Feyer P. Supportivtherapie bei malignen Erkrankungen. Online-Publikation, Kap. 12.5. http://www.onkodin.de/e6/e94850/e94865 (Zugriff am 31.08.2016)
- Bruns F, Hadamitzky C, Büntzel J. Lymphödem: Definition und Problembeschreibung. Letzte Änderung: 14.09.2012. In: Link H, Bokemeyer C, Feyer P. Supportivtherapie bei malignen Erkrankungen. Online-Publikation, Kap. 12.1. http://www.onkodin.de/e6/e94850/e94851 (Zugriff am 31.08.2016)
- Bruns F, Hadamitzky C, Büntzel J. Lymphödem: Pathophysiologie. Letzte Änderung: 14.09.2012. In: Link H, Bokemeyer C, Feyer P. Supportivtherapie bei malignen Erkrankungen. Online-Publikation, Kap. 12.3. http://www.onkodin.de/e6/e94850/e94859 (Zugriff am 31.08.2016)
- Harder Y, Müller D, Rezaeian F, Stock K, Sörensen D, Becker C, Machens H. Mikrovaskuläre Lymphknotentransplantation zur Behandlung des chronischen Lymphödems: ein 1‑Jahres Follow-up. Senologie, 2012; 9: A63. doi: 10.1055/s‑0032–1313429