Einleitung
Der medizinische Fortschritt sowie ein gesundheitsbewussterer Lebensstil tragen unter anderem dazu bei, dass die Menschen nicht nur länger leben, sondern auch länger fit bleiben. Diese Aspekte der demografischen und gesundheitlichen Entwicklung haben Auswirkungen auf die Konzeption von Therapieregimen. So beeinflusst zunehmend das biologische Alter – anstelle des biografischen Alters – die Therapieentscheidung im Allgemeinen.
Im speziellen Fall der traumatischen Querschnittläsion im Alter lässt sich bei der Betrachtung der aktuellen Statistiken unschwer eine deutliche Zunahme solcher Verletzungen im Laufe der Zeit konstatieren: Im Vergleich zu 1980 haben die jährlichen Zahlen der Krankenhausaufnahmen älterer Patienten (≥ 70 Jahre) mit Rückenmarkverletzungen um das Fünffache zugenommen 1. Auch innerhalb der gesamten Patienten mit traumatischer Rückenmarkverletzung aller Altersklassen hat der Prozentsatz älterer Menschen von 4,2 % Anfang der achtziger Jahre auf 15,4 % in der ersten Hälfte des Jahrzehnts 2000 bis 2010 zugenommen; das durchschnittliche Alter der Patienten mit Querschnittläsionen ist in derselben Zeitperiode von 33,7 auf 44,3 Jahre gestiegen 2. Lewis und Kollegen prognostizieren zudem die Mehrheit der traumatischen Rückenmarkverletzungen im Jahre 2032 bei Patienten über 70 Jahren 3. Diese Entwicklung hat im Laufe der Zeit ein Umdenken innerhalb der chirurgischen Gesellschaften in der Behandlung traumatischer Rückenmarkverletzungen bewirkt.
Kausalität
Stürze sind die häufigste Ursache einer traumatischen Rückenmarkverletzung im Alter. So entstehen 74 % der Rückenmarkverletzungen älterer Menschen nach einem Sturz. Verkehrsunfälle stellen mit 13 % die zweithäufigste Ursache dar 4. Wie die Statistik zeigt, haben ältere Personen eine deutlich höhere Wahrscheinlichkeit, eine Rückenmarkläsion nach einem Sturzereignis zu erleiden, als junge Menschen. Grund dafür ist in den meisten Fällen die vorhandene degenerative Veränderung der Wirbelsäule, die aus einem minimalen Trauma wie einer Halswirbelsäulendistorsion eine schwerwiegende Schädigung der neuralen Strukturen verursacht. So spielen zum Beispiel Spinalkanalstenose und Spondylarthrose eine wichtige Rolle bei der Potenzierung der Schadenentstehung am Rückenmark. In einem engen Spinalkanal, in dem sich im Laufe der Jahre unspezifisches osteoligamentäres Bindegewebe gebildet hat, hat das Rückenmark im Falle einer traumabedingten mechanischen Beanspruchung nur limitierte Räume, um zu entweichen. So verursacht ein Sturzereignis bei einem älteren Menschen mit degenerativer Wirbelsäule einen größeren Schaden als bei einer juvenilen Wirbelsäule mit noch vorhandenem Ausweich- und Kompensierungspotenzial.
Diagnostik
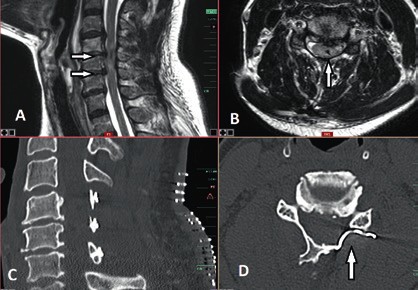
Bei anamnestischem und klinischem Verdacht auf traumatische Rückenmarkläsionen erfolgt in der Regel als erste diagnostische Methode eine CT-Untersuchung der Wirbelsäule auf Höhe der vermuteten Läsionssegmente zum Ausschluss oder zur Darstellung möglicher Frakturen und Dislokationen. Bei jüngeren Patienten kann die CT-Untersuchung beim Beweis einer dislozierten Fraktur, die zur klinisch vermuteten Rückenmarkläsion passt, ausreichend sein. Jedoch empfiehlt sich bei älteren Patienten – trotz im CT nachgewiesener dislozierter Fraktur – die Durchführung einer zusätzlichen MRT-Untersuchung der Läsionshöhe und der benachbarten Segmente zur genaueren Darstellung möglicher degenerativer kompressiver Veränderungen der Wirbelsäule auf Höhe der benachbarten Segmente, welche die Therapieentscheidung und das Therapieausmaß entscheidend beeinflussen können.
Bei fehlendem Nachweis einer knöchernen kompressiven Verletzung der Wirbelsäule durch die CT-Untersuchung ist es obligat, eine ergänzende notfallmäßige MRT-Untersuchung der klinisch vermuteten Läsionshöhe durchzuführen. Ergänzend sollten eine Farbduplexsonografie und gegebenenfalls – bei fehlenden Kontrastmittelkontraindikationen – eine CT-Angiografie der Aa. vertebrales bei lateralen Wirbelkörper- oder Wirbelbogenfrakturen der Halswirbelsäule zum Ausschluss einer Dissektion erfolgen. Zudem sind die Verletzungen der inneren Organe bei Verlust der Schmerzwahrnehmung im Falle einer Querschnittläsion schwierig zu diagnostizieren; daher ist eine schnelle orientierende Sonografie von Thorax und Abdomen bei Traumapatienten von großer Bedeutung, um mögliche innere Blutungen auszuschließen, zumal die Sonografie weder zeitaufwendig noch strahlenbelastend ist.
Einteilung
Querschnittverletzungen werden generell qualitativ in komplette und inkomplette Läsionen unterteilt. Aufgrund der Komplexität der Rückenmarkschädigung und der daraus resultierenden Lähmungsbilder mit Ausfall motorischer, sensibler und vegetativer Funktionen werden Querschnittverletzungen mit Hilfe von Scoring-Skalen eingestuft. Die American Spinal Injury Association (ASIA) entwickelte dazu eine qualitative Klassifizierung (Abb. 1), die eine breite Anwendung im praktischen Alltag findet. Solche Skalen sind wichtige Evaluationsmittel, die den funktionellen Schweregrad einer Rückenmarkverletzung darstellen und gleichzeitig bei der Dokumentation des Therapieerfolges im Verlauf der Behandlung helfen. In der Akutphase einer traumatischen Querschnittläsion sollte der neurologische Status grundsätzlich engmaschig kontrolliert und mit Hilfe einer standardisierten Skala dokumentiert werden, um eine mögliche Verschlechterung frühzeitig zu erkennen, da diese wiederum die Therapieentscheidung beeinflussen kann.
Präoperative Phase
Ein wichtiger Aspekt, den man bei der Literaturbetrachtung findet, ist der verzögerte Zeitpunkt einer operativen Therapie bei älteren Patienten mit Querschnittsymptomatik 5. Diese Verzögerung kommt nicht durch das biografische Alter an sich zustande, sondern aufgrund der meistens mit dem Alter verbundenen multiplen internistischen Erkrankungen. Entgegen der früheren Meinung, dass eine direkte Korrelation zwischen biografischem Alter und Operationskomplikationen besteht, zeigt die aktuelle Literatur, dass das biologische Alter mit seinen Begleiterkrankungen die entscheidende Rolle in der Einschätzung anästhesiologischer Operationsrisiken spielt 6.
Basierend auf dieser Entwicklung besteht Konsens darüber, dass zur Minimierung der perioperativen Komplikationen die „Operabilität älterer Patienten“ optimiert werden soll. Auf der Einschätzung des Operationsrisikos für ältere Patienten und der Optimierung der Vorbereitung auf eine operative Therapie liegt das Hauptaugenmerk der internistischen und anästhesiologischen Kollegen in der präoperativen Phase. Für die Chirurgen gilt es, möglichst genaue Informationen über die geplante Operation an die beteiligten Fachabteilungen weiterzugeben, um eine optimale perioperative internistische und anästhesiologische Betreuung zu erreichen. So gilt es weiterhin als primäres Ziel, dass die Patienten die Operationen gut überstehen und die OP-Risiken minimiert werden. Diesbezüglich sind in den letzten 20 Jahren enorme Fortschritte – auch in der Entwicklung neuer Operationstechniken – zu erkennen, die eine minimalinvasive Operation zulassen und OP-Dauer und ‑Belastung reduzieren.
Ein weiterhin kontrovers diskutiertes Thema ist die Gabe von Steroiden in der akuten Phase eines spinalen Traumas. Derzeit stellt Methylprednisolon das einzige Kortikosteroid dar, das in der Behandlung der akuten traumatischen Querschnittläsion verwendet wird. Nach der aktuellen Literaturlage kann zwar nicht ausgeschlossen werden, dass eine hochdosierte Methylprednisolon-Gabe für bestimmte Patienten von Vorteil sein kann, jedoch zeigt sie Komplikationen wie das häufigere Auftreten von Infektionen und Hyperglykämie. Diese stellen eine Kontraindikation zur hochdosierten Gabe von Methylprednisolon bei älteren Patienten mit Komorbiditäten wie Diabetes mellitus oder Herzinsuffizienz dar 7 8.
So bedarf es vor jeder hochdosierten Methylprednisolon-Gabe einer kritischen Einzelfallentscheidung unter Berücksichtigung der Kontraindikationen wie Polytrauma, Schädel-Hirn-Trauma, Infekte und internistische Begleiterkrankungen. Demnach kann eine allgemeine Empfehlung für eine Methylprednisolon-Gabe bei traumatischer Querschnittlähmung nicht ausgesprochen werden; aber wenn die Therapieentscheidung zugunsten der Verwendung von Methylprednisolon fällt, so empfiehlt sich die Gabe gemäß NASCIS-Schema 9.
Kriterien und Techniken der operativen Therapie
Das Ziel der Therapie einer Wirbelsäulenverletzung ist die Wiederherstellung der statischen, dynamischen und protektiven Funktion der Wirbelsäule und die Dekompression neuraler Strukturen. Grundsätzlich wird zwischen harten Kriterien einer Wirbelsäulen- und Rückenmarkverletzung, die eine operative Versorgung unabdingbar machen, und weichen Kriterien unterschieden.
Ein hartes Kriterium ist die Stabilität der Wirbelsäule: Eine instabile Wirbelsäule stellt nicht nur eine zusätzliche enorme Hürde in der Rehabilitationsphase dar, die nach Stabilitätswiederherstellung überbrückbar ist, sondern verursacht auch rezidivierende Mikro- und Makrotraumata, die die Rückenmarkschädigung verschlimmern können 10. In diesen Fällen unterscheidet sich die Indikationsstellung zur operativen Versorgung im Falle eines älteren Patienten nicht von einem jüngeren, denn die Stabilität der Wirbelsäule ist eine wesentliche altersunabhängige Voraussetzung für die Erzielung der Rehabilitationsfähigkeit.
Für die Indikationsstellung zur operativen Versorgung an der Wirbelsäule im Falle einer Instabilität liegen gute Klassifikationen vor. In Europa findet die Klassifikation der Arbeitsgemeinschaft für Osteosynthesefragen (AO-Klassifikation) weite Verwendung, wohingegen in Amerika der Thoracolumbar Injury Classification and Severity Score (TLICS) verbreiteter ist 11 12.
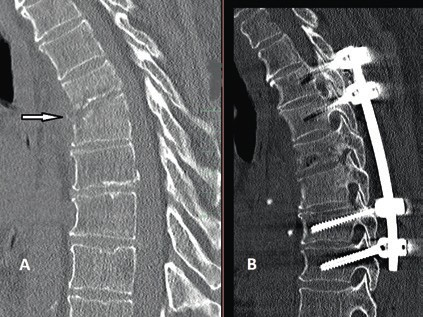
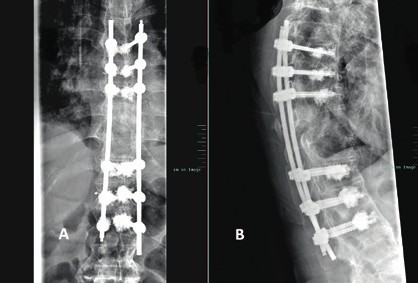
Prinzipiell richtet sich die Entscheidung, welche operative Versorgung durchgeführt wird, nach Ausmaß und Art der Verletzung. Für die Stabilisierung der dorsalen Säule reicht im Falle einer stabilen ventralen Säule die dorsale Instrumentierung aus. Hier gewährleisten dorsale Pedikelschrauben, die mit einem Stab verbunden sind, eine gute Wiederherstellung der Stabilität (Abb. 2). Im Falle einer instabilen ventralen Säule ist hingegen eine Implantation von Wirbelkörperersatz und eine dorsoventrale Segmentversteifung indiziert (Abb. 3). Die entwickelten minimalinvasiven Techniken – zum Beispiel die transkutane Pedikelschraubenimplantation oder der Wirbelkörperersatz durch endoskopische Thorakotomie – haben dazu geführt, dass das Wundgebiet und die operationsbedingte Gewebeschädigung reduziert werden und somit eine Belastungsreduktion für den Körper erzielt wird. Dieser Aspekt ist insbesondere bei älteren Patienten mit multiplen Begleiterkrankungen von Vorteil. Im Falle einer osteoporotischen Wirbelsäule werden die implantierten Pedikelschrauben zementiert (Abb. 4). Auch hier erlaubt die Entwicklung fenestrierter Schrauben eine optimale Möglichkeit der Zementapplikation.
Die funktionellen pathologischen Mechanismen einer Rückenmarkverletzung können grundsätzlich in zwei Gruppen subsumiert werden:
- Primäre direkte mechanische Rückenmarkverletzung, zum Beispiel druckbedingt durch Dislokation von Teilen eines Wirbelkörpersegments oder durch scherende oder stauchende Gewalteinwirkung und Übertragung der traumatischen physikalischen Kräfte einer Druckwelle im Rückenmark. Dieses Primärtrauma führt zu struktureller irreversibler Zerstörung des Rückenmarks.
- Sekundäre Rückenmarkschädigung, zum Beispiel durch Perfusionsstörungen in den benachbarten Rückenmarksegmenten, dessen Ausmaß in einem direkt proportionalen Zusammenhang zum Ausmaß des Primärereignisses steht 13.
Ziel einer operativen Therapie in beiden Fällen ist die Entlastung der neuralen Strukturen. Auch in diesem Bereich wurden Operationstechniken entwickelt, die mit minimalinvasiven „Schlüsselloch-“ oder mikroskopischen Methoden eine gute Entlastung erreichen. Diese Entwicklung der operativen Methoden spiegelt sich in der Literatur wider. So finden wir im Jahre 1949 die Laminektomie als führende Operationstechnik zur Rückenmarkentlastung; hingegen wird diese Technik heutzutage nicht mehr favorisiert. Es werden heute moderne entlastende Operationstechniken mit deutlich weniger Gewebszerstörung angewendet, etwa die mikrochirurgische oder endoskopische Dekompression mittels Laminotomie oder die Crossover-Technik, die eine beidseitige Entlastung durch einen einseitigen Zugang erlaubt. Auch Laminoplastie und Duraerweiterungsplastik sind im Laufe dieser Entwicklungsrichtung weniger invasiv geworden und werden bei älteren Patienten zunehmend eingesetzt (Abb. 5).
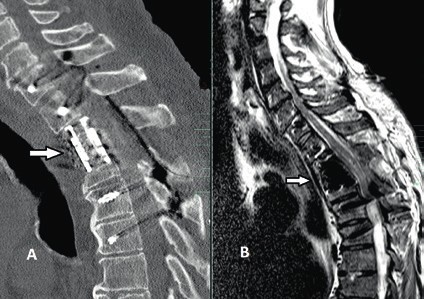
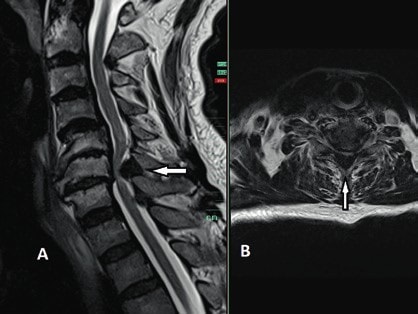
Die operative Therapie ist unabdingbar im Falle von Wirbelsäuleninstabilität und/oder Rückenmarkkompression mit progredienter inkompletter Querschnittsymptomatik. In diesen Fällen besteht ein breiter Konsens, dass die operative Versorgung bei älteren Patienten eine dringende Indikation und in den Fällen sukzessiver neurologischer Verschlechterung eine Notfallindikation darstellt. Dagegen ist es bei der Indikationsstellung zur operativen Therapie bei stabilen, jedoch degenerativen Wirbelsäulen mit posttraumatischen Querschnittverletzungen schwieriger, einen Konsens zu finden 14 15. In diesen Fällen ist die Evaluation der potenziellen Vorteile einer Dekompression der neuralen Strukturen entscheidend für die Indikationsstellung einer operativen Therapie. Die Dynamik des posttraumatischen neurologischen Status spielt hier die entscheidende Rolle in der Evaluation. So werden Patienten mit komprimierender Spinalkanalstenose und zunehmender neurologischer posttraumatischer Verschlechterung von einer Dekompression des Spinalkanals mit großer Wahrscheinlichkeit profitieren (Abb. 6). Auch wenn die neurologische Erholung des Rückenmarks ungewiss bleibt, entfernt eine ausreichende Dekompression die schädigungsbegünstigende Ursache und beendet in den meisten Fällen die Verschlechterungsdynamik. Auch in den Fällen, in denen eine komplette Querschnittläsion besteht, kann die Dekompression perfusionsbedingte Sekundärschäden verhindern.
Hingegen ist in Fällen einer spontanen Erholung und eines Rückgangs der Anfangssymptomatik ein abwartendes Vorgehen zu empfehlen, zugleich, ob Myelopathie-Signale vorliegen oder nicht. Hier kann eine operative Behandlung der Spinalkanalstenose im Verlauf elektiv geplant und die konservative Therapie bei vorhandenen Erholungstendenzen zu Ende geführt werden.
Operative Behandlung von Spätfolgen
Weitere neurochirurgische Aspekte der operativen Behandlung traumatischer Querschnittläsionen und deren Spätfolgen sind die operative Therapie der posttraumatischen Syringomyelie und die der spastischen Lähmung. Obwohl mehr als die Hälfte aller Patienten mit Querschnittläsionen an der Verletzungsstelle eine Zyste – meistens ohne Dynamik oder Wachstumstendenz – im Rückenmark entwickeln, entsteht eine symptomatische posttraumatische Syringomyelie bei ca. 4 % der Patienten innerhalb von 6 Monaten bis zu mehreren Jahren. Die Entstehungsmechanismen der posttraumatischen Syringomyelie sind nicht gänzlich geklärt; jedoch wird ein multifaktorielles Geschehen postuliert, in dem residuelle Kyphosen der Wirbelsäule, Einengungen des Spinalkanals, intramedulläre Hämatome, vaskuläre Dysregulation und gestörte Liquor-Dynamik miteinander zusammenhängende Rollen spielen. Bei symptomatischer Syringomyelie und progredienter neurologischer Befundverschlechterung ist eine operative Therapie angezeigt 16 17. Die operative Therapie der Syringomyelie zielt in erster Linie auf die Beseitigung der Ursache – falls identifizierbar – ab, um ein Fortschreiten der Erkrankung zu verhindern; dabei ist eine genaue Diagnostik mit vollständiger Darstellung des kranialen und kaudalen Endes der Syrinx obligat. So kommen im Falle von residuellen Kyphosen und Einengungen des Spinalkanals dekompressive und/oder stabilisierende Verfahren mit oder ohne Duraerweiterungsplastik – wie oben beschrieben – zur Anwendung.
Wenn keine identifizierbare oder behebbare Ursache der symptomatischen fortschreitenden Syringomyelie vorliegt, besteht die Möglichkeit der operativen Behandlung mittels Shunt. Dabei werden Mikrokatheter in die Syrinx gelegt und die Höhlenflüssigkeit darüber entweder in den Subarachnoidalraum oder in die Pleura oder ins Peritoneum abgeleitet, um so ein Zusammenfallen der Syrinx zu erreichen. Eine weitere Methode ist die Implantation eines subarachnoidal-subarachnoidalen Bypasses; dabei wird ein Mikrokatheter in das kraniale und kaudale Ende des gesunden Subarachnoidalraumes – ohne Myelotomie – implantiert und die Syrinx dadurch überbrückt. Diese Art der Bypass-Operation hat in den letzten Studien gute Ergebnisse in der Behandlung der posttraumatischen progredienten Syringomyelie erzielt 18. Jedoch können diese Methoden zusätzlich zu den allgemeinen Operationsrisiken auch mechanische Komplikationen mit sich bringen, da ein Fremdkörper im Rückenmark verbleibt und es durch mechanische Irritationen oder Verschlüsse zu einer erneuten Syrinx-Entstehung kommen kann.
Einige Wochen nach der Rückenmarkverletzung tritt bei 65 bis 78 % der Querschnittpatienten eine posttraumatische spinale Spastik ein. Wenn diese zu einer funktionellen Verschlechterung oder zu erheblichen Schmerzen führt und die konservative Symptomatik-Regulierung fehlschlägt, kommt die intrathekale antispastische Medikation, zum Beispiel mit Baclofen, über eine implantierte Medikamentenpumpe in Frage. Ziel dieser Operation ist die Reduktion der Spastik auf ein tolerierbares Niveau, da deren Ausmaß einen deutlichen Einfluss auf die Rehabilitationsfähigkeit hat 19.
Schlussfolgerung
Die Entscheidung zur operativen Versorgung bei einer traumatischen Querschnittlähmung im Alter ist von multiplen Faktoren abhängig: Zum einen stellt die Wiederherstellung der Stabilität der Wirbelsäule bei instabilen knöchernen oder diskoligamentären Wirbelsäulenverletzungen den ersten Schritt auf dem Wege der Remobilisation dar; zum anderen zielt sie in solchen Zuständen auf die Herbeiführung einer Schmerzlinderung und die Minimierung von Sekundärschäden. Hingegen hängt die Entscheidungsfindung bei degenerativen Wirbelsäulenprozessen und akuter posttraumatischer neurologischer Verschlechterung bei erhaltener Wirbelsäulenstabilität vom möglichen Vorteil einer Dekompression der neuralen Strukturen ab. Dabei spielt die Dynamik des posttraumatischen neurologischen Status die entscheidende Rolle. In Fällen von lediglich passagerer Verschlechterung des neurologischen Status und spontaner Remission liegt keine dringende Indikation zur operativen Therapie vor, wohingegen eine zunehmende neurologische Verschlechterung, zum Beispiel bei vorliegender zervikaler Spinalkanalstenose, eine dringende OP-Indikation darstellt. Das Timing einer Operation im Fall von stabilen inkompletten Rückenmarkverletzungen und bestehender Kompression ist umstritten. Die Autoren tendieren zur Dekompression dieser Patienten, sobald sie internistisch stabil sind, um einer späteren neurologischen Verschlechterung vorzubeugen.
Nach einer traumatischen Rückenmarkverletzung bleibt die funktionelle Erholung der neuralen Strukturen ungewiss; jedoch ist die Restabilisierung der Wirbelsäule unabdingbar und von immenser Wichtigkeit, unabhängig davon, ob die Querschnittlähmung eine komplette oder eine inkomplette ist. In beiden Fällen bestehen folgende Vorteile einer operativen Therapie: das Wiedererlangen der Stabilität und die dadurch bedingte Erleichterung der Mobilität und der Patientenpflege, eine frühere Einleitung der Rehabilitationsmaßnahmen, ein früherer Verzicht auf Orthesen, eine Schmerzreduktion und die Vorbeugung gegen eine Sekundärschädigung der benachbarten Rückenmarksegmente. All das hilft auch bei der Prävention von Druckulcera und Pneumonie und lässt zudem die Möglichkeit offen, dass die geschädigten neuralen Strukturen sich rehabilitieren.
Durch eine evidenzbasierte umfassende Evaluation der verschiedenen Therapiemöglichkeiten und eine effiziente multidisziplinäre präoperative Vorbereitung können Lebensqualität und Autonomie sowohl älterer als auch jüngerer querschnittgelähmter Patienten positiv beeinflusst werden.
Für die Autoren:
Dr. med. univ. Ghassan Kerry
Paracelsus Medizinische Privatuniversität
Neurochirurgische Klinik
Klinikum Nürnberg, Breslauer Straße 201
90471 Nürnberg
ghassan.kerry@klinikum-nuernberg.de
Begutachteter Beitrag/reviewed paper
Kerry G, Steiner H.-H. Querschnittläsion im Alter – welche Versorgungsmöglichkeit ist wann indiziert? Orthopädie Technik, 2018; 69 (9): 22–27
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Ein engagierter Leistungssportler mit Hemiparese und der Einsatz sensomotorischer Fußorthesen (SMFO) — 12. Februar 2026
- Fassett DR, Harrop JS, Maltenfort M, Jeyamohan SB, Ratliff JD, Anderson DG, et al. Mortality rates in geriatric patients with spinal cord injuries. J Neurosurg Spine, 2007; 7 (3): 277–281
- Jackson AB, Dijkers M, Devivo MJ, et al. A demographic profile of new traumatic spinal cord injuries: change and stability over 30 years. Arch Phys Med Rehabil, 2004; 85: 1740–1748
- Lewis R, Noonan V, Zhong G, et al. What will traumatic spinal cord injury care look like in 20 years in Canada? Resource planning by forecasting. Can J Surg, 2013; 56 (Suppl 2): S65–S66
- Lewis R, Noonan V, Zhong G, et al. What will traumatic spinal cord injury care look like in 20 years in Canada? Resource planning by forecasting. Can J Surg, 2013; 56 (Suppl 2): S65–S66
- Ahn H, Bailey CS, Rivers CS, Noonan VK, Tsai EC, Fourney DR, Attabib N, Kwon BK, Christie SD, Fehlings MG, Finkelstein J, Hurlbert RJ, Townson A, Parent S, Drew B, Chen J, Dvorak MF. Effect of older age on treatment decisions and outcomes among patients with traumatic spinal cord injury. CMAJ, 2015; 187: 873–880
- Rossaint R, Werner C, Zwißler B. Die Anästhesiologie: Allgemeine und spezielle Anästhesiologie, Schmerztherapie und Intensivmedizin. Berlin: Springer-Verlag, 2012
- Hulbert RJ. Methylprednisolone for acute spinal cord injury: An inappropriate standard of care. J Neurosurg (Spine), 2000; 93: 1–7
- Bracken MB, Holford TR. Neurological and functional status 1 year after acute spinal cord injury: estimates of functional recovery in National Acute Spinal Cord Injury Study II from results modeled in National Acute Spinal Cord Injury Study III. J Neurosurg, 2002; 96 (Suppl. 3): 259–266
- Bracken MB, Holford TR. Neurological and functional status 1 year after acute spinal cord injury: estimates of functional recovery in National Acute Spinal Cord Injury Study II from results modeled in National Acute Spinal Cord Injury Study III. J Neurosurg, 2002; 96 (Suppl. 3): 259–266
- Paquet J, Rivers CS, Kurban D., Finkelstein J, Tee JW, Noonan VK, Kwon BK, Hurlbert RJ, Christie S, Tsai EC, Ahn H, Drew B, Bailey CS, Fourney DR, Attabib N, Johnson MG, Fehlings MG, Parent S, Dvorak MF; RHSCIR Network. The impact of spine stability on cervical spinal cord injury with respect to demographics, management, and outcome: a prospective cohort from a national spinal cord injury. The Spine J, 2017; 18 (1): 88–98
- Magerl F, Aebi M, Gertzbein SD, Harms J, Nazarian SA. Comprehensive classification of thoracic and lumbar injuries. Eur Spine, 1994; 3: 184–201
- Vaccaro AR, Lehman RA, Hurlbert RJ, Anderson PA, Harris M, Hedlund R. A new classification of thoracolumbar injuries: the importance of injury morphology, the integrity of the posterior ligamentous complex, and neurologic status. Spine, 2005; 30 (20): 2325–2333
- Hall ED, Springer JE. Neuroprotection and Acute Spinal Cord Injury: A Reappraisal. NeuroRx, 2004; 1: 80–100
- Fehlings MG, Vaccaro A, Wilson JR, et al. Early versus delayed decompression for traumatic cervical spinal cord injury: results of the Surgical Timing in Acute Spinal Cord Injury Study (STASCIS). PLoS One, 2012; 7: e32037
- van Middendorp JJ, Hosman AJ, Doi SA. The effects of the timing of spinal surgery after traumatic spinal cord injury: a systematic review and meta-analysis. J Neurotrauma, 2013; 30: 1781–1794
- Carroll AM, Brackenridge P. Post-traumatic syringomyelia: a review of the cases presenting in a regional spinal injuries unit in the north east of England over a 5‑year period. Spine (Phila Pa 1976), 2005; 30: 1206–1210
- Hayashi T, Ueta T, Kubo M, Maeda T, Shiba K. Subarachnoid-subarachnoid bypass: a new surgical technique for posttraumatic syringomyelia. J Neurosurg Spine, 2013; 18 (4): 382–387
- Hayashi T, Ueta T, Kubo M, Maeda T, Shiba K. Subarachnoid-subarachnoid bypass: a new surgical technique for posttraumatic syringomyelia. J Neurosurg Spine, 2013; 18 (4): 382–387
- Maierl P. Funktionales Verhaltensmuster „Aktivität und Bewegung“ – Spastik. In: Haas U (Hrsg.). Pflege von Menschen mit Querschnittlähmung. Probleme, Bedürfnisse, Ressourcen und Interventionen. Bern: Huber, 2012: 239–246