Einleitung
In der Prothetik sind aufgrund der vielen Innovationen die Ansprüche an die Versorgung gestiegen. Daher ist eine funktionierende Schnittstelle zwischen Stumpf und Schaft wichtiger denn je. Sobald diese Schnittstelle problematisch ist, nützen die besten Passteile wenig. Mit hilfsmitteltechnischen Maßnahmen lässt sich nicht immer das Ziel eines prothesenfähigen Stumpfes erreichen bzw. es liegt deutlich unter den Erwartungen. Dann sollte geprüft werden, ob und welche operativen Maßnahmen sinnvoll sind, um den Stumpf wieder prothesenfähig zu machen. In diesem Zusammenhang merkt Baumgartner im Standardwerk „Amputation und Prothesenversorgung“ an: „Einen schlechten Stumpf vermag auch die beste Prothese nicht zu verbessern, bestenfalls zu verbergen.“ 1
Bei einem nicht prothesenfähigen Stumpf muss als Erstes die Schmerzursache geprüft werden. Hierbei kann der Schmerzursprung im Bereich der Haut, der Muskulatur, der Nerven, der Gefäße und der Knochen zu lokalisieren sein. Häufig sind diese Ursachen multifaktoriell, das heißt, dass z. B. die Ursache für einen nicht prothesenfähigen Stumpf eine Exostose am Knochenstumpf ist, die durch die Weichteile drückt und zusätzlich durch eine schlechte muskuläre Weichteildeckung noch verstärkt wird. Eine gute Weichteildeckung kann evtl. den Druck durch die Exostose kompensieren. Für die operative Planung bedeutet dies wiederum, dass sowohl die Exostose abgetragen als auch die Weichteile korrigiert werden müssen.
Im weiteren Verlauf dieses Artikels wird auf die operativen Korrekturmöglichkeiten für die einzelnen Regionen (Haut, Muskulatur, Nerven und Knochen) und deren Ursachen eingegangen, um einen systematischen Überblick zu schaffen. Wie bereits erwähnt, ist dabei zu beachten, dass häufig eine Kombination aus mehreren operativen Korrekturschritten erfolgen muss. Auf die operativen Korrekturmöglichkeiten und deren Ursachen bei Gefäßproblemen wird in diesem Artikel dagegen nicht eingegangen, da sie eine Domäne der Gefäßchirurgie und Angiologie ist. Es ist zu betonen, dass ein Patient mit einer bekannten peripheren arteriellen Verschlusskrankheit (pAVK) und/oder einem Diabetes mellitus, der einen kalten Stumpf hat oder bei dem die Gefäße in höheren Abschnitten der noch vorhandenen Extremität nicht ertastet werden können, zur Abklärung angiologisch bzw. gefäßchirurgisch vorgestellt werden sollte. Insbesondere bei geplanten operativen Korrekturen am Stumpf sollte der Patient mit Symptomen vorgestellt werden, da bei übersehener pAVK postoperative Wundheilungsstörungen drohen.
Haut
Hautprobleme sind am Amputationsstumpf üblich. Eine niederländische Arbeitsgruppe zeigte, dass nach Amputationen an der unteren Extremität 63 % der Patienten mindestens einmal im Leben Hautprobleme am Stumpf beklagten 2. Zu den Problemen zählen Ulcera, Infektionen, allergische Kontaktdermatitis, Ekzeme, Prothesenrandknoten und noch viele weitere. Die meisten dieser Fälle kann man jedoch konservativ lösen, nur wenige benötigen eine operative Lösung.
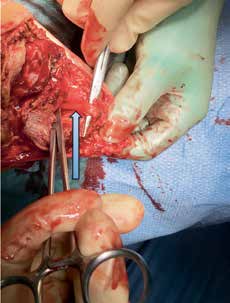
Bei der Amputation versucht man stets, in die Belastungszonen sensible Eigenhaut zu schwenken, die gut unterpolstert ist. Narben sollten nicht in der Belastungszone liegen. Daher ist besonders Haut mit Gefühlsstörungen und/oder solche, die direkt an den Knochen adhärent ist, gefährdet für einen Zusammenbruch ihrer Struktur und die Bildung von Ulzerationen. Diese Schwierigkeiten sind zum Beispiel bei Meshgraft-Transplantaten vorzufinden. So kann es durch Scherkräfte im Prothesenschaft zum Aufreißen transplantierter Haut kommen (Abb. 1). Dennoch sind Meshgraft-Transplantate zur Erhaltung einer maximalen Stumpflänge sinnvoll. Bei jungen Patienten nach traumatischen Amputationen kann die Meshgraft zur Überbrückung eingesetzt werden. In der Interimsphase können sich intakte und dehnbare Haut und Weichteile konditionieren. In einem weiteren Schritt wird die Meshgraft reseziert und der Stumpf vollständig durch Schwenkung von sensibler Haut in die Belastungszone gedeckt. Somit kann für den Patienten eine funktionell sehr wichtige maximale Stumpflänge für die Prothesenversorgung gewonnen werden 3. Ferner darf man nicht vergessen, dass Meshgrafts auf einem belastbaren und gut durchbluteten Muskel sehr gut funktionieren können und keine weitere Revision benötigen.
Tief eingezogene Narben können ein hygienisches Problem darstellen. Sie bilden Kammern für Schmutz, Bakterien und Pilze, die teilweise schwer zugänglich sind. Durch Schweiß kommt es zusätzlich zu Mazerationen der Haut und somit zum Zusammenbruch der Schutzfunktion. Dadurch können Bakterien und andere Erreger in die Haut gelangen und tiefe Infektionen verursachen. Die Exzision dieser eingezogenen Narben ist bei immer wiederkehrenden Infektionen sinnvoll, da sie eine einfache Operation mit geringen Komplikationsraten darstellt. Meistens sind auch keine weiteren größeren Weichteilplastiken oder Nachresektionen am Knochen notwendig.
Chronische Ulzerationen sollten sorgfältig untersucht werden. Oberflächlich erscheinende Ulcera zeigen teilweise klinisch tiefergehende Fistelgänge. Eine Abheilung dieser Ulcera bedingt häufig die Exzision der Fistelgänge. Mittels Fistulographie sollte man präoperativ die Ausdehnung der Fistelgänge darstellen, um die Operation akribisch planen zu können. Eine Beteiligung des Knochens kann mittels Fistulographie ebenfalls bereits erfasst werden. Trotzdem sollten vor einer Exzision der Fistel zusätzlich weitere bildgebende Untersuchungsverfahren wie eine Magnetresonanztomographie oder eine Skelettszintigraphie durchgeführt werden, um eine Osteomyelitis sicher auszuschließen. Falls eine Osteomyelitis vorliegt, muss sie adäquat – zumeist chirurgisch – therapiert werden. Während der Operation kann Methylenblau eingesetzt werden, um den Fistelgang bzw. die Fistelgänge besser darzustellen und die Übersicht bei der Operation zu behalten. Die Fistelgänge und das betroffene Gewebe werden dabei blau angefärbt. Dies erleichtert dem Operateur das Erreichen einer vollständigen Resektion. Persistierende Fistelgänge können im Zeitverlauf zu einer malignen Transformation führen (Fistelkarzinom).
Muskel
Nach einer Amputation können sich am Stumpfende massiv überschüssige Weichteile bilden. Diese können dazu führen, dass der Patient in seiner Prothese nicht ausreichend Stabilität hat. Dieser Weichteilüberschuss kann dadurch bedingt sein, dass bei der Amputation das Gewebe durch Trauma, Infektion und/oder Ischämie stark angeschwollen war. In der postoperativen Phase geht die Schwellung zurück, und es bildet sich ein massiver Weichteilüberschuss, obwohl sich der Stumpf intraoperativ nur schwer verschließen ließ. Es kommt zum Verlust der muskulären Vorspannung. Diese Vorspannung soll eine massive Atrophie der Muskulatur verhindern. Die Atrophie führt zu einer fettigen Degeneration mit verminderter Durchblutung und den dazugehörigen Problemen wie z. B. Ischämieschmerzen. Ebenso kann es bedingt durch das ständige Hinwegrutschen der nicht ausreichend angespannten Muskulatur über das knöcherne Stumpfende zu einer Pseudobursabildung kommen. Eine Pseudobursa entsteht ebenfalls, wenn das knöcherne Stumpfende nicht adäquat mit Muskulatur bedeckt ist und der Knochen direkt auf die Haut drückt.
Diese Zustände können dazu führen, dass der Stumpf nicht prothesenfähig und eine operative Korrektur# notwendig ist. Dabei gibt es zwei unterschiedliche Techniken: Myoplastik und Myodese. Bei der Myoplastik werden die Antagonisten der Muskelstümpfe bzw. die Muskelfaszien über dem knöchernen Stumpfende miteinander vernäht. Dederich schlug diese Technik basierend auf den Erfahrungen aus dem Zweiten Weltkrieg bei Oberschenkelamputationen vor. Dabei vernähte er die Quadrizepsmuskulatur gegen die Hamstring-Muskulatur 4. Allerdings können sich mit der Zeit die Muskelnähte wieder auslockern, sodass es zu einer erneuten instabilen Situation der Myoplastik mit ausgeprägter Dezentrierung des Femurs kommt. Als weitere operative Revisionsmöglichkeit steht die Myodese oder Myopexie zur Verfügung. Ihre Anwendung wird jedoch durch die Knochen- und Muskelqualität begrenzt. Bei der Myodese werden die Muskeln transossär fixiert. Wichtig ist bei allen Techniken ein gut durchbluteter Muskel, sodass die pAVK ein limitierender Faktor sein kann. Besteht präoperativ die o. g. Pseudobursa, wird diese bei der Muskeldeckungsoperation vollständig mitreseziert.
Burgess und Weiss empfehlen die transossäre Technik für den Einsatz bei der Oberschenkelamputation 5. Dabei werden zwei transossäre Bohrlöcher gesetzt, die jeweils ca. 5 bis 10 mm vom knöchernen Stumpfende entfernt sind. Die Bohrlochkanäle liegen dabei ca. in 90-Grad-Stellung zueinander. Die Gefahr bei der Bohrung besteht allerdings darin, dass sich im weiteren Verlauf durch Hitzenekrosen Kronensequester bilden können. Hitzenekrosen entstehen durch inadäquate Kühlung des Bohrers. Das Setzen der Nähte muss in relativer Neutralstellung des Femurs erfolgen. Dabei wird das restliche Femur extendiert und adduziert. Ein Kissen unter dem Gesäß des auf dem Rücken liegenden Patienten ist dabei hilfreich. Für die Naht verwenden die Verfasser einen kräftigen resorbierbaren Faden. Beim Durchstechen des Muskels wird darauf geachtet, dass nicht der ganze Muskel gefasst wird, um Strangulationen zu vermeiden. Es werden vier Schlingen gelegt, um die Muskelstümpfe zu fixieren. Erst nach Legen aller Schlingen werden die Nähte geknotet. Danach wird das knöcherne Stumpfende muskulär gedeckt und die oberflächlichen Muskelfaszien miteinander vernäht. Eine andere Myodesentechnik ist die von Gottschalk und Jaegers vorgeschlagene Adductor-magnus-Technik 6. Dabei wird der Adductor magnus um das Femurende herumgeschlagen und die Sehne des Muskels mit zwei Bohrlöchern am Femur fixiert. Diese Myodesetechnik wurde für die primäre Oberschenkelamputation vorgeschlagen und ist weniger für Stumpfrevisionen geeignet.
Kommt es zu einem Versagen der Myodese mit Abrutschen der Muskulatur und Auftreten erneuter Instabilitäten in der Prothese, so sollte die Revision so früh wie möglich durchgeführt werden. Dies verhindert eine Retraktion und spätere Atrophie der Muskulatur, die eine Revision erschweren und den Operationserfolg unsicherer machen würde.
Nerven
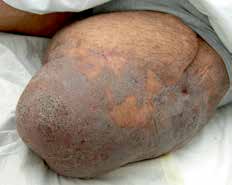
Alle durchtrennten Nerven bilden nach einer Amputation als typische Spätkomplikation ein Neurom. Unzählige Techniken und Technologien wurden entwickelt und vorgeschlagen, um Neuromen und deren akuten Folgen vorzubeugen. Keine dieser Techniken konnte zeigen, dass sie der konventionellen einfachen Neurotomie überlegen ist, wenn der Operateur bei der Amputation einige wichtige Faktoren beachtet. Dazu zählen die ausreichende Kürzung des Nerven und dessen Einbettung in eine gut gepolsterte Region. Die Einbettung erfolgt meistens in die Muskulatur, in der der Nerv vor Druck und mechanischer Irritation geschützt ist. Werden Nerven nicht ausreichend gekürzt und/oder in eine gut gepolsterte Region gelegt, dann liegen sie knapp unter der Haut und teilweise auf dem Knochen, sodass sie stark elektrisierende Schmerzen verursachen und eine Prothesenversorgung teilweise unmöglich machen können. Der N. suralis ist sicherlich mit am häufigsten von o. g. Komplikationen betroffen, da er leider immer wieder bei der Unterschenkelamputation im wahrsten Sinne des Wortes „vergessen“ wird zu versorgen (Abb. 2). Wendet man dann noch die Burgess-Technik an, kommt der Nerv direkt am vorderen tibialen knöchernen Stumpfende zu liegen und wächst meistens in die Hautnarbe ein, mit konsekutiver Ausbildung starker elektrisierender Schmerzen.
Nach einer Amputation kann es trotz adäquater Kürzung und muskulärer Einbettung des jeweiligen Nerven als Spätfolge zu einem symptomatischen Neurom kommen. Dieses ist bedingt durch die mit der Zeit sich entwickelnde Atrophie der umgebenden Weichteilstrukturen. Das Neurom bekommt dadurch eine exponierte Lage im Stumpf und wird mehr Druck ausgesetzt. Falls Änderungen am Schaft nicht zur Beschwerdefreiheit führen, muss das Neurom entfernt werden. Das persistierende symptomatische Neurom wird genauso operativ angegangen wie der frisch durchtrennte Nerv bei der primären Amputation: Es erfolgt eine proximale Neurotomie und Einbettung des Nerven in eine gut gepolsterte Region. Diese Region sollte bzw. muss außerhalb des Endes bzw. der Kante der Prothese liegen, damit der Nerv nicht unnötig erneut höheren Drücken und Scherkräften ausgesetzt ist.
Bei der Revisionsoperation des Nerven kann der Operateur sich überlegen, ob er die Operation durch die alte Narbe durchführt oder einen neuen Schnitt proximaler im Verlauf des jeweiligen Nerven setzt. Nach einer Unterschenkelamputation kann man ein symptomatisches Neurom des N. peroneus (oberflächlicher und/oder tiefer Ast) durch eine kleine Inzision der Haut dorsolateral oberhalb der Kniekehle therapieren. Dabei wird der Nervus peroneus communis an seiner Leitstruktur der Sehne des Musculus biceps femoris aufgesucht und dort ein 2 bis 3 cm langes Segment des Nerven entfernt. Diese Art der Operation hat den Vorteil, dass das operative Trauma geringer ist, da man nicht durch vernarbtes Gewebe präparieren muss und der Schnitt deutlich kleiner sein kann. Für den Patienten bedeutet dies eine geringe Komplikationsrate bei zügigerer Wundheilung und somit schnellere erneute prothetische Versorgung. Der Nachteil dieser Operation ist aber, dass Muskelgruppen denerviert und dadurch atrophisch und funktionslos werden. Ferner muss der weitere prothetische Fortschritt im Bereich Neuroprothetik und Myoelektrik bedacht werden.
Vollständigkeitshalber wird in diesem Beitrag nur kurz die TMR (Target Muscle Reinnervation) erwähnt, die ebenfalls sehr erfolgreich zur Behandlung des symptomatischen Neuroms eingesetzt werden kann und bereits in einem vorausgegangenen Beitrag ausführlich behandelt wurde 7.
Knochen
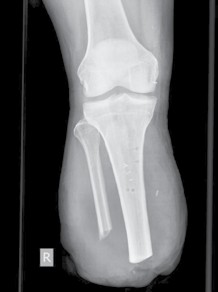
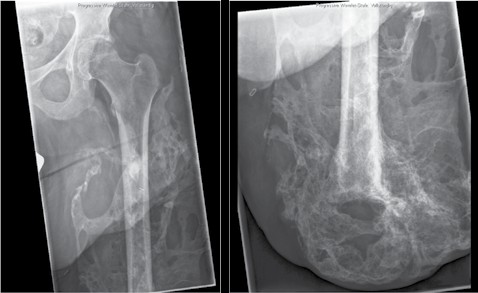
Knochenkanten, Exostosen und heterotope Ossifikationen treten nicht selten nach Amputationen auf. Diese Folgen könnten evtl. durch achtsamen Umgang mit dem Knochen und dem dazugehörigen Periost während der Amputation verhindert werden. Bei der Osteotomie des Knochens sollte beachtet werden, dass das Ende nicht schräg und spitz gesägt wird, sondern derart, dass eine möglichst große lasttragende Fläche gebildet wird und die Kanten sorgfältig abgerundet werden. Ferner sollte das Periost nicht exzessiv gestrippt und Periostfetzen liegen gelassen werden. Ein weiterer Fehler die Unterschenkelamputation betreffend besteht darin, die Fibula länger zu belassen als die Tibia. Des Weiteren darf die Osteotomieebene der Fibula nicht falsch angesetzt werden (Abb. 3). Beim kurzen Unterschenkelstumpf sollte die proximale Fibula zudem nicht belassen werden, da die fehlende Membrana interossea zu einer Hypermobilität der restlichen Fibula führen kann. Bei Vorliegen einer solchen Instabilität kann zunächst versucht werden, den Schaft auszubessern und der hypermobilen Fibula ausreichend Platz zu geben. Falls dies nicht zur Beschwerdefreiheit führt, sollte die restliche Fibula vollständig reseziert werden.
Eine symptomatische tibiofibulare Instabilität kann auch bei langen Unterschenkelstümpfen entstehen. Führen Schaftänderungen nicht zur Beschwerdefreiheit, können die Patienten mit einer Knochenbrücke zwischen Fibula und Tibia therapiert werden. Im angloamerikanischen Raum wird dieses Verfahren als „Ertl procedure“ bezeichnet, obwohl die Idee auf den Chirurgen August Bier (1861–1949) zurückgeht und von Ertl und Dederich im Zweiten Weltkrieg sowie von Guedes-Pinto im jetzigen Jahrhundert weiterentwickelt wurde 8. Bei der Knochenbrücke nach Ertl/Dederich wird vor allem ein kortikoperiostaler Lappen von der Tibia genutzt, während Guedes-Pinto ein Stück Fibula verwendet. Beim Verfahren nach Ertl/Dederich wird das Periost an der vorderen Tibiakante und an der hinteren medialen Kante längsinzidiert. Dann werden mittels Meißel aus der Kortikalis vorsichtig Knochenchips herausgeschlagen und der Lappen gebildet. Wichtig ist, dass die Knochenchips dabei in Verbindung mit dem Periost bleiben. Auf gleiche Weise wird nun ebenfalls ein 5 bis 7 cm langer lateraler Lappen gebildet. Danach wird die Tibia unter Schonung der Lappen am Lappenrand osteotomiert. Die Kanten werden abgerundet. Die Fibula wird auf gleicher Höhe leicht schräg abgesetzt. Die kortikoperiostalen Lappen werden zu einem Schlauch vereinigt und an der Fibula fixiert. Die Kortikalisspäne sind innenliegend. Beim Verfahren nach Guedes-Pinto wird ein Stück Fibula in eine zuvor gebildete Nut in Tibia und Fibula verankert. Wichtig ist dabei, dass Muskulatur bei der Gewinnung an dem Fibulasegment erhalten bleibt, um die Durchblutung zu gewährleisten. Das Fibulasegment kann mittels Schrauben, Drähten oder resorbierbaren transossären Nähten fixiert werden. Im angloamerikanischen Raum wird häufig eine Kombination aus beiden Verfahren angewendet.
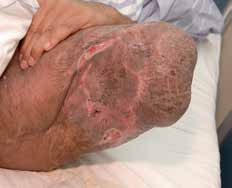
Knochenkanten und Exostosen, die zu nicht prothesenfähigen Stümpfen führen, können einfach reseziert und geglättet werden, teilweise in Kombination mit weichteilverbessernden Maßnahmen. Heterotope Ossifikationen stellen ein größeres Problem dar (Abb. 4). Sie treten bei ca. 23 % der zivilen Patienten nach Amputationen auf, unabhängig von der Ätiologie 9, und bei ca. 63 % der kriegsbedingten Amputationen 10. Bei den kriegsbedingten Amputationen stellten Explosionsverletzungen und Amputationen direkt im Bereich der Verletzung einen Risikofaktor für die Entstehung heterotoper Ossifikationen dar 11. Ferner sind heterotope Ossifikationen häufig mit Rückenmarks- und Hirnverletzungen assoziiert. Die Revisionsoperationen sind häufig nicht nur groß und aufwendig, sondern auch mit hohen Komplikationsraten behaftet. Als Komplikationen treten beispielsweise Blutungen sowie Wundheilungsstörungen auf. Erfreulicherweise können die meisten Komplikationen gut beherrscht werden, und die Patienten erlangen weitestgehende Schmerzfreiheit und prothesenfähige Stümpfe. Patienten, die trotz der Revisionsoperation keine prothesenfähigen Stümpfe erlangen, bedingt z. B. durch Reossifikationen, können auch der Osseointegration zugeführt werden. Auf die Osseointegration wird in diesem Beitrag ebenfalls nicht weiter eingegangen, da sie bereits in einem vorausgegangenen Beitrag ausführlich behandelt wurde 12.
Bei Kindern können ebenfalls spitze knöcherne Stumpfenden die prothetische Versorgung erschweren. Es kann sogar zur Perforation der Haut kommen. Die Ursache dafür sieht man einerseits in der proximal erhaltenen Wachstumsfuge und andererseits in der mechanischen Wirkung der Muskulatur auf die Knochenform 13. Es gibt diverse OP-Techniken zur Verhinderung eines erneuten spitzen knöchernen Stumpfes. Diese wurden aber bisher teilweise nicht wissenschaftlich fundiert nachuntersucht. Aus diesem Grund soll aktuell keine operative Therapieempfehlung abgegeben werden.
Schlussfolgerung
Um unnötige Revisionsoperationen zu vermeiden, sollte zuallererst die primäre Amputation sorgfältig durchgeführt werden. Treten in der Folge Komplikationen auf, können sie meistens mit Modifikationen am Prothesenschaft und/oder anderen konservativen Therapieformen erfolgreich behandelt werden und benötigen keinerlei operative Revision. Jedoch können für Patienten mit persistierenden Beschwerden Revisionsoperationen sinnvoll sein, um Schmerzfreiheit, bessere Funktionalität, Prothesenakzeptanz und nicht zuletzt Lebensqualität zu gewinnen. Diese Operationen sollten sorgfältig geplant und in spezialisierten Einrichtungen durchgeführt werden.
Für die Autoren:
Dr. med. Tymoteusz Budny
Universitätsklinikum Münster
Klinik für Allgemeine Orthopädie und Tumororthopädie
Albert-Schweitzer-Campus 1, Gebäude A1
48149 Münster
Tymoteusz.budny@ukmuenster.de
Begutachteter Beitrag/reviewed paper
Budny T, Hardes J, Wegs V, Gosheger G. Operative Stumpfkorrekturen bei nicht prothesenfähigen Stümpfen an der unteren Extremität. Orthopädie Technik, 2016; 67 (10): 36–39
- Dynamische Hüftabduktions-Lagerungsorthese zur Behandlung pathologisch veränderter Hüften bei neuromuskulären Erkrankungen in der Kinderorthopädie — 5. Juni 2025
- Ein neuronal gesteuertes Exoskelett in der Therapie von Patientinnen und Patienten mit Querschnittlähmung — 5. Juni 2025
- Digitale Wunddokumentation: Warum Papier keine Option mehr ist — 5. Juni 2025
- Schäfer M, Baumgartner R. Prinzipien der Prothesentechnik. In: Greitemann B, Brückner L, Schäfer M, Baumgartner R. Amputation und Prothesenversorgung. 4., vollständig überarbeitete Auflage. Stuttgart: Thieme-Verlag, 2016: 159
- Meulenbelt HE, Geertzen JH, Jonkman MF, Dijkstra PU. Determinants of skin problems of the stump in lower-limb amputees. Arch Phys Med Rehabil, 2009; 90 (1): 74–81
- Polfer EM, Tintle SM, Forsberg JA, Potter BK. Skin grafts for residual limb coverage and preservation of amputation length. Plast Reconstr Surg, 2015; 136 (3): 603–609
- Dederich R. Technique of myoplastic amputations. Ann R Coll Surg Engl, 1967; 40 (4): 222–226
- Murdoch G. Myoplastic Techniques. Bulletin of Prosthetics Research, 1968; 10 (9): 4–13
- Gottschalk F, Jaegers SMHM. Transfemoral Amputation. In: Murdoch G, Wilson AB (eds.). Amputation: Surgical Practice and Patient Management. New York: Butterworth Heinemann, 1996
- Salminger S, Mayer JA, Sturma KD, Bergmeister KD, Riedl O, Aszmann OC. Plastischchirurgische Verfahren zur Verbesserung der Stumpfqualität. Orthopädie Technik, 2016; 67 (7): 40–44
- Baumgartner R, Greitemann B. Knochenbrücke zwischen Tibia und Fibula. In: Greitemann B, Brückner L, Schäfer M, Baumgartner R. Amputation und Prothesenversorgung. 4., vollständig überarbeitete Auflage. Stuttgart: Thieme-Verlag, 2016: 315–317
- Matsumoto ME, Khan M, Jayabalan P, Ziebarth J, Munin MC. Heterotopic ossification in civilians with lower limb amputations. Arch Phys Med Rehabil, 2014; 95 (9): 1710–1713
- Potter BK, Burns TC, Lacap AP, Granville RR, Gajewski DA. Heterotopic ossification following traumatic and combat-related amputations: Prevalence, risk factors and preliminary results of excision. J Bone Joint Surg Am, 2007; 89 (3): 476–486
- Potter BK, Burns TC, Lacap AP, Granville RR, Gajewski DA. Heterotopic ossification following traumatic and combat-related amputations: Prevalence, risk factors and preliminary results of excision. J Bone Joint Surg Am, 2007; 89 (3): 476–486
- Salminger S, Mayer JA, Sturma KD, Bergmeister KD, Riedl O, Aszmann OC. Plastischchirurgische Verfahren zur Verbesserung der Stumpfqualität. Orthopädie Technik, 2016; 67 (7): 40–44
- Baumgartner R, Brückner L. Stumpfkappenplastik nach Ernst Marquardt. In: Greitemann B, Brückner L, Schäfer M, Baumgartner R. Amputation und Prothesenversorgung. 4., vollständig überarbeitete Auflage. Stuttgart: Thieme-Verlag, 2016: 482–483