Einleitung
Die Neurotechnik elektrisiert Patienten, Ärzte und Techniker gleichermaßen mit der Idee, über Nervensignale Prothesen zu steuern, Fühlen durch Strompulse wiederherzustellen und Krankheiten durch “Überschreiben“ der Nervensignale zu behandeln. Was ist heute schon möglich, was sogar schon im klinischen Einsatz, und was ist Zukunftsmusik?
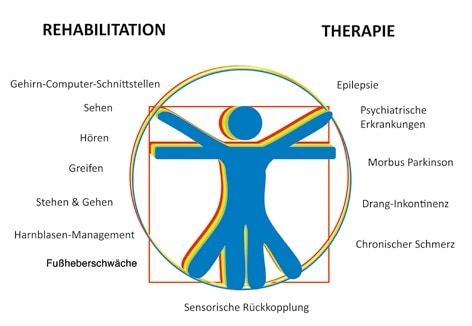
Der Begriff der Neurotechnik ist im deutschen Sprachgebrauch noch recht jung, wird international als “neural engineering“ an der Schnittstelle zwischen Medizintechnik, Neurowissenschaften, Medizin und Rehabilitationstechnik aber schon seit über zehn Jahren verwendet. Die Neurotechnik umfasst im Hinblick auf medizinische Anwendungen die Neuroprothetik zur Wiederherstellung verloren gegangener sensorischer und motorischer Funktionen sowie die Neuromodulation zur Behandlung neurologischer Erkrankungen. In den letzten Jahren ist noch die bioelektrische Medizin hinzugekommen, die auch mit dem Begriff der Elektrozeutika beschrieben wird. Dieser Teil hat sich zum Ziel gesetzt, Erkrankungen der inneren Organe, die üblicherweise mit Pharmazeutika medikamentös behandelt werden, mit Hilfe neuroelektrischer Implantate zu behandeln. Dabei wird für alle in Forschung und Klinik verwendeten Ansätze und Geräte (Abb. 1) in diesem Artikel zur Vereinfachung der Begriff der Neuroprothesen verwendet, auch wenn es sich um Neuromodulation oder bioelektronische Anwendungen handelt.
Der Urahn aller elektrisch aktiven Implantate ist der Herzschrittmacher, der mittlerweile über 350.000-mal pro Jahr bei Patienten implantiert wird. An ihm müssen sich Neuroimplantate messen, wenn es um Patientenzahlen, aber auch um Wirtschaftlichkeit und Absatzmarkt geht 1. Eine Studie zur Verbreitung von Erkrankungen, bei denen das Gehirn eine entscheidende Rolle spielt – von Depressionen über Schlaganfall bis hin zu Morbus Parkinson – zeigt bereits für das Jahr 2010 auf, dass die jährlichen Kosten im Gesundheitswesen in Europa diejenigen für Herz-Kreislauf- und Krebs-Erkrankungen zusammen übersteigen; Tendenz steigend in der alternden Gesellschaft Europas 2.
Ein Bedarf scheint vorhanden zu sein. Wie sehen die gegenwärtigen Lösungen aus und welchen Herausforderungen müssen sich Forschung und Medizintechnik-Industrie stellen? Diese Fragen sollen beleuchtet und zukünftige Entwicklungstrends anhand von Beispielen zur bedarfsgerechten Neuromodulation des Gehirns mit Elektrodenarrays, des Funktionsersatzes und des “Überschreibens“ von Signalen zur Therapie anstelle von Medikamentengabe erläutert werden.
Neurotechnische Implantate in Forschung und klinischer Praxis
Elektrisch aktive Implantate im medizinischen Einsatz helfen bei der Diagnose von Erkrankungen, indem mit ihnen Signale aufgenommen und Ereignisse erkannt werden. Sie modulieren die Nervenaktivität und lindern dadurch Symptome von Erkrankungen. In der Rehabilitation ersetzen sie funktionell die verloren gegangenen Funktionen 3. Im Bereich der Forschung wurden alle erdenklichen Anwendungen bereits untersucht und in Pilotstudien auf den Menschen übertragen (siehe Abb. 1). Wiederherstellung von Seh- und Hörsinn, Greifen, Stehen und Gehen, Zwerchfellstimulation zur Atmung, Stimulation des um das Herz gewickelten Schultermuskels zur Herzkraftunterstützung, Aktivierung des Fußes nach Schlaganfall (Fallfuß) und Harnblasenmanagement sind in der Rehabilitation bereits untersucht worden. Elektrische Stimulation des Rückenmarks zur Verringerung chronischen Schmerzes und zur Behandlung von Dranginkontinenz, Tiefenhirnstimulation bei Morbus Parkinson, aber auch bei schwersten psychiatrischen Erkrankungen, Gehirn- und Vagusnervstimulation bei Epilepsie stellen Optionen zu medikamentösen Therapien bereit.
Bei jeder Anwendung sind im Hinblick auf die Funktion, den Nutzen und die Sicherheit einige grundlegende Fragen zu beantworten. Die “W‑Fragen“ für Implantate lauten:
- Warum will ich ein Neuroimplantat verwenden? (medizinischer Hintergrund)
- Wo soll es implantiert werden? (Ort)
- Wie kommt es dorthin? (operativer Zugang)
- Wie viele Kanäle benötige ich? (Komplexität)
- Wie oft soll es stimulieren? (Funktionsweise und ‑dauer)
Unabhängig von den Antworten auf diese Fragen müssen die grundlegenden Anforderungen, wie sie das Medizinproduktegesetz vorschreibt, erfüllt werden. Ihre Erfüllung gewährleistet die Sicherheit und Verträglichkeit des Implantates im Zielgewebe. Die Material-Gewebe-Schnittstelle muss derart beschaffen sein, dass es aufgrund der Implantation zu keinerlei Veränderung der Nervenaktivität kommt. Das Material darf keine giftigen Stoffe freisetzen und auch selbst nicht giftig sein (Oberflächenbiokompatibilität), und es darf durch seine Formgebung nicht das Zielgewebe schädigen (Strukturbiokompatibilität). Spitze Ecken und scharfe Kanten sind ebenso zu vermeiden wie steife Materialien in direktem Kontakt zum weichen Nervengewebe. Die Lebensdauer eines aktiven Implantates muss heutzutage im Bereich von Jahren bis Jahrzehnten liegen. Batteriewechsel wie bei Herzschrittmachern werden toleriert, wenn der Nutzen des Implantates hoch genug ist.
Die Forschung zu neurotechnischen Implantaten hat innerhalb der letzten zehn Jahre rasant zugenommen und eine Vielzahl technischer Prototypen von Elektroden und elektronischen Systemen hervorgebracht. Nur wenige Gruppen nehmen sich jedoch der Herausforderung an, einen Prototyp unter den regulatorischen Anforderungen der europäischen Richtlinien in ein zugelassenes Medizinprodukt zu überführen. Im Durchschnitt dauert dieser Prozess über 12 Jahre und benötigt neben einem langen Atem auch eine solide finanzielle Basis und geduldige Kapitalgeber.
Mittlerweile sind in der Neuroprothetik einige Erfolgsgeschichten geschrieben worden 4. Die größte stellen derzeit die Cochlea-Implantate dar, die Mitte der 1980er Jahre zum ersten Mal in Pilotstudien ertaubten Menschen einen Höreindruck vermittelten und heute weltweit bei mehr als einer Viertelmillion Menschen implantiert sind. Durch Implantation im frühkindlichen Alter können taub geborene Kinder mit Hilfe eines Implantates das Hören lernen und vergleichbare Wege zu ihren hörend geborenen Gleichaltrigen beschreiten. Rückenmarkstimulatoren unterdrücken bei mehr als 130.000 Patienten chronische Schmerzen, jährlich kommen rund 14.000 neue Patienten hinzu. Tiefenhirnstimulation wird bei über 80.000 Patienten bei Morbus Parkinson eingesetzt, um Zittern (Tremor) und Bewegungssteifigkeit (Akinese) zu behandeln und die überschießenden Bewegungen (Dyskinesien) aufgrund der medikamentösen Therapie zu verringern. Da das Gehirn keinerlei Schmerzempfindung hat, fühlen die Patienten den Strom nicht als unangenehme Erscheinung.
Andere zugelassene Systeme sind entweder wie der Sakralwurzelstimulator zur Harnblasenentleerung nach Querschnittlähmung oder der Atemschrittmacher durch alternative Methoden wie Botulinustoxin-Injektion oder mobile Überdruckbeatmungsgeräte ersetzt oder bislang nur bei relativ wenigen Patienten implantiert worden. Die beiden zugelassenen Sehprothesen besitzen erst seit wenigen Jahren eine Zulassung und helfen knapp 100 Patienten weltweit, sich frei in der Umgebung zurechtzufinden. Auch implantierbare Stimulatoren zur Behebung der Fußheberschwäche nach Schlaganfall (Fallfuß) sind erst bei ungefähr 100 Patienten im Einsatz. Damit Implantate ihre Arbeitsweise bedarfsgerecht anpassen können, müssen Informationen über den Patienten aufgenommen werden 5: Erste Geräte befinden sich im klinischen Einsatz, bei denen die Stromstärke angepasst wird, je nachdem, ob der Patient steht, sitzt oder liegt. Änderungen der Herzfrequenz werden als Zeichen für einen bevorstehenden epileptischen Anfall gedeutet, die die Vagusnervstimulation einleiten. Ein Implantat, das die Stimulation nach Aufnahme der Gehirnsignale autonom in einer geschlossenen Regelschleife einsetzt, wurde 2014 in den USA als Medizinprodukt in der Epilepsietherapie zugelassen. Das System entscheidet anhand der Signale selbstständig, ob ein Anfall im Entstehen ist und durch Senden von elektrischen Impulsen unterbrochen werden muss. Die Patienten sind zwar noch nicht zu 100 % anfallsfrei, können jedoch ihren alltäglichen Tätigkeiten wieder im normalen Rahmen nachgehen.
Die Entwicklung von Implantaten für Anwendungen wie chronische Lähmung, Epilepsie, Schlaganfall und Morbus Parkinson erfordert interdisziplinäre Verbundforschung über Jahre hinweg, um Erfolge aufweisen zu können. Forschungsprogramme wie Präsident Obamas “Brain Initiative“ in den USA oder Forschungscluster innerhalb der deutschen Exzellenzinitiative bieten hierzu gute Rahmenbedingungen. Der Exzellenzcluster “BrainLinks-BrainTools“ an der Albert-Ludwigs-Universität Freiburg bindet Ingenieure, Naturwissenschaftler und Mediziner in ein Forschungsumfeld ein, das die Grundlagen bildet, neue Ideen zu generieren und bis zur Anwendung in klinischen Studien am Menschen weiterzuentwickeln. Die Herausforderungen an Neuroprothesen als intelligente Implantate, die in geschlossenen Regelkreisen möglichst autonom arbeiten und mit wenig Energiebedarf am besten autark auskommen sollen, sind mannigfaltig. Dabei sehen die Detaillösungen für jede Anwendung unterschiedlich aus, auch wenn die grundlegenden Anforderungen gleich sind.
Möglichkeiten und Herausforderungen für mikrotechnische Neuroimplantate
Mikrotechnische Fertigungsverfahren erlauben die Fertigung feinster Systeme mit Strukturgrößen, die kleiner als der Durchmesser eines menschlichen Haares (ca. 70 Mikrometer = 0,070 mm) sind. Diese Mikroimplantate können in den peripheren Nerven oder um ihn herum implantiert werden, auf das Gehirn gelegt oder in die Großhirnrinde oder tiefe Hirnstrukturen hinein implantiert werden 6. Neue Materialien und die Integration mikroelektronischer Schaltungen lassen komplexe intelligente Implantate entstehen, die neue Möglichkeiten eröffnen, die aber zuallererst die grundlegenden Anforderungen an Biokompatibilität und Biostabilität erfüllen müssen. Anhand dreier ausgewählter Ansätze werden im Folgenden die Möglichkeiten der Mikrotechnologien erläutert.
1. Strukturbiokompatibilität durch smarte Materialien
Der Körper erkennt Implantate als Fremdkörper und versucht sie entweder aufzulösen oder, wenn dies nicht gelingt, so mit einer Zellschicht einzukapseln, dass sie von den restlichen Zellen nicht mehr als Fremdkörper erkannt werden. Während orthopädische Implantate (wie beispielsweise Hüftendoprothesen) Kräfte aufnehmen und sich gut am Knochen abstützen müssen, sollen sich neurotechnische Implantate möglichst mit dem umgebenden Nervengewebe mitbewegen, ohne auf es zu drücken oder sich relativ zu ihm zu bewegen. Die mechanische Anpassung von technischem Material und biologischem Zielgewebe erfordert weiche technische Materialien bzw. sehr kleine Implantate, die im dauerhaften Kontakt mit dem Weichgewebe flexibel, aber robust genug sind, dass sie dem Milieu im Körper widerstehen. Je kleiner, weicher und graziler die technischen Strukturen sind, desto schwieriger wird auch deren Implantation.
Die Forschung kümmert sich nicht nur um die Entwicklung geeigneter Implantationswerkzeuge, sondern arbeitet auch an Ansätzen zu bioresorbierbaren Beschichtungen, mit denen die Implantate überzogen werden. Die Schichten versteifen die feinen Kontakte und Trägerstrukturen und schützen sie. Nach der Implantation lösen sie sich im Gehirn auf und lassen flexible Kontakte und Zuleitungen zurück, die wie Seegras im Meer den Bewegungen des Gehirns bei Atmung und Herzschlag folgen. Auch an Tarnkappenbeschichtungen wird gearbeitet, um die Fremdkörperreaktionen zu verringern und dauerhaft die elektrischen Signale einzelner Zellen mit dem Implantat aufzunehmen, ohne dass isolierende Zellen der Immunabwehr sich dazwischensetzen und langfristig das Signal abschirmen. Forschergruppen aus Materialwissenschaft, Chemie, Mikrotechnik und Neurowissenschaften widmen sich diesem Thema. Die Ergebnisse der meist erkenntnisorientierten, grundlagenwissenschaftlichen präklinischen Studien aus den unterschiedlichsten Richtungen weisen Erfolge bislang nur bei Nagern auf. Von dort ist es aber noch ein langer Weg zu humanen Erfolgen. Bis diese Erkenntnisse in zugelassenen Medizinprodukten zu finden sind, gehen noch viele Jahre ins Land.
2. Erhöhte Komplexität und Miniaturisierung
Neurotechnische Implantate sind komplexe Systeme mit elektronischen Schaltungen in hermetischen Gehäusen, die die Elektronik vor Wasser, Salzen und Enzymen aus dem Körper und den Körper vor toxischen Stoffen aus den elektronischen Bausteinen schützen. Eine große Herausforderung stellen elektrisch leitfähige Durchführungen durch ein solches gas- und wasserfestes Gehäuse dar. Im klinischen Alltag stellen Cochlea-Implantate mit gut 20 Durchführungen gegenwärtig die obere technologische Grenze dar. Für neuartige Implantate im Gehirn, die die Aktivität aufzeichnen und damit technische Hilfsmittel oder gar Sehprothesen ansteuern sollen, werden mindestens Hunderte, teilweise über eintausend solcher Durchführungen gefordert. Eine Skalierung “nach oben“ mit etablierten Technologien ist keine Lösung, da die Anatomie der Zielregion die maximale Implantatgröße vorgibt. Kleinere Abstände und Strukturgrößen sind die einzige Möglichkeit, die Gesamtgröße eines Implantates bei höherer Komplexität beizubehalten, sie im Idealfall sogar noch zu verkleinern. Neue Technologien und Materialien müssen hierbei auf ihre Biokompatibilität und Langzeitstabilität in der Körperflüssigkeit, Gesamtsysteme auf ihre Robustheit getestet werden, damit sie auch nach (Verkehrs-)Unfällen noch sicher arbeiten und den Implantatträger nicht schädigen. Parallel zur Implantatentwicklung müssen immer auch Prüfmethoden entwickelt und validiert werden, damit die Zuverlässigkeit der Implantate über ihre Lebensdauer vor dem Markteintritt sichergestellt werden kann.
3. Anpassung mit Hilfe von Redundanz
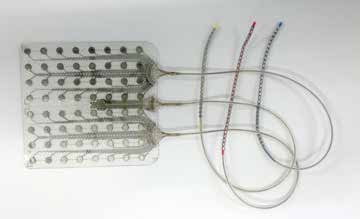
Neurotechnische Implantate werden zur Behandlung fortschreitender Erkrankungen wie Morbus Parkinson eingesetzt oder sollen Gehirnaktivitäten bei Epilepsie als Therapiemaßnahme verändern. Auch bei modernsten Bildgebungsverfahren bleibt stets eine Restunsicherheit über die Anatomie des einzelnen Patienten vor der Operation. Die erste Justierung der Neuroimplantate findet zunächst intraoperativ durch ihre Platzierung statt, danach elektronisch über eine Veränderung der Strompulse auf den ausgewählten Elektroden oder durch Umschalten auf einen anderen Kontakt auf dem Implantat. Ohne die spezifische Anatomie eines Patienten zu kennen, ist eine Implantation nur dann erfolgreich, wenn genügend Elektroden vorhanden sind, die nach der Operation elektronisch ausgewählt werden können (Abb. 2). Sind sie in so hoher Zahl vorhanden, dass eine Redundanz vorliegt, so kann ein intraoperatives Screening deutlich verkürzt werden. Gerade für Untersuchungen, bei denen nicht von vornherein klar ist, wo ein gewünschtes Signal auf der Großhirnrinde zu erwarten ist, wie bei der prächirurgischen Epilepsiediagnostik oder wenn es bei Gehirn-Computer-Schnittstellen durch die Plastizität im Gehirn aufgrund von Lernprozessen zu räumlichen Verschiebungen der Signale kommt, kann Redundanz bei Elektrodenkontakten die Lösung darstellen, auch langfristig die bestmöglichen Signale aufzunehmen 7. Die Herausforderung bei diesem Ansatz stellt die große Anzahl der Kontakte dar. Die Kontakte müssen über Zuleitungen mit einem Implantatgehäuse und der innenliegenden Aufnahmeelektronik verbunden werden. Zuverlässige miniaturisierte Gehäuse mit einer hohen Zahl elektrischer Durchführungen sind die unabdingbare Voraussetzung für diese Lösung.
Welche medizinischen Ansätze mit den vorgestellten technologischen Entwicklungen der Mikrotechnik möglich sind, wird im Folgenden am Beispiel der Therapie von Bluthochdruck und am sensorischen Feedback nach Amputation vorgestellt.
Therapie von Bluthochdruck mit Strom statt mit Pillen
Von einer Bluthochdruckerkrankung (arterielle Hypertonie) sind ca. 25 % der deutschen Bevölkerung betroffen. Trotz großer Fortschritte in der medikamentösen, antihypertensiven Therapie und bei präventiven Gesundheitsprogrammen kann bei ca. 35 % dieser Patienten der Blutdruck nicht dauerhaft in den therapeutisch gewünschten Bereich (systolisch < 140 mmHg) gesenkt werden. Da der Bluthochdruck für über 50 % aller Folgeerkrankungen im Herz-Kreislauf-System und bei Schlaganfällen verantwortlich ist und sowohl eine große Sterblichkeit aufweist als auch hohe Kosten für das Gesundheitssystem verursacht, besteht Handlungsbedarf.
Der Blutdruck des menschlichen Körpers wird hauptsächlich von drei Systemen kontrolliert: Das akute System verfügt über (körpereigene) Drucksensoren, die sich in den Gefäßwänden vor allem der Aorta und der Halsschlagadern befinden. Die Sensoren in der Halsschlagader (dem Sinus caroticus), übermitteln ihre Signale über den N. glossopharyngeus an den Hirnstamm. Die Sensoren in der Aorta, Aortenbogenrezeptoren genannt, sind über den N. vagus mit dem Hirnstamm verbunden. Melden diese Sensoren einen Blutdruckanstieg oder ‑abfall, reagiert das Gehirn reflexartig hierauf und steuert durch Veränderung der Herzkraft und der Gefäßwiderstände dagegen. Dieser Regelkreislauf wird Baroreflex genannt und ist der Ansatzpunkt für neurotechnische Therapieansätze.
Seit einigen Jahren ist ein Implantat auf dem Markt, das die Druckrezeptoren auf den Blutgefäßen elektrisch stimuliert und damit den Blutdruck über den Baroreflex senkt 8. Bislang bietet es noch keine Möglichkeit, die Stimulation an den vorherrschenden Blutdruck anzupassen oder gar den Blutdruck über die Aufnahme der Aktivität der körpereigenen Sensoren abzuschätzen. Die Information der Aortenbogenrezeptoren wird beim Menschen über den N. vagus an den Hirnstamm weitergeleitet. Dieser Nerv kann im Bereich des Halses relativ leicht kontaktiert und stimuliert werden, ohne die Rezeptoren direkt stimulieren zu müssen. Eine unselektive Stimulation des gesamten Nerven führt allerdings zu unerwünschten Nebenwirkungen wie Verlangsamung des Herzschlages (Bradykardie) oder Aussetzern in der Atmung (Apnoe) sowie Magen-Darm-Beschwerden. Die weiter oben schon beschriebenen Vagusnerv-Stimulatoren zur Reduktion der Anfallshäufigkeit bei Epilepsiepatienten bewirken aufgrund der geringen Amplituden und der intermittierenden Stimulation gewöhnlich keine Blutdrucksenkung. Soll die Stimulation des Vagusnerven zur Blutdrucksenkung eingesetzt werden, bedarf es also eines Verfahrens, selektiv nur diejenigen Fasern zu stimulieren, die für die Blutdrucksenkung verantwortlich sind.
Ziel der Verfasser ist es, im Rahmen einer individualisierten Therapie die körpereigenen Blutdrucksignale aus dem Vagusnerven aufzunehmen und deren Ort im Nervenquerschnitt zu bestimmen (Abb. 3). Anschließend werden aus diesen Blutdruckdaten errechnete Bedarfswerte in elektrische Stimulationssignale umgesetzt, mit denen über den Baroreflex der Blutdruck gesenkt wird 9. In einem geschlossenen Regelkreis wird so patientenindividuell dauerhaft der Blutdruck geregelt. Die technische Schnittstelle zum Nerven besteht aus einer Manschettenelektrode, auf deren Umfang Elektroden verteilt sind, mit deren Hilfe die Signalquelle im Nerven ermittelt werden kann. Räumlich selektive Stimulation erregt dann nur diese Blutdruck-Information tragenden Fasern und überschreibt das ursprüngliche Signal mit Strompulsen, sodass der Blutdruck je nach Muster dieser Pulse kurz- oder langfristig gesenkt wird. Signalverarbeitung und Schnittstelle zum Nerven wurden gemeinsam optimiert und in ein Implantatkonzept umgesetzt, das nun zu einem Medizinprodukt weiterentwickelt werden soll.
Nervenschnittstellen für fühlende Prothesen
Hand- und Beinprothesen haben sich in den letzten Jahren rasant weiterentwickelt. Handprothesen können mit Hilfe von Muskelsignalen unterschiedliche Griffe ausführen und Finger unabhängig voneinander bewegen. In die Ansteuerung der Handprothesen ist viel Entwicklungsarbeit geflossen, die die Patienten nun im Alltag nutzen können. Das Fühlen mit der künstlichen Hand, die sensorische Rückmeldung von Griffkraft und Festigkeit der gegriffenen Gegenstände, ist allerdings noch nicht in intuitiv nutzbare Produkte umgesetzt worden, sondern noch Gegenstand der Forschung. Der Wegfall dieser sensorischen Rückmeldung nach Amputation durch den Wegfall der Hand und deren Sensoren ist einer der Gründe für Phantomschmerz, an dem viele Menschen nach Amputation leiden.
Eine Frage, der die Autoren im Rahmen europäischer Verbundforschung im 7. Rahmenprogramm nachgehen, lautet, ob ein Patient durch Elektrostimulation der noch im Amputationsstumpf vorhandenen Nerven intuitiv sensorische Informationen über Griffkraft und Objektform wahrnehmen und zur Steuerung von Handprothesen einsetzen kann. Inwieweit diese Stimulation auch den Phantomschmerz beeinflussen kann, ist ein weiterer Punkt der geplanten klinischen Studien. Innerhalb von fünf Jahren wurde eine haarfeine Elektrode entwickelt und präklinisch getestet 10, mit der Faserbündel im Nerven selektiv stimuliert werden können (Abb. 4). Je zwei Elektroden mit jeweils 14 Kontaktpunkten wurden in einer humanen Pilotstudie an einem Patienten 11 12 in den N. ulnaris und den N. medianus im Arm implantiert. In einem aufwendigen Screeningverfahren wurden diejenigen Kontaktpunkte auf den Elektroden identifiziert, bei denen der Patient ein Berührungsgefühl von den Innenseiten des Daumens, des Zeigefingers und des kleinen Fingers berichtete. Diese Kontaktpunkte der Elektroden stellten nun den Rückmeldekanal dar, über den Informationen von Kontakt und Kraft aus Sensoren der Handprothese als elektrische Stimulationssignale in die Nerven eingeleitet und an den Patienten zurückgemeldet wurden. Durch diese Art der Rückmeldung gelang es dem Patienten nahezu intuitiv, innerhalb weniger Minuten die Informationen beim Greifen nutzbar zu machen. Er konnte drei unterschiedliche Formen (Kugel, Zylinder, Würfel) sowie drei Härtegrade (einen Stapel Baumwollflies = weich, einen Einwegtrinkbecher aus Kunststoff = mittel, ein Glas = hart) unterscheiden. Wahrnehmung und Rückmeldung blieben zuverlässig über den Implantationszeitraum von 30 Tagen; die Elektroden arbeiteten reproduzierbar im sicheren Bereich. Die Studie war aufgrund (sicherheits-)technischer Gründe und regulatorischer Rahmenbedingungen des Medizinproduktegesetzes auf 30 Tage begrenzt.
Zukünftige chronische Studien werden neben der sensorischen Rückkopplung auch die Beeinflussung von Phantomschmerz durch selektive Nervenstimulation in den Fokus nehmen. Die Stimulation kleiner Faserverbünde im Nerven über viele Kontaktpunkte ist gegenwärtig ebenfalls noch eine Herausforderung auf dem Weg zu einem vollständig implantierbaren System. Implantierbare Stecker mit einer hohen Anzahl von Kontakten und kleinem Durchmesser, wie sie zur Verbindung von Elektroden und Implantatelektronik notwendig wären, gibt es leider immer noch nicht für chronische Implantate zu kaufen.
Fazit
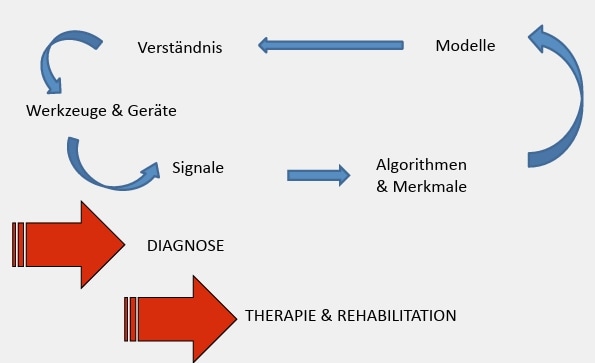
Neurotechnische Implantate eröffnen neue Möglichkeiten in Diagnostik, Therapie und Rehabilitation. Medizinisches Expertenwissen ist noch notwendig, um die Systeme patientenspezifisch einzustellen, gerade wenn eine Regelschleife geschlossen werden soll. Die neuen Implantate sind allerdings auch Werkzeuge, mit denen Signale aufgenommen und neue Algorithmen eingesetzt werden können, um Modelle zu überprüfen, Wissen über den Körper und die Änderungen bei Erkrankungen zu gewinnen und besser zu verstehen und damit neue Therapien und Implantate zu entwickeln (Abb. 5). In diesem Fall scheint es sich also für Ärzte und Techniker zu lohnen, im Kreis zu gehen, um Fortschritte zu erzielen und Patienten besser versorgen zu können.
Für die Autoren:
Univ.-Prof. Dr.-Ing. habil.
Thomas Stieglitz
Lehrstuhl für Biomedizinische Mikrotechnik
Institut für Mikrosystemtechnik – IMTEK
Albert-Ludwigs-Universität Freiburg
Georges-Köhler-Allee 102
79110 Freiburg
thomas.stieglitz@imtek.uni-freiburg.de
Begutachteter Beitrag/reviewed paper
Stieglitz T, Schüttler M, Plachta DTT. Neuroprothetik heute und morgen. Orthopädie Technik, 2015; 66 (6): 32–37
- Ein neuronal gesteuertes Exoskelett in der Therapie von Patientinnen und Patienten mit Querschnittlähmung — 6. Juni 2025
- Dynamische Hüftabduktions-Lagerungsorthese zur Behandlung pathologisch veränderter Hüften bei neuromuskulären Erkrankungen in der Kinderorthopädie — 5. Juni 2025
- Digitale Wunddokumentation: Warum Papier keine Option mehr ist — 5. Juni 2025
- Stieglitz T. Neuroprothetik und Neuromodulation – Forschungsansätze und klinische Praxis bei Therapie und Rehabilitation. Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz, 2010; 53 (3): 783–790
- DiLuca M, Olesen J. The Cost of Brain Diseases: A Burden or a Challenge? Neuron, 2014; 82: 1205–1208
- Stieglitz T. Neuroprothetik und Neuromodulation – Forschungsansätze und klinische Praxis bei Therapie und Rehabilitation. Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz, 2010; 53 (3): 783–790
- Stieglitz T. Neuroprothetik und Neuromodulation – Forschungsansätze und klinische Praxis bei Therapie und Rehabilitation. Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz, 2010; 53 (3): 783–790
- Denison T, Morris M, Sun F. Building a Bionic Nervous System. Spectrum IEEE, 2015; 52 (2): 29–35
- Ordonez J, Schuettler M, Boehler C, Boretius T, Stieglitz T. Thin-Films and Microelectrode Arrays for Neuroprosthetics. MRS Bulletin, 2012; 37 (6): 590–598
- Henle C, Schuettler M, Rickert J, Stieglitz T. Towards Electrocorticographic Electrodes for Chronic Use in BCI Applications. In: Allison BZ, Dunne S, Millan JD, Neuper C, Nijholt A. (eds.). Towards Practical BCIs. Berlin, New York: Springer, 2012: 75–96
- Barostim neoTM, http://www.cvrx.com, letzter Zugriff am 16.03.2015
- Plachta DTT, Gierthmuehlen M, Cota O, Espinosa N, Boeser F, Herrera TC, Stieglitz T, Zentner J. Blood Pressure Control with Selective Vagal Nerve Stimulation and Minimal Side Effects. Journal of Neural Engineering, 2014; 11 (3): 036011
- Boretius T, Badia J, Pascual-Font A, Schuettler M, Navarro X, Yoshida K, Stieglitz T. A Transversal Intrafascicular Multichannel Electrode (TIME) to Interface with the Peripheral Nerve. Biosensors and Bioelectronics, 2010; 26 (1): 62–69
- Raspopovic S, Capogrosso M, Petrini FM, Bonizzato M, Rigosa J,
- Pino GD, Carpaneto J, Controzzi M, Boretius T, Fernandez E, Granata G, Oddo CM, Citi L, Ciancio AL, Cipriani C, Carrozza MC, Jensen W, Guglielmelli E, Stieglitz T, Rossini PM, Micera S. Restoring Natural Sensory Feedback in Real-Time Bidirectional Hand Prostheses. Science Translational Medicine, 2014; 6 (22): 222ra19