Einleitung
Nosokomiale Infektionen, insbesondere durch multiresistente Erreger (MRE), gehören zu den häufigsten Komplikationen in medizinischen und pflegerischen Einrichtungen und haben daher auch eine Bedeutung für das medizinische Versorgungswesen, u. a. die Technische Orthopädie.
Ursachen für die zunehmende Resistenz, d. h. Unempfindlichkeit gegenüber bestimmten Antibiotika, sind:
- der häufige Einsatz von Antibiotika ohne medizinische Indikation, z. B. bei viralen Infektionen;
- ein nicht testgerechter Einsatz von Antibiotika, u. a. auch der kalkulierte Einsatz von sog. Reserveantibiotika;
- eine verminderte Compliance des Patienten mit unzuverlässiger Medikamenteneinnahme;
- eine falsche Therapiedauer, wobei eine zu kurze und eine zu lange Therapie zur Resistenzentwicklung führen kann;
- der Einsatz von Antibiotika in der Lebensmittelindustrie.
Die Problematik bei nosokomialen Infektionen mit multiresistenten Keimen besteht in eingeschränkten therapeutischen Möglichkeiten, verlängerter Aufenthaltsdauer in medizinischen Einrichtungen und einer erhöhten Morbidität und Mortalität 1. Ein erhöhter Diagnostik- und Behandlungsaufwand ist mit Mehrkosten für das Gesundheitssystem verbunden. Der häufigste multiresistente Erreger nosokomialer Infektionen in Europa ist der Methicillin-resistente Staphylococcus aureus (MRSA). Schätzungen für MRSA zeigen z. B., dass jährlich etwa 170.000 Infektionen mit mehr als 5.000 Todesfällen einhergehen. Das hat zur Folge, dass über eine Million zusätzliche Hospitalisationstage und Mehrkosten von ca. 380 Mio. Euro für das europäische Gesundheitssystem anfallen 2.
Surveillance
Unter Surveillance wird die systematische und kontinuierliche Überwachung inklusive Bewertung von Erkrankungen und Todesfällen verstanden. Im Fokus der Problematik mit nosokomialen Infektionen und multiresistenten Erregern stehen die Patientensicherheit und die Optimierung des Einsatzes limitierter finanzieller Mittel. Der Prävention nosokomialer Infektionen sowie der Eindämmung multiresistenter Erreger kommt dabei eine besondere Bedeutung zu. National und international konnten über die Anpassung von Kontrollmaßnahmen nach lückenloser Registrierung und Bewertung von nosokomialen Infektionen gezeigt werden, dass Surveillancemaßnahmen geeignet sind, nosokomiale Infektionen zu vermeiden 3 4 5. Die Durchführung einer Surveillance ist daher gesetzlich in § 23 Infektionsschutzgesetz verankert.
Um in Deutschland sicherstellen zu können, dass solche Referenzdaten aussagekräftige Informationen liefern, nehmen mehr als 1.400 Krankenhäuser und 839 Intensivstationen am sogenannten Krankenhaus-Infektions-Surveillance-System (KISS) teil. KISS ist ein Projekt des Nationalen Referenzzentrums (NRZ) für die Surveillance nosokomialer Infektionen und hat sich zu einem nationalen Netzwerk entwickelt. KISS, das seit 1996 besteht, ist modulartig aufgebaut und stellt Daten zur Häufigkeit von nosokomialen Infektionen und deren Erregern sowie zum Auftreten von Erregern mit besonderer epidemiologischer Relevanz zur Verfügung. Es nutzt im Wesentlichen Daten, die während der Versorgung von Patienten erhoben werden, um daraus einen Erkenntnisgewinn zur Optimierung des Infektionspräventions- und Hygienemanagements zu erzielen 6.
Einteilung multiresistenter Erreger (MRE)
Die verschiedenen Erreger entwickeln über bestimmte Mechanismen eine gezielte Widerstandsfähigkeit gegenüber Antibiotika; diese Eigenschaft nennt man Resistenzentwicklung. Wenn die Keime gegen mehrere Antibiotika resistent sind, geht man von einer Multiresistenz aus. Multiresistente Erreger (MRE) können in grampositive und gramnegative Erreger unterteilt werden. Zu den häufigsten grampositiven MRE gehören der Methicillin-resistente Staphylococcus aureus (MRSA) und die Vancomycin-resistenten Enterokokken (VRE) 7 8. Die wichtigsten gramnegativen multiresistenten Erreger sind Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa und Acinetobacter baumannii. Das Resistenzspektum lässt auch weitere Einteilungen zu, z. B. die Extended-Spectrum-Beta-Lactamase-bildenden Erreger (ESBL), hier insbesondere Escherichia coli und Klebsiella pneumoniae. Erreger aus der Gruppe der Enterobacteriaceae (hierzu zählen u. a. auch Escherichia coli und Klebsiella pneumoniae) mit Resistenz gegen Gruppe-3-Cephalosporine (G3C) gewinnen zunehmend an Bedeutung 9. Des Weiteren werden spezifische Resistenzen, u. a. Imipenemresistente Acinetobacter baumannii, beschrieben 10 11.
Multiresistente grampositive Erreger
Methicillin-resistente Staphylococcus aureus (MRSA)
Der bekannteste grampositive Erreger Staphylococcus aureus ist ein natürlicher Hautkeim, der am häufigsten auf der Schleimhaut des Nasenvorhofs und seltener in der Hautflora des Menschen vorkommt. Methicillin-resistente Staphylococcus aureus (MRSA) sind die Antibiotika-resistente Variante von Staphylococcus aureus. In Deutschland wird dieser Erreger auch ORSA (Oxacillin-resistenter Staphylococcus aureus) genannt, weil die Behandlung mit dem Antibiotikum Oxacillin erfolgt, allerdings in den Vereinigten Staaten routinemäßig mit Methicillin.
Gegen den MRSA sind bestimmte Antibiotika wie Beta-Lactam-Antibiotika (z. B. Penicilline und Cephalosporine) unwirksam. MRSA besitzt das Resistenzgen mecA, welches ein modifiziertes Penicillin-Bindeprotein kodiert. Eigentlich wirken die Antibiotika, indem sie dieses Protein imitieren und die Zellwandsynthese der Erreger hemmen. Das modifizierte Penicillin-Bindeprotein bindet die Beta-Lactam-Antibiotika, sodass die Antibiotika keinen Einfluss auf die Hemmung der Zellwandsynthese haben 12.
Die klassischen Reservoire für MRSA-Infektionen sind Krankenhäuser und Einrichtungen des Gesundheitswesens. Diese werden als HAMRSA (Hospital- oder Healthcare-associated MRSA) bezeichnet. Seit mehreren Jahren berichten verschiedene Länder über eine zunehmende Inzidenz von MRSA-Infektionen in der Allgemeinbevölkerung, der sog. CA-MRSA (Community-acquired MRSA). Hier erfolgt die Infektion außerhalb des stationären Krankenhausaufenthaltes in der Allgemeinbevölkerung, bei ambulanten Patienten oder nach einem bestimmten Zeitraum nach Krankenhausaufnahme. Des Weiteren gewinnen die LA-MRSA (Lifestock-associated MRSA) an Bedeutung, welche in den letzten Jahren durch die Nutztierhaltung als neue Infektionsquelle für den Menschen identifiziert wurden. LA-MRSA treten bei Menschen mit direktem Kontakt zu Nutztieren auf. Landwirte, Veterinäre und auch Schlachthofmitarbeiter sind hier besonders gefährdet 13 14.
Die Häufigkeit von Patienten mit MRSA wird als „Prävalenz” (Patienten mit MRSA/100 Patienten) bezeichnet. Dies berücksichtigt auch asymptomatische Träger. Träger bedeutet nicht Erkrankung. Ein asymptomatischer MRSA-Träger kann jedoch potenziell MRSA auf einen anderen Menschen übertragen. Im Alltag ist dies allerdings von geringerer Bedeutung. In medizinischen und pflegerischen Einrichtungen ist hingegen zum Eigen- und Fremdschutz die Einhaltung von Hygienemaßnahmen von größter Bedeutung.
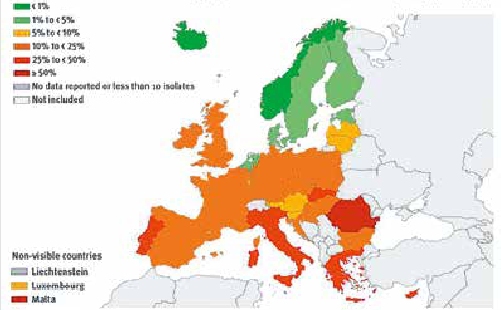
Die MRSA-Prävalenz beträgt 30 bis 80 % in den USA und Japan, während sie in Skandinavien und den Niederlanden bei 1 % liegt. CA-MRSA ist in den USA bereits der häufigste Erreger (> 50 %) von ambulant erworbenen Haut- und Weichgewebeinfektionen; die Zahl dieser Infektionen hat sich innerhalb von sechs Jahren fast verdoppelt. In Deutschland liegt die Prävalenz bei ca. 10 %. Die Infektion mit diesen Erregern fordert bis zu 700 bzw. 1.500 Todesopfer pro Jahr in Deutschland (Abb. 1) 15 16.
Oft (in ca. 15 % aller Fälle) sind diese Erreger auch der Grund für Implantat-assoziierte Infektionen. Die Erreger gelangen während oder nach der Operation von der besiedelten Haut des immungeschwächten Patienten in die Operationswunde und können so zum Teil schwere Infektionen verursachen (Abszess, Sepsis etc.) 17. Die besondere Problematik von Infektionen mit diesen multiresistenten Erregern liegt darin, dass für die Behandlung der Infektion nur sehr wenige Antibiotika zur Verfügung stehen, welche den Ort der Infektion (insbesondere Knochen) oft nur eingeschränkt erreichen.
Vancomycin-resistente Enterokokken (VRE)
Zu den grampositiven MRE gehören des Weiteren Vancomycin-resistente Enterokokken (VRE). Enterokokken sind generell nur gering pathogen, man findet sie meistens als reine Kolonisationskeime im Darm. Die zunehmende Resistenz gegen Glykopeptid-Antibiotika wie Vancomycin ist therapeutisch von großer Bedeutung. Man unterscheidet die nicht übertragbare natürliche Resistenz (Genotyp VanC) von den erworbenen übertragbaren Resistenzen (Genotypen VanA und VanB), welche klinisch die größere Relevanz aufweisen. Der VRE-VanB-Genotyp zeigt im Gegensatz zum VRE-VanA-Genotyp eine Sensibilität gegenüber dem Antibiotikum Teicoplanin 18.
Die Vancomycin-resistenten Enterokokken sind zu 99 % den Enterococcus-faecium-Stämmen zugehörig. Deren Vancomycin-Resistenzrate nimmt tendenziell zu und liegt aktuell bei 8 bis 11 % in Deutschland 19. Insgesamt zeigt die Prävalenz von VRE große regionale Unterschiede. Weiterhin handelt es sich meistens um eine Kolonisation (Besiedelung von Personen ohne krankmachende Wirkung) und weniger um eine Infektion, daher ist die klinische Relevanz im Vergleich zu anderen MRE als geringer einzustufen. Dennoch muss der Prävention von VRE im medizinischen und pflegerischen Bereich (z. B. in Zusammenhang mit offenen Wunden, Operationen, intensivmedizinischer Behandlung u. v. m.) ein besonderes Interesse zugeschrieben werden (s. u.).
Multiresistente gramnegative Erreger (MRGN)
Der Begriff „Multiresistenz” ist für bakterielle gramnegative Erreger in Deutschland nicht eindeutig definiert 20. Eine Konsensusdefinition der Multiresistenz bei MRGN des ECDC (European Centre for Disease Prevention and Control) und der US-amerikanischen CDC (Centers for Disease Control and Prevention) ist in der Patientenversorgung wegen ihrer großen Komplexität nur schwer anwendbar 21.
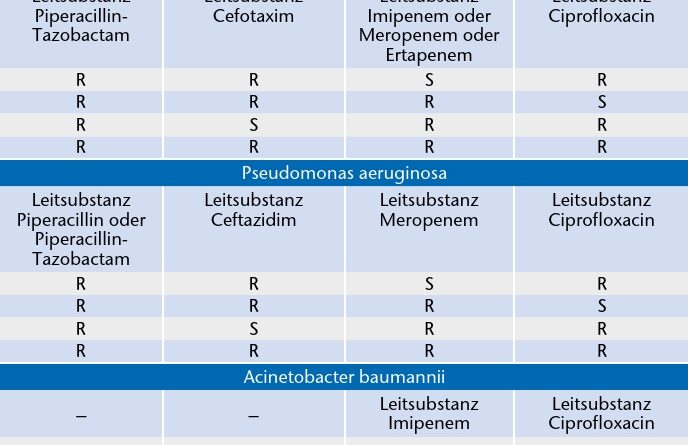
Eine kürzlich veröffentlichte Definition multiresistenter gramnegativer Erreger der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) basiert für Enterobacteriaceae (u. a. Escherichia coli, Klebsiella pneumoniae und Enterobacter cloacae), Pseudomonas aeruginosa und Acinetobacter baumannii auf der Bewertung von vier antibiotischen Leitsubstanzen. Für diese Bewertung werden vier bakterizid wirkende Antibiotikagruppen herangezogen: Penicilline, Cephalosporine, Carbapeneme und Fluorchinolone. Eine Multiresistenz liegt vor, wenn nur noch eine Stellvertretersubstanz (3MRGN) oder keine (4MRGN) sensibel getestet wird 22 (Tab. 1). Die Definition gilt jedoch nicht für seltene gramnegative Erreger, z. B. Stenotrophomonas maltophilia.
Die Beta-Lactam-Resistenz von gramnegativen Erregern begründet sich in einer enzymatischen Inaktivierung durch Beta-Lactamasen. Extended-Spectrum-Beta-Lactamasen(ESBL-)bildende Erreger und Speziesspezifische sogenannte AmpC-Beta-Lactamasen zeigen ein erweitertes Substratspektrum, das neben Penicillinen auch alle Cephalosporine umfasst. Dementsprechend sind bei ESBL-Bildnern in der o. g. Definition die Stellvertretersubstanzen der Penicilline und Cephalosporine resistent; eine Ausweisung als Multiresistenz liegt erst vor, wenn Carbapeneme und/oder Fluorchinolone zusätzlich resistent getestet werden 23.
Infektionen mit multiresistenten gramnegativen Erregern (MRGN) sind im Vergleich zu nichtmultiresistenten Erregern mit höheren Kosten und einem verlängertem Krankenhausaufenthalt sowie einer 21 % höheren Letalität verbunden 24. Die Übertragung erfolgt durch indirekten oder direkten Kontakt z. B. mit kontaminierter Haut, Wundsekreten und Urin. Fast alle MRGN können mehrere Tage auf Oberflächen überleben 25.
Screening und diagnostische Möglichkeiten als Grundlage zur Prävention
In den industrialisierten Ländern stellen nosokomiale Infektionen und die zunehmende Ausbreitung von multiresistenten Krankheitserregern hochaktuelle Probleme dar. Eine sachgerechte Diagnostik und Therapie sowie insbesondere die Prävention erfordert umfangreiche und spezielle Kenntnisse.
Während sich in den USA die klinische Infektiologie durch die Infectious Diseases Society of America als eigenes Fachgebiet etabliert, werden in Deutschland schwere Infektionen meistens von den jeweiligen organspezifischen Fächern behandelt. Eine qualifizierte infektiologische Beratung hat hierbei ihren Nutzen; so konnte in mehreren Studien gezeigt werden, dass eine direkte infektiologische konsiliarische Mitbetreuung bei klinisch manifesten Infektionen und bei intensivmedizinisch behandelten Patienten zu einer Senkung von Morbidität und Letalität führen konnte 26.
Die zunehmende Ausbreitung von MRSA veranlasste das Robert-Koch-Institut bereits 2004 zu konkreten Empfehlungen hinsichtlich des aktiven Screenings 27. Nur durch eine generelle Untersuchung auf MRSA bei Aufnahme in ein Krankenhaus können Patienten mit MRSA-Besiedlung identifiziert werden. Der personelle und finanzielle Untersuchungsaufwand ist hierbei jedoch immens. Die Niederlande sind seit Jahrzehnten ein Vorreiter im Screening und im Umgang mit MRSA, aber auch in Deutschland konnte der Trend des jahrelangen Anstiegs der MRSA-Zahlen aus Infektionsisolaten stabilisiert, tendenziell sogar umgekehrt werden 28. Das aktive Screening kann durch einfache Tupferabstriche vorgenommen werden. Die Abstriche erfolgen im Operationsgebiet, der Leiste, der Nase und im Rachen.
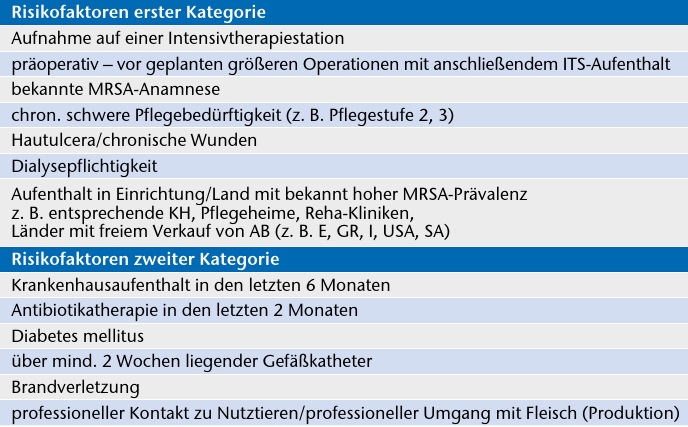
Um das Screening möglichst effektiv einzusetzen, hat die Kommission für Krankenhaushygiene und Infektionsprävention Risikofaktoren beziehungsweise Patientengruppen definiert, bei denen ein Aufnahmescreening erfolgen sollte (Tab. 2). Wird das Aufnahmescreening auf diese Patientengruppen beschränkt, kann trotz reduzierten Untersuchungsumfangs die Mehrzahl der MRSA-Patienten identifiziert werden. Es werden Risikofaktoren der ersten und der zweiten Kategorie unterschieden. Treffen ein Risikofaktor der ersten oder zwei Risikofaktoren der zweiten Kategorie zu, gilt die Empfehlung zum aktiven Screening 29.
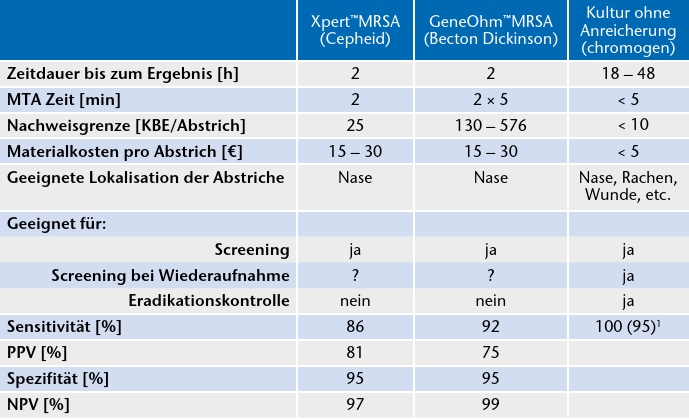
Für den Nachweis stehen zwei verschiedene Methoden zur Verfügung: zum einen der phänotypische Nachweis der Oxacillin-Resistenz in der Kultur, zum anderen der genotypische Nachweis des Resistenzgens MecA beziehungsweise des Staphylokokken-Kassetten-Chromosoms SCCmec, auch als „Schnelltest” bekannt. Der „Schnelltest” liefert nach 1 bis 3 Stunden erste Ergebnisse, ist jedoch mit hohen Kosten verbunden. Er bestimmt die verantwortlichen Oxcacillinresistenzen über die dazugehörigen Resistenzgene und erkennt Staphylococcus aureus und zusätzlich die verschiedenen Vertreter der koagulasenegativen Staphylokokken (KNS). In klinischen Proben mit gleichzeitiger Anwesenheit von Staphylococcus aureus und koagulasenegativen Staphylokokken sind diese parallel mit nachzuweisen, um falsch positive Testergebnisse auszuschließen 30.
Wird das Aufnahmescreening auf Risikopatienten beschränkt, kann trotz reduzierten Untersuchungsumfangs die Mehrzahl der MRSA-Patienten identifiziert werden. Hohe Screening-Kosten, insbesondere bei der Verwendung von Schnelltests, können somit in einer gesunden Kosten-Nutzen-Relation gehalten werden (Tab. 3).
Resistente Keime sind nicht nur das Problem von Krankenhäusern und Pflegeeinrichtungen, sondern auch des ambulanten medizinischen Sektors. Die Kassenärztliche Bundesvereinigung (KBV) und der GKV-Spitzenverband haben deshalb im Jahr 2012 eine spezielle Vergütungsvereinbarung für MRSA-Leistungen abgeschlossen. Seit dem 1. April 2014 sind diese Leistungen nun Bestandteil des Einheitlichen Bewertungsmaßstabes (EBM). Eine ambulante Sanierung und insbesondere Kontrollscreening-Untersuchungen bei bekannten MRSA-Patienten können somit bereits im Vorfeld stationärer Behandlungen extrabudgetär durchgeführt werden. Damit erfolgt die Ausdehnung der Surveillance und Prävention in den ambulanten Sektor.
Gemäß den MRSA-Empfehlungen der KRINKO ist die räumliche Distanzierung von Patienten mit MRSA sowie eine sogenannte Barrierehygiene (Mundschutz, Schutzkleidung, Handschuhe) für Personal und Besucher die entscheidende Voraussetzung, eine Übertragung zu verhindern 31. Das primäre Ziel muss dennoch eine Beachtung der Standardhygiene (z. B. Händedesinfektion) und eine solide hygienische Grundversorgung aller Patienten und auch der Hilfsmittel sein. Dies gilt auch für die ambulante Weiterbehandlung in sämtlichen medizinischen Einrichtungen (z. B. Arztpraxis, Sanitätshaus, Physio- und Ergotherapie).
Eine Empfehlung für ein aktives Screening bei VRE kann bei unzureichend fundierter Datenlage aktuell nicht gegeben werden. Dies wird mit der im Vergleich zu MRGN und MRSA geringeren klinischen Bedeutung begründet 32.
Auch für eine VRE-Kolonisation sind Risikofaktoren in epidemiologischen Studien identifiziert worden. Allen voran steht die Gabe von Antibiotika mit einem 1,25- bis 31,9‑fach erhöhten Risiko, aber auch die vorhergehende Hospitalisierung (3,7- bis 39,8‑fach erhöhtes Risiko), Diarrhö (48,0‑fach erhöhtes Risiko), die Gabe von Immunsuppressiva (2,9‑fach erhöhtes Risiko), Intubation, mechanische Beatmung, weitere invasive Maßnahmen (5,2- bis 16,8‑fach erhöhtes Risiko) und chronische Hämodialysepflichtigkeit (3,9- bis 5,8‑fach erhöhtes Risiko) 33.
VRE haben ihr Reservoir im gesamten Gastrointestinaltrakt, eine Sanierung ist daher unwahrscheinlich, und es existieren im Unterschied zu MRSA keine Sanierungsschemata. Somit besitzt die Krankenhaushygiene zur Infektionsprophylaxe eine vorrangige Bedeutung. Unter Berücksichtigung der o. g. Fakten ist eine Kontaktisolierung nur für Risikobereiche (Intensivstationen, Intermediate-Care-Stationen, Hämatologie-Onkologie [immunsupprimierte Patienten], Transplantationsstationen, Neonatologie und Dialyse) und Risikopatienten (VRE-infizierte Patienten mit sezernierenden Wunden, kolonisierte Patienten mit Diarrhö, Clostridiumdifficile-assoziierter Diarrhö, Stuhlinkontinenz, Enterostoma und kolonisierte Patienten mit mangelnder persönlicher Hygiene und Compliance) empfohlen 34.
Für MR-GNE sind Prävalenzen von 51 % (Pflegeheim, Irland) und 3 bis 9 % (Intensivstationen, Deutschland) beschrieben. Eine generelle Empfehlung zum aktiven Screening bei MRGN liegt nicht vor. Ein aktives Screening bei Kontaktpatienten mit Carbapenem-resistenten gramnegativen Erregern (Enterobacteriaceae und Acinetobacter baumannii) ist jedoch akzeptiert 35.
In der Diagnostik kommen phänotypische und genotypische Verfahren bei MRGN zur Anwendung. Die Bestätigung von z. B. AmpC-Beta-Lactamasen, Metallo-Beta-Lactamasen und anderen Carbapenemasen erfolgt mittels unterschiedlicher Testsysteme, welche jedoch nicht immer eine befriedigende Spezifität und Sensitivität aufweisen 36. Genotypische Nachweisverfahren wie die PCR-Amplifikation und die Sequenzierung sind kosten- und arbeitsintensiv, bleiben bisher Speziallaboren vorbehalten und stehen für ein aktives Screening nur eingeschränkt zur Verfügung. Des Weiteren liegen noch keine fundierten Daten zur Wahl der Patientenmaterialien zum aktiven Screening vor. Hier erscheinen aktuell Abstriche von offenen Wunden, von Trachealsekret bei beatmeten Patienten und Perianal-/Rektalabstriche sinnvoll.
Beim Auftreten von MRGN empfiehlt sich die Unterbringung in Einzelzimmern oder in der Kohorte und die Einhaltung von Hygienemaßnahmen. Bei 4MRGN, ESBL-Bildnern oder Resistenz gegenüber Carbapenemen sowie beim Nachweis multiresistenter Acinetobacter baumannii sollten immer entsprechende Isolierungsmaßnahmen durchgeführt und Hygienerichtlinien strikt eingehalten werden 37 38.
Eine Verbesserung des Nachweises von Erregern auf Implantaten konnte durch die Sonikation erreicht werden 39. Bei den Implantat-assoziierten Infektionen werden die potenziell bakteriell besiedelten Implantat-Komponenten operativ entnommen und der durch die Bakterien entstandene Biofilm (dreidimensionale Ansammlung von Bakterien, eingebettet in einem selbstproduzierten Schleimfilm aus Polysacchariden) durch Ultraschallbehandlung (Sonikation) abgelöst. Durch diese Methode werden die Bakterien aus dem Biofilm herausgelöst und die Sensitivität des Erregernachweises der Protheseninfektion erhöht. Die Ultraschall-Lösung wird anschließend durch weiterführende Tests untersucht (PCR und Ausplattierung auf Agar) 40.
Therapie
Dekolonisation und Hygienemanagement
Bei der Kolonisation (Besiedlung) des Körpers durch Erreger können diese dem Menschen normalerweise nicht schaden. Wenn jedoch das Immunsystem und damit die Abwehrlage des Körpers geschwächt ist oder Keime in eine Operationswunde gelangen, können sie zu einer Infektion führen. Aus diesen Gründen müssen in medizinischen und pflegerischen Einrichtungen entsprechende Maßnahmen im Falle einer Kolonisation ergriffen werden 41.
Beispielsweise sollte der Patient bei einer Kolonisation mit MRSA in einem Einzelzimmer isoliert werden. Sogenannte Kontaktpersonen, d. h. Patienten in Mehrbettzimmern mit Kontakt zu MRSA-Patienten, die nicht primär mit MRSA kolonisiert waren, sollten bis zum Eingang eines negativen Screening-Ergebnisses ebenfalls entsprechend isoliert werden. Die Räumlichkeiten werden mit einem Türschild gekennzeichnet, welches die wichtigsten Informationen zu den Hygienemaßnahmen darlegt.
Das Tragen von Schutzhandschuhen, Mund-Nasen-Schutz und Kittel beim Betreten des Zimmers und beim Kontakt mit dem betroffenen Patienten sowie konsequente Händedesinfektion müssen eingehalten werden. Die Desinfektion von Kontakt- und Oberflächen von Möbeln und auch orthopädietechnischen Hilfsmitteln sind mittels aldehydischer bzw. alkoholischer Wischdesinfektionen zu erreichen. Die Beförderung des Patienten sollte möglich vermieden werden. Im Falle von diagnostisch/therapeutisch notwendigen Transporten innerhalb der Einrichtung ist die Zielstation/Abteilung über die Kolonisierung zu informieren.
Bei der Besiedlung der Nase erfolgt die Applikation antibiotischer bzw. antiseptischer Nasensalbe. Alternativ können PVP-Jod-Präparate oder andere lokal applizierbare Antibiotika mit nachgewiesener Wirksamkeit eingesetzt werden. Bei einer MRSA-Kolonisation der Mundhöhle und des Rachenraums werden desinfizierende Mundlösungen eingesetzt. Hautläsionen bedürfen eines täglich mehrmaligen Aufbringens antiseptischer Lösungen. Ganzkörperwaschungen unter Einschluss der Haare mit antiseptischen Seifen führen ebenfalls zur Dekolonisierung. Drei Tage nach Beendigung einer Sanierungsbehandlung werden Kontrollabstriche von den vorher nachweislich besiedelten und den sanierten Bereichen an 3 aufeinanderfolgenden Tagen zur Dekolonisierungskontrolle abgenommen 42.
Systemische Therapie mit Antibiotika
Der systemische Einsatz von Antibiotika muss auch im Hinblick auf die weitere Resistenzentwicklung von Erregern immer kritisch geprüft werden. Daher gilt z. B. bei MRSA-Nachweis 43:
- Die simple Kolonisation ist keine Indikation.
- Eine Behandlung mit systemischen Antibiotika erfolgt nur bei klinisch relevanten Infektionen.
- Im Falle einer Infektion ist ggf. eine adäquate chirurgische Therapie durchzuführen.
- Die Dauer der Therapie mit Ausnahme von Osteomyelitis und Endokarditis sollte unabhängig vom mikrobiologischen Befund bis etwa 3 bis 5 Tage über die klinische Besserung hinaus durchgeführt werden.
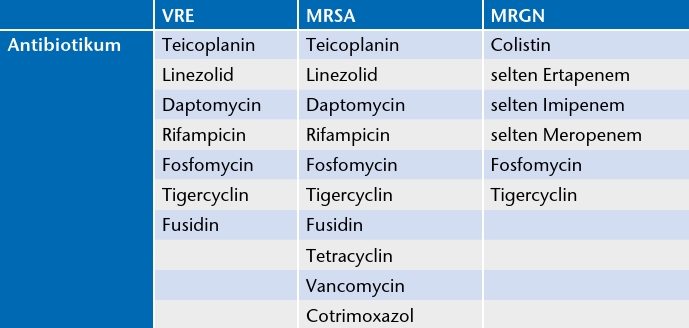
Bei Infektionen mit multiresistenten Erregern ist die Antibiotikagabe in der Therapie abhängig vom Keim und vom entsprechenden Resistogramm, welches eine Aussage über die Antibiotikaresistenz der Erreger erlaubt 44. Die Antibiotikatherapie sollte möglichst aufgrund eines vorliegenden Resistogramms verordnet werden. Die wenigen meist sensibel getesteten Antibiotika, sog. Reserveantibiotika, gegen die wichtigsten multiresistenten Erreger sind in Tabelle 4 dargestellt.
Informationsweitergabe
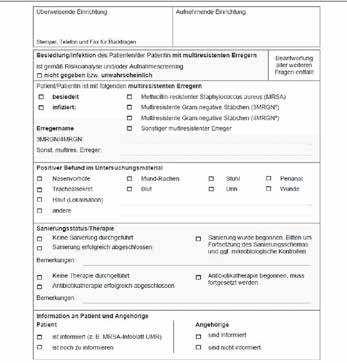
Im Falle einer Kolonisierung oder Infektion mit multiresistenten Keimen ist die Weitergabe von Informationen über eine MRE-Besiedlung von Patienten an die weiterbetreuende Institution (z. B. Rehaklinik, Pflegeeinrichtung, Hausarzt) von großer Bedeutung. Dies dient der sofortigen Einleitung entsprechender Hygienemaßnahmen und kann die weitere Ausbreitung von MRE reduzieren. Eine entsprechende Informationsweitergabe sollte in Form eines Überleitungsbogens stattfinden (Abb. 2) 45.
Ansätze für die Zukunft
Eine Infektion mit MRE zu verhindern und die Ansteckung zu minimieren ist ein Ziel der heutigen Wissenschaft und Forschung. Folgende Ansätze seien beispielhaft genannt: Die Entwicklung keimreduzierender Oberflächen auf der Basis des natürlichen Säureschutzmantels der menschlichen Haut bzw. bakterizider Metalle sind dabei praktische Ansätze.
Für die Technische Orthopädie und die Hilfsmittelversorgung steht eine neuartige Technologie zur antimikrobiellen Ausstattung von Kunststoffen, Lacken und Keramik zur Verfügung. Hierbei werden Übergangsmetalloxide in Werkstoffe (z. B. für Orthesen) eingebracht. Unter Anwesenheit von Luftfeuchtigkeit entsteht direkt an den Oberflächen der Werkstoffe ein Säurefilm, der Bakterien, Viren und Pilze rasch abtötet. Diese Verfahren wurden gegen Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa und weitere Keime erprobt 46. Die Vorteile der Technologie liegen in der Keimabtötung bereits bei Kontakt sowie im breiten Aktivitätsspektrum unabhängig von Antibiotikaresistenzen, zum Beispiel gegen MRSA und VRE 47.
Für die Autoren:
Priv.-Doz. Dr. med. habil.
Philipp Bergschmidt
Orthopädische Klinik und Poliklinik
Universitätsmedizin Rostock
Doberaner Straße 142
18057 Rostock
philipp.bergschmidt@med.uni-rostock.de
Begutachteter Beitrag/reviewed paper
Zaatreh S, Klemke A, Ellenrieder M, Mittelmeier W, Bergschmidt P. Multiresistente Keime – ein Überblick. Orthopädie Technik, 2015; 66 (1): 46–53
- Silikon-Maßliner: effiziente Lösungen für anspruchsvolle Prothesenversorgungen — 5. Juli 2024
- Osseointegrierte Prothese versus Schaftprothese: Welche Gehfähigkeit erreichen Oberschenkelamputierte? — 5. Juli 2024
- „Ich fühle, wie ich gehe“ – ein innovatives, nicht-invasives, gangsynchrones, vibrotaktiles Feedbacksystem. Eine Roadmap zu Versorgungsmöglichkeiten — 5. Juli 2024
- Geffers C, Gastmeier P. Nosokomiale Infektionen und multiresistente Erreger in Deutschland. Deutsches Ärzteblatt, 2011; 6: 87–93
- Köck R, Becker K, Cookson B, van Gemert-Pijnen JE, Harbarth S, Kluytmans J, Mielke M, Peters G, Skov RL, Struelens MJ, Tacconelli E, Navarro Torné A, Witte W, Friedrich AW. Methicillin-resistant Staphylococcus aureus (MRSA): burden of disease and control challenges in Europe. Euro Surveill, 2010; 15 (41): 19688
- Rioux C, Grandbastien B, Astagneau P. Impact of a six-year control programme on surgical site infections in France: results of the INCISO surveillance. J Hosp Infect, 2007; 66: 217–223
- Gastmeier P, Schwab F, Sohr D, Behnke M, Geffers C. Reproducibility of the surveillance effect to decrease nosocomial infection rates. Infect Control Hosp Epidemiol, 2009; 30: 993–999
- Geubbels EL, Nagelkerke NJ, Mintjes-De Groot AJ, et al. Reduced risk of surgical site infections through surveillance in a network. Int J Qual Health Care, 2006; 18: 127–133
- Geffers C, Gastmeier P. Nosokomiale Infektionen und multiresistente Erreger in Deutschland. Deutsches Ärzteblatt, 2011; 6: 87–93
- Köck R, Becker K, Cookson B, van Gemert-Pijnen JE, Harbarth S, Kluytmans J, Mielke M, Peters G, Skov RL, Struelens MJ, Tacconelli E, Navarro Torné A, Witte W, Friedrich AW. Methicillin-resistant Staphylococcus aureus (MRSA): burden of disease and control challenges in Europe. Euro Surveill, 2010; 15 (41): 19688
- Mutters NT, Mersch-Sundermann V, Mutters R, Brandt C, Schneider-Brachert W, Frank U. Kontrolle von Vancomycin-resistenten Enterokokken im Krankenhaus. Deutsches Ärzteblatt, 2013; 43: 87–93
- Mattner F, Bange FC, Meyer E, Seifert H, Wichelhaus TA, Chaberny IF. Prävention der Ausbreitung von multiresistenten gramnegativen Erregern. Deutsches Ärzteblatt 2012; 3: 725–731
- Mattner F, Bange FC, Meyer E, Seifert H, Wichelhaus TA, Chaberny IF. Prävention der Ausbreitung von multiresistenten gramnegativen Erregern. Deutsches Ärzteblatt 2012; 3: 725–731
- Tiwari V, Tiwari M. Quantitative proteomics to study carbapenem resistance in Acinetobacter baumannii. Front Microbiol, 2014; 5: 512
- Chambers HF. Methicillin-resistant staphylococci. Clin Microbiol Rev, 1988; 1 (2): 173–186
- Köck R, Becker K, Cookson B, van Gemert-Pijnen JE, Harbarth S, Kluytmans J, Mielke M, Peters G, Skov RL, Struelens MJ, Tacconelli E, Navarro Torné A, Witte W, Friedrich AW. Methicillin-resistant Staphylococcus aureus (MRSA): burden of disease and control challenges in Europe. Euro Surveill, 2010; 15 (41): 19688
- Vandenesch F, Naimi T, Enright MC, Lina G, Nimmo GR, Heffernan H, Liassine N, Bes M, Greenland T, Reverdy ME, Etienneet J. Community-Acquired Methicillin-Resistant Staphylococcus aureus Carrying Panton-Valentine Leukocidin Genes: Worldwide Emergency. Emerging Infectious Diseases, 2003; 9: 978–984
- Geffers C, Gastmeier P. Nosokomiale Infektionen und multiresistente Erreger in Deutschland. Deutsches Ärzteblatt, 2011; 6: 87–93
- Köck R, Becker K, Cookson B, van Gemert-Pijnen JE, Harbarth S, Kluytmans J, Mielke M, Peters G, Skov RL, Struelens MJ, Tacconelli E, Navarro Torné A, Witte W, Friedrich AW. Methicillin-resistant Staphylococcus aureus (MRSA): burden of disease and control challenges in Europe. Euro Surveill, 2010; 15 (41): 19688
- Kowalski TJ, Berbari EF, Osmon DR. Epidemiology, treatment, and prevention of community-acquired methicillin-resistant Staphylococcus aureus infections. Mayo Clin Proc, 2005; 80 (9): 1201–1207
- Mutters NT, Mersch-Sundermann V, Mutters R, Brandt C, Schneider-Brachert W, Frank U. Kontrolle von Vancomycin-resistenten Enterokokken im Krankenhaus. Deutsches Ärzteblatt, 2013; 43: 87–93
- Mutters NT, Mersch-Sundermann V, Mutters R, Brandt C, Schneider-Brachert W, Frank U. Kontrolle von Vancomycin-resistenten Enterokokken im Krankenhaus. Deutsches Ärzteblatt, 2013; 43: 87–93
- Chaberny IF, Ziesing S, Gastmeier P. Umfrage zum Vorgehen bei Patienten mit multiresistenten gramnegativen Erregern in deutschen Universitätskliniken. Hyg Mikrobiol, 2004; 8: 22–25
- Mattner F, Bange FC, Meyer E, Seifert H, Wichelhaus TA, Chaberny IF. Prävention der Ausbreitung von multiresistenten gramnegativen Erregern. Deutsches Ärzteblatt 2012; 3: 725–731
- Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO): Definition der Multiresistenz gegenüber Antibiotika bei gramnegativen Stäbchen im Hinblick auf Maßnahmen zur Vermeidung der Weiterverbreitung. Epidemiol Bull, 2011; 36: 337–339
- Mattner F, Bange FC, Meyer E, Seifert H, Wichelhaus TA, Chaberny IF. Prävention der Ausbreitung von multiresistenten gramnegativen Erregern. Deutsches Ärzteblatt 2012; 3: 725–731
- Mattner F, Bange FC, Meyer E, Seifert H, Wichelhaus TA, Chaberny IF. Prävention der Ausbreitung von multiresistenten gramnegativen Erregern. Deutsches Ärzteblatt 2012; 3: 725–731
- Neely AN. A Survey of Gram-negative Bacteria Survival on Hospital Fabrics and Plastics. Journal of Burn Care and Rehabilitation, 2000; 21: 523–527
- Vehreschild J, Seifert H, Fätkenheuer G. Klinische Infektioologie: Erfahrungen zeigen hohe Akzeptanz. Deutsches Ärzteblatt, 2012; 109 (29–30): A1487-A1490
- Kommission für Krankenhaushygiene und Infektionsprävention. Kommentar zu den „Empfehlungen zur Prävention und Kontrolle von Methicillin-resistenten Staphylococcus-aureus-Stämmen in Krankenhäusern und anderen medizinischen Einrichtungen”. Epidemiol Bull, 2004; 46: 396
- Kresken M, Hafner D, Körber-Irrgang B. Abschlussbericht – Teilprojekt H. Epidemiologie und Resistenzsituation bei klinisch wichtigen Infektionserregern aus dem Hospitalbereich gegenüber Antibiotika. Bericht über die Ergebnisse einer multizentrischen Studie der Paul-Ehrlich-Gesellschaft für Chemotherapie e. V. aus dem Jahre 2010. Rheinbach: Antiinfectives Intelligence, 2013
- Kommission für Krankenhaushygiene und Infektionsprävention. Kommentar zu den “Empfehlungen zur Prävention und Kontrolle von Methicillin-resistenten Staphylococcus-aureus-Stämmen in Krankenhäusern und anderen medizinischen Einrichtungen”. Epidemiol Bull, 2004; 46: 396
- Oberdorfer K, Wendt C. MRSA – rationale und rationelle Diagnostik. Mikrobiologie, 2008; 18: 97–106
- Kappstein I. Aktuelle MRSA Problematik. Chirurg, 2006; 77: 499–505
- Meyer E, Schwab F, Schroeren-Boersch B, Gastmeier P. Dramatic increase of third-generation cephalosporin-resistant E. coli in German intensive care units: secular trends in antibiotic drug use and bacterial resistance, 2001 to 2008. Crit Care, 2010; 14: 113
- Mutters NT, Mersch-Sundermann V, Mutters R, Brandt C, Schneider-Brachert W, Frank U. Kontrolle von Vancomycin-resistenten Enterokokken im Krankenhaus. Deutsches Ärzteblatt, 2013; 43: 87–93
- Mutters NT, Mersch-Sundermann V, Mutters R, Brandt C, Schneider-Brachert W, Frank U. Kontrolle von Vancomycin-resistenten Enterokokken im Krankenhaus. Deutsches Ärzteblatt, 2013; 43: 87–93
- Fankhauser C, Zingg W, Francois P, Dharan S, Schrenzel J, Pittet D, Harbarth S. Surveillance of extended-spectrum-beta-lactamase-producing Enterobacteriaceae in a Swiss Tertiary Care hospital. Swiss Med Wkly, 2009; 139: 747–751
- Pfeifer Y. ESBL, AmpC und Carbapenemasen: Vorkommen, Verbreitung und Diagnostik beta-Lactamase bildender gramnegativer Krankheitserreger. J Lab Med, 2010; 34: 205–215
- Mattner F, Bange FC, Meyer E, Seifert H, Wichelhaus TA, Chaberny IF. Prävention der Ausbreitung von multiresistenten gramnegativen Erregern. Deutsches Ärzteblatt 2012; 3: 725–731
- Siegel JD, Rhinehart E, Jackson M, Chiarello L. Management of multidrug-resistant organisms in health care settings, 2006. Am J Infect Control, 2007; 35: 165–193
- Trampuz A, Piper KE, Jacobson MJ, Hanssen AD, Unni KK, Osmon DR, Mandrekar JN, Cockerill FR, Steckelberg JM, Greenleaf JF, Patel R. Sonication of removed hip and knee prostheses for diagnosis of infection. N Engl J Med, 2007; 357: 654–663
- Trampuz A, Piper KE, Jacobson MJ, Hanssen AD, Unni KK, Osmon DR, Mandrekar JN, Cockerill FR, Steckelberg JM, Greenleaf JF, Patel R. Sonication of removed hip and knee prostheses for diagnosis of infection. N Engl J Med, 2007; 357: 654–663
- Universitätsmedizin Rostock. Hygienemerkblatt MRSA (Methicillin resistenter Staphylococcus aureus). http://www.imikro.uni-rostock.de/Doku/Hygiene/HMB/MRSA.pdf
- Universitätsmedizin Rostock. Hygienemerkblatt MRSA (Methicillin resistenter Staphylococcus aureus). http://www.imikro.uni-rostock.de/Doku/Hygiene/HMB/MRSA.pdf
- Kappstein I. Aktuelle MRSA Problematik. Chirurg, 2006; 77: 499–505
- Hewitt WS, Vincent S. Theory and Application of Microbiological Assay. San Diego: Academic Press, 1989
- Universitätsmedizin Rostock. Hygienemerkblatt MRSA (Methicillin resistenter Staphylococcus aureus). http://www.imikro.uni-rostock.de/Doku/Hygiene/HMB/MRSA.pdf
- Zollfrank C, Gutbrod K, Wechsler P, Guggenbichler JP. Antimicrobial activity of transition metal acid MoO3 prevents microbial growth on material surfaces. Materials Science and Engineering 2012; 32 (1): 47–54
- Zollfrank C, Gutbrod K, Wechsler P, Guggenbichler JP. Antimicrobial activity of transition metal acid MoO3 prevents microbial growth on material surfaces. Materials Science and Engineering 2012; 32 (1): 47–54