1 Medizinische Hochschule Hannover, Klinik für Unfallchirurgie, Carl-Neuberg-Straße 1, 30625 Hannover, Deutschland
2 Universitätsmedizin Göttingen, Klinik für Unfallchirurgie, Orthopädie und Plastische Chirurgie, Robert-Koch-Straße 40, 37075 Göttingen, Deutschland
3 John + Bamberg GmbH & Co. KG, Anna-von-Borries-Straße 2, 30625 Hannover, Deutschland
4 Brixsana Private Clinic, Zentrum für Plastische‑, Ästhetische- und Rekonstruktive Chirurgie mit Handchirurgie, Julius-Durst-Straße 28, 39042 Brixen, Italien
10MWT = 10-Meter-Walk-Test
2MWT = 2‑Minute-Walk-Test
FSST = Four-Square-Step-Test
MCID = Minimal Clinically Important Difference
MDC = Minimal Detectable Change
TMR = Targeted Muscle Reinnervation
TSR = Targeted Sensory Reinnervation
TUG = Timed-Up-and-Go-Test
VTFS = Vibrotaktiles Feedbacksystem
Einleitung
Das Fehlen von sensorischen Informationen nach der Amputation einer Gliedmaße stellt weiterhin eine große Herausforderung in der prothetischen Versorgung von Amputierten dar. Trotz innovativer Entwicklungen in der Orthopädietechnik und der Amputationschirurgie ist die Ablehnungsquote von Prothesen weiterhin sehr hoch. Ein häufig aufgeführter Grund der Betroffenen ist das Fehlen von sensorischem Feedback1 2 3 4. Ein solcher Verlust kann schwerwiegende Einschränkungen auf die Mobilität und amputations-assoziierte Schmerzen von Amputierten haben.
Studien haben gezeigt, dass Amputierte insgesamt von einem erhöhten Sturzrisiko betroffen sind, da Hindernisse überwiegend nur visuell wahrgenommen werden5 6. Zusätzlich kann es durch die resultierende Mehrbelastung der Gegenseite zu der Ausbildung eines unphysiologischen Gangbildes kommen, welches mit einem erhöhten metabolischen Umsatz, schnellerer Ermüdung und reduziertem Gehvermögen einhergeht7 8. Das fehlende sensorische Feedback führt zu einer höheren kognitiven Anstrengung, schränkt das Embodiment der Prothese – also das Anerkennen der Prothese als körpereigene Gliedmaße – ein und ist an der Entstehung und Aufrechterhaltung von Phantomschmerzen beteiligt9 10 11 12 13 14.
Zahlreiche Studien konnten zeigen, dass die Wiederherstellung der Übermittlung sensorischer Informationen von der Prothese zum Gehirn die Interaktion der Patienten mit der Prothese erheblich steigert15 16. Das somatosensorische Feedback gilt als entscheidend für die Verbesserung der Prothesensteuerung und der damit verbundenen Mobilität des Betroffenen, für die Reduktion von Phantomschmerzen sowie für die Anerkennung der Prothese als Teil des eigenen Körpers17 18 19 20 21 22 23 24 25.
Ein innovatives, nicht-invasives vibrotaktiles Feedbacksystem
Obwohl die Wiederherstellung von sensorischem Feedback intensiv untersucht wurde und Feedbacksysteme entwickelt wurden, gibt es derzeit auf dem Markt kein funktionierendes (Prothesen-)System, welches sensorische Informationen zuverlässig übertragen kann.
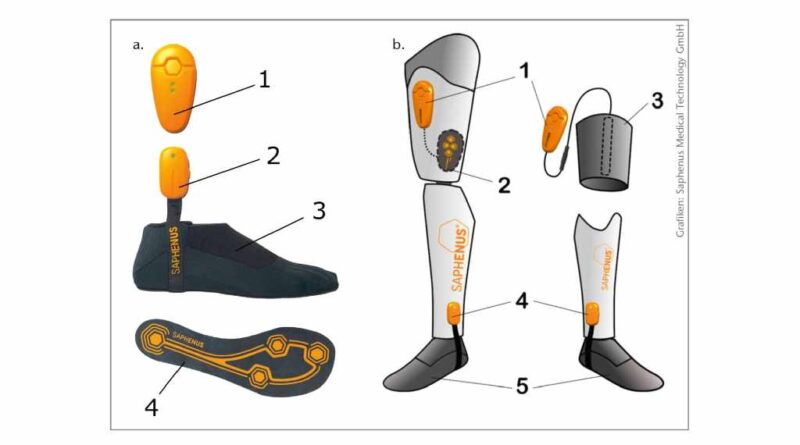
Das kommerziell erhältliche, nicht-invasive, gangsynchronisierte, mikroprozessor-gesteuerte, vibrotaktile Feedbacksystem Suralis der Firma Saphenus verschlüsselt Druck der Fußsohle in Vibration auf definierte Hautareale, um so sensorische Informationen an periphere Hautrezeptoren und das Gehirn über die amputierte Gliedmaße zurückgeben. Das System besteht aus einer Sensorsocke, einer Sender- und einer Aktuatoreinheit (Abb. 1).
Die Sensorsocke verfügt über vier Drucksensoren – je einen an der Ferse, im lateralen und im medialen Vorfußbereich sowie an der Großzehe – und wird über den Prothesenfuß gezogen (Abb. 1a). Die Drucksensoren in Vor- und Rückfuß erfassen das Abrollverhalten des Prothesenfußes und senden es drahtlos (via Bluetooth) an die Aktuatoreinheit mit den vier Vibrationsaktuatoren. Dort ist jedem Drucksensor ein Vibrationsaktuator zugeordnet, der bei Druckbelastung des Fußes vibriert und somit die Haut stimuliert. Diese Information wird vom Träger des Systems empfunden. Die Sensorsocke kann über jeden Prothesenfuß gezogen werden.
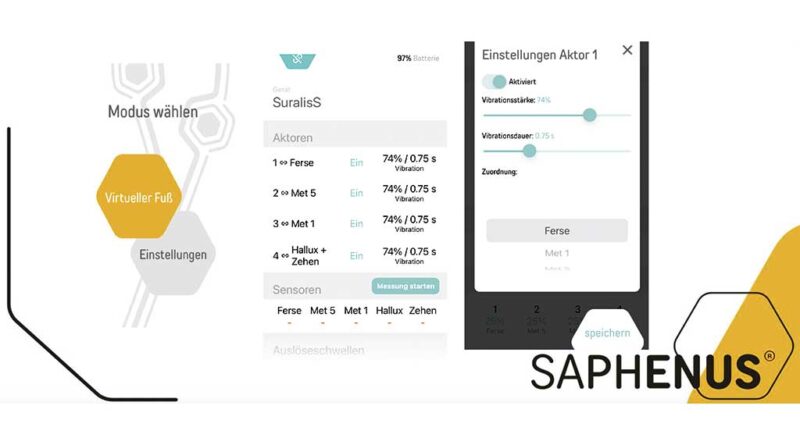
Die Vibrationsaktuatoren schwingen mit einer Amplitude von 60–120 Hz und die Latenzzeit zwischen Bodenkontakt und Auslösung der Vibration beträgt weniger als 100 ms. Die Vibrationsstärke, ‑dauer und Schwellenwerte für eine Stimulation können über eine App angepasst werden (Abb. 2).
Systemmodi: Aktiv- und Rehamodus
Das Grundprinzip des Aktivmodus besteht darin, das Druckempfinden der Fußsohle durch vibrotaktile Stimulation eines definierten Hautareals zu rekonstruieren. Die Funktionsweise basiert in ihren Grundzügen auf der klassischen Konditionierung, wie sie in der behavioristischen Lerntheorie beschrieben wird26 27, sowie der humanen Neuroplastizität. Ein positiver Einfluss gangsynchroner, vibrotaktiler Stimulation auf die Koordination und Balance von transtibialen Amputierten konnte bereits gezeigt werden28 29.
Neben dem Aktivmodus, bei dem die Abrollbewegung des Prothesenfußes über die Sensorsocke und die Vibrationselemente an ein definiertes Hautareal weitergegeben wird, gibt es einen zusätzlichen Rehamodus. In diesem Modus vibrieren alle Vibrationsaktuatoren abwechselnd mit einer Stärke von 75 % für eine Dauer von 15 Minuten. Dieser Modus erlaubt die Applikation einer lokalen Vibrationstherapie am Amputationsstumpf, der außerhalb der Prothesentragezeiten oder von noch nicht gehfähigen Patienten genutzt werden kann. Zusätzlich können Patienten nach TSR-Operationen das Vibrationsempfinden im reinnervierten Hautareal vor dem Einbau des Systems in den Schaft dadurch schulen. Phantomschmerzspitzen nach Ablegen der Prothese am Abend – von denen Betroffene häufig berichten – können am Abend oder nachts durch den Rehamodus nicht-medikamentös adressiert werden. Zweck und Ziel ist hier die Erhöhung oder gar Supplementierung des fehlenden afferenten sensorischen Inputs zur Reduktion der sensomotorischen Inkongruenz als angenommene Ursache von Phantomschmerzen30.
Hinsichtlich der Platzierung der Aktuatoreinheit gibt es drei verschiedene Versorgungsmöglichkeiten, die im Folgenden näher erläutert werden:
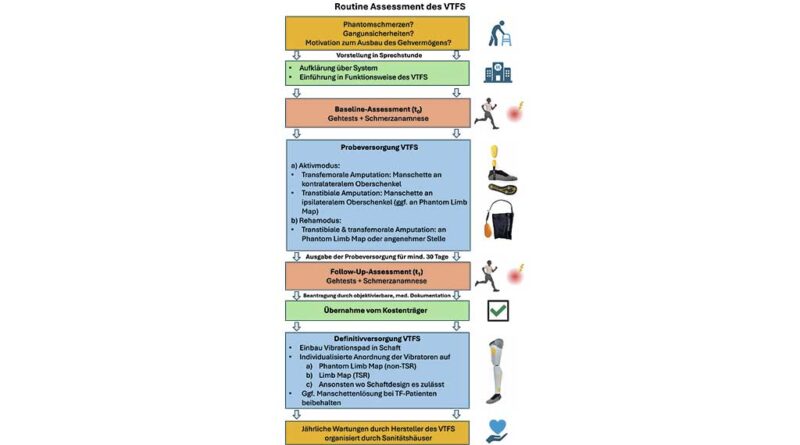
Versorgungsmöglichkeit 1: Probeversorgung
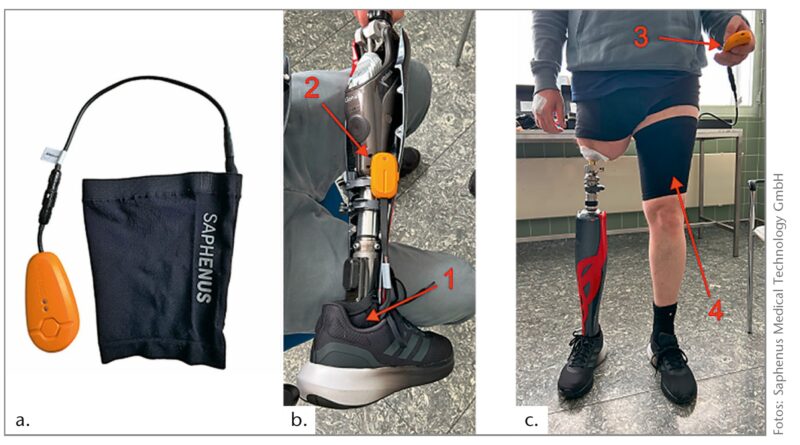
Die Probeversorgung dient dazu, dass der Patient das System nicht-invasiv und ohne eine Anpassung des Schaftsystems – dies würde eine Kostenübernahme durch den Kostenträger erfordern – austesten kann. Hierfür wird eine elastische Bandage verwendet. Diese Bandage beinhaltet die vier Vibrationsaktuatoren, die in einer Reihe von oben nach unten eingebettet sind; sie kann über den Amputationsstumpf als Oberschenkel-Beinmanschette getragen werden (Abb. 3). Bei transtibial Amputierten kann die Manschette am gleichseitigen Oberschenkel getragen werden, bei transfemoralen Patienten wird die Beinmanschette an der kontralateralen gesunden Seite angebracht. Das System wird dann entsprechend umprogrammiert, sodass eine Druckdetektion am Vor- und Rückfuß der amputierten Seite antizyklisch zur Stimulation des kontralateralen, gesunden Oberschenkels führt.
Phantomschmerzen, Stumpfschmerzen und standardisierte Gehtests (Timed-Up-and-Go-Test [TUG], Four-Square-Step-Test [FSST], 10-Meter-Walk-Test [10MWT], 2‑Minute-Walk-Test [2MWT]) werden als Baseline (Erstmessung, t0) erhoben und das System für mindestens 30 Tage für den alltäglichen Gebrauch ausgehändigt. Ein Folgetermin wird vereinbart. Der Patient wird aufgefordert, das System in diesem Zeitraum täglich zu tragen und ggf. den Rehamodus (s. oben, Systemmodi) zu nutzen. Im Folgetermin (Follow-up-Messung, t1) werden die narrative Schmerzanamnese und die Gehtests wiederholt.
Die Differenzen zwischen Erst- und Zweitmessung werden einander gegenübergestellt und anhand von Referenzwerten in der Literatur wird überprüft, ob interventionsbedingte bzw. klinisch relevante Veränderungen nach der Intervention vorliegen. Tabelle 1 zeigt die Referenzwerte für interventionsbedingte Änderungen (Minimal Detectable Change, MDC) im TUG und FSST sowie die Referenzwerte für klinisch-relevante Veränderungen (Minimal Clinically Important Difference, MCID) im 10MWT und 2MWT.
Die Ergebnisse und das subjektive Empfinden sowie die Handhabung werden mit dem Patienten besprochen. Sollte die Probeversorgung die Schmerzen subjektiv reduziert und das Gehvermögen verbessert haben, wird das System beantragt. Die Assessments dienen als Argumentationsgrundlage und der Objektivierung in der Kommunikation mit dem Kostenträger.
Sollte der Patient in der klinischen Untersuchung ein eindeutiges, schmerzhaftes Suralis-Neurom, weitere Neurome oder andere Pathologien haben, die eine operative Stumpfrevision erfordern, so kann eine simultane, kombinierte TSR-Operation erwogen werden (s. unten, Targeted Sensory Reinnervation). Anschließend können die Probeversorgung und der Rehamodus des Feedbacksystems genutzt werden, um das reinnervierte Hautareal zu stimulieren und sensorisch zu schulen.
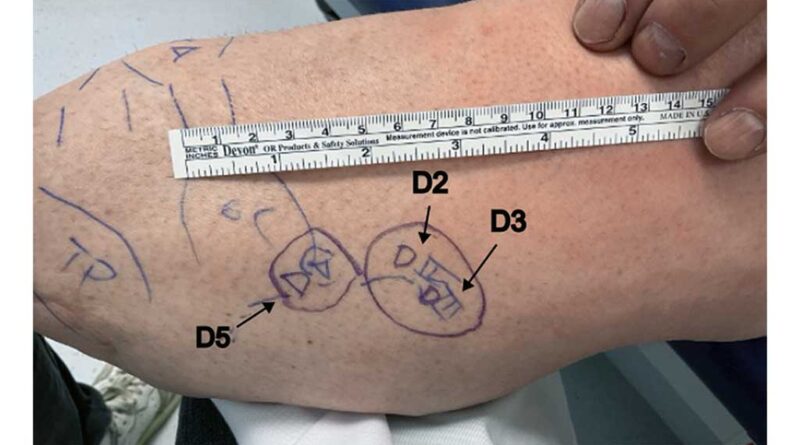
Versorgungsmöglichkeit 2: Definitivversorgung
Nach positiver Probeevaluation und Kostenübernahme kann das System in den Schaft implementiert werden. Hierfür werden entweder ein Vibrationspad eingebaut oder individuell platzierte, singuläre Vibrationsaktuatoren im Schaft implementiert (Abb. 4). Dazu wird der Patient am Stumpf untersucht. Die Befragung, das Beklopfen und Bestreichen des Stumpfes dienen dazu, ein Areal am Stumpf zu identifizieren, bei dem Teile der Fußsohle gespürt werden. Dies wird als Phantom Limb Map bezeichnet31 32 33. Die Vibrationsaktuatoren oder gar das Vibrationspad können so gezielt an dieser Stelle platziert werden. Alternativ kann ein Platz im Schaft gewählt werden, der angenehm ist und Raum bietet, ohne zu Ulzerationen, Druckstellen oder Schmerzen zu führen (Abb. 5). Die Einbettung in den Prothesenschaft ersetzt folglich die Beinmanschette.
Andererseits kann bei Patienten, die eine TSR-Operation hatten, das reinnervierte Hautareal – die sogenannte Limb Map – am Amputationsstumpf gezielt stimuliert werden, um die Somatotopie der Empfindung zu verbessern. Die genaue Platzierung der Vibrationsaktuatoren im Prothesenschaft wird individuell von Patienten zu Patienten geplant.
Zur Kostenkalkulation haben sich versorgende Orthopädietechnikhäuser auf eine Kostenkalkulation verständigt, die dem Bundesinnungsverband für Orthopädietechnik (BIV-OT) vorgelegt wurde.
Sollte eine Einbettung nicht möglich sein, kann weiterhin eine personalisierte Versorgung mithilfe einer Manschette am proximalen amputierten oder kontralateralen gesunden Bein erwogen werden. Die Stimulationsparameter können durch eine begleitende App durch den Orthopädietechniker angepasst werden (s. Abb. 2).
Innerhalb der ersten zwei Jahre nach Erwerb des Systems werden in jährlichen Intervallen die Sensorsocke, das Vibrationspad sowie die Einstellungen des Systems vom Hersteller überprüft und ggf. ausgetauscht. Aus hygienischen Gründen wird die Beinmanschette alle sechs Monate überprüft und ggf. ausgetauscht. Das versorgende Orthopädietechnikhaus organisiert zusammen mit der Firma Saphenus die Wartung und notwendige Reparaturen.
Targeted Sensory Reinnervation (TSR) – Steigerung der Authentizität
Um die Authentizität des sensorischen Empfindungsvermögens der amputierten Fußsohle zu steigern, können die sensorischen Nervenanteile, die ehemals die Fußsohle innerviert haben, aus dem Amputationsstumpf heraus präpariert und gezielt mit einem sensorischen Hautnerv mikrochirurgisch verbunden werden. Durch die Durchtrennung des ursprünglichen Hautnervs ist die Haut zunächst taub (denerviert), bis sie von dem Fußsohlennerv reinnerviert wird. Anschließend entsteht ein Hautareal am Stumpf, das die Empfindung der Fußsohle auslöst und darüber eine sensorische Mensch-Maschinen-Schnittstelle erlaubt.
MERKE: Die Targeted Sensory Reinnervation (TSR) ist eine Operationstechnik, bei der zunächst ein bestimmtes Hautareal am Amputationsstumpf chirurgisch denerviert wird. Anschließend wird dieses denervierte Hautareal mithilfe des Nerventransfers eines spezifischen sensorischen Nervs aus der amputierten Gliedmaße reinnerviert34 35 36. Das Ziel der Operation ist die Wiederherstellung der Somatotopie der Empfindung, sodass eine Stimulation des operierten Hautareals als Stimulation an dem ursprünglichen Innervationsgebiet des transponierten Nervs wahrgenommen wird.
Die Grundidee und der Ablauf der Operation ist an die Targeted Muscle Reinnervation (TMR) angelehnt, in der ein gemischter Nerv, welcher motorische und sensorische Fasern enthält, transponiert wird und einen denervierten Muskel reinnerviert37 38 39.
Die Kombination der TSR-Operation mit einem sensorischen Feedbacksystem ist eine Möglichkeit der Wiederherstellung der Sensibilität nach Amputation mit einer Verbesserung der funktionellen Leistungsfähigkeit sowie einer Reduktion der sensomotorischen Inkongruenz und der Deafferenzierung. Beide Mechanismen werden gegenwärtig als an der Entstehung von Phantomschmerzen beteiligt angenommen40 41.
Der genaue Operationsablauf und die Auswahl der Spender- und Empfängernerven richten sich nach der Amputationshöhe und sollen im Folgenden näher erläutert werden.
Operatives Vorgehen bei transtibialer Amputation
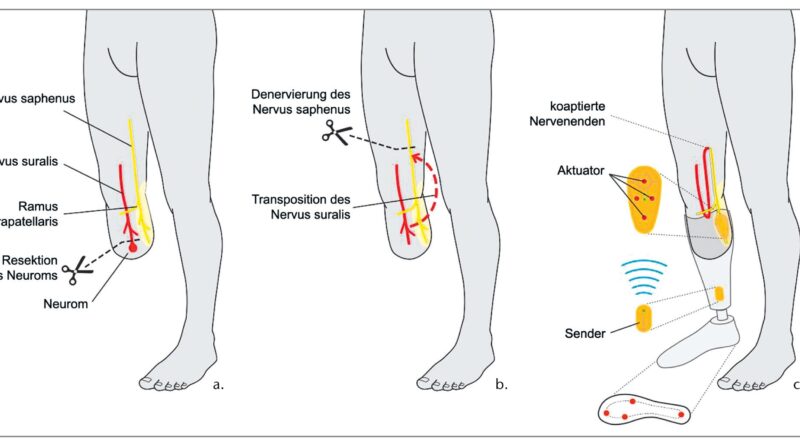
Bei einer Amputation des Beines auf Höhe des Unterschenkels dient meist der Nervus suralis, der den lateralen Fußrand und die Ferse sensibel innerviert, als Spendernerv, um die Sensibilität der Fußsohle wiederherzustellen, und der Nervus saphenus, der die Haut des medialen Oberschenkels innerviert, als Empfängernerv (Abb. 6).
Der erste Operationsschritt umfasst die Darstellung, Freilegung und Mobilisation des Nervus suralis in dem dorsalen Hautlappen zwischen den beiden Bäuchen des M. Gastrocnemius sowie die Resektion eines ggf. vorhandenen Neuroms. Anschließend wird der Nervus saphenus oberhalb der Innenseite des Knies dargestellt, präpariert und durchtrennt (Denervierung), wodurch die sensible Innervation der Haut distal des medialen Oberschenkels und folglich auch der Innenseite des Unterschenkels unterbrochen wird. Um einer Neurombildung vorzubeugen, wird der proximale Nervenstumpf des Nervus saphenus in das Muskelgewebe der Adduktorengruppe eingebettet und versenkt. Der distale Anteil des Nervus saphenus wird mit dem aus dem Unterschenkel ausgelösten und tunnelierten Nervus suralis durch eine mikrochirurgische Naht auf der Höhe des medialen Knies verbunden. Die Nervenfasern des Nervus suralis wachsen nun entlang des distalen Anteils des Nervus saphenus als eine Art Leitschiene in den medialen Unterschenkelstumpf ein und reinnervieren diesen42. Teile der Fußsohle werden nach abgeschlossener Reinnervation erwartungsgemäß am medialen Unterschenkelstumpf empfunden. Diese Empfindung bezeichnen wir als Limb Map (Abb. 7). Die Reinnervation hat eine zu erwartende Geschwindigkeit von 1 mm/Tag43 44 45. Der Fortschritt der Reinnervation kann durch Beklopfen (Hofmann-Tinel-Zeichen) überwacht werden. Wir fordern die Patienten auf, Empfindungen mit einem hautfreundlichen Stift am Unterschenkel einzuzeichnen. Sobald die Limb Map stabil und die Reinnervation abgeschlossen ist, kann die Stimulationseinheit an dieser Stelle in den Schaft implementiert werden. Eine transtibiale TSR ist bei der primären Amputation, aber auch bei Stumpfkorrekturen oder Revisionen möglich.
Operatives Vorgehen bei transfemoraler Amputation
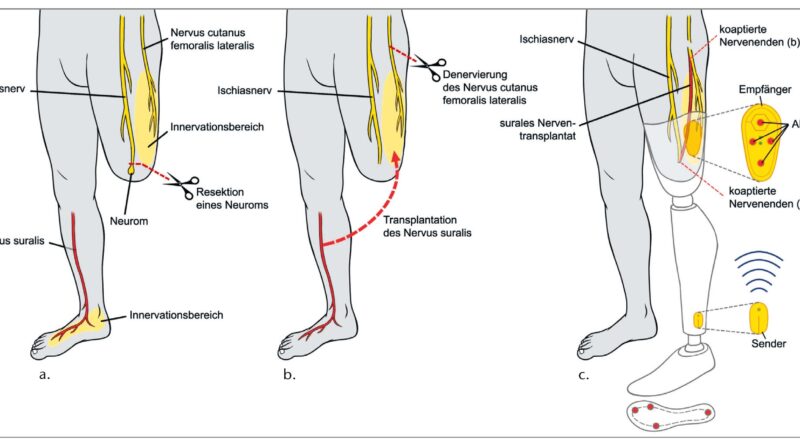
Ähnlich wie bei einer transtibialen Amputation wird auch bei einer Amputation des Beines auf Höhe des Oberschenkels der Nervus suralis als Spendernerv genutzt (Abb. 8). Als Empfängernerv dient nun hingegen der Nervus cutaneus femoris lateralis, der die Haut des lateralen Oberschenkels innerviert. Da bei einer Knieexartikulation und einer transfemoralen Amputation eine weite Distanz zwischen Spender- und Empfängernerv überbrückt werden muss, muss ggf. der Nervus suralis auf der Gegenseite (kontralateral) entnommen und für die Reinnervierung verwendet werden.
Als erster Schritt erfolgen auch hier erneut die Darstellung und Freilegung des gleichseitigen (ipsilateralen) Nervus suralis am distalen Unterschenkel, die Resektion von bestehenden Neuromen sowie die Darstellung und Freilegung des kontralateralen Nervus suralis. Als Nächstes wird der kontralaterale Nervus suralis transplantiert und Ende-zu-Ende mit dem distalen Ende des ipsilateralen Nervus suralis verbunden. Daraufhin folgen die Darstellung, Präparation und proximale Durchtrennung des Nervus cutaneus femoris lateralis in der Leiste. Wie vorher beschrieben, wird auch hier das proximale Nervenende zur Neuromprophylaxe in umliegendes Muskelgewebe eingebettet. Dann folgt die Ende-zu-Ende-Koaptation des distalen Endes des Nervus suralis oder des Transplantats mit dem distalen Teil des Nervus cutaneus femoris lateralis und somit eine gezielte Reinnervierung der denervierten Haut des lateralen Oberschenkels durch den Nervus suralis46.
Eine TSR-Operation ist bisher bei der primären Amputation und bei transtibialen auch bei Stumpfkorrekturen/-revisionen möglich. Die Indikation ist durch einen erfahrenen Chirurgen in enger Kommunikation mit dem versorgenden Orthopädietechnikhaus und nach umfassender und vollständiger Diagnostik zu erwägen. Außerhalb von primären TSR-Operationen bei akuten notfallmäßigen Amputationen sollte die Kostenübernahme beim Kostenträger vor einer Operation erfolgen und die Assessments beinhalten. Bezüglich des Spender- und Empfängernervs sind Variationen möglich. Insbesondere die Reinnervation des Oberschenkels bei Unterschenkelamputierten ist eine nennenswerte Variation.
Ist der Einfluss eines vibrotaktilen Feedbacksystems (VTFS) auf das Gehvermögen von Beinamputierten objektivierbar?
Um den Einfluss nicht-invasiver, gangsynchronisierter, vibrotaktiler Stimulation auf das Gehvermögen von Patienten mit einer Amputation der unteren Extremität zu untersuchen, evaluieren wir an der Medizinischen Hochschule Hannover (MHH) das therapeutische Potential der Stimulation durch routinemäßige Assessments unserer Patienten im Rahmen der Sprechstunde. Die Bewertung des Gehvermögens erfolgt anhand der vier Parameter Sturzrisiko, Koordination, Gehgeschwindigkeit und Ausdauer. Anhand einer Schmerzskala werden amputationsassoziierte Schmerzen erfasst. Dabei verwenden wir die vier bereits erwähnten standardisierten Gangtests: den TUG47 48, den FSST49, den 10MWT50 und den 2MWT51 52.
Patienten, die unter Phantomschmerzen und/oder an Gehunsicherheit leiden, erhalten zunächst eine umfassende Einführung in die Funktionsweise des vibrotaktilen Feedbacksystems (VTFS) und eine Anpassung der Probeversorgung an die Prothesenversorgung. Anschließend führt der Patient zur Ermittlung der Baseline-Werte (t0-Messung) die vier Gehtests mit ausgeschaltetem Feedbacksystem durch (Abb. 9, Video 1). Danach kann der Patient das eingeschaltete Feedbacksystem für mindestens 30 Tage zu Hause und im Alltag testen. Abschließend stellt er sich erneut in unserer Sprechstunde vor und führt dieselben vier Gehtests sowie die Schmerzanamnese durch – diesmal jedoch mit eingeschaltetem Feedbacksystem, damit der Einfluss des Feedbacksystems auf das Gehvermögen ermittelt werden kann (t1-Messung) (Video 2). Ist der Patient mit dem Ergebnis zufrieden, beginnt dann die Beantragung des Systems beim Kostenträger.
Derzeit befinden wir uns in der ersten Datenauswertung. Erste Rückmeldungen der Patienten zeigen eine deutliche Verbesserung des Gehvermögens, besonders an dunklen Orten oder in der Nacht, einen positiven Einfluss auf das Prothesen-Embodiment und eine Reduktion von Phantomschmerzen53.
Video 1 Videodokumentation eines Oberschenkelamputierten vor der Erprobungsphase (vibrotaktiles Feedbacksystem „AUS“). Der Patient geht mit deutlich reduzierter Gehgeschwindigkeit und assistiert an Unterarmgehstützen. (Video: Saphenus Medical Technology GmbH)
Video 2 Videodokumentation desselben Oberschenkelamputierten nach der Erprobungsphase (vibrotaktiles Feedbacksystem „EIN“). Der Patient geht mit einer erhöhten Gehgeschwindigkeit und ist nicht auf die Unterarmgehstützen angewiesen.
Fallvorstellungen
Im Folgenden stellen wir zwei Patientenfälle vor. Patient 1 hat eine TSR-Operation erhalten. Patient 2 hat keine TSR-Operation erhalten und beantragt derzeit das System.
Patient 1: Der 73-jährige männliche Patient wurde im Dezember 2021 aufgrund eines Ulkus auf den Boden einer peripheren arteriellen Verschlusskrankheit und Diabetes mellitus mit septischem Verlauf am distalen Unterschenkel auf Höhe des Unterschenkels amputiert (Tab. 2). Im Rahmen der Amputation hat der Patient zur Neurom- und Phantomschmerzprophylaxe einen selektiven Nerventransfer in Form einer Targeted Sensory Reinnervation erhalten.
Nach abgeschlossener Wundheilung und Anpassung einer Prothese erhielt der Patient im Oktober 2022 (zehn Monate nach Amputation) das vibrotaktile Feedbacksystem für 30 Tage in einer Probeversorgung und testete dieses als Beinmanschette am Oberschenkel und bei postoperativ starken Phantomschmerzen auch im Rehamodus. Die Ergebnisse der Gehtests vor und nach Testung des Feedbacksystems sind in Tabelle 3 dargestellt.
Patient 2: Der 53-jährige männliche Patient wurde aufgrund eines Traumas auf Höhe des Oberschenkels amputiert (Tab. 2). Der Patient hat eine standardmäßige Amputation erhalten. Das vibrotaktile Feedbacksystem erprobte er für 120 Tage als Beinmanschette am kontralateralen Oberschenkel. Die Ergebnisse der Gehtests vor und nach der Testung des Feedbacksystems sind in Tabelle 3 dargestellt.
Die Intervention mit dem vibrotaktilen Feedbacksystem hat die Gangparameter in allen vier Gehtests verbessert. Vergleiche mit den Referenzwerten in der Literatur (s. Tab. 1) zeigen, dass Patient 1 eine interventionsbedingte Verbesserung im TUG (Sturzrisiko) 54 55 sowie eine klinisch relevante Verbesserung im 10MWT (Gehgeschwindigkeit) 56 erreicht hat, wohingegen Patient 2 eine interventionsbedingte Verbesserung im TUG (Sturzrisiko) 57 58 und im FSST (Koordination) 59 gezeigt hat. Amputations-assoziierte Schmerzen waren ebenso bei beiden Patienten verringert.
Die gangsynchronisierte, vibrotaktile Stimulation hat bereits in der Probeversorgung einen positiven Effekt auf relevante Gehparameter von sowohl TSR- als auch Non-TSR-Patienten gezeigt, besonders bei Patienten mit Gangunsicherheiten60 61 62. Um diese neue Technologie für Betroffene besser zugänglich zu machen und um weitere Effekte, wie Langzeiteffekte, Effekte auf amputationsassoziierte Schmerzen und biomechanische Effekte, zu untersuchen, sollten eine Registerarbeit und ein Standardprotokoll im Rahmen einer multizentrischen Studie etabliert werden.
Für die Autoren:
Magnus Niklas Kalff
Klinik für Unfallchirurgie
Medizinische Hochschule Hannover
Carl-Neuberg-Straße 1
30625 Hannover
Kalff.Magnus@mh-hannover.de
Mobil: 0151–19168481
Begutachteter Beitrag/reviewed paper
Kalff MN et al. „Ich fühle, wie ich gehe“ – ein innovatives, nicht-invasives, gangsynchrones, vibrotaktiles Feedbacksystem. Eine Roadmap zu Versorgungsmöglichkeiten. Orthopädie Technik, 2024; 75 (7): 52–61
Tabelle 1 In der Literatur beschriebene MCID- bzw. MDC-Werte für die vier funktionellen Gehtests.
| Gehtest | MCID | MDC | Quelle |
|---|---|---|---|
| TUG | n. a. | 3,6 s 2,2 s | [30] [31] |
| FSST | n. a. | 2,0 s | [31] |
| 10MWT | 0,21 m/s | n. a. | [32] |
| 2MWT | 37,2 m | n. a. | [32] |
Tabelle 2 Demographie und versorgungsrelevante Daten der Patienten.
| Patient | Geschlecht | Alter | Kohorte | Amputationshöhe | Betroffene Seite | Amputationsursache | Zeit seit Amputation |
|---|---|---|---|---|---|---|---|
| 1 | Männlich | 73 | TSR | Transtibial | Links | Durchblutungsstörung (pAVK) | 1,6 Jahre |
| 2 | Männlich | 53 | Non-TSR | Transfemoral | Links | Trauma | 2,5 Jahre |
Tabelle 3 Ergebnisse des funktionellen Assessments (TUG, FSST, 10MWT, 2MWT) der Patienten. Veränderungen zwischen Erst- (t0) und Zweitmessung (t1) (Darstellung absolut und relativ). Eine Abnahme der benötigten Zeit im TUG und im FSST, eine Zunahme der Gehgeschwindigkeit im 10MWT sowie eine Zunahme der Gehstrecke im 2MWT sind (fett) hervorgehoben dargestellt.
MW = Mittelwert; Δ = Differenz.
| Patient | MW TUG (t0) [t in s] | MW TUG (t1) [t in s] | Δ TUG [t in s] | MW FSST (t0) [t in s] | MW FSST (t1) [t in s] | Δ FSST [t in s] |
| 1 | 18,71 | 12,73 | -5,98 (-32 %) | 25,36 | 23,60 | -1,76 (-6,9 %) |
| 2 | 15,14 | 10,84 | -4,3 (-28,4 %) | 12,91 | 10,35 | -2,56 (-19,8 %) |
| Patient | MW 10MWT (t0) [v in m/s] | MW 10MWT (t1) [v in m/s] | Δ 10MWT [v in m/s] | MW 2MWT (t0) [s in m] | MW 2MWT (t1) [s in m] | Δ 2MWT [s in m] |
| 1 | 0,71 | 0,97 | 0,26 (36,6 %) | 73 | 109 | 36 (49,3 %) |
| 2 | 1,07 | 1,17 | 0,1 (9,3 %) | 105 | 131 | 26 (24,8 %) |
- Compliance in der Skoliose-Korsettversorgung – Einflussfaktoren und Herausforderungen einer erfolgreichen Therapie — 5. Juli 2025
- Elektrische Anregung eines Teleskop-Phantoms – Fallstudie an einer beinamputierten Patientin — 4. Juli 2025
- Dynamische Hüftabduktions-Lagerungsorthese zur Behandlung pathologisch veränderter Hüften bei neuromuskulären Erkrankungen in der Kinderorthopädie — 5. Juni 2025
- Biddiss EA, Beaton D, Chau T. Consumer Design Priorities for Upper Limb Prosthetics. Disability and Rehabilitation: Assistive Technology, 2009; 2 (6): 346–357. doi: 10.1080/17483100701714733
- Biddiss EA, Chau T. Upper Limb Prosthesis Use and Abandonment: A Survey of the Last 25 Years. Prosthetics and Orthotics International, 2007; 31 (3): 236–257. doi: 10.1080/03093640600994581
- Manz S et al. A review of user needs to drive the development of lower limb prostheses. Journal of NeuroEngineering and Rehabilitation, 2022; 19 (1): 119. doi: 10.1186/s12984-022–01097‑1
- Atkins DJ, Heard DCY, Donovan WH. Epidemiologic Overview of Individuals with Upper-Limb Loss and Their Reported Research Priorities. Journal of Prosthetics and Orthotics, 1996; 8 (1): 2–11. doi: 10.1097/00008526–199600810-00003
- Miller WC, Speechley M, Deathe B. The Prevalence and Risk Factors of Falling and Fear of Falling among Lower Extremity Amputees. Archives of Physical Medicine and Rehabilitation, 2001; 82 (8): 1031–1037. doi: 10.1053/APMR.2001.24295
- Fuchs K et al. Influence of Augmented Visual Feedback on Balance Control in Unilateral Transfemoral Amputees. Frontiers in Neuroscience, 2021; 13 (15): 727527. doi: 10.3389/fnins.2021.727527
- Nolan L et al. Adjustments in Gait Symmetry with Walking Speed in Trans-Femoral and Trans-Tibial Amputees. Gait & Posture, 2003; 17 (2): 142–151, doi: 10.1016/S0966-6362(02)00066–8
- Waters RL, Perry J, Antonelli D, Hislop H. Energy Cost of Walking of Amputees: The Influence of Level of Amputation. Journal of Bone & Joint Surgery, 1976; 58 (1): 42–46, doi: 10.2106/00004623–197658010-00007
- Blanke O. Multisensory Brain Mechanisms of Bodily Self-Consciousness. Nature Reviews Neuroscience, 2012; 13 (8): 556–571. doi: 10.1038/nrn3292
- Heller BW, Datta D, Howitt J. A pilot study comparing the cognitive demand of walking for transfemoral amputees using the intelligent prosthesis with that using conventionally damped knees. Clinical Rehabilitation, 2000; 14 (5): 518–522. doi: 10.1191/0269215500CR345OA
- Ehrsson HH et al. Upper limb amputees can be induced to experience a rubber hand as their own. Brain, 2008; 131 (12): 3443–3452. doi: 10.1093/BRAIN/AWN297
- Svensson P, Wijk U, Björkman A, Antfolk C. A review of Invasive and Non-Invasive Sensory Feedback in Upper Limb Prostheses. Expert Review of Medical Devices 2017, 14, 439–447. doi: 10.1080/17434440.2017.1332989
- Culp CJ, Abdi S. Current Understanding of Phantom Pain and Its Treatment. Pain Physician, 2022; 25 (7): E941–E957
- Makin TR, Flor H. Brain (re)organisation following amputation: Implications for phantom limb pain. NeuroImage 2020; 218: 116943. doi: 10.1016/J.NEUROIMAGE.2020.116943
- Sensinger JW, Dosen S. A Review of Sensory Feedback in Upper-Limb Prostheses From the Perspective of Human Motor Control. Frontiers in Neuroscience, 2020; 14: 345. doi: 10.3389/FNINS.2020.00345
- Raspopovic S. Neurorobotics for Neurorehabilitation. Science (1979) 2021; 373 (65555): 634–635. doi: 10.1126/science.abj5259
- Ehrsson HH et al. Upper limb amputees can be induced to experience a rubber hand as their own. Brain, 2008; 131 (12): 3443–3452. doi: 10.1093/BRAIN/AWN297
- Dietrich C et al. Leg Prosthesis With Somatosensory Feedback Reduces Phantom Limb Pain and Increases Functionality. Frontiers in Neurology, 2018: 9. doi: 10.3389/FNEUR.2018.00270
- Preibler S et al. The Feeling Prosthesis—Somatosensory Feedback from the Prosthesis Foot Reduces Phantom Limb Pain Dramatically. Pain Medicine, 2018; 19 (8): 1698–1700. doi: 10.1093/PM/PNX295
- Dietrich C et al. Sensory Feedback Prosthesis Reduces Phantom Limb Pain: Proof of a Principle. Neuroscience Letters, 2012; 507 (2): 97–100. doi: 10.1016/J.NEULET.2011.10.068
- Gardetto A et al. Reduction of Phantom Limb Pain and Improved Proprioception through a TSR-Based Surgical Technique: A Case Series of Four Patients with Lower Limb Amputation. Journal of Clinical Medicine, 2021; 10 (17): 4029. doi: 10.3390/JCM10174029
- Marasco PD et al. Robotic Touch Shifts Perception of Embodiment to a Prosthesis in Targeted Reinnervation Amputees. Brain, 2011; 134 (3): 747–758. doi: 10.1093/BRAIN/AWQ361
- Markovic M et al. The clinical relevance of advanced artificial feedback in the control of a multi-functional myoelectric prosthesis. Journal of NeuroEngineering and Rehabilitation, 2018; 15 (1): 28. doi: 10.1186/S12984-018‑0371‑1
- Petrini FM et al. Sensory Feedback Restoration in Leg Amputees Improves Walking Speed, Metabolic Cost and Phantom Pain. Nature Medicine, 2019; 25: 1356–1363. doi: 10.1038/s41591-019‑0567‑3
- De Nunzio AM et al. Relieving phantom limb pain with multimodal sensory-motor training. Journal of Neural Engineering, 2018; 15 (6): 066022. doi: 10.1088/1741–2552/AAE271
- Clark RE. The classical origins of pavlov’s conditioning. Integrative Physiological and Behavioral Science, 2004; 39 (4): 279–294. doi: 10.1007/BF02734167/METRICS.
- Bodenmann G, Schaer M. Klassische Konditionierung. Sprache, Stimme, Gehör, 2006; 30 (1): 2–7. doi: 10.1055/S‑2006–931524/BIB
- Penasso H et al. Safety and Efficacy of Vibrotactile Feedback for Adults with Transtibial Amputation: A Randomized Controlled Cross-over Trial. In Submission. Clinical Biomechanics, 2024
- Kalff M. Einfluss eines vibrotaktilen Feedbacksystems auf das Gehvermögen von Beinamputierten. Unveröffentlichte Masterthesis, Private Hochschule Göttingen, 2023
- Harris AJ. Cortical origin of pathological pain. The Lancet, 1999; 354 (9188): 1464–1466. doi: 10.1016/S0140-6736(99)05003–5
- Pirowska A et al. Phantom phenomena and body scheme after limb amputation: A literature review. Polish Journal of Neurology and Neurosurgery, 2014; 48 (1): 52–59. doi: 10.1016/J.PJNNS.2013.03.002
- Huang H et al. Automatic hand phantom map generation and detection using decomposition support vector machines. BioMedica Engineering OnLine, 2018; 17 (74): 1–30. doi: 10.1186/S12938-018‑0502‑8/TABLES/3
- Aszmann OC, Farina D. Bionic Limb Reconstruction; Cham: Springer Nature, 2021
- Gardetto A et al. Reduction of Phantom Limb Pain and Improved Proprioception through a TSR-Based Surgical Technique: A Case Series of Four Patients with Lower Limb Amputation. Journal of Clinical Medicine, 2021; 10 (17): 4029. doi: 10.3390/JCM10174029
- Kuiken TA et al. Redirection of Cutaneous Sensation from the Hand to the Chest Skin of Human Amputees with Targeted Reinnervation. Proceedings of the National Academy of Sciences, 2007; 104 (50): 20061–20066. doi: 10.1073/PNAS.0706525104
- Marasco PD, Schultz AE, Kuiken TA. Sensory capacity of reinnervated skin after redirection of amputated upper limb nerves to the chest. Brain, 2009; 132 (6): 1441–1448. doi: 10.1093/BRAIN/AWP082
- Aszmann OC, Farina D. Bionic Limb Reconstruction; Cham: Springer Nature, 2021
- Bergmeister KD, Salminger S, Aszmann OC. Targeted Muscle Reinnervation for Prosthetic Control. Hand Clin, 2021; 37: 415–424. doi: 10.1016/J.HCL.2021.05.006
- Kuiken TA et al. The use of targeted muscle reinnervation for Improved myoelectric prosthesis control in a bilateral shoulder disarticulation amputee. Prosthetics and Orthotics International, 2004; 28 (3): 245–253. doi: 10.3109/03093640409167756
- Gardetto A et al. Reduction of Phantom Limb Pain and Improved Proprioception through a TSR-Based Surgical Technique: A Case Series of Four Patients with Lower Limb Amputation. Journal of Clinical Medicine, 2021; 10 (17): 4029. doi: 10.3390/JCM10174029
- Marasco PD et al. Robotic Touch Shifts Perception of Embodiment to a Prosthesis in Targeted Reinnervation Amputees. Brain, 2011; 134 (3): 747–758. doi: 10.1093/BRAIN/AWQ361
- Gardetto A et al. Reduction of Phantom Limb Pain and Improved Proprioception through a TSR-Based Surgical Technique: A Case Series of Four Patients with Lower Limb Amputation. Journal of Clinical Medicine, 2021; 10 (17): 4029. doi: 10.3390/JCM10174029
- Lundy-Ekman L. Neuroscience: Fundamentals for Rehabilitation. Amsterdam: Elsevier, 2018
- Stoll G, Müller HW. Nerve injury, axonal degeneration and neural regeneration: basic insights. Brain Pathology, 1999; 9 (2): 313–325. doi: 10.1111/J.1750–3639.1999.TB00229.X
- Fugleholm K, Schmalbruch H, Krarup C. Early peripheral nerve regeneration after crushing, sectioning, and freeze studied by implanted electrodes in the cat. Journal of Neuroscience, 1994; 14 (5): 2659–2673. doi: 10.1523/JNEUROSCI.14–05-02659.1994
- Gardetto A et al. Reduction of Phantom Limb Pain and Improved Proprioception through a TSR-Based Surgical Technique: A Case Series of Four Patients with Lower Limb Amputation. Journal of Clinical Medicine, 2021; 10 (17): 4029. doi: 10.3390/JCM10174029
- Sawers A, Kim J, Balkman G, Hafner BJ. Interrater and Test-Retest Reliability of Performance-Based Clinical Tests Administered to Established Users of Lower Limb Prostheses. Physical Therapy Journal, 2020; 100 (17): 1206–1216. doi: 10.1093/PTJ/PZAA063
- Tan JM, Halford GRJ, Lukin M, Kohler F. Recommendations from the ISPO Lower-Limb COMPASS: Patient-Reported and Performance-Based Outcome Measures. Prosthetics and Orthotics International, 2023; 47 (1): 13. doi: 10.1097/PXR.0000000000000197
- Sawers A, Kim J, Balkman G, Hafner BJ. Interrater and Test-Retest Reliability of Performance-Based Clinical Tests Administered to Established Users of Lower Limb Prostheses. Physical Therapy Journal, 2020; 100 (17): 1206–1216. doi: 10.1093/PTJ/PZAA063
- Sawers A, Kim J, Balkman G, Hafner BJ. Interrater and Test-Retest Reliability of Performance-Based Clinical Tests Administered to Established Users of Lower Limb Prostheses. Physical Therapy Journal, 2020; 100 (17): 1206–1216. doi: 10.1093/PTJ/PZAA063
- Tan JM, Halford GRJ, Lukin M, Kohler F. Recommendations from the ISPO Lower-Limb COMPASS: Patient-Reported and Performance-Based Outcome Measures. Prosthetics and Orthotics International, 2023; 47 (1): 13. doi: 10.1097/PXR.0000000000000197
- Gaunaurd I et al. The Utility of the 2‑Minute Walk Test as a Measure of Mobility in People With Lower Limb Amputation. Archives of Physical Medicine and Rehabilitation, 2020; 101 (7): 1183–1189. doi: 10.1016/J.APMR.2020.03.007
- Kalff M. Einfluss eines vibrotaktilen Feedbacksystems auf das Gehvermögen von Beinamputierten. Unveröffentlichte Masterthesis, Private Hochschule Göttingen, 2023
- Resnik L, Borgia M. Reliability of outcome measures for people with lower-limb amputations: Distinguishing true change from statistical error. Physical Therapy Journal, 2011; 91 (4): 555–565. doi: 10.2522/PTJ.20100287
- Sawers A, Kim J, Balkman G, Hafner BJ. Interrater and Test-Retest Reliability of Performance-Based Clinical Tests Administered to Established Users of Lower Limb Prostheses. Physical Therapy Journal, 2020; 100 (17): 1206–1216. doi: 10.1093/PTJ/PZAA063
- Carse B et al. Minimal Clinically Important Difference in Walking Velocity, Gait Profile Score and Two Minute Walk Test for Individuals with Lower Limb Amputation. Gait & Posture, 2021; 88: 221–224. doi: 10.1016/J.GAITPOST.2021.06.001
- Resnik L, Borgia M. Reliability of outcome measures for people with lower-limb amputations: Distinguishing true change from statistical error. Physical Therapy Journal, 2011; 91 (4): 555–565. doi: 10.2522/PTJ.20100287
- Sawers A, Kim J, Balkman G, Hafner BJ. Interrater and Test-Retest Reliability of Performance-Based Clinical Tests Administered to Established Users of Lower Limb Prostheses. Physical Therapy Journal, 2020; 100 (17): 1206–1216. doi: 10.1093/PTJ/PZAA063
- Sawers A, Kim J, Balkman G, Hafner BJ. Interrater and Test-Retest Reliability of Performance-Based Clinical Tests Administered to Established Users of Lower Limb Prostheses. Physical Therapy Journal, 2020; 100 (17): 1206–1216. doi: 10.1093/PTJ/PZAA063
- Gardetto A et al. Reduction of Phantom Limb Pain and Improved Proprioception through a TSR-Based Surgical Technique: A Case Series of Four Patients with Lower Limb Amputation. Journal of Clinical Medicine, 2021; 10 (17): 4029. doi: 10.3390/JCM10174029
- Penasso H et al. Safety and Efficacy of Vibrotactile Feedback for Adults with Transtibial Amputation: A Randomized Controlled Crossover Trial. In Submission. Clinical Biomechanics, 2024
- Kalff M. Einfluss eines vibrotaktilen Feedbacksystems auf das Gehvermögen von Beinamputierten. Unveröffentlichte Masterthesis, Private Hochschule Göttingen, 2023