Einleitung
Jährlich erleiden weltweit 15 Millionen Menschen einen Schlaganfall; 6 Millionen Menschen sterben daran; 5 Millionen sind dauerhaft beeinträchtigt. In Deutschland erleiden jährlich ca. 250.000 Menschen einen Schlaganfall 1. Die in Deutschland aufgebaute medizinische Versorgungsstruktur führt zu einer verbesserten Überlebenschance der Betroffenen. 25 % der Überlebenden genesen mit geringen Einschränkungen; 40 % leiden jedoch weiterhin an mittleren bis schweren Einschränkungen 2. Angesichts der demografischen Entwicklung wird die Zahl der jährlichen Schlaganfallpatienten Vorausberechnungen zufolge in Hessen bis zum Jahr 2050 kontinuierlich um über 65 % steigen. Der weit überwiegende Anteil der Schlaganfallpatienten wird dann älter als 74 Jahre sein. Die Anzahl der schwer betroffenen, pflegebedürftigen Schlaganfallpatienten wird aufgrund dessen überdurchschnittlich zunehmen 3.
In der Akutphase wird der Patient in Deutschland in der Regel in einer spezialisierten Schlaganfallstation, der sogenannten Stroke Unit, versorgt. Dabei wird intensivmedizinisch alles unternommen, um das Überleben des Patienten sicherzustellen und die medizinischen Grundlagen zu schaffen, die dem Betroffenen die Voraussetzungen für ein möglichst gutes Rehabilitationsergebnis zur Teilhabe am Alltag ermöglichen. Dieser Beitrag stellt die Behandlung und Versorgung von Patienten nach einem Schlaganfall im interdisziplinären und interprofessionellen Zentrum in Egelsbach aus Sicht der Physiotherapie, der Ergotherapie sowie der Orthopädie- und Rehatechnik dar.
Von Beginn an werden die Patienten auf den Intensivstationen der regionalen Kliniken von unseren Ergotherapeuten behandelt. Die physiotherapeutische Betreuung wird von den Therapeuten der Kliniken selbst abgedeckt. Damit wird der Grundstein für eine adäquate motorische und funktionelle Rehabilitation gelegt. Bereits innerhalb der ersten drei Tage ist aufgrund der Diagnose und des Verlaufes zu erkennen, inwiefern der Patient die Klinik mit Einschränkungen verlassen wird. Dies gilt auch für die Patienten, die infolge der Schwere des Schlaganfalls einen längeren Weg in ein anderes, neues Leben zurücklegen müssen. Jene Patienten sind es, denen das „Egelsbacher Konzept“ mittels frühzeitiger bedarfsgerechter Behandlung und Versorgung durch ein interprofessionelles Team helfen soll, schnellstmöglich eine angemessene Mobilität und Lebensqualität wiederzuerlangen.
Im Folgenden werden Therapieansätze und Versorgungsmöglichkeiten zunächst für die unter Extremität, sodann in einem separaten Abschnitt für die obere Extremität beschrieben.
Therapie und Versorgung der unteren Extremität
Der Fuß des Patienten zeigt nach einem Schlaganfall im ungünstigsten Fall eine Fehlstellung, wie sie der spanische Maler Jusepe de Ribera bereits im 17. Jahrhundert eindrucksvoll in einem Gemälde dargestellt hat (Abb. 1). Die Konsequenzen des Gangbildes bei Menschen mit einem sogenannten Spitzfuß sind seit Jahrhunderten die gleichen: Eine solche Fehlstellung muss während des Gehens kompensiert werden, zum Beispiel durch kreisförmiges Nach-vorne-Führen des betroffenen Beines in der Schwungphase (Zirkumduktion). Selbst bei einer geringen Spitzfußkontraktur sind aufwendige Orthesen erforderlich, um das Standbein zu stabilisieren und damit gleichzeitig die Schwungphase des gesunden Beines zu gewährleisten. Ein Spitzfußausgleich an der Orthese (mit Verkürzungsausgleich am Schuh der kontralateralen Seite) wird nötig, um die physiologische Dorsalextension des oberen Sprunggelenkes während der terminalen Standphase zu ermöglichen, ohne dass es dabei zu Kompensationsbewegungen des unteren Sprunggelenkes kommt. Sind aufwendige Orthesenversorgungen erforderlich, so gehen diese zwangsläufig mit einer Zunahme des Orthesengewichtes einher, was wiederum einen negativen Einfluss auf den Kraft- und Energieverbrauch beim ohnehin beschwerlichen Stehen und Gehen des Betroffenen mit Halbseitenlähmung hat. Sind Tonuserhöhung sowie Fehlstellungen und Kontrakturen ausgeprägt, wird in der Leitlinie „Therapie des spastischen Syndroms“ der DGN nach sorgfältiger Prüfung und Ausschöpfung der konservativen Behandlungsmethoden das Erwägen operativer Verfahren empfohlen 4. Dabei sollte die Entscheidung zur Operation in Abhängigkeit des Therapiezieles und unter Einbeziehung des Patienten, seines Umfeldes sowie des interprofessionellen Teams getroffen werden. Dabei trägt die präoperative Therapie- und Hilfsmittelplanung zur Sicherung des Operationsergebnisses bei.
Nachfolgend wird genauer auf die Entstehung eines Spitzfußes eingegangen; zudem werden daran anknüpfend Maßnahmen zur Kontrakturprophylaxe beschrieben.
Maßnahmen zur Vorbeugung gegen die Entstehung eines Spitzfußes
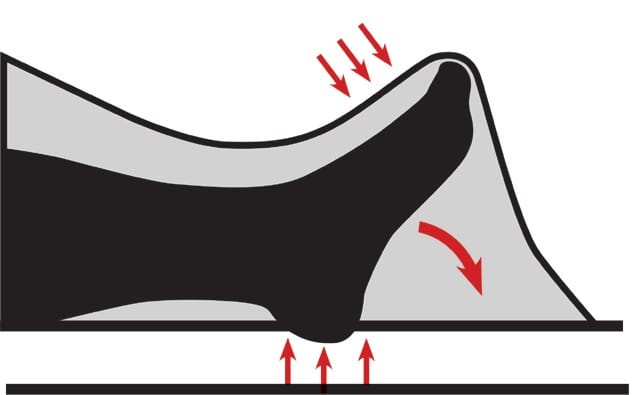
Auf der Intensivstation verweilt der Patient die meiste Zeit des Tages in Rückenlage. Der Fuß fällt der Schwerkraft folgend nach unten, die Bettdecke tut ein Übriges und drängt den Fuß in eine Spitzfußstellung (Abb. 2). Das Entstehen einer solchen Kontraktur lässt sich anhand einer Arbeit von Tabary und Kollegen aus dem Jahr 1972 5 erklären: Sie stellten fest, dass die Ruhigstellung in Annäherung von Ursprung und Ansatz des (Waden-) Muskels zum Verlust von Sarkomeranteilen im Muskel führt.
Die Behandlung bzw. die Vorbeugung gegen das Auftreten von Kontrakturen erfolgt überwiegend physiotherapeutisch im Sinne der Kontrakturprophylaxe, das heißt durch manuelles passives Durchbewegen, Aufsetzen und Stehen. Es lässt sich feststellen, dass allein pflegerische und therapeutische Maßnahmen bei vielen Patienten nicht ausreichen, um eine Spitzfußkontraktur zu vermeiden. Dies ist auch dem Sachverhalt geschuldet, dass Lagerung und Dehnung über mehrere Stunden am Tag stattfinden müssten, um erfolgversprechend zu sein. Die dafür erforderliche Zeit lässt sich durch das vorhandene Personal weder in der Pflege noch durch Therapeuten sicherstellen. Einfache Lagerungsschienen, die zur Spitzfußprophylaxe aus der Traumatologie bekannt sind, werden den Anforderungen eines neurologischen Patienten nicht gerecht, denn dabei wird nur eine Gelenkachse gehalten und ein punktueller Druck auf den Vorfußballen appliziert. Diese Art von Lagerungsorthesen kann konstruktionsbedingt die Abweichung des Vorfußes bei Tonusveränderungen nicht halten und begünstigt in einem solchen Fall sogar die Entstehung von Fehlstellungen.
Vorbeugung und Behandlung einer beginnenden Kontraktur
Eine leichte, langanhaltende Dehnung über 6 bis 12 Stunden täglich ist laut Glasgow et al. 6 die Technik der Wahl zur Behandlung von Kontrakturen. Dies wirft allerdings die Frage auf, wie sich die zuvor beschriebenen Kontrakturen vermeiden und das Gehen früh und mit akzeptablem Gangbild ermöglichen lassen. Lässt die Versorgung eines akuten Schlaganfallpatienten auf einer Intensivstation Raum für vorausschauende Maßnahmen, die die Rehabilitation des betroffenen Patienten nachhaltig entscheidend beeinflussen können? Diese Frage sollte mit einem überzeugten Ja beantwortet werden. Die aktuelle Leitlinie zur „Rehabilitation von sensomotorischen Störungen“ der DGN unterstreicht diese Überzeugung: Dort heißt es, dass Patienten, die nach einem Schlaganfall frühzeitig mobilisiert werden, eine frühere unabhängige Gehfähigkeit und bessere funktionsmotorische Fähigkeiten erreichen. Des Weiteren sei „ein früher Einsatz von Hilfsmitteln wie Stock oder Sprunggelenksorthesen […] sinnvoll“ 7. Lamprecht 8 schreibt in diesem Zusammenhang: „Durch die frühe Mobilisation können die Patienten früher mit dem Gehtraining beginnen und benötigen weniger Ausweichbewegungen“, was die Gangsymmetrie verbessere und das Sturzrisiko verringere. Um dies zu erreichen, favorisieren die Autoren eine spezielle Unterschenkelorthese (Ankle Foot Orthosis, AFO) nach Gipsabdruck aus Kunststoff mit dynamischem Gelenk (Abb. 3). Dieses Gelenk ist kein extern angebrachtes Orthesengelenk im klassischen Sinne, sondern es entsteht durch die besondere Formgebung auf Höhe des oberen Sprunggelenkes. Die Formgebung des Polypropylens wird durch einen vor dem Tiefziehen aufgebrachten „Gelenkdummy“ erzielt. Die Steifigkeit der Orthese kann durch die Kürzung des Zuschnittes im Bereich des Gelenkes gut dosiert werden. Da diese AFO nur aus einem Stück besteht, ist sie ausgesprochen leicht und auf der Intensivstation initial auch als Lagerungsorthese einsetzbar. In der Frühphase der Mobilisation sichert eine solche individuell gefertigte Orthese in der Standphase den Fuß, das obere und untere Sprunggelenk, über die Bodenreaktionskräfte das Knie und somit die gesamte muskuloskelettale Kette des betreffenden Standbeins. Der Einfluss auf das untere Sprunggelenk kann zudem mittels eines integrierten Innenschuhs verstärkt werden, wenn dies aufgrund des klinischen Status des Patienten erforderlich ist.
Im Folgenden wird die besondere Bedeutung des M. triceps surae in der Standphase beim Gehen verdeutlicht. Der M. soleus und der M. gastrocnemius dienen während der Einzelunterstützungsphase der vertikalen Aufrichtung und während der Terminal Stance der Vorwärtsbewegung. Der M. gastrocnemius unterstützt die Einleitung der Kniebeugung in der PreSwing-Phase 9. Des Weiteren wird die Kniestabilität ab Mid Stance in erster Linie durch den M. triceps surae hervorgerufen. Dies wird durch einen Mechanismus gewährleistet, der als „plantar flexion/knee extension couple“ bezeichnet wird. Dabei kontrolliert die Aktivität des M. soleus die Vorwärtsbewegung der Tibia über den plantigraden Fuß und steuert somit die Stellung des Kniegelenkes in Bezug auf die Bodenreaktionskräfte. Dadurch wird ein kniestreckendes Drehmoment erzeugt, wozu keine Aktivität des M. quadriceps femoris notwendig ist 10. Wird der Patient in der frühen Phase nach seinem Schlaganfall mit einer solchen Orthese versorgt und wird diese konsequent getragen, wird einem spastischen Bewegungsmuster entgegengewirkt; der M. soleus und der M. gastrocnemius werden bei jeder Schrittfolge gedehnt, um die Muskellänge zu erhalten. Des Weiteren nimmt das Kunststoffmaterial der Orthese die exzentrisch entstandene Energie auf, speichert sie und gibt sie am Ende der terminalen Standphase wieder ab. Das heißt, die fehlende Kraft des gelähmten M. triceps surae wird so teilweise ausgeglichen.
Erste Untersuchungen durch den Hauptautor dieses Artikels haben gezeigt, dass die Kinematik des Orthesengelenkes nahezu mit dem Drehpunkt des anatomischen oberen Sprunggelenkes übereinzustimmen scheint. Dies wiederum würde bedeuten, dass somit praktisch keine Scherbewegungen auf die Haut des Patienten einwirken. Zur Validierung dieser Aussage bedarf es jedoch weiterführender Untersuchungen. Dieses Versorgungskonzept ermöglicht es nach Meinung der Autoren, den Patienten früher und sicherer zu vertikalisieren und das Gehen zielgerichteter zu trainieren als ohne den Einsatz von Hilfsmitteln.
Bei einigen Patienten zeigt sich zudem eine Plegie des Hüftbeugemuskels, sodass der Patient sein Bein nicht mit eigener Muskelkraft vorbringen kann. Bei diesen Patienten ist eine eigens entwickelte sogenannte Pro Walk Dynamische Beinorthese sinnvoll, bei deren Entwicklung Anleihen bei alten Prothesen gemacht wurden, die sich zum Vorbringen des Unterschenkels eines Gummizuges bedienten. In Abbildung 4 ist zu erkennen, wie ein solcher „Vorbringer“ aussieht, der zweigelenkig eine ähnliche Kraftentfaltung wie der M. rectus femoris erbringen soll. Die Vorspannung, die sich individuell einstellen lässt, ist am Ende der terminalen Standphase am höchsten und erleichtert es in der Schwungphase, das betroffene Bein nach vorne zu bringen. In Abbildung 4 ist eine solche Orthese mit einem Fußheberzügel kombiniert. Mit dieser Orthese, die mit einem spiraligen Zug gegen die Innen- oder Außenrotation ergänzt werden kann, wird es nach Meinung der Autoren möglich, den kompensatorischen Bewegungsmustern entgegenzuwirken.
Rehabilitationsphasen
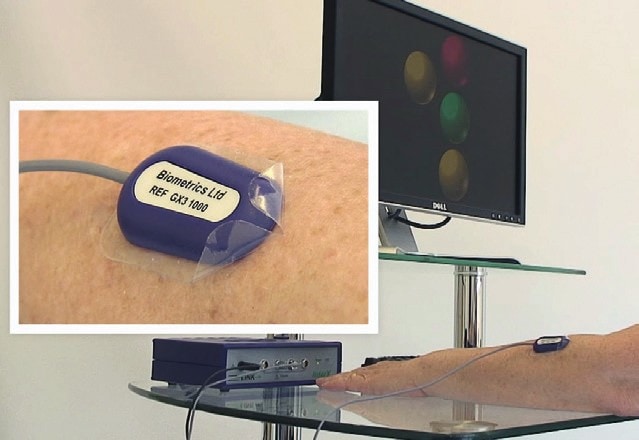
Der überwiegende Teil der Patienten beginnt die Therapie in Egelsbach im Anschluss an den Aufenthalt in einer Reha-Klinik; vereinzelt kommen auch Patienten, die nach der Behandlung in der Stroke Unit direkt in ihr häusliches Umfeld zurückkehren konnten. Voraussetzung für den Therapiebeginn ist, dass der Patient transportfähig ist und an der Therapie mitwirken kann – dies entspricht in der Regel Patienten ab der neurologischen Reha-Phase C. Besonders schwer betroffene Patienten kommen in Begleitung ihrer Betreuer bzw. Pfleger und gelangen teilweise mit einem Krankentransport nach Egelsbach. Nach einer umfassenden physiotherapeutischen und ergotherapeutischen Befundung wird gemeinsam mit dem Patienten bzw. seinen Angehörigen eine individuelle und messbare Zielvereinbarung (SMART-Ziele gemäß ICF) getroffen, wobei auch Zwischenziele definiert werden. In der Regel wird nach der zweiten oder dritten Therapiesitzung ein Orthopädietechniker hinzugezogen, um die vorhandenen Hilfsmittel zu prüfen und ggf. zu optimieren oder entsprechende Bedarfe zu ermitteln. Zur Analyse des aktuellen Gangbildes wird eine videogestützte Ganganalyse sowie eine Kraftmesseinrichtung der Fa. Biometrics (Abb. 5) genutzt, die neben der Diagnostik auch in der Therapie einsetzt wird. Dieses Vorgehen erlaubt es, den Ist-Zustand im ambulanten Bereich zu erheben. Die videogestützte Ganganalyse hilft außerdem bei der Orthesenplanung, der Orthesen- und Therapieoptimierung und der Dokumentation des individuellen Verlaufes.
Patienten, die ihr Körpergewicht mit den Beinen nicht sicher halten und stabilisieren können, werden in einem dynamischen Stehtrainer vertikalisiert, um mit ihm in der Aufrechten unter anderem an seiner Rumpfstabilität und der Verbesserung des Gleichgewichts arbeiten zu können. Im nächsten Schritt wird der Patient über einen Gangroboter an das Wiedererlernen bzw. das Einüben eines physiologischen Gangzyklus herangeführt. Dies erfolgt unter Verwendung eines „Lyra“-Gangroboters (Abb. 6), der auf dem Endeffektor-Prinzip basiert (das bedeutet, dass die Unterstützung an den Füßen erfolgt und dass der Patient Knie- und Hüftgelenke unter Gewichtsentlastung aktiv kontrollieren muss).
Neben Endeffektor-Systemen gibt es in der automatisierten Gangtherapie Exoskelett-Systeme wie beispielsweise den „Lokomaten“. In einem systematischen Review konnte allerdings ermittelt werden, dass Schlaganfallpatienten, die mit Endeffektor-Geräten therapiert wurden, eine höhere Gehgeschwindigkeit erreichten als solche während der Therapie mit Exoskelett-Geräten 11. Zudem hat die Deutsche Gesellschaft für Neurorehabilitation den Einsatz von Endeffektor-Geräten bei nicht gehfähigen Schlaganfallpatienten in ihrer S2e-Leitlinie „Rehabilitation der Mobilität nach Schlaganfall“ als „Sollte“-Empfehlung eingestuft, während für das Gehen mit Exoskelett-Systemen nur eine „Kann“-Empfehlung ausgesprochen wurde 12.
Bei der Lokomotionstherapie mit dem Lyra-Gangroboter ist eine konsistente und symmetrische Beinführung möglich. Schrittlänge und Gehgeschwindigkeit können den individuellen Bedürfnissen des Patienten angepasst werden. Es lässt sich eine hohe Repetitionsrate erzielen, die immer gleich und therapeutenunabhängig ist. Nur so lässt sich das Gehen wieder anbahnen. Hesse prägte in diesem Zusammenhang den Satz: „Wer gehen will, muss gehen!“ 13.
Als Nächstes arbeiten die Patienten auf dem Laufband an der Verbesserung ihres Gangbildes – mit oder ohne Gewichtsentlastung, mit unterschiedlichen Geschwindigkeiten und unterschiedlichen Steigungswinkeln. Liegt eine Fußheberschwäche vor, die das Vorschwingen des Beines erschwert, wird den Patienten bei entsprechender Indikation eine Funktionelle Elektrostimulation (FES) angeboten, die aufgrund der langjährigen Erfahrungen in der Versorgung mit dem FES-System „WalkAide“, häufig in Kombination mit dem Laufband, durchgeführt wird. Sprechen die Patienten gut auf das FES-System an, wird eine Definitivversorgung für den Patienten angestrebt.
Des Weiteren wird im Rahmen der sogenannten ADLs (Aktivitäten des täglichen Lebens) eine Therapietreppe verwendet, deren Stufen elektrisch in der Höhe verstellbar sind. Auf diese Weise kann die Höhe der häuslichen Treppenstufen nachgestellt und unter Anleitung des Therapeuten die beste Strategie für das Treppauf- und Treppabgehen erarbeitet werden. Des Weiteren stehen unterschiedliche Therapiegeräte zur Verfügung, mit denen die Schwierigkeitsgrade in der Therapie weiter erhöht werden können – bis hin zum gezielten Krafttraining an speziell für einen Patienten mit Schlaganfall adaptierten Geräten. In Abbildung 7 ist der Einsatz von Kraftmessplatten im Rahmen des Biofeedbacks dargestellt. Mit entsprechenden Computerspielen lässt sich die Gewichtsverlagerung auf das betroffene Bein visualisieren und einfordern. Diese evidenzbasierten Therapien können sowohl in herkömmliche Therapiekonzepte wie die sogenannte Bobath-Therapie bzw. Krankengymnastik, in motorisch-funktionelle Ergotherapie, sensomotorisch-perzeptive Ergotherapie und weitere therapeutische Maßnahmen integriert, aber auch als alleinige Therapieanwendungen angeboten werden.
Therapie und Versorgung der oberen Extremität
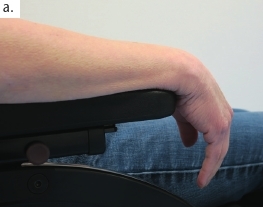
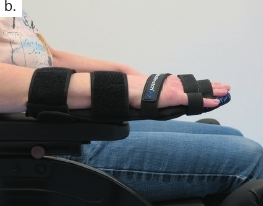
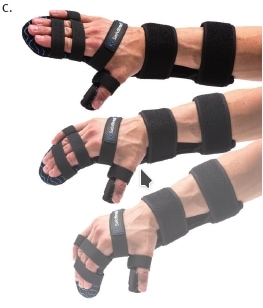
Auch bei der oberen Extremität gilt es, die Konsequenzen möglicher Kontrakturen von Beginn an im Blick zu haben, wobei die Weichen ebenfalls bereits am dritten Tag auf der Intensivstation gestellt werden. Abbildung 8 veranschaulicht den Einsatz einer Unterarm-Hand-Orthese zur Prophylaxe von Kontrakturen. Abbildung 8a veranschaulicht, inwiefern die Schwerkraft eine Kontrakturstellung begünstigt. Zur Kontrakturprophylaxe erfolgt eine Dehnung der gesamten Hand- und Fingerflexoren mit Hilfte der dynamischen Unterarm-Hand-Orthese „Saebo Stretch“ (Abb. 8b), die konstruktionsbedingt bei Tonusänderungen nachgibt und dann, wenn die Spannung wieder nachlässt, die Finger in die Streckung zurückführt (Abb. 8c). Nach Kenntnis der Autoren gibt es derzeit keine vergleichbare konfektionierte dynamische Orthese, die sich in dieser Art und Weise je nach den individuellen Bedürfnissen des Patienten einstellen beziehungsweise an sie anpassen lässt. Ist der Tonus zu hoch oder sind bereits bestehende Kontrakturen und Fehlstellungen zu ausgeprägt, ist der Einsatz individuell angefertigter Unterarm-Hand-Finger-Orthesen mit dynamischem Gelenk sinnvoll.
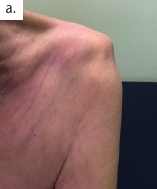
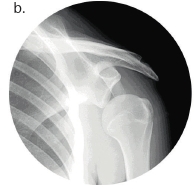
Eine weitere große Herausforderung stellt eine Subluxation der Schulter dar (Abb. 9a u. b), die mit starken Schmerzen für die Patienten verbunden sein kann. Auf der Intensivstation achtet das Personal besonders bei den Transfers darauf, dass der plegische Arm unterstützt wird, nicht herunterfällt oder daran gezogen wird. Schränken die durch die Subluxation bedingten Schmerzen die Lebensqualität des Patienten ein, sollte über den Einsatz einer Orthesenversorgung nachgedacht werden. Dazu stehen verschiedene Modelle – von Soft-Orthesen bis hin zu komplexeren, oftmals bewegungslimitierenden Varianten – zur Verfügung. Die Auswahl eines geeigneten Hilfsmittels aus dem Repertoire an konfektionierten und individuellen Versorgungsmöglichkeiten korreliert maßgeblich mit dem klinischen Status des Patienten, dem definierten Therapieziel sowie dem Umfeld des Patienten (etwa in Bezug auf die Notwendigkeit einer Hilfestellung beim Anziehen). Daher ist eine pauschale Empfehlung eines Hilfsmittels in diesem Segment nicht sinnvoll.
Auch in Bezug auf die obere Extremität erfolgt eine umfassende physiotherapeutische und ergotherapeutische Befundung mit individueller Zielvereinbarung und einer Konsultation von Orthopädietechnikern, um die vorhandenen Hilfsmittel zu prüfen, ggf. zu optimieren oder entsprechende Bedarfe zu ermitteln. Für die meisten Patienten hat die Erreichung der Handfunktion höchste Priorität. Funktionelle Einschränkungen, hervorgerufen durch neurologische Störungen, führen zu Unsicherheit, weniger Bewegung und ziehen u. U. Kontrakturen sowie ein Trainingsdefizit nach sich. Dies führt zu noch mehr Unsicherheit, noch weniger Bewegung und noch geringerem Gebrauch der Finger und der Hand. Dieses Phänomen ist bekannt unter dem Begriff „erlernter Nichtgebrauch“. Taub 14 stellt in diesem Zusammenhang fest: „Ist eine Extremität in ihrer Funktion eingeschränkt, ist jede Handlung nur mühsam zu vollziehen und führt oft nicht zum gewünschten Erfolg. Um diese ‚Bestrafung‘ des Handlungsversuchs zu umgehen, versucht ein Individuum automatisch die Kompensation mit der gesunden Extremität.“ Es wird versucht, diesen Teufelskreis mit Elementen aus der sogenannten Constraint-Induced Movement Therapy (CIMT) (auch als „Forced-Use Training“ bezeichnet) zu durchbrechen. Bei der CIMT-Therapie wird u. a. der kompensatorische Einsatz des nicht betroffenen Arms z. B. mittels Binde oder Fausthandschuh gehemmt, um so einem in der akuten Phase „erlernten Nichtgebrauch“ der betroffenen Seite entgegenzuwirken.
Insgesamt sollten die innovativen computergestützten therapeutischen Möglichkeiten des Therapiezentrums möglichst vielen Betroffenen zeitgemäße Angebote zugänglich machen, um dem erlernten Nichtgebrauch entgegenzuwirken und Arm und Hand wieder in Verrichtungen des Alltags einzubeziehen. Dabei wird stets ein Maßnahmenplan entwickelt, der den individuellen Möglichkeiten und Zielen des Patienten gerecht wird.
Bedeutung von Therapiedauer und ‑intensität
Unter dem Begriff „Neuroplastizität“ versteht man die Fähigkeit des Gehirns, Neuronen anatomisch und auch funktionell zu regenerieren und neue synaptische Verbindungen herzustellen. Ein professioneller Pianist beispielsweise hat im Durchschnitt mehr als 10.000 Stunden trainiert, um seine Perfektion zu erreichen 15. Diese Zeit steht einem Patienten nach einem Schlaganfall nicht mehr zur Verfügung. Entscheidend für die Rückgewinnung motorischer Funktionen der Hand sind jedoch Therapieintensität und Therapiedauer. Kwakkel und Kollegen 16 konnten aufzeigen, dass erst 16 Stunden zusätzliches aktives Training (gegenüber der herkömmlichen Behandlungszeit der Kontrollgruppe) signifikante Effekte auf die ADL bewirken. Für die Therapie ist außerdem von entscheidender Bedeutung, dass sie eine hohe Alltagsrelevanz hat, Aufmerksamkeit verlangt, motivierend ist, Spaß bereitet und das Durchhaltevermögen fördert. Um einer Verkürzung der Unterarm- und Handflexoren vorzubeugen bzw. sie zurückzudrängen, wird bei Patienten, die die entsprechenden klinischen Voraussetzungen erfüllen, die Verwendung einer „SaeboFlex“-Orthese – eine dynamische, redressierende Unterarm-Handgelenk-Hand-Finger-Orthese – bevorzugt. Diese individuell hergestellte Orthese besteht aus starren bzw. selbsttragenden Elementen, in die eine dynamische Quengelung durch Federn in verschiedener Stärke in Verbindung mit Fingerkappen integriert ist (Abb. 10). Mit einer solchen Redressionsorthese kann der Betroffene aktive Bewegungen gegen Widerstand durchführen. Sie erlaubt dadurch das Greifen und trägt so zur Kräftigung der Hand, der Finger, des Daumens und der gesamten oberen Extremität außerhalb des pathologischen Bewegungsmusters bei 17. Nach Kenntnis der Autoren gibt es auf dem Markt derzeit kein vergleichbares Orthesenkonzept, das sowohl eine individuelle Dosierung der Redression erlaubt als auch gleichzeitig ein willkürliches Schließen der Hand ermöglicht und danach deren Öffnen unterstützt. Untersuchungsergebnisse deuten auf eine Verbesserung der alltagsrelevanten Handfunktion bei unktionell schwer eingeschränkten Patienten (mit initialem Fugl-Meyer Score < 25, bei denen kein aktives Handöffnen möglich ist) im chronischen Stadium durch den intensiven Einsatz der Handorthese hin 18 19.
Neben dem Einsatz unterschiedlicher Handorthesen kann ferner auf folgende Methoden zurückgegriffen werden:
- Funktionelle Elektrostimulation (FES; bei entsprechender Indikation) mit der Unterarmorthese „ReGrasp“, die am betroffenen Unterarm angelegt wird. Eingearbeitet sind mehrere Elektroden, die die für das Greifen und Loslassen zuständigen Muskeln durch einen elektrischen Impuls stimulieren, sodass diese die Bewegung selbstständig ausführen. Der Impulsgeber wird am Ohr getragen, quasi wie ein Hörgerät. Nickt der Patient, greift die Hand zu – nickt er erneut, öffnet sie sich wieder (Abb. 11). Nach Kenntnis der Autoren ist dies aktuell das einzige System, das ohne weiteres Equipment das willkürliche Greifen und Loslassen der Hand erlaubt, das ortsunabhängig und damit auch im eigenen Umfeld anwendbar ist, das beide Hände zur freien Verfügung einsetzbar belässt und das gleichzeitig so wenig aufträgt, dass es auch unter herkömmlicher Kleidung getragen werden kann.
- Die EMG-getriggerte Muskelstimulation (Abb. 12) ist eine Kombination aus Biofeedback und elektrischer Stimulation. Dabei wird die willkürliche Muskelaktivität des Patienten aufgenommen und verstärkt.
- Repetitive Periphere Magnetstimulation (rPMS): Für viele Patienten ist die willkürliche Ansteuerung bestimmter Muskeln oder Muskelgruppen nach einem Schlaganfall erschwert. Diesen Patienten kann die sogenannte FMS (Funktionelle Magnetstimulation) bzw. die repetitive Periphere Magnetstimulation (rPMS) angeboten werden. Durch die funktionelle Magnetstimulation erfolgt eine Aktivierung der Motoneuronen, die für die resultierenden Muskelkontraktionen verantwortlich sind. Es kommt dabei nicht zur direkten Stimulation der Muskelfasern selbst, sondern es erfolgt eine indirekte Stimulation über die motorischen Nervenzellen 20 21. Die somit neuronal gesteuerte Kontraktion ist eine wichtige Grundvoraussetzung für die Rehabilitation, denn durch die Stimulation der sensomotorischen Nervenfasern wird die Bewegung im sensomotorischen Kortex wahrgenommen. Mit anderen Worten: Nur was gespürt wird, kann auch bewegt werden.
Das Armlabor in Egelsbach
Sowohl mechanisch zu bedienende Geräte als auch computergestützte Trainingsstationen lassen eine unermessliche Vielfalt von Therapie- und Trainingsmöglichkeiten für unterschiedliche Funktionsbereiche der oberen Extremität zu. Damit werden folgende Ziele verfolgt:
- eine hohe Repetitionsrate an selektiven Bewegungen und Bewegungsabfolgen, die beispielsweise durch Zirkeltrainings oder EMG-getriggertes Biofeedback (Abb. 12) erreicht werden kann;
- eine selektive Handfunktion;
- eine Verbesserung der Fingerfunktion (unter Abnahme der Schwere des Arms) (Abb. 13);
- eine Verbesserung isolierter oder komplexer Bewegungselemente – zum Beispiel unter Zuhilfenahme motivierender Computerspiele (Abb. 14).
Buschfort et al. 22 konnten in ihrer Arbeit darlegen, dass der Einsatz eines Armstudios zur Intensivierung der Rehabilitation der oberen Extremität nach einem Schlaganfall ein vielversprechender Ansatz ist.
Fazit
Entscheidend für eine bestmögliche Wiederherstellung der durch einen Schlaganfall verlorengegangenen Funktionen ist, wie gezeigt wurde, eine individuelle, frühzeitige, interdisziplinäre und interprofessionelle sowie bedarfsgerechte therapeutische und orthopädietechnische Versorgung des Patienten direkt nach dem Schlaganfall. Unter „frühzeitig“ ist in diesem Zusammenhang die Versorgung eines Patienten mit Unterarm-Hand-Finger-Orthesen und Unterschenkelorthesen schon ab dem dritten Tag nach dem Schlaganfall auf der Intensivstation zu verstehen, wenn möglich. Dadurch sollen die Orthesen das Entstehen von Sekundärschäden – wie Verkürzungen der Muskellängen, Tonuserhöhungen oder Kontrakturen – verhindern beziehungsweise aufhalten und somit günstige Voraussetzungen für die AnschlussHeilbehandlung schaffen.
Im Idealfall sollte die Orthesenversorgung Hand in Hand und in Abstimmung der unterschiedlichen Professionen geplant und die Orthesen so gewählt werden, dass sie im Verlauf individuell adaptierbar sind, somit von Beginn an genutzt werden können und zudem in der Zeit der Anschluss-Heilbehandlung sowie darüber hinaus für die Verwendung im Alltag und die ambulante Therapie zur Verfügung stehen. Um Funktionen zu erlernen und wiederzuerlangen, ist eine hohe Repetitionsrate unabdingbar. Dafür stehen den Patienten in Egelsbach neben herkömmlichen bewährten Therapien, Gangrobotern und computergestützten Trainingsstationen auch moderne Orthesenkonzepte zur Verfügung, die die Nutzung der betroffenen Extremität auch außerhalb der Therapiesituation gewährleisten sollen.
Mit den vorgestellten Therapiemöglichkeiten und dynamischen Orthesenkonzepten lässt sich die Rehabilitation eines Schlaganfallpatienten unabhängig von dessen Rehabilitationsphase unterstützen und so aus Sicht der Autoren die bestmöglichen Rahmenbedingungen für das Wiedererlangen des Gehens und Greifens schaffen.
Für die Autoren:
Benedikt Preisler
Geschäftsführender Gesellschafter
Preisler Group GmbH
Woogstr. 48
63329 Egelsbach
preisler@prowalk.de
Begutachteter Beitrag/reviewed paper
Preisler B, Hemme L, Hihn M, Malich R, Preisler C, Schmitt M. Interdisziplinäre und interprofessionelle Therapie und Versorgung von Patienten nach einem Schlaganfall. Das „Egelsbacher Konzept“. Orthopädie Technik. 2020; 71 (3): 36–43
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 11. Februar 2026
- Landesärztekammer Baden-Württemberg. Bei Schlaganfall ist schnelles Handeln gefragt! (letzte Änderung am 19.03.2013). https://www.aerztekammer-bw.de/news/2013/2013_03/schlaganfall_01/index.html (Zugriff am 05.02.2020)
- Heuschmann P, Busse O, Wagner M et al. für das Kompetenznetz Schlaganfall, die Deutsche Schlaganfall Gesellschaft sowie die Stiftung Deutsche Schlaganfall-Hilfe. Schlaganfallhäufigkeit und Versorgung von Schlaganfallpatienten in Deutschland. Akt Neurol, 2010; 37 (7): 333–340
- Foerch C, Misselwitz B, Sitzer M, Steinmetz H, Neumann-Haefelin T. Die Schlaganfallzahlen bis zum Jahre 2050. Dtsch Arztebl, 2008; 105 (26): 467–473. doi: 10.3238/arztebl.2008.0467
- Deutsche Gesellschaft für Neurologie e. V. (DGN) (Hrsg.). S2k-Leitlinie „Therapie des spastischen Syndroms“ (AWMF-Leitlinienregister Nr. 030–078). Stand: 01.11.2018 , gültig bis 31.10.2021. https://www.awmf.org/uploads/tx_szleitlinien/030–078k_S2k_Therapie_spastisches_Syndrom_2019-06.pdf (Zugriff am 05.02.2020)
- Tabary JC, Tabary C, Tardieu C, Tardieu G, Goldspink G. Physiological and structural changes in the cat’s soleus muscle due to immobilization at different lengths by plaster casts. J Physiol, 1972; 224 (1): 231–244
- Glasgow C, Wilton J, Tooth L. Optimal daily total end range time for contracture: resolution in hand splinting. J Hand Ther, 2003; 16 (3): 207–218
- Deutsche Gesellschaft für Neurologie (Hrsg.). S2k-Leitlinie „Rehabilitation von sensomotorischen Störungen“ (AWMF-Leitlinienregister Nr. 030–123). Stand: 06.11.2017, gültig bis 05.11.2020. https://www.awmf.org/uploads/tx_szleitlinien/030–123l_S2k_Rehabilitation_sensomotorische_St%C3%B6rungen_2018-04.pdf(Zugriff am 05.02.2020)
- Schupp W, Elsner B (Hrsg.): Sensomotorische Neurorehabilitation. Therapieoptionen und Versorgungsalltag. Erfahrungen zwischen Evidenz und Praxis. Bad Honnef: Hippocampus, 2017: 104
- Neptune RR, Kautz SA, Zajac FE. Contributions of the individual ankle plantar flexors to support, forward progression and swing initiation during walking. Journal of Biomechanics, 2001; 34 (11): 1387–1398
- Novacheck TF, Gage JR. Orthotic management of spasticity in cerebral palsy. Child’s Nervous System, 2007; 23 (9): 1015–1031
- Mehrholz J, Thomas S, Werner C, Kugler J, Pohl M, Elsner B. Electromechanical-assisted training for walking after stroke. Cochrane Database of Systematic Reviews, 2017; 5: CD006185. doi: 10.1002/14651858. CD006185.pub4.
- Dohle C, Quintern J, Saal S et al. S2e-Leitlinie „Rehabilitation der Mobilität nach Schlaganfall (ReMoS)“. Kurzfassung der Konsensusversion. Neurol Rehabil, 2015; 21 (4): 179–184
- Hesse S, Werner C. Elektromechanisch gestützte Gangrehabilitation nach Schlaganfall. Neuroreha, 2010; 2 (1): 10–14
- Taub E. The behavior-analytic origins of constraint-induced movement therapy: an example of behavioral neurorehabilitation. Behav Anal, 2012; 35: 155–178
- Ericsson KA, Krampe RT, Tesch-Römer C. The role of deliberate practice in the acquisition of expert performance. Psychol Rev, 1993; 100: 363–406
- Kwakkel G, Peppen R van, Wagenaar RC. Effects of augmented exercise therapy time after stroke: a meta-analysis. Stroke, 2004; 35: 2529–2536
- Harris JE, Eng JJ. Strength training improves upper-limb function in individuals with stroke: a meta-analysis. Stroke, 2010; 41: 136–140
- Butler AJ et al. Attempting to improve function and quality of life using the FTM protocol: case report. J Neurol Phys Ther, 2006; 30: 148–156
- Farrell JF, Hoffman HB, Snyder JL, et al. Orthotic aided training of the paretic upper limb in chronic stroke: results of a phase 1 trial. NeuroRehabilitation, 2007; 22: 99–103
- Lotz BP, Dunne JW, Daube JR. Preferential activation of muscle fibers with peripheral magnetic stimulation of the limb. Muscle Nerve, 1989; 12 (8): 636–639
- Machetanz J, Bischoff C, Pichlmeier R, Riescher H, Meyer BU, Sader A, Conrad B. Magnetically induced muscle contraction is caused by motor nerve stimulation and not by direct muscle activation. Muscle Nerve, 1994; 17 (10): 1170–1175
- Buschfort R, Brocke J, Hess A, Werner C, Waldner A, Hesse S. Arm studio to intensify the upper limb rehabilitation after stroke: concept, acceptance, utilization and preliminary clinical results. J Rehabil Med, 2010; 42 (4): 310–314