Einleitung
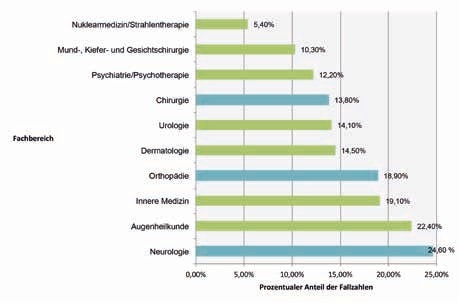
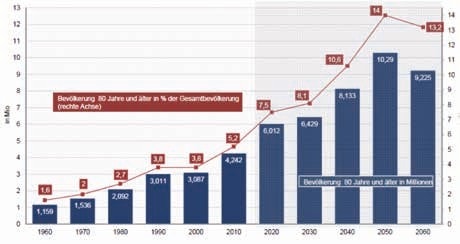
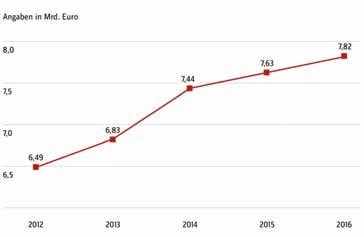
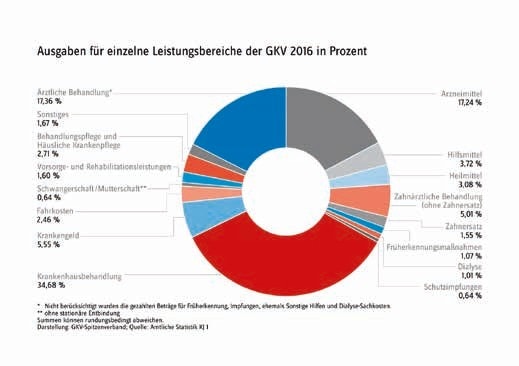
Der „Health Care Indicator 2016“ des Wirtschaftsprüfungsunternehmens Deloitte prognostiziert für das Fachgebiet der Neurologie bis zum Jahr 2030 ein Plus bei den Fallzahlen von 24,6 % und damit den stärksten prozentualen Zuwachs aller medizinischen Fachbereiche (Abb. 1). Dieser Umstand ist insbesondere der demografischen Entwicklung geschuldet: Der Anteil der über 60-jährigen Patienten wird von aktuell 52 % auf 59 % im Jahr 2030 steigen 1. Die Gesamtentwicklung zeigt, dass Ende 2015 etwa 5,8 % der Bevölkerung 80 Jahre und älter waren, während es 2030 etwa 8,1 % und 2050 etwa 14 % sein werden (Abb. 2). Dieses starke Wachstum der Bevölkerung im hohen Alter hat nicht zuletzt auch Auswirkungen auf unser Gesundheitssystem 2, denn rein statistisch gehen Inzidenz und Prävalenz neurologischer Krankheitsbilder mit der Bevölkerungsentwicklung einher. Folgerichtig nahmen die Ausgaben für Hilfsmittel in den vergangenen Jahren zu und lagen 2016 bei 3,72 % der GKV-Gesamtausgaben, doch vor dem Hintergrund der permanenten Kostendiskussion im Gesundheitswesen haben die Kostentreiber Krankenhausbehandlung, ärztliche Behandlung sowie Arzneimittel ein deutlich höheres Einsparpotenzial als das recht kleine Ausgabenfeld der Hilfsmittel (Abb. 3 u. 4).
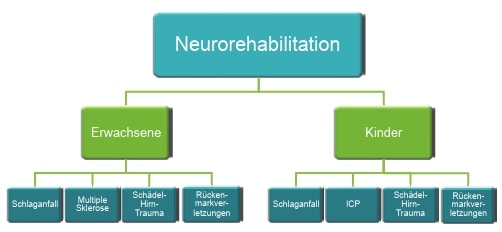
Zu den häufigsten und somit wichtigsten neurologischen Indikationen gehören:
- Schlaganfall,
- Schädel-Hirn-Trauma,
- Multiple Sklerose,
- Infantile Zerebralparese sowie
- Rückenmarkverletzungen 3.
Der Schlaganfall ist weltweit die zweithäufigste Todesursache und somit nicht nur in Deutschland einer der zentralen Kostentreiber im Gesundheitswesen 4. Obwohl die Inzidenz der Schädel-Hirn-Traumata mit etwa 260.000 Patienten pro Jahr nahezu mit der Zahl der Schlaganfall-Patienten übereinstimmt, erhielten nur 3,7 % von ihnen stationäre Rehabilitationsmaßnahmen 5. Diese vergleichsweise geringe Quote erklärt sich in erster Linie aus der großen Spannweite in der Erfassung der Diagnose „Schädel-Hirn-Trauma“, die nicht zwangsläufig eine entsprechende stationäre Versorgung nach sich zieht: Während beispielsweise ein leichtes Schädel-Hirn-Trauma keine oder nur eine ambulante Behandlung erfordert, ist bei einer schweren Verletzung die Versorgung auf einer Intensivstation oder eine Operation mitunter notwendig. Zur Bestimmung des Schweregrads des Schädel-Hirn-Traumas hat sich die Glasgow Coma Scale (GCS) als Standard etabliert:
- 3–8 Punkte: schweres Schädel-Hirn-Trauma
- 9–12 Punkte: mittelschweres Schädel-Hirn-Trauma
- 13–15 Punkte: leichtes Schädel-Hirn-Trauma
Die GCS klassifiziert nicht nur, sondern prognostiziert in Kombination mit weiteren neurologischen Untersuchungen auch das patientenspezifische Rehapotenzial.
Die häufigste Autoimmunerkrankung des zentralen Nervensystems ist die Multiple Sklerose (MS). Laut einer aktuellen Erhebung liegt die Inzidenz bei 12.600 Neuerkrankten pro Jahr, die Prävalenz bei etwa 224.000 Menschen 6. Die Multiple Sklerose tritt oftmals erstmalig zwischen dem 20. und dem 40. Lebensjahr auf, wobei Frauen signifikant häufiger betroffen sind als Männer. Die Ursachen der MS sind bislang ungeklärt. Fest steht jedoch, dass ein chronisch-entzündlicher Prozess eine fortschreitende Schädigung der Myelinhüllen der Nerven bewirkt und durch die gehemmte neuronale Signalweiterleitung unterschiedliche Symptome auftreten können. Dazu zählen Beeinträchtigungen des Sehvermögens, Blasenfunktionsstörungen, psychische und somatische Erschöpfungszustände (Fatigue-Syndrom), Lähmungen der Extremitäten sowie Störungen der Feinmotorik. Eine ursächliche Therapie zur Behandlung der MS steht gegenwärtig nicht zur Verfügung; allerdings empfiehlt sich entgegen früheren Annahmen moderat durchgeführter Sport in fast allen Varianten. Für das aktive Eigentraining kann u. a. der Gebrauch von Hilfsmitteln wie z. B. Orthesen hilfreich sein.
Rehabilitation in der Neurologie
Grundsätzlich ist die Neurologie durch eine bewährte Kombination aus Akutversorgung und stationär-ambulanter Rehabilitation gekennzeichnet. Die Bundesarbeitsgemeinschaft Rehabilitation hat bereits 1995 ein entsprechendes Phasenmodell 7 auf den Weg gebracht, das den multidisziplinären Versorgungsansatz bereits erkennen lässt. Tabelle 1 zeigt in diesem Zusammenhang die einzelnen Phasen des Behandlungsprozesses mit den entsprechenden Therapiemerkmalen auf, die jeweils nur von spezialisierten Professionen in Teamarbeit geleistet werden können.
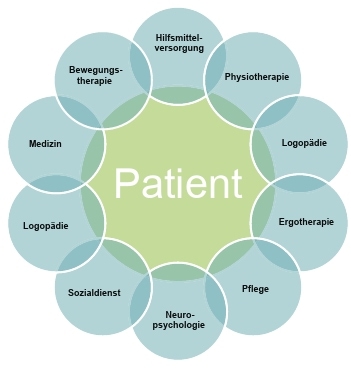
Die Deutsche Gesellschaft für Neurologie hat in diesem Zusammenhang bereits 2012 in ihren Leitlinien festgehalten: „Das multidisziplinäre Vorgehen ist dadurch charakterisiert, dass jeder Teilnehmer sich darauf beschränkt, die Entwicklung des Rehabilitanden – und die daraus resultierenden weiteren Behandlungsschritte – aus der Sicht seines eigenen Fachgebietes darzustellen“ 8. Abbildung 5 zeigt schematisch die Zusammensetzung eines multiprofessionellen Teams in der Neurorehabilitation auf und veranschaulicht die Notwendigkeit der Zusammenarbeit.
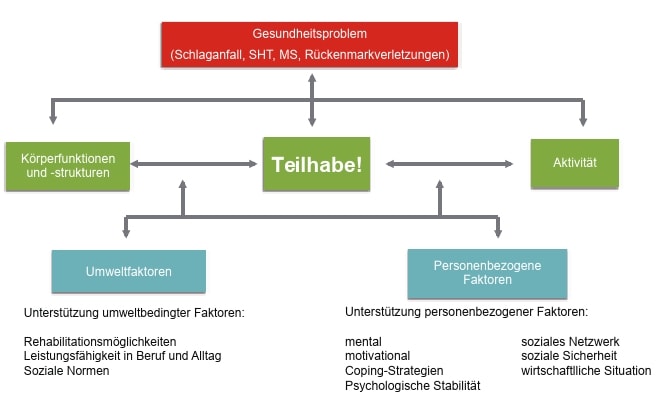
Ein weiteres, zunehmend wichtigeres Instrument – insbesondere auch in der Frührehabilitation – ist ein ICF-basierter Ansatz, in dessen Fokus unter anderem die Auswirkungen funktioneller Beeinträchtigungen im Hinblick auf die Teilhabe stehen (Abb. 6) 9 10. So hat eine Meta-Analyse von 21 Studien mit 2.042 Patienten in acht elektronischen Datenbanken gezeigt, wie wichtig Partizipationsübungen für die Patienten sind. Ein entsprechender 1a-Evidenznachweis wurde bei Therapien sowohl in einfachen als auch komplexeren Settings erbracht 11. Zugleich bedarf es – insbesondere bei aktivierenden Maßnahmen in der Frührehabilitation – differenzierter Therapiestrategien 12:
- bei schweren Hirnverletzungen und/oder hohem Alter der Patienten eine niedrige Intensität in den ersten zwei Wochen, beginnend frühestens 24 Stunden nach dem Ereignis, anschließend moderater Anstieg;
- Mobilisation eher kurz und häufig statt lang und selten;
- bei leichten Schädigungen hohe Intensität bereits innerhalb der ersten Woche mit sukzessivem Anstieg.
Tabelle 2 zeigt beispielhaft die Inhalte der Rehabilitation für Patienten nach Schlaganfall auf.
Können Hilfsmittel bereits in dieser Phase ein wichtiger Therapiebaustein sein, wächst ihre Bedeutung im weiteren Rehabilitationsverlauf noch weiter, zumal der funktionell bedeutsame Teil der natürlichen Spontanerholung nach etwa drei bis sechs Monaten abgeschlossen ist. Sollte bis dahin keine deutliche Verbesserung der Beinmotorik erreicht worden sein, ist die Prognose für das Erlernen des selbstständigen Gehens ungünstig 13; es bedarf also umso mehr einer Unterstützung mit Hilfsmitteln.
Evidenzgrad der Hilfsmittel
Lange Zeit wurde die Überlegenheit bestimmter neurophysiologischer Behandlungstechniken diskutiert, doch konnte in einem Cochrane-Review eindrucksvoll belegt werden, dass physiotherapeutische Behandlungsansätze wie Bobath, Vojta oder PNF als absolut gleichwertig zu betrachten sind 14. Viel entscheidender für Therapieinhalte ist die Kombination wissenschaftlicher Evidenz mit individueller klinischer Erfahrung 15, sinnvoll unterstützt mit adäquat ausgewählten Hilfsmitteln. Ein systematisches Review bzw. eine Meta-Analyse konnte beispielsweise zeigen, dass Orthesen zum Erreichen einer komfortablen Gehgeschwindigkeit bei Schlaganfallpatienten sehr wirksam sind 16, während bei einer anderen Meta-Analyse die gleiche Empfehlung für FES-Systeme ausgesprochen wurde 17. Der differenzierte Einsatz verschiedener Therapieansätze nach Schlaganfall, insbesondere aber auch die Verwendung unterschiedlicher Hilfsmittel, ist ein mitunter sehr komplexes Feld, bedarf einer systematischen Analyse und führt unter dieser Voraussetzung im Idealfall zu eindeutigen Hilfsmittelempfehlungen 18. Gerade bei ICP-Patienten ist die sorgsame Auswahl der adäquaten Orthese die Aufgabe des spezialisierten Orthopädie-Technikers: Sie bewirkt nicht nur mehr Stabilität in Fuß und Becken, sondern beeinflusst auch die Rumpfbewegungen 19.
Funktion des Sanitätsfachhandels bei der Nachsorge
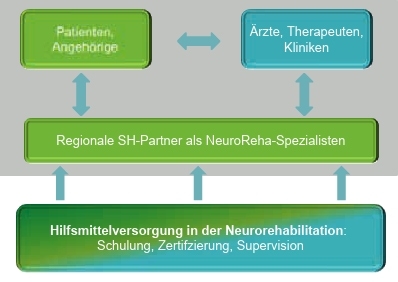
Was passiert jedoch, wenn der Patient plötzlich „austherapiert“ ist und keinerlei ärztliche Verordnungen für Heil- oder Hilfsmittel mehr erhält? Eine Vielzahl von Patienten unterschiedlichster Indikationen fällt an dieser Stelle durch das Nachsorgeraster. Eine solide Konstante im weiteren Reha-Verlauf ist die Versorgung mit Hilfsmitteln im spezialisierten Sanitätshaus. Dieses kann somit als Basis für die Bildung regionaler Netzwerke dienen und im Austausch mit Patienten und Angehörigen einerseits sowie Ärzten und Therapeuten andererseits innerhalb einer fundierten Beratung und Versorgung für eine optimale Hilfsmittelunterstützung verantwortlich zeichnen. Angesichts immer komplexerer und erklärungsbedürftigerer Hilfsmittellösungen ist eine auf das Indikationsfeld zugeschnittene Fortbildung, Unterstützung vor Ort und ggf. Supervision ein Instrument, das beim Aufbau regionaler Netzwerke sinnvoll eingesetzt werden sollte (Abb. 7), um den Patienten indikations- und zielgruppenspezifisch in einem multiprofessionellen Setting versorgen zu können (Abb. 8). Mit Hilfe regionaler Netzwerke können die Strukturmerkmale der multidisziplinären Neurorehabilitation in einem Maße verändert werden, wie es seinerzeit in der Akutneurologie durch die Einführung der Stroke Units erfolgte. Seit es diese spezialisierten Institutionen gibt, greift eine nachhaltige Verbesserung der Prozessqualität in der Routineversorgung. Gleiches gilt es nun in der Nachsorge zu realisieren, zumal die Umsetzung der wissenschaftlichen Forderung nach adäquaten Kompetenznetzen und Versorgungen infolge zunehmender neurologischer Erkrankungen nicht neu ist und von Versorgungsforschern bereits seit Langem gefordert wird 20.
Fazit
Die Heterogenität neurologischer Erkrankungen erfordert vielfältiges und multiprofessionelles Wissen vor dem Hintergrund eines patientenzentrierten Ansatzes. Doch „patientenzentriert“ heißt nicht, unreflektiert alles zu tun, was der Patient sich wünscht. Es bedeutet vielmehr, die Perspektive des Patienten einzunehmen und nach den daraus resultierenden Kriterien die Entscheidungsfindung für eine entsprechende Versorgung herbeizuführen 21 sowie patientenrelevante und indikationsspezifische Parameter als wichtige Voraussetzung für eine Kostenerstattung zu dokumentieren 22. Die Bedeutung von Hilfsmitteln in der multidisziplinären Neurorehabilitation hat inzwischen Einzug in die Leitlinien nahezu aller wissenschaftlichen und therapeutischen Fachgesellschaften gehalten. So formuliert die Deutsche Gesellschaft für Neurorehabilitation in ihrer S2e-Leitlinie: „Die Fortbewegung im Rollstuhl dient nicht nur der Mobilität, sondern erlaubt auch eine schrittweise Steigerung der kardiopulmonalen Belastbarkeit und bereitet somit die Patienten auf ein intensiveres Gehtraining vor. Das Gehtraining selber kann nach dem initialen Trainingsstadium häufig von den Patienten durch ein Gehen am Rollator mit oder ohne Begleitung unterstützt werden. Einige Patienten bleiben auch längerfristig auf einen Rollstuhl, einen Rollator oder eine Orthese angewiesen, um selbstständig mobil zu bleiben.“ 23
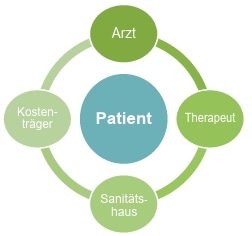
Die Auswahl des geeigneten Hilfsmittels, seine Anpassung und ggf. Modifikation kann nur von spezialisierten Technikern geleistet werden, die in enger Zusammenarbeit mit Therapeuten, Ärzten und Kostenträgern die Patienten rundum versorgen (Abb. 9) und somit entscheidend zur Versorgungsqualität beitragen.
Interessenkonflikt:
Der Autor ist wissenschaftlicher Leiter des Fachbereichs NeuroRehabilitation der Otto Bock HealthCare Deutschland GmbH.
Der Autor:
Dr. Thorsten Böing
Leiter NeuroRehabilitation
Otto Bock HealthCare Deutschland GmbH
Max-Näder-Straße 15
37115 Duderstadt
thorsten.boeing@ottobock.com
Begutachter Beitrag/reviewed paper
Böing T. Hilfsmittel – wichtiger Baustein in der multidisziplinären Neurorehabilitation. Orthopädie Technik, 2018; 69 (3): 28–33
| Phase | Merkmal |
|---|---|
| A | Akutbehandlungsphase unmittelbar nach dem Ereignis |
| B | Behandlungsphase, in der noch intensivmedizinische Behandlungsmöglichkeiten vorgehalten werden müssen |
| C | Behandlungs-/Rehabilitationsphase, in der die Patienten bereits in der C Therapie mitarbeiten können, aber noch kurativ-medizinisch und mit hohem pflegerischem Aufwand betreut werden müssen |
| D | Rehabilitationsphase nach Abschluss der Frühmobilisation |
| E | Behandlungs-/Rehabilitationsphase nach Abschluss einer intensiven medizinischen Rehabilitation. Im Mittelpunkt stehen nachgehende Reha-Leistungen unter Einschluss von Leistungen zur Teilhabe am Arbeitsleben und am Leben in der Gemeinschaft. |
| F | Langzeitpflege und Langzeitbehandlung; Behandlungsphase, in der dauerhaft unterstützende, betreuende und/oder zustandserhaltende Leistungen erforderlich sind |
| Rahmen | Ziele | Häufigkeit/Intensität/Zeit |
|---|---|---|
REHABILITATION Aerobes Training
| Erhöhung der Gehgeschwindigkeit und der Leistungsfähigkeit
|
|
Muskelkraft/Ausdauer
|
|
|
Neuromuskulär
|
|
|
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Ein engagierter Leistungssportler mit Hemiparese und der Einsatz sensomotorischer Fußorthesen (SMFO) — 12. Februar 2026
- Deloitte. Health Care Analytics. Health Care Indicator 2016. https://www2.deloitte.com/de/de/pages/life-sciences-and-healthcare/articles/health_care_indicator_deloitte_deutschland_life_sciences_and_health_care.html (Zugriff am 15.11.2017)
- Universität Duisburg-Essen, Institut Arbeit und Qualifikation. Bevölkerung im Alter 80 Jahre und älter 1950–2060. Zahl und Anteil an der Gesamtbevölkerung. http://www.sozialpolitik-aktuell.de/tl_files/sozialpolitik-aktuell/_Politikfelder/Bevoelkerung/Datensammlung/PDF-Dateien/abbVII-I1d.pdf (Zugriff am 17.11.2017)
- Schupp W. DGRW Update Neurologie: Von empirischen Strategien hin zu evidenzbasierten Interventionen. Rehabilitation, 2011; 50: 354–362
- Feigin VL, Roth GA, Naghavi M, Parmar P, Krishnamurthi R, Chugh S, Mensah GA, Norrving B, Shiue I, Ng M, Estep K, Cercy K, Murray CJL, Forouzanfar MH. Global burden of stroke and risk factors in 188 countries, during 1990– 2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet Neurology, 2016; 15 (9): 913–924
- Arbeitsgemeinschaft NeurologischNeurochirurgische Frührehabilitation, Pohl M. Rehabilitationverlauf von Patienten nach schwerem Schädel-Hirn-Trauma. Neuroreha, 2017; 9: 131–134
- Holstiege J, Steffen A, Goffrier B, Bätzing J. Epidemiologie der Multiplen Sklerose – eine populationsbasierte deutschlandweite Studie. Zentralinstitut für die kassenärztliche Versorgung in Deutschland. Versorgungsatlas-Bericht Nr. 17/09. Berlin, 2017. doi: 10.20364/VA-17.09. http://www.versorgungsatlas.de/themen/alle-analysen-nach-datum-sortiert/?tab=6&uid=86 (Zugriff am 21.12.2017)
- Bundesarbeitsgemeinschaft für Rehabilitation. Das Phasenmodell der neurologischen Rehabilitation. https://www.bar-frankfurt.de/fileadmin/dateiliste/1‑News-Seiten/5‑BAR_eV/BAR-Symposium_Neuro/downloads/Hintergrund_neurologisches_Phasenmodell.pdf (Zugriff am 15.11.2017)
- Diener HC, Weimar C (Hrsg.). Leitlinien für Diagnostik und Therapie in der Neurologie. Herausgegeben von der Kommission „Leitlinien“ der Deutschen Gesellschaft für Neurologie. Stuttgart: Thieme Verlag, 2012
- Beyer J, Seidel EJ. Frührehabilitation ist erstes Glied einer nahtlosen Rehabilitationskette. Rehabilitation, 2017; 56: 272–285
- World Health Organization. International Classification of Functioning, Disability, and Health (ICF). http://www.who.int/classifications/icf/en/ (Zugriff am 15.11.2017)
- Obembe AO, Eng JJ. Rehabilitation Interventions for Improving Social Participation After Stroke: A Systematic Review and Meta-analysis. Neurorehabil Neural Repair, 2016; 30 (4): 384–392
- Bernhardt J, Churilov L, Ellery F, Collier J, Chamberlain J, Langhorne P, Lindley RI, Moodie M, Dewey H, Thrift AG, Donnan G on behalf of the AVERT Collaboration Group. Prespecified dose-response analysis for A Very Early Rehabilitation Trial (AVERT). Neurology, 2016; 86 (23): 2138–2145
- Kwakkel G, Kollen BJ. Predicting activities after stroke: what is clinically relevant? Stroke, 2013; 8: 25–32
- Pollock A, Baer G, Pomeroy VM, Langhorne P, et al. Physical rehabilitation approaches for the recovery of function and mobility following stroke. Cochrane Database Syst Rev 2014; (4): CD001920. doi: 10.1002/14651858. CD001920.pub3
- Liepert J. Evidence-Based Methods in Motor Rehabilitation after Stroke. Fortschr Neurol Psychiatr, 2012; 80: 388–393
- Veerbeek JM, van Wegen E, van Peppen R, van der Wees PJ, Hendriks E, Rietberg M, Kwakkel G. What Is the Evidence for Physical Therapy Poststroke? A Systematic Review and Meta-Analysis. PLoS One, 2014; 9 (2): e87987
- Howlett OA. Functional Electrical Stimulation Improves Activity After Stroke: A Systematic Review With Meta-Analysis. Arch Phys Med Rehabil, 2015; 96 (5): 934–943
- Teasell R, Foley N, Salter K, Richardson M, Allen M, Hussein N, Bhogal S, Jutai J, Speechley M. Evidence-Based Review of Stroke Rehabilitation: executive summary, 16th edition (online). http://www.ebrsr.com/sites/default/files/documents/executive-summary-srebr_final_16ed.pdf (Zugriff am 16.12.2017)
- Swinnen E, Baeyens J‑P, Van Mulders B, Verspecht J, Degelaen M. The influence of the use of ankle-foot orthoses on thorax, spine, and pelvis kinematics during walking in children with cerebral palsy. Prosthet Orthot Int, 2017. doi: 10.1177/0309364617706750 [ahead of print]
- Reese J‑P, Dodel R, KolominskyRabas P. Neurologie. In: Pfaff H, Neugebauer EAM, Glaeske G, Schrappe M (Hrsg.). Lehrbuch Versorgungsforschung. Systematik – Methodik – Anwendung. Stuttgart: Schattauer, 2011: 382–386
- McGrath JC, Kischka U. Interdisziplinäre Teamarbeit und Zielsetzung in der Rehabilitation. In: Frommelt P, Lösslein H (Hrsg.). Neuro-Rehabilitation. Ein Praxisbuch für interdisziplinäre Teams. Heidelberg: Springer Verlag, 2010: 107–113
- Rothmann M, Burke L, Erickson P, Leidy N, Patrick D, Petrie C. Use of existing patient-reported outcome (PRO) instruments and their modification: the ISPOR Good Research Practices for Evaluating and Documenting Content Validity for the Use of Existing Instruments and Their Modification PRO Task Force Report. Value Health, 2009; 12: 1075–1083
- Deutsche Gesellschaft für Neurorehabilitation. S2e-Leitlinie „Rehabilitation der Mobilität nach Schlaganfall (ReMoS)“ (AWMF-Leitlinienregister Nr. 080/004). http://www.dgnr.de/images/pdf/leitlinien/S2e_Leitlinie_Rehabilitation_der_Mobilitaet_nach_Schlaganfall.pdf (Zugriff am 20.12.2017)