Aus therapeutischer Sicht muss vor diesem Hintergrund die Behandlung der Spastizität hinterfragt werden. Breitere und variablere Bewegungsmuster und Funktionen schon früh zu fordern, ist eine Behandlungsstrategie, die auf den Aufbau individueller Kompensationsmechanismen zielt. Dabei müssen gefährliche Situationen vermieden und die Entwicklung von Deformitäten bestmöglich verhindert werden. Die orthopädische konservative wie operative Behandlung zielt in erster Linie auf die Vermittlung von Stabilität und die Korrektur funktionell störender Deformitäten. Damit bleibt dem Patienten das größtmögliche Spektrum an Kompensationsmöglichkeiten erhalten.
Einleitung
Unter Gangstörungen verstehen wir Gangbilder, die vom normalen Gangbild abweichen. Uns ist bestens bekannt, dass Gangstörungen ganz unterschiedliche Ursachen und Krankheitsgruppen zugrunde liegen können. Wir kennen orthopädische, neurologische und psychogene Ursachen.
Kommt es vor, während oder in den ersten Monaten nach der Geburt zu einer Schädigung des Gehirns, entwickelt sich eine Zerebralparese. Die Ursachen für die Schädigung sind vielfältig. Die häufigsten sind Hirninfarkte, Sauerstoffmangel, Infektionen, metabolische Störungen sowie genetische Malformationen des Gehirns. Die Erstbeschreibungen der Krankheitsbilder fokussierten auf die motorische Dysfunktion1 2, und auch in den modernen Definitionen steht die gestörte Motorik im Vordergrund3 4. Der Schweregrad der Affektion weist ein sehr breites Spektrum auf: von gut gehfähigen und funktionell wenig betroffenen Patienten bis zu Patienten, die keine Funktion aufweisen und keinen Kontakt mit der Umwelt herstellen können. Der Schweregrad wird übersichtlich im Gross Motor Function Classification System (GMFCS) gegliedert5. Diese Klassifikation beruht auf der Funktionalität, was wiederum die Motorik in den Vordergrund stellt, und bezieht die Entwicklung über die Zeit mit ein.
Die motorischen Veränderungen zeigen einerseits Minussymptome wie Schwäche, andererseits Plussymptome wie zeitlich abnorme und übermäßige Muskelaktivität, meist als Spastik bezeichnet. Dabei wird zwischen Hyperreflexie und erhöhtem, zu Steifigkeit führendem Muskeltonus unterschieden6. Bekannt ist auch, dass Spastik Schwäche kompensieren kann. Bei Dystonien ist der Muskeltonus wechselnd, bei ataktischen Bildern sind die Muskelaktivitäten inadäquat. Häufige oder dauernde Muskelhyperaktivitäten führen zu strukturellen Verkürzungen der Muskelsehnenapparate und zu Skelettdeformitäten. So werden sie auch für Hüftluxationen, Fußdeformitäten oder Skoliosen verantwortlich gemacht7 8 9. Funktionelle Störungen, vor allem Gangstörungen, werden mit Bewegungsanalysen untersucht, welche die Mechanik der Bewegungen ausmessen. Dabei werden die Bewegungen (Kinematik) sowie die Nettodrehmomente und physikalischen Leistungen (Kinetik) in den Gelenken berechnet. Anhand dieser Daten wird auf die Muskelaktivität geschlossen, wobei die Ergebnisse mit den Muskelaktivitätsdaten aus elektrischen Oberflächenmuskelableitungen abgeglichen werden. Letztlich liefert diese Untersuchung vertiefte Informationen über die Mechanik der Bewegung. Die veränderten, von der Norm abweichenden, Muskelaktivitäten werden als pathologisch gewertet und einer Behandlung zugeführt. Überaktive Muskeln werden temporär oder langfristig geschwächt oder verlagert, und ein global erhöhter steifer Muskeltonus wird medikamentös oder operativ reduziert. Verkürzte Muskeln werden längenmäßig korrigiert und Skelettdeformitäten behoben, wobei man sich an der Norm orientiert. All diese Maßnahmen zielen auf eine Korrektur der Mechanik ab mit dem Ziel einer bestmöglichen Angleichung an die Norm. Allerdings werden derart ausgedehnte Korrekturen kaum je erreicht, trotz Verbesserung der Operationstechniken und orthetischen Behandlungen. Es erstaunt, dass nicht häufiger die Frage gestellt wird, was wir grundsätzlich übersehen haben.
Dazu müssen wir die Grundlagen für eine adäquate Motorik betrachten. Sicher besteht bei Zerebralparesen ein Verlust von Verbindungen des oberen Motoneurons im präfrontalen Kortex zum zweiten Motoneuron im Vorderhorn des Rückenmarks. Dadurch werden Reflexe schlechter kontrolliert, und frühkindliche Reflexe persistieren. Die Läsion betrifft die Region der weißen (Bahnen-)Substanz um die Seitenventrikel, die typischerweise aufgrund der zerstörten Bahnen vergrößert sind (bezeichnet als Leukomalazie). Auch die Hirnkerne oder der Kortex können betroffen sein, was zu veränderten oder schwereren Symptomen führen kann.
In den modernen Definitionen der Zerebralparese enthalten ist die Möglichkeit von Begleitsymptomen zur motorischen Affektion wie kognitive oder sensorische Beeinträchtigungen. Tatsächlich wurde schon in den 1950er Jahren auf die Häufigkeit von sensorischen Störungen hingewiesen. Moderne Untersuchungen belegen derartige Störungen bei fast allen Patienten. Tatsächlich besteht in der weißen Substanz um die Seitenventrikel ein Fasermix, welcher auch sensorische Komponenten beinhaltet. Während der Hirnreifung bis zum Ende des zweiten Lebensjahres wachsen die Axone aus den Nervenzellen aus. Dies bedeutet, dass die motorischen Axone bereits zum Zeitpunkt der Läsion teilweise schon vorhanden waren und zerstört wurden, während die Zellkerne der sensorischen Axone in der Peripherie liegen und das Einsprossen der Axone in die Hirnareale weniger vollständig war. Trotzdem sind beide Komponenten betroffen. Tatsächlich belegen Untersuchungen mit funktioneller Magnetresonanztomographie (fMRI) und Traktorgraphien, dass sensorische Verbindungen regelmäßig und in ähnlichem Ausmaß wie die motorischen in Abhängigkeit vom Schweregrad der Affektion fehlen10 11 12. Zudem ist die Verarbeitung der sensorischen Informationen verändert13 14. Diese Perzeptionsstörungen betreffen nicht nur die periphere Somatosensorik mit all ihren Komponenten, sondern auch die Sinne wie Sehen, Hören und Gleichgewicht15 16.
Während die Störung von Motorik und Funktion ins Auge sticht, ist die Affektion der sensorischen Seite kaum zu erkennen. Eltern schildern zuweilen, dass ihre Kinder mit Zerebralparese weniger schmerzempfindlich oder überempfindlich sind.
Wir wissen, dass die motorischen neuralen Verbindungen gestört sind. Daraus erklärt sich teilweise die Schwäche, welche alle Patienten mit Zerebralparese aufweisen. Daneben führt auch der veränderte Gebrauch der Muskeln im Alltag zu bekannten Veränderungen des Muskelgewebes, was ebenfalls die Schwäche erklärt. Hier soll aber nicht auf diese Veränderungen eingegangen werden. Auch sensorische Störungen haben aber einen wesentlichen Einfluss auf die Motorik und die Funktion17 18.
Ohne sensorische Information keine adäquate motorische Antwort
Aus der Peripherie erreichen unser Hirn Informationen über Spannungen in Gelenkkapseln und Ligamenten sowie Sehnen und Muskeln. Wir kennen die Position unserer Körpersegmente sowie unseres Körpers im Raum. Auf der Basis all dieser Informationen kreiert das Hirn eine motorische Antwort. Sie dient beispielsweise dazu, die extern auf eine Hüfte luxierend wirkenden Kräfte zu neutralisieren oder den Rumpf in aufrechter Haltung gerade zu halten. Wollen wir eine Bewegung ausführen, aktiviert das Hirn die notwendigen Muskeln im korrekten Ausmaß und richtiger zeitlicher Abfolge. Wir spannen nicht bewusst den M. biceps an, wenn wir den Arm beugen wollen, sondern wir wollen den Arm beugen und der M. biceps spannt sich an. Ist die sensorische Information inkomplett oder inkorrekt, können weder Gelenke zuverlässig stabilisiert noch Bewegungen koordiniert ausgeführt werden.
Abnorme Bewegungsmuster
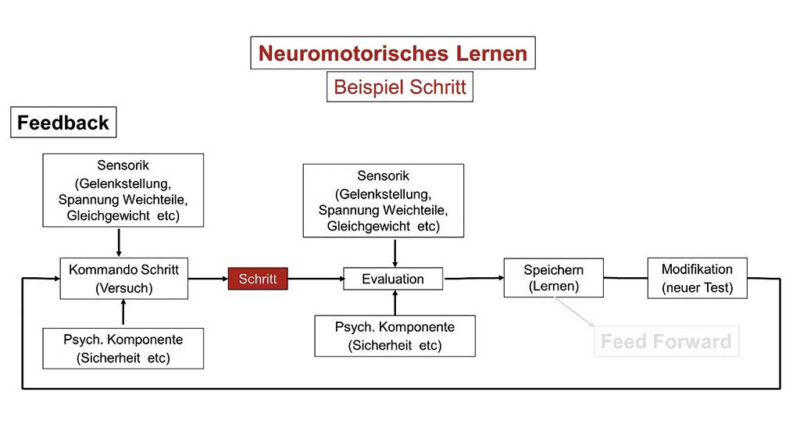
Motorisches Lernen funktioniert über Trial and Error. Aufgrund der sensorischen Informationen planen wir eine Funktion, die wir dann ausführen. Schon bei der Bewegungsausführung überwachen wir, ob wir tendenziell unser Ziel erreichen und ob dies ohne negative Empfindungen wie Überlastung, Schmerz, Angst oder andere mehr erfolgt. Wir bewerten nach der Durchführung, ob wir das Ziel erfolgreich erreicht haben. Zugleich bewerten wir unser Tun, also ob die Ausführung zu unangenehmen oder störenden Empfindungen geführt hat. Wir brauchen somit wieder die Sensorik, um Durchführung und Ergebnis zu überwachen, und zusätzlich unsere mentalen Fähigkeiten, um unsere Aktivität zu bewerten. Waren wir mit der Ausführung zufrieden, speichern wir das Bewegungsmuster ab und aus einer Feedback-gesteuerten Aktivität wird ein Feedforward-Programm. Sind wir nicht zufrieden, modifiziert unser Hirn den Ablauf und wir beginnen mit dem nächsten Test (Abb. 1). Fehler sind nötig, um die Motorik optimal an unsere individuelle Anatomie anzupassen, müssen aber über die Sensorik erkannt werden.
Entwicklungsverzögerung
Vor allem kleine Kinder sind ja beinahe grenzenlos motiviert, Funktionen immer wieder zu probieren. Sie kopieren unsere Funktion, z. B. das Gehen, und versuchen mit ihren Mitteln, Schritte zu machen, bis das Gehen sich einstellt. Je schlechter und unpräziser die Sensorik, umso öfter müssen sie probieren und umso länger brauchen sie, die Funktion zu erlernen. Je mehr Mühe sie haben, umso mehr klafft die Kluft der Entwicklung bei sensorischer Störung gegenüber den gesunden Altersgenossen auf. Zudem führen diese Schwierigkeiten zu einer relativen Bewegungsarmut. Die Patienten zeigen weniger Variabilität in ihren Funktionen, sind weniger aktiv als ihre gesunden Kameraden und weniger mutig, Neues zu versuchen. Damit vergrößert sich der Abstand zur normalen Entwicklung zunehmend.
Instabilitätsgefühl
Gehen ist unsere Fortbewegungsart, bei der wir eine Zeit lang nur auf einem Bein stehen. Es ist selbstredend, dass wir dies nur erreichen können, wenn unser Standbein stabil ist. Dabei kann es in den Gelenken passiv verriegelt sein. So lernen wir zu gehen, indem wir den Fuß nach unten drücken, die Tibia hinten halten und dadurch das Knie vor einer Beugung schützen, die wir zu Beginn nicht sicher kontrollieren können. Wir haben Angst zu stürzen und machen deshalb unser Bein steif. Schließlich bauen wir das Vertrauen auf, dass unser Bein uns trägt. Wir entwickeln ein Sicherheitsgefühl, welches uns ermöglicht, das Gegenbein vom Boden zu lösen und nach vorne zu schwingen. Ohne diese Sicherheit bleiben wir stehen, und es ist auch diese Sicherheit, die es uns erlaubt, ein variables und dynamisches Gehen aufzubauen. Fühlen wir uns dagegen unsicher, haben wir verschiedene Möglichkeiten:
- Wir halten uns an Gegenständen fest (Gehen an Möbeln entlang, aber auch Stöcke oder Rollator).
- Wir machen unser Bein wieder oder weiterhin zu einer steifen Säule, um die Beugung des Kniegelenkes zu vermeiden. Wir drücken den Fuß nach unten und die Tibia nach hinten. Bei einer Zerebralparese wird diese Spitzfüßigkeit oft als Spastizität gedeutet. Die Plantarflexion tritt aber schon in der Schwungphase auf, bei der der Fuß frei beweglich ist. Spastizität kann so schlecht ausgelöst werden. Zudem zeigen Patienten mit anderen Grundkrankheiten wie beispielsweise Muskeldystrophien gleiche Bewegungsmuster, wenn sie schwach und unsicher werden19. Reflektorische Spastik kann dann aber ausgelöst werden, wenn der Fuß mit den Zehen aufgesetzt und belastet wird, wobei die Achillessehne abrupt gedehnt wird.
- Wir spannen unsere Muskeln generell mehr an, um durch die größere Spannung ein Zusammenbrechen zu verhindern (hoher Muskeltonus, Spastizität). Es sind die Angst und der Stress, sich aufrecht zu kontrollieren, welche diese Reaktionen auslösen können.
Tonussteigerung
Angst und Stress (und andere psychische Reaktionen) führen zu einer Tonussteigerung (der steifen Komponente der Spastizität). Erwachsene Patienten können dies artikulieren, und vor allem Patienten mit Multipler Sklerose beschreiben, dass sie mit zunehmendem Verlust an Sensibilität unsicher werden, dabei einen Spitzfuß ausbilden und der Tonus steigt. Es kann angenommen werden, dass Patienten mit anderen Grundleiden, aber gleicher Problematik auch gleich reagieren. Zudem können Kinder sich noch schlecht reflektieren und deshalb über diese Phänomene keine Auskunft geben. Damit kann sogar zumindest ein Teil der Spastizität bei Patienten mit Zerebralparese als Konsequenz der sensorischen Affektion gesehen werden.
Übermäßige Empfindungen
Auch eine verstärkte Empfindung ist möglich. So sind chronische Schmerzen bei Patienten mit Zerebralparese keine Seltenheit. Die Inzidenz steigt mit dem Schweregrad der Affektion. Ein wesentlicher Faktor ist der Nichtgebrauch der Muskulatur. Muskeln geben antiphlogistische Substanzen ab, die neuroinflammatorische Veränderungen verhindern. Das geringere Repertoire an Bewegungsstrategien, die unsichere sensorische Information, Angst und Stress reduzieren die Motivation, sich zu bewegen und neue Funktionen auszuprobieren. Die Muskelmasse wird reduziert und weniger eingesetzt, weshalb diese antiphlogistisch wirkenden Substanzen zumindest teilweise fehlen20.
Funktionelle Deformitäten
Andere Muskelaktivitäten werden kompensatorisch nötig, was die auf den Bewegungsapparat einwirkenden Kräfte verändert (funktionelle Deformitäten).
Die fehlenden und veränderten sensorischen Informationen führen zu anderen, nicht der Norm entsprechenden Muskelaktivitäten. Weiter bestehen Perzeptionsstörungen (wie Störungen von Gleichgewicht oder Sehsinn). Die Folge ist eine schlechte Körperkontrolle, wodurch reaktive und kompensatorische Muskelaktivitäten hervorgerufen werden. Spitzfüßigkeit führt zu einem Stehen auf den Zehenspitzen, womit die Belastungsfläche klein wird und die Bodenreaktionskraft durch den Vorfuß und nicht wie normalerweise durch den Mittelfuß fällt. Damit muss der Körperschwerpunkt nach vorne verlagert werden, und dazu werden mindestens die Hüften, meist auch die Kniegelenke gebeugt. Neben der Überaktivität der Plantarflexoren ist auch eine zusätzliche Aktivität der Hüftstrecker (Gluteus maximus und ischiokrurale Muskeln) nötig, bei Kniebeugung auch der Kniestrecker. Wird die Plantarflexion als ungenügend oder instabil empfunden, werden weitere plantarflektierende Muskeln eingesetzt wie der Tibialis posterior und die Zehenbeuger. Die meisten abnormalen Muskelaktivitäten lassen sich also erklären und sind nicht simple Fehlleistungen eines geschädigten Gehirns.
Strukturelle Deformitäten
Nach dem Gesetz „Form follows Function“ 21 passen sich die Strukturen des Bewegungsapparates der neuen Situation an. Es kommt zu strukturellen Veränderungen des Bewegungsapparates, wenn sich neue Muskellängen und Skelettformen entwickeln. Die übermäßig beanspruchten Muskeln verkürzen sich ähnlich wie bei Sportlern, was vor allem auf mehrgelenkige Muskeln zutrifft. Der Kniestreckapparat dagegen wird in der Regel in die Länge gezogen; dies zeigt sich in einer Patella alta bei verlängertem Ligamentum patellae. Es verändern sich aber nicht nur die internen, von den Muskeln herrührenden Kräfte, sondern auch die von außen einwirkenden Kräfte (Beschleunigung, Schwerkraft) wirken in anderer Weise auf den Bewegungsapparat ein. Die veränderte Richtung der Kraft im Hüftgelenk führt zu einer Deformierung des Azetabulums, welche den Kopf austreten lässt. Die bei einem diplegischen Gang einwirkenden Kräfte führen zu einer Vermehrung der femoralen Antetorsion, wie in einer Modellstudie nachgewiesen werden konnte22. Bei Persistenz von Deformitäten an Fuß oder Wirbelsäule entwickeln die Knochen keilförmige Formveränderungen, welche es nicht mehr erlauben, in die normale Stellung zurückzukehren. Die strukturellen Veränderungen machen dann wieder Kompensationen notwendig, und die Spirale dreht sich weiter.
Konsequenzen für die Behandlungsstrategien
Unter diesen Aspekten verdienen unsere Therapiemaßnahmen einen kritischen Blick:
Behandlung der Spastizität
Es konnte gezeigt werden, dass Schwäche aus irgendeinem Grund zu einem vermehrten Einsatz der Plantarflexoren führt. Das Phänomen besteht unabhängig vom Grundleiden, auch bei Muskeldystrophie23. Als Mechanismus kann angenommen werden, dass wegen der Schwäche die Haltung als unsicher empfunden wird, was dann wie beschrieben zu einer Spitzfußtendenz mit Überstreckung des Kniegelenks führt. Macht also die Schwächung beispielsweise durch eine Botulinumtoxin-Injektion eines bereits schwachen Systems Sinn? Bei älteren Kindern wird die Effizienz dieser Maßnahme schlechter24.
Ebenso muss hinterfragt werden, ob eine Reduktion von Sensibilität zur Reduktion von Reflexen bei sensorischer Affektion sinnvoll ist. Die idealen Patienten für eine selektive dorsale Rhizotomie sind kräftig, weisen eine gute Selektivität der Muskelsteuerung und gute kognitive Funktionen auf und sind damit GMFCS-I-klassiert. Auch Gesunde müssen lernen, ihre individuell unterschiedlich stark ausgeprägten Reflexe für Funktionen wie das Gehen zu kontrollieren. Es ist nachgewiesen, dass die Reflexkontrolle auch bei Patienten mit neurologischen Affektionen moduliert werden kann25 26. Patienten mit Zerebralparese und GMFCS I sind damit bestens qualifiziert, ihre Reflexkontrolle zu erlernen. Allerdings benötigen sie, wie oben beschrieben, dazu deutlich länger.
Unter diesen Gesichtspunkten erstaunt es wenig, dass kürzlich in einer vergleichenden Studie bei einer Kohorte mit und einer ohne Behandlung der Spastizität kaum eine Differenz im Outcome gefunden wurde27.
Alternativen
Die oben beschriebenen Überlegungen stellen die Empfindung von Instabilität, Angst und Stress als einen Faktor für die motorische Dysfunktion als wichtigen Parameter dar. Therapeutische Maßnahmen müssen folglich Stabilität vermitteln. Einerseits erfolgt dies über orthopädische Maßnahmen, wie unten beschrieben. Andererseits muss die dynamische Stabilität trainiert werden. Es müssen andere Bewegungsformen in neuen Funktionen angeboten und gefordert werden. Das gesamte Spektrum der Bewegungserfahrung muss verbessert werden, und therapeutisch sollte nicht vorwiegend an einer und immer der gleichen Funktion gearbeitet werden. Letztlich ist aus diesen Gesichtspunkten eine sportliche Aktivität hilfreich. Die Patienten führen Bewegungen mit einem Ziel aus, das sie zu erreichen motiviert sind. Damit wird die automatische Kontrolle viel besser integriert als bei einer bewussten Korrektur einer spezifischen Funktion, wie z. B. des Gehens.
Unser Lernen ist darauf ausgerichtet, dass wir Strategien für unsere individuellen Fähigkeiten entwickeln, um gewünschte Funktionen auszuführen. Fehlen etwa Finger, lernen die Patienten, dies bestmöglich zu kompensieren. Dieses Prinzip kann als grundsätzlich angesehen werden. Im Alltag wie in Therapiesituationen müssen folglich Fehler erlaubt sein, und möglicherweise findet der Patient eine Strategie, die uns ungeeignet erscheint. Die Therapien müssen sich aber in erster Linie an den Fähigkeiten des Patienten orientieren. Gefährliche Situationen müssen vermieden werden, auch damit keine Ängste entstehen; Deformitäten müssen vermieden und allenfalls korrigiert werden. Das Training muss möglichst früh beginnen, damit sich die Schere der Bewegungserfahrung und des Aktivitätslevels nicht zu stark zwischen Gesunden und Patienten öffnet. Vermehrte Aktivität führt auch zu vermehrtem Muskeleinsatz und damit größer ausgebildeten Muskeln, was sich letztlich positiv auf Schmerzprobleme auswirkt.
Orthopädische Behandlung
Die orthopädische Behandlung fokussiert auf die Korrektur der Mechanik28. Mechanische Hindernisse, welche funktionell stören, werden korrigiert. Hebelarme werden optimal ausgerichtet, um die funktionelle Kontrolle zu optimieren. Besonders im Fußbereich stehen dazu eine ganze Reihe verschiedener Orthesen als konservative und verschiedene Eingriffe als operative Maßnahmen zur Verfügung. Auch Verlagerungen von Sehnen, die durch Fehlstellungen übermäßige oder zu kurze Hebelarme haben, können die Funktionalität verbessern.
Ein weiterer wesentlicher Punkt ist die Vermittlung von Stabilität und die Kontrolle von Dynamik in der Funktion. Besonders Patienten, welche noch keine genügende Kontrolle über die aufrechte Position erworben haben, sind auf Stabilität angewiesen. Orthesen halten Gelenke in festen Stellungen, denn Beweglichkeit ist nur von Nutzen, wenn sie kontrolliert werden kann. Andernfalls resultiert ein Instabilitätsgefühl, welches zu negativen Folgen führt. Das Stabilitätsgefühl kann nicht erzwungen werden. So werden steife Unterschenkelorthesen zum Stehen oder steife Korsette für eine instabile Rumpfhaltung im Sitzen verwendet. Alternativ zur konservativen Seite stehen Arthrodesen, an der Wirbelsäule die Spondylodese. Zudem werden Gelenkspositionen erhalten oder wiederhergestellt, die eine intrinsische Stabilität nutzbar machen. So wird z. B. eine Kniebeugekontraktur korrigiert, damit sich der Patient wieder in die Gelenkkapsel und Bänder hängen kann und nicht auf koordinativ anspruchsvolle Kniestreckeraktivität angewiesen ist. Wird der Patient stabiler, beginnt er, Funktionen auszuführen. Dann werden gewisse Bewegungen zugelassen, z. B. die Unterschenkelorthese im Sprunggelenk beweglich konstruiert, während andere Anteile wie der Mittelfuß weiterhin steifgehalten werden. Derart kann die Funktion langsam ohne wesentliche Instabilität aufgebaut werden. Operativ gibt es dazu keine Alternative. Allerdings sind diese funktionellen Hilfsmittel extrem anfällig für biomechanische Fehler, vor allem auf ungenügend gut eingestellte Achsen der Körpersegmente, die sie überbrücken. Eine Vorlage führt zu einer Instabilität in der Sagittalebene, Varus oder Valgus in der Frontalebene. Solche Fehler können sich derart negativ auswirken, dass eine bereits gegebene Funktion schlechter wird. Stabile Patienten sind denn auch nach meiner Erfahrung weniger spastisch als Patienten in instabilen Situationen.
Muskelverlagerungen zur funktionellen Verbesserung sind dagegen wesentlich kritischer. Je nach Position der Körpersegmente im Raum und damit unterschiedlicher Einwirkung der Schwerkraft werden andere Muskeln für die gleiche Bewegung eingesetzt. Muskelverlagerungen können sich deshalb immer nur auf eine bestimmte Position beziehen. Der funktionelle Gewinn ist schwierig vorherzusehen. Dies gilt selbstverständlich weniger für die Hand, die relativ leicht ist und damit der Schwerkraft wenig Einfluss bietet.
Der Autor:
Prof. Dr. med. Reinald Brunner F.R.C.S.
Konsiliararzt Neuroorthopädie
Orthopädie
Universitätskinderspital beider Basel UKBB
Spitalstrasse 33
4031 Basel
Schweiz
reinald-g‑h.brunner@unibas.ch
Begutachteter Beitrag/reviewed paper
Brunner R. Gangstörung bei Zerebralparese: ein mechanisches oder komplexes Problem? Orthopädie Technik, 2024; 75 (4), 78–83
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Ein engagierter Leistungssportler mit Hemiparese und der Einsatz sensomotorischer Fußorthesen (SMFO) — 12. Februar 2026
- Freud S. Die infantile Cerebrallähmung. Wien: Hölder, 1897
- Little WJ. On the influence of abnormal parturition, difficult labours, premature birth, and asphyxia neonatorum, on the mental and physical condition of the child, especially in relation to deformities. London Obstetrical Society, 1861; 3: 293–344
- Armstrong RW. Definition and classification of cerebral palsy. Developmental Medicine and Child Neurology, 2007; 49 (3): 166
- Rosenbaum P et al. A report: the definition and classification of cerebral palsy April 2006. Developmental Medicine and Child Neurology, 2007; 109: 8–14
- Palisano R et al. Development and reliability of a system to classify gross motor function in children with cerebral palsy. Developmental Medicine and Child Neurology, 1997; 39 (4): 214–223
- van den Noort JC et al. European consensus on the concepts and measurement of the pathophysiological neuromuscular responses to passive muscle stretch. European Journal of Neurology, 2017; 24 (7): 981–e38. doi: 10.1111/ene.13322
- Lonstein JE, Beck K. Hip dislocation and subluxation in cerebral palsy. Journal of Children‘s Orthopaedics, 1986; 6 (5): 521–526
- Miller F et al. Computer modeling of the pathomechanics of spastic hip dislocation in children. Journal of Children‘s Orthopaedics, 1999; 19 (4): 486–492
- Gudjonsdottir B, Mercer VS. Hip and spine in children with cerebral palsy: musculoskeletal development and clinical implications. Pediatric Physical Therapy, 1997; 9 (4): 179–185
- Alves-Pinto A, Emch M, Lampe R. Effects of Piano Training in Unilateral Cerebral Palsy Using Probabilistic and Deterministic Tractography: A Case Report. Frontiers in Human Neuroscience, 2021; 15: 622082
- Trivedi R et al. Correlation of quantitative sensorimotor tractography with clinical grade of cerebral palsy. Neuroradiology, 2010. 52 (8): 759–765
- Yoshida S et al. Quantitative diffusion tensor tractography of the motor and sensory tract in children with cerebral palsy. Developmental Medicine and Child Neurology, 2010; 52 (10): 935–940
- Marsico P et al. Psychometric Properties of Lower Limb Somatosensory Function and Body Awareness Outcome Measures in Children with Upper Motor Neuron Lesions: A Systematic Review. Developmental Neurorehabilitiation, 2022; 25 (5): 314–327
- Marsico P et al. Feasibility, Validity, and Reliability of Lower Limb Tactile and Body Awareness Assessments in Children With Upper Motor Neuron Lesions. Archives of Physical Medicine and Rehabilitation, 2023; 104 (9): 1447–1455
- Guzzetta A, Mercuri E, Cioni G. Visual disorders in children with brain lesions: 2. Visual impairment associated with cerebral palsy. European Journal of Paediatric Neurology, 2001; 5 (3): 115–119
- Philip SS et al. Relationship between brain structure and Cerebral Visual Impairment in children with Cerebral Palsy: A systematic review. Research in Developmental Disabilities, 2020; 99: 103580.
- Brunner R, Götz-Neumann K. A critical view on the importance of treating spasticity and new options to improve function in patients with cerebral palsy GMFCS I–III. Medical Research Archives, 2023; 11 (4). doi: 10.18103/mra.v11i4.3812
- Brunner R, Strobl W. Sensory function in cerebral palsy: an overview and considerations for consequences. Medical Research Archives, 2023
- Schweizer K, Romkes J, Brunner R. The association between premature plantarflexor muscle activity, muscle strength, and equinus gait in patients with various pathologies. Research in Developmental Disabilities, 2013; 34 (9): 2676–2683
- Xanthos DN, Sandkuhler J. Neurogenic neuroinflammation: inflammatory CNS reactions in response to neuronal activity. Nature Reviews Neuroscience, 2014; 15 (1): 43–53
- Wolff J. Die Lehre von der functionellen Knochengestalt. Archiv für pathologische Anatomie und Physiologie und für klinische Medicin, 1899; 155 (2): 256–315
- Carriero A, Jonkers I, Shefelbine SJ. Mechanobiological prediction of proximal femoral deformities in children with cerebral palsy. Computer Methods in Biomechanics and Biomedical Engineering, 2011; 14 (3): 253–262
- Schweizer K, Romkes J, Brunner R. The association between premature plantarflexor muscle activity, muscle strength, and equinus gait in patients with various pathologies. Research in Developmental Disabilities, 2013; 34 (9): 2676–2683
- Graham HK et al. Recommendations for the use of botulinum toxin type A in the management of cerebral palsy. Gait & Posture, 2000; 11 (1): 67–79. doi: 10.1016/s0966-6362(99)00054–5
- Chen XY et al. Reflex conditioning: a new strategy for improving motor function after spinal cord injury. Annals of the New York Academy of Sciences, 2010; 1198 (1): E12–E21. doi: 10.1111/j.1749–6632.2010.05565.x
- Thompson AK, Wolpaw JR. H‑reflex conditioning during locomotion in people with spinal cord injury. Journal of Physiology, 2021; 599 (9): 2453–2469. doi: 10.1113/JP278173
- MacWilliams BA et al. Long-term effects of spasticity treatment, including selective dorsal rhizotomy, for individuals with cerebral palsy. Developmental Medicine and Child Neurology, 2021; 64 (5): 561–568. doi: 10.1111/dmcn.15075
- Brunner R, Rutz P. Biomechanics and muscle function during gait. Journal of Children‘s Orthopaedics, 2013; 7 (5): 367–371. doi: 10.1007/s11832-013‑0508‑5