Einleitung
Eine immer älter werdende Gesellschaft mit einer rasant zunehmenden Zahl an Patienten mit neurologischen Erkrankungen bedingt rein statistisch eine ebenso wachsende Zahl von ausgeprägten Fußheberschwächen und ‑paresen. Diese können aus den verschiedensten Diagnosen resultieren. Beispielsweise kann der Nervus peroneus communis einerseits infolge peripherer Störungen geschädigt sein, etwa
- nach Implantation von Knie- oder Hüfttotalendoprothesen,
- nach traumatisch bedingten Schädigungen der unteren Extremität oder
- nach Bandscheibenvorfällen.
Andererseits können sie aber auch als Ergebnis zentralnervöser Diagnosen vorliegen, z. B. bei
- Schlaganfall,
- Multipler Sklerose,
- Schädel-Hirn-Trauma,
- inkompletten Rückenmarksverletzungen oder
- infantiler Zerebralparese.
Die Peroneusparese gehört zu den häufigsten Folgeerscheinungen der oben genannten zentralnervösen Diagnosen und stellt somit eine besondere Herausforderung in der Versorgung mit Hilfsmitteln dar. Das typische Gangbild zeigt in der Schwungbeinphase zumeist einen plantarflektierten Fuß in ausgeprägter Supinationsstellung, kombiniert mit einer Zirkumduktion in der Hüfte. Letztere ist notwendig, damit der Fuß beim Durchschwingen nicht hängen bleibt, kompensiert also die fehlende Fußheberfunktion.
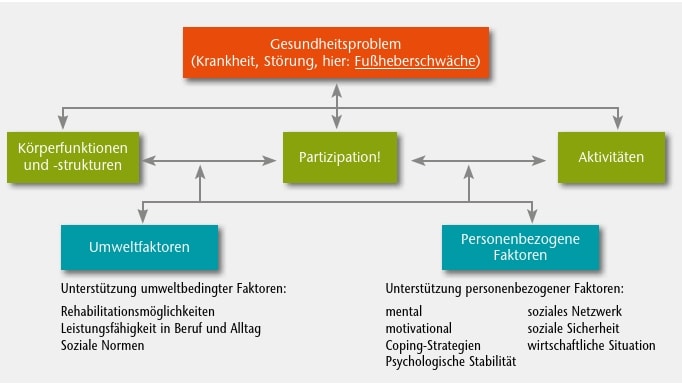
Gerade Patienten nach Schlaganfall zeigen häufig eine ausgeprägte Fußheberschwäche, folglich ein erhöhtes Sturzrisiko sowie reduzierte Gehgeschwindigkeit und Gehstrecke: Drei Monate nach einem Schlaganfall sind bei knapp 70 % der Patienten die Fuß- und Beinfunktionen massiv beeinträchtigt, 25 % beklagen einen vollständigen Verlust. Neben den gestörten Körperfunktionen sind insbesondere auch Aktivität und Partizipation am sozialen Leben betroffen. Die Folge: Viele Patienten werden nach und nach sozial isoliert. Entsprechend stehen demnach nicht nur die Körperfunktionen und ‑strukturen im Fokus einer Hilfsmittelversorgung, sondern gemäß der „International Classification of Functioning, Disability, and Health” (ICF, Abb. 1) mindestens gleichbedeutend die damit korrespondierenden Felder „Partizipation“ (Teilhabe) und „Aktivität“ 1.
Therapeutischer Nutzen von Orthesen
Über viele Jahre hinweg war man überzeugt, dass Patienten nach Schlaganfall bei ihrer Genesung lediglich ein bestimmtes „Plateau“ erreichen können und dass darüber hinaus keine deutlichen Verbesserungen mehr möglich sind. Inzwischen ist jedoch bekannt, dass sich große Fortschritte sehr wohl auch später noch realisieren lassen. In der Regel werden Schlaganfallpatienten im Rahmen der Physiotherapie mit klassischen neurophysiologischen Techniken behandelt, wobei es keine Überlegenheit bestimmter Techniken gibt 2, der Anteil gezielter bewegungstherapeutischer Interventionen jedoch inzwischen deutlich zugenommen hat 3 4 5 bzw. die Notwendigkeit eines weiterführenden kraftorientierten ADL-Trainings nachgewiesen wurde 6. Um diesen aktivitätsfordernden Aspekten Folge leisten zu können, bedarf es individueller und patientenzentrierter Hilfsmittellösungen, die sowohl den Schweregrad der Fußheberschwäche als auch das Aktivitätsniveau des Patienten widerspiegeln. Diese Anforderungen erfüllen moderne Orthesen, die gezielt adaptiert werden können und damit ein dynamisches und physiologisches Gangbild durch den flexiblen Vorfuß- und Fersenbereich ermöglichen. Bei der Versorgung mit Orthesen ist es unerheblich, ob es sich um eine periphere oder zentralnervöse Indikation handelt.
FES als Therapie- und Versorgungsoption
Jedoch hat sich bei zentralnervösen Diagnosen alternativ inzwischen die Versorgung mit funktioneller Elektrostimulation (FES) als Therapie- und Versorgungsoption nachhaltig etabliert 7. Moderne FES-Systeme verbinden neueste medizinisch-technische Errungenschaften mit therapeutischem Know-how und bieten in der Versorgung betroffener Patienten einzigartige Perspektiven. Gütekriterien sind:
- möglichst drahtlos,
- einhändig anzulegen,
- eindeutig zu repositionieren,
- für jeden einzelnen Patienten individuell konfigurierbar.
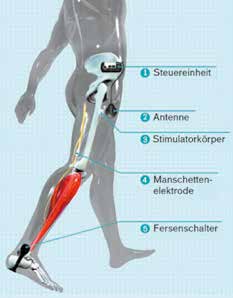
Zudem sind die meisten FES-Systeme leicht und unauffällig. Sie werden direkt am Körper getragen, können je nach Bedarf vom Patienten und Therapeuten ein- oder ausgeschaltet werden und sind sowohl für die stationäre und ambulante Rehabilitation als auch für den alltäglichen Einsatz im Privatbereich geeignet. Ein Druckentlastungssensor (Abb. 2) unter der Ferse des betroffenen Beins signalisiert der Beinmanschette (Abb. 3), ob sich die Ferse auf dem Boden oder in der Luft befindet, und wann die Stimulation somit erforderlich ist. Der Nervus peroneus communis und der Musculus tibialis anterior werden in der Schwungbeinphase der betroffenen Extremität mittels der in der Manschette befindlichen Elektroden angesteuert und sorgen für eine ausbalancierte Eversion/Dorsalextension. Mit Hilfe eines speziellen Einstelltools werden die patientenspezifischen Parameter konfiguriert (Abb. 4), sodass in jeder Schwungbeinphase eine zuverlässige Stimulation ausgelöst wird. Über die Fernbedienung (Abb. 5) kann der Patient das Gerät bequem ein- und ausschalten sowie bei Bedarf die Stimulation in einem vorab definierten Stimulationsfenster nachregulieren. Sofern der Patient für die FES geeignet ist, lassen sich mit Hilfe der Oberflächen-Elektrostimulation hervorragende Versorgungsergebnisse erzielen:
- Verbesserung der lokalen Blutzirkulation,
- Vermeidung oder Verzögerung einer Atrophie,
- Wiedererlernen motorischer Abläufe,
- Aufrechterhaltung bzw. Erweiterung des Bewegungsumfangs im Knie- und Sprunggelenk,
- Verbesserung des Physiological Cost Index,
- Verlängerung der Gehstrecke bei gleichzeitig ökonomischerem Gangbild,
- Verbesserung der Gangsicherheit und Stabilität auf ebenem, unebenem Terrain sowie Treppen und schrägen Ebenen sowie
- Reduktion des Sturzrisikos 8 9 10 11 12 13 14 15 16.
Ebenso lassen sich eine verbesserte Knie- und Hüftkontrolle 17 18 sowie eine beeindruckend verbesserte Teilnahme und Aktivität im Alltag des Patienten nachweisen 19. Dabei handelt es sich um einen mehrdimensionalen Therapieansatz, der dem Patienten funktionelle, pädagogische und psychosoziale Vorteile bietet, wie wir sie aus anderen Therapiebereichen bereits kennen 20. Zusammengefasst führen all diese Studienergebnisse dazu, dass die funktionelle Elektrostimulation inzwischen das Evidenzlevel 1a („strong“) erreicht hat (Tab. 1) 21.
Invasive funktionelle Elektrostimulation
Das gleiche Niveau gilt neben der zuvor beschriebenen Oberflächenstimulation auch für das elektromechanisch assistierte Gehen mit Gangtrainern: nicht gehfähige Patienten profitieren signifikant von dieser Therapieoption 22. Eine weitere FES-Versorgungsoption ist die invasive funktionelle Elektrostimulation. Sie funktioniert nahezu analog zur Oberflächenstimulation, wird jedoch im Rahmen einer Operation implantiert (Abb. 6). Der Vorteil ist, dass kein tägliches händisches Replatzieren einer FES-Orthese notwendig ist und dass mit etwas geringeren Stimulationsintensitäten gearbeitet werden kann. Allerdings unterliegt die Patientenselektion einem strengen Indikations-/Kontraindikationskatalog. Im Zuge einer damit eingehenden klinischen Untersuchung prüft der Operateur, ob der Patient für ein Implantat in Frage kommt. Notwendig hierzu ist, dass die Patienten
- unter einer bereits mindestens sechs Monate andauernden einseitigen Hemiparese aufgrund eines zerebrovaskulären Insults (ZVI) leiden,
- ihr Wachstum vollständig abgeschlossen haben,
- fähig sind, 20 Meter in weniger als 2 Minuten mit oder ohne Gehhilfe, aber ohne Hilfe von Dritten zu gehen,
- eine verminderte Gehgeschwindigkeit aufweisen,
- fähig sind, mit beiden Fersen in Berührung zum Boden aufrecht zu stehen, während sich Hüfte und Knie in neutraler Position befinden,
- das betroffene obere Sprunggelenk in einem passiven Bewegungsbereich von mindestens 30° bewegen können sowie
- grundlegend positiv auf elektrische Oberflächenstimulation des N. peroneus communis reagieren und die motorische Reaktion auf die Stimulation final zu einem verbesserten Gang führt.
Ist der Patient geeignet, wird ihm im Rahmen einer etwa 60- bis 90-minütigen Operation von einem spezialisierten Chirurgen das System implantiert, das nach vollständiger Wundheilung – im Normalfall etwa drei Wochen nach der Operation – aktiviert wird. Dabei überzeugen sowohl die gangbildspezifischen und biomechanischen Analysen als auch die Ergebnisse bzgl. der eingangs geforderten ICF-Aspekte „Partizipation“ und „Aktivität“ 23 24 25 26 27.
Als trennscharfe Kriterien zwischen transkutaner und invasiver FES lassen sich vier Aspekte definieren:
- kognitive Einschränkungen in Umgang und Anwendung,
- Schwierigkeiten bei der täglichen System-Repositionierung,
- elektrodenbedingte Hautirritationen,
- Stimulationshypersensitivität.
Fazit
Zusammenfassend betrachtet gelten bei der Versorgung mit funktioneller Elektrostimulation folgende Gütekriterien:
- eine sorgfältige Anamnese mit Überprüfung der Indikationskriterien,
- eine systematische, wissenschaftliche Evidenz in Kombination mit individueller klinischer Empirie 28 29,
- eine individuelle, auf die Bedürfnisse des Patienten abgestimmte Therapie 30,
- die Umsetzung in adäquaten Kompetenznetzen und Versorgungsinstitutionen 31,
- eine sorgfältige vergleichende Dokumentation AFO vs. FES.
Aus aktuellen Publikationen ist bekannt, dass Patienten so schnell wie möglich wieder so mobil und aktiv wie möglich gemacht werden sollten. Heutzutage können neben den bewährten orthetischen Hilfsmittellösungen insbesondere Versorgungen mit funktioneller Elektrostimulation dazu beitragen. Dabei wirken sie vermutlich umso besser, je früher sie zum Einsatz kommen, und verhelfen den Patienten nachweislich zu mehr Teilhabe und Aktivität, also zu einer deutlich verbesserten Lebensqualität.
Interessenkonflikt
Der Autor ist wissenschaftlicher Leiter des Fachbereichs Neurorehabilitation der Otto Bock HealthCare Deutschland GmbH.
Der Autor:
Dr. Thorsten Böing
Leiter Neurorehabilitation D‑A-CH
Otto Bock HealthCare Deutschland
Max-Näder-Straße 15
37115 Duderstadt
thorsten.boeing@ottobock.com
Begutachteter Beitrag/reviewed paper
Böing T. Funktionelle Elektrostimulation (FES) bei Peroneusparese und Fußheberschwäche. Orthopädie Technik, 2015; 66 (7): 38–42
| Ebene | Bewertung | Beschreibung |
|---|---|---|
| 1a | stark | Ergebnisse aus verfügbaren Metaanalysen oder aus 2 oder mehr RCTs angemessener Qualität |
| 1b | moderat | Ergebnisse aus einer RCT angemessener Qualität |
| 2 | begrenzt | Ergebnisse aus mindestens einer kontrollierten Untersuchung mit mindestens 10 TN pro Arm (ohne Randomisierung: Kohortenstudie o. Ä.) |
| 3 | Konsensus | Übereinstimmung einer Expertengruppe bzgl. einer akzeptablen Intervention. Dieses Level wird als das niedrigste Evidenzniveau betrachtet. Insofern ist es in seiner Aussagekraft diskutabel. |
| 47 | wiedersprüchlich | Keine Übereinstimmung der Ergebnisse von mindestens 2 RCTs. Bei mehr als 4 RCTs mit nur einem widersprüchlichen Resultat basiert das Gesamtergebnis auf der Mehrheit der Einzelergebnisse, sofern die abweichende Studie keine höhere Qualität hatte. |
- Vergleichende Prüfung konventioneller und additiv gefertigter Prothesenschäfte in Anlehnung an DIN EN ISO 10328:2016 — 10. März 2026
- Easypreg – ein Faserverbundwerkstoff zum Tiefziehen — 9. März 2026
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- World Health Organization. International Classification of Functioning, Disability, and Health (ICF). http://www.who.int/classifications/icf/en/ (Zugriff am 28.11.2013)
- Pollock A, Baer G, Pomeroy VM, Langhorne P. Pollock, et al. Physical rehabilitation approaches for the recovery of function and mobility following stroke. Cochrane Database of Systematic Reviews 2014, Issue 4. Art. No.: CD001920.DOI: 10.1002/14651858. CD001920.pub3
- Cumming T, Thrift A, Collier J, Churilov L, Dewey H, Donnan G, Bernhardt J. Very early mobilization after stroke fast-tracks return to walking: further results from the phase II AVERT randomized controlled trial. Stroke, 2011; 42 (1): 153–158
- Kuyss S, Brauer S, Ada L. Higher-intensity treadmill walking during rehabilitation after stroke in feasible and not detrimental to walking pattern or quality: a pilot randomized trial. Clin Rehabil, 2011; 25 (4): 316–326
- Pohl M, Mehrholz J, Ritschel C, Rückriem S. Speed-dependent treadmill training in ambulatory hemiparetic stroke patients: a randomized controlled trial. Stroke, 2002; 33: 553–558
- Carvalho C, Sunnerhagen K, Willén C. Walking performance and muscle strength in the later stage post-stroke: a nonlinear relationship. Arch Phys Med Rehabil, 2013; 94 (5): 845–850
- Schuhfried O, Crevenna R, Fialka-Moser V, Paternostro-Sluga T. Non-invasive neuromuscular electrical stimulation in patients with central nervous system lesions: an educational review. J Rehabil Med, 2012; 44: 99–105
- Winter T. Funktionelle Elektrostimulation in der Gangrehabilitation nach Schlaganfall. Neurol Rehabil 2011, 17 (3): 266–267
- Everaert D, Stein R, Abrams G, Dromerick A, Francisco G, Hafner B, Huskey T, Munin M, Nolan K, Kufta V. Effect of a Foot-Drop Stimulator and Ankle-Foot Orthosis on Walking Performance After Stroke: A Multicenter Randomized Controlled Trial. Neurorehabil Neural Repair, 2013, 27 (7): 579–591.doi: 10.1177/1545968313481278. Epub 2013 Apr 4
- Kluding P, Dunning K, O’Dell M, Wu S, Ginosian J, Feld J, McBride K. Foot Drop Stimulation Versus Ankle Foot Orthosis After Stroke: 30-week outcomes. Stroke, 2013; 44 (6): 1660–1669. doi: 10.1161/STROKEAHA.111.000334. Epub 2013 May 2
- Sheffler L, Taylor P, Gunzler D, Buurke J, Ijzerman M, Chae J. Randomized Controlled Trial of Surface Peroneal Nerve Stimulation for Motor Relearning in Lower Limb Hemiparesis. Archives of Physical Medicine and Rehabilitation, 2013; 94: 1007–1014
- Burridge J, Taylor P, Hagan S, Wood D, Swain I. The effects of common peroneal nerve stimulator on the effort and speed of walking: a randomized controlled clinical trial with chronic hemiplegic patients. Clin Rehabil 1997, 11: 201–210
- Taylor P, Burridge J, Dunkerley A, Lamb A, Wood D, Norton J. Patients’ perceptions of the Odstock dropped foot stimulator (ODFS). Clinical Rehabilitation, 1999, 13: 439–446
- Kottink A, Oostendorp L, Buurke J, Nene A, Hermens H, Ijzerman M. The orthotic effect of functional electrical stimulation on the improvement of walking in stroke patients with a dropped foot: a systematic review. Artificial Organs, 2004, 28: 577–586
- Ring H, Treger I, Gruendlinger L, Hausdorff J. Neuroprosthesis for footdrop compared with an ankle-foot orthosis: effects on postural control during walking. Journal of Stroke and Cardiovascular Disease, 2009, 18: 41–47
- Laufer Y, Ring H, Sprecher E, Hausdorff J. Gait in Individuals with Chronic Hemiparesis: One-Year Follow-up of the Effects of a Neuroprosthesis That Ameliorates Foot Drop. JNPT, 2009; 33: 104–110
- Kim JH, Kim Y, Kang HK, Jung KS, Chung Y, Hwang S. Functional electrical stimulation applied to gluteus medius and tibialis anterior corresponding gait cycle for stroke. Gait & Posture, 2012; 36 (1): 65–67
- Springer S, Vatine J‑J, Wolf A, Laufer Y. The effects of dual-channel functional electrical stimulation on stance phase sagittal kinematics in patients with hemiparesis. J Electromyogr Kinesiol, 2013; 23: 476–482
- Böing T. Hilfsmittelversorgungen bei ZNS-bedingter Peroneusparese im ICF-Fokus von Aktivität und Teilhabe. DGNR-Jahrestagung Singen, 05.12.2014
- Vanden-Abeele J, Schüle K, Huber G. Wissenschaftliche Begründung der Sporttherapie. In: Schüle K, Huber G (Hrsg.). Grundlagen der Sporttherapie. Prävention, ambulante und stationäre Rehabilitation. München: Urban & Fischer, 2000: 9–37
- Teasell R, Foley N, Salter K, Richardson M, Allen M, Hussein N, Bhogal S, Jutai J, Speechley M. Evidence-Based Review of Stroke Rehabilitation: executive summary, 16th edition (online). http://www.ebrsr.com/sites/default/files/documents/executivesummary-srebr_final_16ed.pdf (Zugriff am 16.12.2014)
- Mehrholz J, Elsner B, Werner C, Kugler J, Pohl M. Electromechanical-assisted training for walking after stroke. Cochrane Database of Systematic Reviews 2013, Issue 7. Art. No.: CD006185. doi: 10.1002/14651858.CD006185.pub3
- Ernst J, Grundeya J, Hewitta M, von Lewinskia H, Kaus J, Schmalz T, Rohde V, Liebetanz D. Towards physiological ankle movements with the ActiGait implantable drop foot stimulator in chronic stroke. Restor Neurol Neurosci, 2013; 31 (5): 557–569
- Böing T. Das FES-Implantat „ActiGait“ in der Versorgung nach Schlaganfall – eine ICF-basierte Anwenderbefragung zu Aktivität und Teilhabe. DGNR-Jahrestagung Berlin, 12.12.2013
- Daniilidis K, Jakubowitz E, Umbach O, Yao D, Windhagen H, Stukenborg-Colsman C. Ergebnisse nach Implantation einer Neuroprothese. Bewegungsanalyse nach einem Eingriff zur Behandlung des neurogenen Fallfußes. Orthopädische Nachrichten, 2014; 10: 37
- van Swigchem R, Weerdesteyn V, van Duijnhoven HJ, den Boer J, Beems T, Geurts AC. Near-Normal Gait Pattern With Peroneal Electrical Stimulation as a Neuroprosthesis in the Chronic Phase of stroke: A Case report. Arch Phys Med Rehabil, 2011; 92: 320–324
- Severinsen K, Grey K, Juhl A, Soerensen P, Oppel L, Larsen B. Patient Satisfaction of Using the ActiGait Drop Foot Stimulator System and Effect of Treatment on Walking. In: Jensen W et al. (eds.). Replace, Repair, Restore, Relieve – Bridging Clinical and Engineering Solutions in Neurorehabilitation. Biosystems & Biorobotics, 2014; 7: 725–734. doi: 10.1007/978–3‑319–08072-7_101
- Schupp W. DGRW-Update: Neurologie – Von empirischen Strategien hin zu evidenzbasierten Interventionen. Rehabilitation, 2012; 50 (6): 354–362
- Liepert J. Evidence-Based Methods in Motor Rehabilitation after Stroke. Fortschr Neurol Psychiatr, 2012; 80: 388–393
- Rothmann M, Burke L, Erickson P, Leidy N, Patrick D, Petrie C. Use of existing Patient Reported Outcome (PRO) instruments and their modification. PRO Task Force Report. Value Health, 2009; 12: 1075–1083
- Reese J‑P, Dodel R, Kolominsky-Rabas P. Neurologie. In: Pfaff H, Neugebauer E, Glaeske G, Schrappe M (Hrsg.). Lehrbuch Versorgungsforschung. Systematik – Methodik – Anwendung. Stuttgart: Schattauer, 2011: 382–386