Einleitung
Der Diabetes mellitus ist eine Volkskrankheit mit globalen Ausmaßen. Nach Schätzungen sind es derzeit ca. 366 Millionen Erwachsene, die an einem Diabetes leiden 1. Bis 2040 kann sich diese Zahl nach Hochrechnungen auf 642 Millionen erhöhen 2. Die dramatische Zunahme der weltweiten Prävalenz von Diabetes hat auch zu einem Anstieg von diabetesassoziierten Komplikationen geführt 3. So haben Personen mit Diabetes mellitus ein 15- bis 25-prozentiges Risiko, während ihres Lebens ein diabetisches Fußgeschwür zu entwickeln, sowie eine 50- bis 70-prozentige Rezidivrate über die folgenden fünf Jahre 456 Diabetische Fußläsionen gehen mit einer hohen Morbidität und Mortalität einher und sind die häufigste Ursache für einen Krankenhausaufenthalt bei Diabetespatienten. Das Risiko für eine Amputation an den unteren Extremitäten ist bei Diabetespatienten 23-mal höher als bei Patienten ohne Diabetes 7. Das Risiko für eine Major-Amputation steigt um 85 %, wenn Fußulzerationen vorliegen 8 9. Kommt es zu einer Amputation, besteht eine 50-prozentigeWahrscheinlichkeit, dass Patienten versterben oder dass das kontralaterale Glied innerhalb von fünf Jahren ebenfalls amputiert wird 10. Daher ist es immens wichtig, Ulzerationen bei Diabetespatienten frühzeitig zu erkennen und zu behandeln. Eine multidisziplinäre Behandlung von Fußulzerationen sowie eine enge Überwachung kann die Amputationsraten um 49 bis 85 % senken 1112.
Gestörte Wundheilung und Fußulcus
Neben der gestörten Wundheilung durch pathophysiologische Anomalien auf zellulärer Basis – z. B. führen insuffiziente Makrophagen in der Entfernung von toten Zellen zu einer verlängerten entzündlichen Antwort – sind die diabetische Neuropathie und die periphere arterielle Erkrankung (pAVK) die wichtigsten Faktoren, die die Entstehung von Fußulcera begünstigen 131415161718. Ebenso kann Diabetes zu einer Verhärtung der ligamentären Gelenkstrukturen führen. Durch die so begrenzte Gelenkbeweglichkeit steigt das Risiko von höheren lokalen Plantardrücken, was wiederum die Ausbildung von Fußulcera bei gleichzeitiger Missempfindung und Durchblutungsstörung begünstigt 19.
Ansätze der Ulcustherapie und bisherige Therapieoptionen
Die Fundamente einer Ulcustherapie sind zum einen die Förderung der Wundheilung, zum anderen eine antibakterielle Wirkung, da offene Wunden in der Regel mit Mikroorganismen besiedelt sind [18]. Die einfachste Option zur Förderung der Wundheilung ist die Entlastung der Ulcera, vor allem, wenn sie plantar gelegen sind [19]. Die topischen Anwendungen von Wundauflagen mit aufsaugenden, befeuchtenden oder antiseptischen Zusätzen sind häufig beschrieben und richten sich oft nach den Wundcharakteristika (Länge, Tiefe, Sekretion der Wunde) sowie den Erfahrungen des Behandelnden 2021. Ein neuerer Ansatzpunkt, um die Wundheilung zu fördern, ist die Verwendung von mesenchymalen Stammzellen mit der Fähigkeit, PDGF, VEGF und EGF auszuschütten 222324. Zur Adressierung der Keimbesiedlung eignet sich eine adäquate Antibiotikatherapie. Typischerweise ist in den Wunden von Diabetespatienten oft eine Mischflora aus gramnegativen Bacilli und grampositiven Kokken zu finden 25. Ausgedehnte Antibiotikatherapien erzeugen Resistenzen und sollten daher nur eingesetzt werden, sobald eine Infektion klinisch wird. Ein weiteres Problem der Keimbesiedlung an chronisch offenen Wunden (länger als 30 Tage) ist die Bildung von Biofilmen mit einer Wahrscheinlichkeit von 60 %, während diese bei akuten Wunden nur zu 6 % besteht 26. Da das Vorhandensein eines Biofilms die Durchschlagkraft von Antibiotika erheblich mindert 27, ist seine Entfernung von immenser Bedeutung. Hierfür eignen sich in erster Linie regelmäßige Débridements sowie die Verwendung von niedrigwelligen Ultraschallbehandlungen 28. Einige Studien schlagen auch die hyperbare Oxygenierung als eine zusätzliche Ulcustherapie vor. Insgesamt ist die aktuelle Studienlage hierzu aber noch kontrovers 2930.
Kaltplasmatherapie
Die sterilisierende Wirkung von Plasma wird seit Jahren zur Aufbereitung von medizinischen Geräten und Implantaten genutzt. Jedoch wird hierfür Hochtemperaturplasma eingesetzt, was für eine Verwendung an menschlichem Gewebe ungeeignet ist 31. Neuere Medizinprodukte erlauben nun die Erzeugung von kaltem Plasma („cold atmospheric plasma“, CAP), das die gleiche sterilisierende Wirkung hat wie Hochtemperaturplasma. Ohne die enorme Wärmeproduktion kann CAP auch auf lebendem Gewebe, z. B. der menschlichen Haut, angewendet werden.
Ein Plasma, das als vierter Aggregatzustand neben den drei klassischen Formen (gasförmig, flüssig und fest) gilt, kann erzeugt werden, indem ein Gas starker Energiezufuhr ausgesetzt wird. Durch die Ionisierung des Gases infolge der Energiezufuhr kommt es zur Abtrennung von Ladungsträgern und zur Aufspaltung molekularer Verbindungen 32. Im Allgemeinen können zwei Arten von CAP unterschieden werden: direktes (di_CAP) und indirektes Plasma. In indirekten Systemen wird das Plasma zwischen zwei Elektroden erzeugt, und ein Trägergas leitet das Plasma auf die zu behandelnde Haut. In direkten Plasmasystemen wirkt die Haut selbst als Gegenelektrode 33. Die Vorteile einer direkten Plasmabehandlung sind die höhere Plasmadichte sowie der in die oberen Schichten der Haut induzierte Hochfrequenzstrom. Das Potenzial des di_CAP, die Bakterienlast ohne relevante Nebenwirkungen zu verringern, wurde bereits in zahlreichen In-vivo und In-vitro-Studien gezeigt 3435. Die sterilisierende Wirkung beruht dabei auf der Schädigung der bakteriellen Membran 3637. Zudem führt eine Plasmabehandlung zur Senkung des pH-Wertesim Wundbereich, und sie kann die Proliferation von endothelialen Zellen über die Stimulation von angiogenen Wachstumsfaktoren fördern, was insgesamt mit einer beschleunigten Wundheilung einhergehen kann 3839.
PlasmaDerm®
Das in der Klinik der Verfasser verwendete Medizingerät ist das PlasmaDerm® Flex9060 (Cinogy GmbH, Duderstadt, Deutschland; Abb. 1). Es generiert ein schwach ionisiertes physikalisches Plasma durch die Anwendung von Wechselspannungsimpulsen mit Amplituden > 10 kV und einer Leistungsdichte von 120 mW/cm². Die Hochspannungselektrode ist abgedeckt durch ein Dielektrikum, das den Übergang der Gasentladung in einen heißen Bogen vermeidet. Die Haut selbst wirkt als Gegenelektrode. Eine berührungsfreie Plasma-Applikation mit konstantem Abstand zur Haut wird mittels eines speziell konstruierten und sterilen Abstandhalters (Elektrode) sichergestellt, der eine Fläche von 27 cm² abdeckt. Die physikalischen Parameter werden von der Steuereinheit bestimmt. Um jegliche Manipulation an den technischen Parametern zu vermeiden, wurde die Bedienung so einfach wie möglich gehalten. So gibt es nur eine On-Taste auf dem Gerät, und ein Timer auf dem Display gibt die maximale Behandlungsdauer von genau 2 × 45 s an.
Eigene Erfahrungen und Erkenntnisse aus der Literatur
In der Klinik der Verfasser wurden über einen Zeitraum von zwei Jahren insgesamt elf Patienten mit einer di_CAP- Therap versorgt. Alle Patienten hatten ein diabetisches Fußsyndrom und litten unter rezidivierenden plantaren Ulcera, die z. T. therapierefraktär waren. Sechs der elf Patienten wurden zur Ulcussanierung operiert. Die Bedienung des PlasmaDerm® Flex9060 wurde sowohl von Ärzten als auch von der Pflege durchgeführt und stets von allen Beteiligten als einfach beschrieben. Ebenso empfanden sämtliche Patienten die Behandlung als angenehm und komplett schmerzlos. Eine Wundheilung konnte bei allen untersuchten Patienten im Verlauf beobachtet werden. Die di_CAP-Therapie war allerdings nicht die einzige Ulcusbehandlung. Vielmehr wurde auch eine Komplexbehandlung aus Entlastung, chirurgischem Débridement, Antibiotikagabe und Wundverbänden je nach klinischer Symptomatik angewandt.
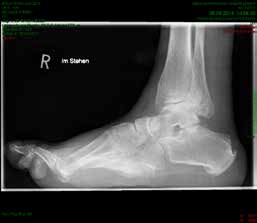
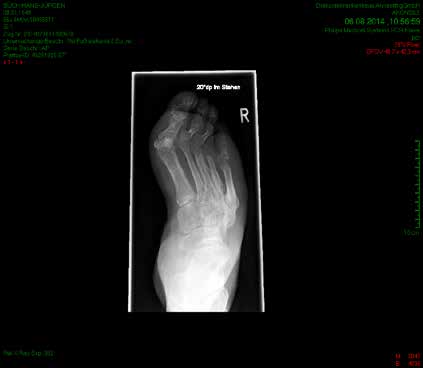
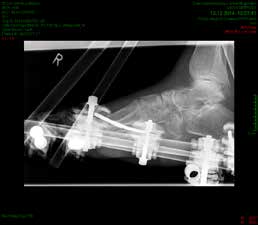
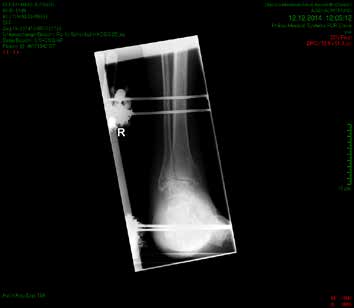
So erhielt ein 67-jähriger männlicher Patient nach operativer Versorgung mittels Fixateur externe neben einer Entlastung nur eine di_CAP-Therapie. Als Hauptdiagnose wurde eine sekundäre Fußfehlstellung in Pes-cavovarus-Position mit chronischem Ulcus am rechten Fußrand bei diabetischer Neuroosteoarthropathie festgehalten (Abb. 2); relevante Nebendiagnosen waren eine pAVK und diabetische Nephropathie. Als operative Therapie wurde eine Stellungskorrektur mit dem Hoffmannschen Fixateur externe durchgeführt (Abb. 3). Intraoperativ konnte eine bakterielle Besiedlung mit Escherichia coli, Enterococcus faecalis und Enterobacter cloacae nachgewiesen werden. Während des stationären Aufenthaltes wurde der Patient zweimal wöchentlich mit di_CAP behandelt. Nach seiner Entlassung erfolgte die Einbestellung zur di_CAP-Therapie nach der 4., 6. und 10. postoperativen Woche. Dabei wurde vor jeder Wundbehandlung ein Abstrich für eine mikrobiologische Untersuchung genommen. Im Verlauf kam es zu einer guten Wundheilung des anfänglich 3 × 5 cm messenden plantaren Ulcus, und in der 10. postoperativen Woche ließ sich eine fast vollkommene Wundheilung beobachten (Abb. 4). Ab der 1. postoperativen Woche war in den mikrobiologischen Abstrichen nur noch E. faecalis nachweisbar, und ab der 4. Woche konnte im Ulcus kein Keim mehr nachgewiesen werden. Aufgrund der geringen Patientenanzahl und der unregelmäßigen Wiedervorstellungen der Patienten konnte die Kohorte nicht suffizient im Verlauf beobachtet werden, um genügend Daten für eine prospektive Studie zu generieren. Die klinischen Erfahrungen der Verfasser decken sich jedoch mit Ergebnissen bisheriger Arbeiten zur di_CAP-Therapie.
Eine klinische Pilotstudie mit PlasmaDerm® wurde bereits durchgeführt 40. Brehmer et al. konnten in ihrer prospektiven Studie zeigen, dass die di_CAP-Therapie in der Behandlung von venösen Unterschenkelulcera eine sichere Methode ist. Zudem wurden antibakterielle Effekte festgestellt. Die Autoren unterteilten randomisiert 14 Patienten mit chronischen (älter als zwölf Wochen) venösen Ulcera in zwei gleich große Kohorten, die jeweils dreimal wöchentlich einbestellt wurden. Die Kontrollgruppe erhielt eine standardisierte Wundversorgung mit Mepitel® oder mit Mepilex®, je nach Wundsekretion. Zudem wurden die Wunden nur mit NaCl gereinigt, andere desinfizierende Maßnahmen waren nicht erlaubt. Die Untersuchungsgruppe erhielt zusätzlich zu der Wundbehandlung noch eine di_CAP-Anwendung von 45 s. Es konnte zwar in beiden Kohorten eine Reduzierung der Ulcusgröße von über 50 % verzeichnet werden, die größere Heilungsfläche wies aber die Untersuchungsgruppe auf (di_CAP: –5,3 cm², Kontrollgruppe: –3,4 cm², P = 0,42). Und die einzige Wunde, die nach sieben Wochen komplett verheilte, war in der Untersuchungsgruppe dokumentiert. Zudem konnte hier eine signifikante Keimreduktion im Vergleich zur Kontrollgruppe verzeichnet werden (P = 0,04).
Die di_CAP-Therapie ist insgesamt positiv zu bewerten. Sie wurde von den Probanden als schmerzlos und nicht nachteilig bewertet. Der bereits in vielen In-vivo- und In-vitro-Studien ermittelte Benefit, sowohl bezüglich der Keimreduktion als auch bezüglich der Förderung der Wundheilung, konnte erstmals im klinischen Setup demonstriert werden 414243. Darüber hinaus werden die Wirkungsweisen der di_CAP-Therapie, wie sie heute bekannt sind, nicht nur erfolgreich in der Wundbehandlung eingesetzt, sondern auch in der Behandlung von entzündlichen oder juckenden Hauterkrankungen und epidermalen Barrieredefekten 4445.
Nichtsdestotrotz bleibt die di_CAP-Therapie im Vergleich zu den konventionellen Wundbehandlungen ein Exot. Das chirurgische Débridement ist hier mit ausreichend vorhandener Evidenz weiterhin der Goldstandard 4647. Durch ein chirurgisches Débridement wird neben der Abtragung von nek rotischem Gewebe auch ein ggf. vorhandener mikrobakterieller Biofilm entfernt und eine Revaskularisierung adäquat angeregt 484950. Neben dem chir urgischen Débridement existiert noch eine Vielzahl von anderen Débridementformen, z. B. die Verwendung von Ultraschall oder Maden 5152. Aufgrund der Vielfalt der unterschiedlichen Therapiemöglichkeiten, die stark von den Anwendern abhängig sind, ist deren Evidenz aber eher gering einzuschätzen. Hinzu kommt, dass die Therapie zum Teil im ambulanten Bereich von Pflegekräften oder Wundmanagern durchgeführt wird und nicht mehr unter einer kompletten ärztlichen Kontrolle steht, sodass sie nur schwer im Gesamten zu validieren ist.
Für die Autoren:
PD Dr. med. Kiriakos Daniilidis
Sporthopaedicum Straubing
Fuß- und Sprunggelenkschirurgie
Bahnhofplatz 27
94315 Straubing
kiriakos-daniilidis@gmx.de
Begutachteter Beitrag/reviewed paper
Daniilidis K, Stukenborg-Colsman C, Yao D. Erfahrungen mit Kaltplasma in der Behandlung des diabetischen Fußes. Orthopädie Technik, 2017; 68 (12): 46–50
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Ein engagierter Leistungssportler mit Hemiparese und der Einsatz sensomotorischer Fußorthesen (SMFO) — 12. Februar 2026
- Brem H, Tomic-Canic M. Cellular and molecular basis of wound healing in diabetes. J Clin Invest, 2007; 117: 1219–1222
- Brem H, Tomic-Canic M. Cellular and molecular basis of wound healing in diabetes. J Clin Invest, 2007; 117: 1219–1222
- Shaw JE, Sicree RA, Zimmet PZ. Global estimates of the prevalence of diabetes from 2010 and 2030. Diabetes Res Clin Pract, 2010; 87: 4–14
- Boulton AJ. The diabetic foot. Med Clin North Am, 2010; 38: 644–648
- Snyder RJ, Kirsner RS, Warriner RA, et al. Consensus recommendations on advancing the standard of care for treating neuropathic foot ulcers in patients with diabetes. Ostomy Wound Manage, 2010; 56: S1–S24
- Boulton AJ, Vileikyte L, Ragnarson-Tennvall G, et al. The global burden of diabetic foot disease. Lancet, 2005; 366: 1719–1724
- O’Loughlin A, McIntosh C, Dinneen S, et al. Review paper: basic concepts to novel therapies: a review of the diabetic foot. Int J Low Extrem Wounds, 2010; 9: 90–102
- Boulton AJ, Vileikyte L, Ragnarson-Tennvall G, et al. The global burden of diabetic foot disease. Lancet, 2005; 366: 1719–1724
- O’Loughlin A, McIntosh C, Dinneen S, et al. Review paper: basic concepts to novel therapies: a review of the diabetic foot. Int J Low Extrem Wounds, 2010; 9: 90–102
- Dargis V. Benefits of a multidisciplinary approach in the management of recurrent diabetic foot ulcerations in Lithuania: a pro spective study. Diabetes Care, 1999; 22: 1428–1431
- Alavi A, Sibbald RG, Mayer D, et al. Diabetic foot ulcers: part I. Pathophysiology and prevention. J Am Acad Dermatol, 2014; 70: E1–E18
- Apelqvist J, Bakker K, van Houtum WH, et al. Practical g uidelines on the management and the prevention of the diabetic foot: based upon the International Consensus on the Diabetic Foot (2007) pre pared by the International Working Group on the Diabetic Foot. Diabetes Metab Res Rev, 2008; 24: S181–S187
- Falanga V. Wound healing and its impairment in the diabetic foot. Lancet, 2005; 366: 1736–1743
- Sibbald RG, Woo KY. Biology of chronic foot ulcers with persons with diabetes. Diabetes Metab Res Rev, 2008; 24: S25–S30
- Blakytny R, Jude E. The molecular biology of chronic wounds and delayed healing in diabetes. Diabet Med 2006; 23: 594–608
- Khanna S, Biswas S, Shang Y, et al. Macrophage dysfunction impairs resolution of inflammation in the wounds of diabetic mice. PLoS One, 2010; 5: E9539
- Rathur HM, Boulton AJ. Recent advances in the diagnosis and management of diabetic neuropathy. J Bone Joint Surg Br, 2005; 87: 1605–1610
- Snyder BJ, Waldman BJ. Venous thromboembolism prophylaxis and wound healing in patients undergoing major orthopedic surgery. Adv Skin Wound Care, 2009; 22: 311–315
- Apelqvist J, Bakker K, van Houtum WH, et al. Practical g uidelines on the management and the prevention of the diabetic foot: based upon the International Consensus on the Diabetic Foot (2007) pre pared by the International Working Group on the Diabetic Foot. Diabetes Metab Res Rev, 2008; 24: S181–S187
- Rayman G, Rayman A, Baker NR, et al. Sustained silverreleasing dressing in the treatment of diabetic foot ulcers. Br J Nurs, 2005; 14: 109–114
- Hinchliffe RJ, Valk GD, Apelqvist J, et al. A systematic review of the effectiveness of interventions to enhance the healing of chronic ulcers of the foot in diabetes. Diabetes Metab Res Rev, 2008; 24: 119–S144
- Javazon EH, Keswani SG, Badillo AT, et al. Enhanced epithelial gap closure and increased angiogenesis in wounds of diabetic mice treated with adult murine bone marrow stromal progenitor cells. Wound Repair Regen, 2007; 15: 305–309
- Zou JP, Huang S, Peng Y, et al. Mesenchymal stem cells/multipotent mesenchymal stromal cells (MSCs): potential role in healing cutaneous chronic wounds. Int J Low Extrem Wounds, 2012; 11: 244–253
- Wu Y, Chen L, Scott PG, et al. Mesenchymal stem cells enhance wound healing through differentiation and angiogenesis. Stem Cells, 2007; 25: 2648–2659
- Abdulrazak A, Bitar ZI, Al-Shamali AA, et al. Bacteriological study of diabetic foot infections. J Diabetes Complications, 2005; 19: 138–141
- James GA, Swogger E, Wolcott R, et al. Biofilms in chronic wounds. Wound Repair Regen, 2008; 16: 37–44
- Davis SC, Ricotti C, Cazzaniga A, et al. Microscopic and physiologic evidence for biofilmssociated wound colonization in vivo. Wound Repair Regen, 2008; 16: 23–29
- Kavros SJ, Miller JL, Hanna SW. Treatment of ischemic wounds with noncontact, low-frequency ultrasound: the Mayo Clinic experience, 2004–2006. Adv Skin Wound Care, 2007; 20: 221–226
- Kranke P, Bennett MH, Martyn-St James M, et al. Hyperbaric oxygen therapy for chronic wounds. Cochrane Database Syst Rev, 2012; 4: CD004123
- Rayman G, Rayman A, Baker NR, et al. Sustained silverreleasing dressing in the treatment of diabetic foot ulcers. Br J Nurs, 2005; 14: 109–114
- Fridman G, Friedman G, Gutsol A, Shekhter AB, Vasilets VN, Fridman A. Applied plasma medicine. Plasma Process Polym 2008; 5: 503–533
- Heinlin J, Isbary G, Stolz W, et al. Plasma applications in medi cine with a special focus on dermatology. J Eur Acad Dermatol Venereol, 2011; 25: 1–11
- Fridman G, Friedman G, Gutsol A, Shekhter AB, Vasilets VN, Fridman A. Applied plasma medicine. Plasma Process Polym 2008; 5: 503–533
- Fridman G, Friedman G, Gutsol A, Shekhter AB, Vasilets VN, Fridman A. Applied plasma medicine. Plasma Process Polym 2008; 5: 503–533
- Daeschlein G, von Woedtke T, Kindel E, Brandenburg R, Weltmann KD, Jünger M. Antibacterial activity of an atmospheric pres sure plasma jet against relevant wound pathogens in vitro on a simulated wound environment. Plasma Process Polym, 2010; 7: 224–230
- Daeschlein G, Scholz S, Arnold A, et al. In vitro susceptibility of important skin and wound pathogens against low temperature atmospheric pressure plasma jet (APPJ) and dielectric barrier discharge plasma (DBD). Plasma Process Polym, 2012; 9: 380–389
- Helmke A, Hoffmeister D, Berge F, et al. Physical and micro biological characterization of Staphylococcus epidermidis inacti vation by dielectric barrier discharge. Plasma Process Polym, 2011; 8: 278–286
- Helmke A, Hoffmeister D, Mertens N, Emmert S, Schuette J, Vioel W. The acidification of lipid film surfaces by non-thermal DBD at atmospheric pressure in air. New J Phys, 2009; 11: 115–125
- Kalghatgi SU, Fridman G, Fridman A, Friedman G, Clyne AM. Non-thermal dielectric barrier discharge plasma treatment of endothelial cells. Conf Proc IEEE Eng Med Biol Soc, 2008; 2: 3578–3581
- Brehmer F, Haenssle HA, Daeschlein G, Ahmed R, Pfeiffer S, Goerlitz A, Simon D, Schoen MP, Wandke D, Emmert D. Alleviation of chronic venous leg ulcers with a hand-held dielectric barrier discharge plasma generator (PlasmaDerm® VU-2010): results of a monocentric, twoarmed, open, prospective, randomized and controlled trial (NCT01415622). J Eur Acad Dermatol Venereol, 2015; 29 (1): 148–155
- Liu R, Li L, Yang M, et al. Systematic review of the effectiveness of hyperbaric oxygen therapy in the management of chronic diabetic foot ulcers. Mayo Clin Proc, 2013; 88: 166–175
- Fridman G, Friedman G, Gutsol A, Shekhter AB, Vasilets VN, Fridman A. Applied plasma medicine. Plasma Process Polym 2008; 5: 503–533
- Isbary G, Koeritzer J, Mitra A, et al. Ex vivo human skin experiments for the evaluation of safety of new cold atmospheric plasma devices. Clinical Plasma Medicine, 2013; 1: 36–44
- Emmert S, Brehmer F, Hänßle H, et al. Atmospheric pressure plasma in dermatology: ulcus treatment and much more. Clinical Plasma Medicine, 2013; 1: 24–29
- Marschewski M, Hirschberg J, Omairi T, et al. Electron spec troscopic analysis of the human lipid skin barrier: cold atmospheric plasmainduced changes in lipid composition. Exp Dermatol, 2012; 21: 921–925
- Steed DL, Donohoe D, Webster MW, Lindsley L. Effect of extensive debridement and treatment on the healing of diabetic foot ulcers. Diabetic Ulcer Study Group. J Am Coll Surg, 1996; 183: 61–64
- Braun LR, Fisk WA, Lev-Tov H, Kirsner RS, Isseroff RR. Diabetic foot ulcer: an evidence-based treatment update. Am J Clin Dermatol, 2014; 15: 267–281
- Steed DL, Donohoe D, Webster MW, Lindsley L. Effect of extensive debridement and treatment on the healing of diabetic foot ulcers. Diabetic Ulcer Study Group. J Am Coll Surg, 1996; 183: 61–64
- Braun LR, Fisk WA, Lev-Tov H, Kirsner RS, Isseroff RR. Diabetic foot ulcer: an evidence-based treatment update. Am J Clin Dermatol, 2014; 15: 267–281
- Morbach S, Müller E, Reike H et al. Diabetisches Fußsyndrom. Diabetologie, 2010; 5: S146–S154
- Kavros SJ, Miller JL, Hanna SW. Treatment of ischemic wounds with noncontact, low-frequency ultrasound: the Mayo Clinic experience, 2004–2006. Adv Skin Wound Care, 2007; 20: 221–226
- El-Tawdy AH, Ibrahim EA, Abdallah ES, Al Sakhawy EM, Morsy TA. Maggot Debridement Therapy (MDT): It Is Safe and Economic for Treating a Diabetic Foot Ulcer. J Egypt Soc Parasitol, 2016; 46: 223–234