Einleitung
Mit dem demografischen Wandel steigt die Anzahl der Patienten mit muskuloskelettalen Erkrankungen stetig. Für die Betroffenen bedeutet dies in der Regel einen Verlust an Lebensqualität. Sozioökonomisch sind zukünftig steigende Kosten für Prävention, Therapie und vor allem Rehabilitation zu erwarten. Vor diesem Hintergrund bedarf es verbesserter diagnostischer Verfahren sowie innovativer therapeutischer Maßnahmen, die die Bewegungsfähigkeit des Patienten schnell wiederherstellen und deren Evidenz eindeutig belegt werden kann.
Im Zusammenhang mit Bewegungsstörungen kann die Evidenz einer Intervention nur dann quantitativ nachgewiesen werden, wenn eine objektive Bewertung des Bewegungsvermögens des Patienten möglich ist 1. Dabei ist es wichtig, dass alltagsrelevante Bewegungen betrachtet werden. Die reine Betrachtung des Bewegungsumfangs oder die Analyse von Teilbewegungen wie sie oft bei isokinetischen Messungen erfolgt, führen häufig zu einer Fehlbeurteilung des tatsächlichen Bewegungsvermögens des Patienten. In der klinischen Praxis stützen sich Arzt und Therapeut neben der klinischen Untersuchung in erster Linie auf die visuelle Beobachtung der Bewegungen. Diese Vorgehensweise ist qualitativ und zudem durch den subjektiven Eindruck des Untersuchers geprägt. Semi-Objektivität kann durch klinische Scores und Fragebögen erreicht werden 2. Sie sind ein wesentlicher Schritt zum Nachweis von Evidenz in der Therapie, liefern jedoch selten objektive Informationen über das tatsächliche Bewegungsvermögen des individuellen Patienten. Eine objektive Analyse von Ursache, Umfang und Schwere der Bewegungseinschränkung verbessert jedoch nicht nur die diagnostischen Möglichkeiten – sie ist vielmehr die Voraussetzung für eine individuelle Anpassung der Therapiemaßnahmen, die Kontrolle des Therapieerfolges und den Nachweis von Evidenz bei Patienten mit Bewegungseinschränkungen.
Die Notwendigkeit, die Bewegungsfähigkeit eines Patienten in möglichst alltäglichen Situationen objektiv zu beurteilen, war die Motivation, Bewegungsanalysesysteme zu entwickeln 3. Heute sind weit fortgeschrittene Bewegungsanalysesysteme kommerziell erhältlich, die eine objektive Analyse der freien Körperbewegungen mit hoher zeitlicher und räumlicher Auflösung erlauben 4. Diese Systeme beruhen meistens auf einem Sender-Empfänger-Prinzip, wobei die Sender als „Marker“ bezeichnet werden. Die Bewegungsbahn jedes Markers im Raum kann dreidimensional (3D) rekonstruiert werden, wenn mindestens zwei Empfänger gleichzeitig den Marker sehen 5. Unter Zuhilfenahme sogenannter biomechanischer Modelle, die die 3D-Markerpositionen mit der individuellen Anatomie des Patienten verknüpfen, wird es möglich, die Bewegungen als Rotationen um die anatomischen Achsen der einzelnen Gelenke zu beschreiben 6 7. Hieraus ergibt sich die quantitative Bestimmung von Gelenkwinkeln, Gelenkwinkel geschwindigkeiten und Gelenkwinkelbeschleunigungen. Diese als „Kinematik“ bezeichnete Beschreibungsform wird häufig durch die Kinetik ergänzt, bei der über die Kinematik hinaus die auf die Gelenke wirkenden Kräfte und Momente mit einbezogen werden 8 9. Insbesondere in der klinischen Ganganalyse haben in den letzten Jahren 3D-Bewegungsanalyseverfahren zunehmend an Bedeutung gewonnen und sind heute klinisch weit verbreitet. Aber auch in der Beurteilung des Bewegungsvermögens der oberen Extremitäten gewinnen bewegungsanalytische Verfahren zunehmend an Bedeutung 10.
Neben der quantitativen Beschreibung der Bewegungsausführung mittels Kinematik und Kinetik muss jedoch gerade im pathologischen Kontext die muskuläre Komponente als eine wesentliche Ursache der Bewegung mit in die Betrachtung einbezogen werden. Hierbei erfolgt die Steuerung der ausgeführten Bewegung über das sogenannte muskuläre Koordinationsmuster, mit dem synergistische und antagonistische Muskeln oder Muskelgruppen durch das zen trale Nervensystem systematisch aktiviert werden. Auf diese Weise wird eine hohe Präzision der Bewegungsausführung erreicht 11. Ziel einer effektiven Bewegungsausführung ist eine möglichst genau ausgeführte, zielgerichtete Bewegung bei gleichzeitig geringem Energieverbrauch. Jegliche funktionellen Bewegungseinschränkungen führen zu Abweichungen im muskulären Koordinationsmuster; Veränderungen des muskulären Koordinationsmusters wiederum führen zu funktionellen Bewegungseinschränkungen. Ausgeführte Bewegung und muskuläre Koordination sind also nicht unabhängig voneinander zu betrachten, und die korrekte Interpretation einer Bewegungsausführung bedarf auch immer der Information über das zugrundeliegende muskuläre Koordinationsmuster. Umgekehrt ist aber auch eine Interpretation des muskulären Koordinationsmusters nicht möglich, wenn keine Information über die ausgeführte Bewegung vorliegt.
Oberflächen-Elektromyographie (sEMG) zur nichtinvasiven Erfassung des muskulären Koordinationsmusters
Die Erregung der Muskelfasern, die zu deren Kontraktion und letztlich zur Kraftentfaltung führt, wird vom zentralen Nervensystem durch Aktionspotenziale, die sich entlang der Muskelfasern ausbreiten, initiiert und gesteuert. Das mit dem Aktionspotenzial verbundene elektrische Feld breitet sich durch den Körper aus und ist auf der Hautoberfläche als elektrisches Signal abzuleiten 12. Dieses Signal wird als „Oberflächen-Elektromyographie-Signal“ (engl. „surface EMG“, sEMG) bezeichnet und stellt ein etabliertes Verfahren dar, die muskuläre Aktivierung eines Muskels nichtinvasiv zu untersuchen. Abgeleitet wird das sEMG mit Oberflächenelektroden von der Hautoberfläche, woraus sich eine geringe räumliche Auflösung ergibt 13. Das konventionelle sEMG spiegelt daher die globale Aktivität einzelner Muskeln oder Muskelgruppen wider, wobei die Amplitude des Signals mit der Anzahl der vom zentralen Nervensystem aktivierten Muskelfasern korreliert. Da jedoch die einzelnen Muskelfasern nicht nur unterschiedlich weit vom Ableitort entfernt liegen, sondern auch bei Erregung durch ein Aktionspotenzial unterschiedliche Kontraktionskräfte generieren, steigt die sEMG-Amplitude nicht linear mit der erzeugten Muskelkraft 14. Die Ableitung der sEMG- Signale erfolgt bipolar und mit einem relativ großen Elektrodenabstand. Meistens wird das Signal nach Erfassung gleichgerichtet und tiefpassgefiltert, sodass eine Hüllkurve („envelope“) gebildet wird, die dann den Grad der muskulären Aktivierung widerspiegelt. Ein internationaler Standard für die Ableitung von sEMG-Signalen ist für unterschiedliche Muskeln im sogenannten SENIAM-Protokoll festgelegt 15.
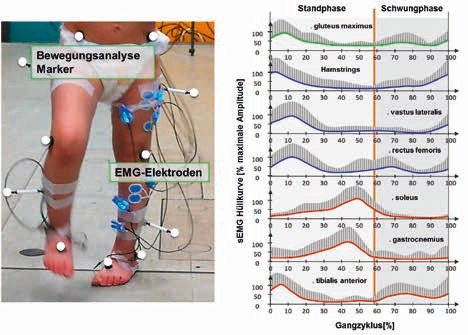
Da es sich beim sEMG um eine nichtinvasive Messmethode handelt, ist diese insbesondere für Untersuchungen des muskulären Koordinationsmusters während der Ausführung von Bewegungen gut geeignet. Zur Erfassung des muskulären Koordinationsmusters werden die sEMG-Signale von mehreren Muskeln oder Muskelgruppen mittels Oberflächen-Elektroden gleichzeitig abgeleitet und mit der mittels 3D-Bewegungsanalyse erfassten Bewegung synchronisiert 16. Auf diese Art und Weise kann jedem Bewegungsabschnitt eindeutig ein muskuläres Koordinationsmuster zugeordnet werden 1718. Abbildung 1 zeigt exemplarisch die Anordnung, wie sie zur Erfassung des muskulären Koordinationsmusters beim Gang genutzt wird. Neben der quantitativen Erfassung der individuellen Gangbewegung ergibt sich das muskuläre Koordinationsmuster aus den Beiträgen folgender Muskeln bzw. Muskelgruppen: Gluteus maximus, Hamstrings, Vastus lateralis, Rectus femoris, Soleus, Gastrocnemius und Tibialis anterior.
Besonderheiten bei der Bestimmung des muskulären Koordinationsmusters in dynamischen Situationen
Die meisten in der Literatur beschriebenen Untersuchungen der muskulären Aktivierung beziehen sich auf isometrische Kontraktionen. Hieraus leitet sich ein umfangreiches Wissen über die muskulären Aktivierungsstrategien des zentralen Nervensystems ab. Das Problem hierbei ist, dass Bewegungen sich durch ein Wechselspiel von konzentrischen und exzentrischen Kontraktionen verschiedener Muskeln zusammensetzen und die isometrische Kontraktion in unserem Alltag eher die Ausnahme darstellt. Ergebnisse aus isometrischen Messungen sind jedoch nicht unbedingt auf dynamische Situationen übertragbar. Hintergrund ist, dass eine Muskelfaser unter unterschiedlichen Randbedingungen bei gleicher Erregung unterschiedliche Kräfte generieren kann. So ist beispielsweise die Kontraktionskraft einer Muskelfaser von der Sarkomerlänge und damit vom Deutungsgrad des Muskels abhängig. Ebenso wurde beschrieben, dass die Kraft, die eine Muskelfaser bei exzentrischer Kontraktion generiert, höher ist als bei konzentrischer Kontraktion 19 und darüber hinaus stark von der Kontraktionsgeschwindigkeit abhängt. Da die sEMG-Amplitude die Anzahl der Muskelfasern widerspiegelt, die aktiviert werden müssen, um eine bestimmte Kraft zu erreichen, ist es nachvollziehbar, dass die sEMG-Amplitude von diesen biomechanischen Fak- toren abhängt 2021. Wird also das sEMG genutzt, um das muskuläre Koordinationsmuster während der Ausführung von Bewegungen zu analysieren, müssen Faktoren wie Kontraktionstyp, Bewegungsgeschwindigkeit oder Gelenkstellung bei der Interpretation des sEMG-Signals berücksichtigt werden.
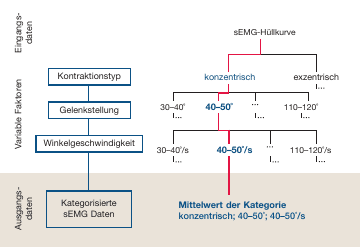
Vorteil einer synchronen Erfassung von muskulärer Aktivierung und Bewegung mittels 3D-Bewegungsanalyse ist, dass die variablen Faktoren Gelenkstellung, Winkelgeschwindigkeit und Kontraktionstyp direkt aus den kinematischen Bewegungsinformationen abgeleitet werden können. Hieraus ergibt sich der Ansatz der Kategorisierung, der es erlaubt, auch in dynamischen Situationen vergleichbare Bedingungen zu schaffen und somit zu einer korrekten Interpretation des sEMGs zu gelangen 22.
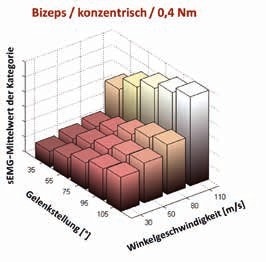
Bei der Kategorisierung werden Zeitabschnitte im sEMG-Signal identifiziert, bei denen gleiche biomechanische Randbedingungen vorliegen. Die Identifizierung der Zeitabschnitte richtet sich nach einem Entscheidungsbaum, mit dessen Hilfe einzelne sEMG-Datenpunkte bestimmten Kategorien zugeordnet werden (Abb. 2). Dafür müssen insbesondere Gelenkstellung und Bewegungsgeschwindigkeit in Intervalle eingeteilt werden, um eine hinreichend hohe Anzahl von sEMG- Datenpunkten in jeder Kategorie zu erhalten. Die Größe der einzelnen Intervalle kann je nach Bewegungsausführung unterschiedlich gewählt werden. Da in jeder Kategorie gleiche Randbedingungen gegeben sind, können die sEMG-Werte nach Bildung der Hüllkurve in jeder Kategorie gemittelt werden. Abbildung 3 zeigt das Ergebnis einer Kategorisierung des sEMG-Signals des M. biceps brachii bei einer Flexionsbewegung des Ellbogens mit unterschiedlicher Bewegungsgeschwindigkeit. Bei der Versuchsdurchführung wurde das externe Drehmoment konstant gehalten, sodass die Kontraktionskraft, die der Muskel aufbringen musste, über den gesamten Bewegungsraum konstant war 23.
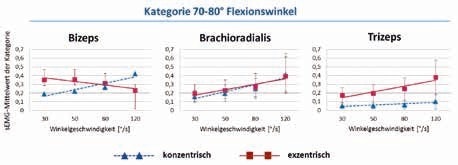
Da sich jede frei ausgeführte Bewegung aus einer Kombination von konzentrischen und exzentrischen Kontraktionen synergistischer und antagonistischer Muskeln zusammensetzt, stellt sich die Frage, ob die einzelnen Muskeln vom zentralen Nervensystem in Abhängigkeit vom Bewegungstyp unterschiedlich aktiviert werden. Abbildung 4 zeigt den Unterschied in der Aktivierung der Muskeln M. biceps brachii, M. brachioradialis und M. triceps brachii bei konzentrischer und exzentrischer Kontraktion exemplarisch für das Intervall 70° bis 80° Ellbogenflexion. Wie im Beispiel vorher wurde das Drehmoment im Ellbogengelenk über den gesamten Bewegungsraum konstant gehalten. Erwartungsgemäß steigt bei konzentrischer Kontraktion die sEMG-Amplitude bei allen drei Muskeln mit zunehmender Geschwindigkeit. Hintergrund ist, dass aufgrund der Geschwindigkeits-Kraft-Relation die Kraft, die von einer Muskelfaser erzeugt wird, mit zunehmender Geschwindigkeit abnimmt. Das zentrale Nervensystem muss daher mehr Muskelfasern aktivieren, um die vorgegebene Kraft zu erreichen. Bei exzentrischer Kontraktion ist aufgrund der Geschwindigkeits-Kraft-Relation das Gegenteil zu erwarten, da sich die Kontraktionskraft der einzelnen Faser mit zunehmender Geschwindigkeit erhöht. Während bei exzentrischer Kontraktion des M. biceps brachii der erwartete Abfall der sEMG-Amplitude bei steigender Bewegungsgeschwindigkeit festgestellt werden kann, tritt bei den Muskeln M. triceps brachii und M. brachioradialis ein Anstieg im sEMG mit zunehmender Bewegungsgeschwindigkeit auf. Diese Tatsache weist auf ein bei Ellbogenextension verändertes muskuläres Koordinationsmuster hin, in dem die beiden Antagonisten M. brachioradialis und M. triceps brachii vom zentralen Nervensystem co-aktiviert werden, um die Bewegung präziser steuern zu können 24.
Expertensysteme zur Unterstützung der Interpretation des muskulären Koordinationmusters
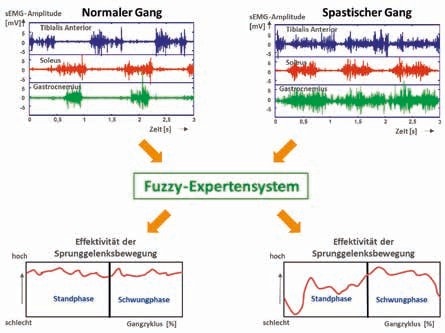
Informationen über Veränderungen im muskulären Koordinationsmuster sind nicht nur für die Bewertung des Bewegungsvermögens wichtig – sie bieten in Kombination mit Informationen über die Bewegungsausführung auch die Möglichkeit, Schlüsse auf kritische Belastungssituationen und deren Prävention zu ziehen. Jedoch ist die Interpretation des muskulären Koordinationsmusters häufig schwierig, insbesondere wenn mehrere Muskeln oder Muskelgruppen betrachtet werden, und besonders, wenn pathologische Veränderungen in der muskulären Koordination vorliegen. Hier können Expertensysteme, die den Untersucher in seiner Interpretation der Ergebnisse unterstützen, zukünftig eine wichtige Rolle spielen 25. Im Expertensystem ist die Information über die Bewegung und das physiologische muskuläre Koordinationsmuster verankert. Beispiele hierfür sind das Wissen über die bewegungsabhängige Aktivierung der Ellbogenflexoren und ‑extensoren, wie in den Abbildungen 3 und 4 dargestellt, oder das Wissen um die aktiven Phasen einzelner Muskeln im Gang (s. Abb. 1) 2627. Neben der Wissensbasis wird ein Algorithmus genutzt („Inferenzmaschine“), der einen Zusammenhang zwischen der Wissensbasis und den Eingangsgrößen (sEMG- Signale und Bewegungsinformation) herstellt und dieses zu einer einfach interpretierbaren Ausgangsgröße verknüpft. Als Inferenzmaschine wird in der Medizin häufig Fuzzylogik verwendet, da diese semantische und vor allem unscharfe Aussagen verarbeiten kann (Abb. 5).
Erstmalig sind solche auf Fuzzylogik basierenden Expertensysteme zur Unterstützung der Interpretation der muskulären Koordination der Unterschenkelmuskulatur während des Gangs eingesetzt worden 2829. Die unverarbeiteten sEMG-Signale von M. tibialis anterior, M. soleus und M. gas trocnemius wurden mit dem Wissen über die physiologische Aktivierung während des Gangs bei selbst gewählter Ganggeschwindigkeit so verknüpft, dass eine Aussage über die Effektivität der Sprunggelenksbewegung möglich wurde (s. Abb. 5). Bei einem physiologischen muskulären Koordinationsmuster ist die Effektivität der Sprunggelenksbewegung zu jedem Zeitpunkt im Gangzyklus hoch. Bei einer spastischen Veränderung der muskulären Koordination beispielsweise wird die Bewegung des Sprunggelenkes insbesondere zu Beginn der Standphase ineffektiv und erholt sich über die Standphase nur langsam. Die von dem Fuzzy-Expertensystem auf der Basis des muskulären Koordinationsmusters der Unterschenkelmuskulatur vorhergesagte Effektivität der Sprunggelenksbewegung stimmt zu 80 % mit der klinischen Beurteilung der Gehfähigkeit bei Kindern mit Infantiler Zerebralparese überein 30. Besonders hervorzuheben ist aber, dass es durch das Expertensystem gelungen ist, von den muskulären Koordinationsmustern und deren pathologischen Veränderungen auf die resultierende Bewegungsausführung zu schließen.
Schlussfolgerungen
Muskuläre Koordination und Bewegungsausführung sind eng aufeinander abgestimmt. Dies betrifft nicht nur physiologische Situationen, sondern insbesondere auch Pathologien. Die korrekte Interpretation einer Bewegungsausführung bedarf daher immer der Information über die zugrundeliegende muskuläre Aktivierung. Andererseits bedarf die korrekte Analyse der muskulären Aktivierung immer der Information über die Bewegungsausführung. Oberflächen-EMG (sEMG) und 3D-Bewegungsanalyse sind geeignete Verfahren, um quantitative Informationen über die Bewegungsausführung zeitlich synchron zur muskulären Aktivierung zu erlangen. Damit sind die technischen Voraussetzungen gegeben, die menschliche Bewegung umfassend zu analysieren. Wegen der hohen Datenmengen und aufgrund der Vielzahl an unterschiedlichen Variablen ist die Interpretation der Ergebnisse aber oft schwierig und führt häufig zu falschen Aussagen. In dynamischen Situationen ist es daher unbedingt erforderlich, vergleichbare Randbedingungen zu schaffen. Will man nicht die Bewegung einschränken, hilft hier der Ansatz der Kategorisierung der sEMG-Signale. Darüber hinaus können Expertensysteme die Interpretation unterstützen, indem sie das Wissen über die physiologische Bewegungsausführung und das zugrundeliegende muskuläre Koordinationsmuster verknüpfen und in einfach interpretierbare Größen überführen.
Die Autorin:
Univ.-Prof. Dr. rer. nat. Catherine Disselhorst-Klug
Lehr- und Forschungsgebiet Rehabilitations- & Präventionstechnik,
RWTH Aachen University
Pauwelsstraße 20
52074 Aachen
disselhorst-klug@ame.rwth-aachen.de
Begutachteter Beitrag/reviewed paper
Disselhorst-Klug C. Die Rolle der sEMG-Messung in der Bewegungsanalyse. Orthopädie Technik. 2017; 68 (12): 30–34.
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- iOrt – Entwicklung einer überwachenden Orthese mit neuartigem optischen Sensorsystem — 11. Februar 2026
- Winter DA. Concerning the scientific basis for the diagnosis of pathological gait and for rehabilitation protocols. Physiotherapy Canada, 1985, 37: 245–252
- Fuchs S, Friedrich M. Beeinflussungsmöglichkeiten von Kniegelenkscores. Unfallchirurg, 2000; 103: 44–50
- Whittle MW. Musculoskeletal applications of three-dimensional analysis. In: Allard P, Stokes AF, Blanchi J‑P (eds.). Three-dimensional analysis of human movement. Selected papers from an invited symposium on three-dimensional analysis held in Montreal in July, 1991. Champaign, Illinois: Human Kinetics, 1995: 295–309
- Rau G, Disselhorst-Klug C, Schmidt R. Movement biomechanics goes upwards: from the leg to the arm. J Biomech, 2000; 33 (10): 1207–1216
- Disselhorst-Klug C, Besdo S, Oehler S. Biomechanik des muskuloskelettalen Systems. In: Kraft M, Disselhorst-Klug C. Biomedizinische Technik – Rehabilitationstechnik. Berlin: De Gruyter, 2015: 53–105
- Rau G, Disselhorst-Klug C, Schmidt R. Movement biomechanics goes upwards: from the leg to the arm. J Biomech, 2000; 33 (10): 1207–1216
- Disselhorst-Klug C, Besdo S, Oehler S. Biomechanik des muskuloskelettalen Systems. In: Kraft M, Disselhorst-Klug C. Biomedizinische Technik – Rehabilitationstechnik. Berlin: De Gruyter, 2015: 53–105
- Rau G, Disselhorst-Klug C, Schmidt R. Movement biomechanics goes upwards: from the leg to the arm. J Biomech, 2000; 33 (10): 1207–1216
- Disselhorst-Klug C, Besdo S, Oehler S. Biomechanik des muskuloskelettalen Systems. In: Kraft M, Disselhorst-Klug C. Biomedizinische Technik – Rehabilitationstechnik. Berlin: De Gruyter, 2015: 53–105
- Kleiber T, Popovic N, Bahm J, Disselhorst-Klug C. A modeling approach to compute modification of net joint forces caused by coping movements in obstetric brachial plexus palsy. Journal of Brachial Plexus and Periphal Nerve Injury, 2013; 8: 10
- von Werder SC, Disselhorst-Klug C. The role of biceps brachii and brachioradialis for the control of elbow flexion and extension movements. Journal of Electromyography and Kinesiology, 2016; 28: 67–75
- Basmajian JV, De Luca CJ. Muscles alive: their functions revealed by electromyography. 5th edition. Baltimore: Williams & Wilkins, 1985
- Basmajian JV, De Luca CJ. Muscles alive: their functions revealed by electromyography. 5th edition. Baltimore: Williams & Wilkins, 1985
- Disselhorst-Klug C, Schmitz-Rode T, Rau G. Surface electromyography and muscle force: limits in sEMG-force relationship and new approaches for applications. Clin Biomech (Bristol, Avon), 2009; 24 (3): 225–235
- Hermens H, Freriks B, Disselhorst-Klug C, Rau G. Development of recommendations for sensors and sensor placement procedures. Journal of Electromyography and Kinesiology, 2000; 10 (5): 361–374
- Disselhorst-Klug C, Besdo S, Oehler S. Biomechanik des muskuloskelettalen Systems. In: Kraft M, Disselhorst-Klug C. Biomedizinische Technik – Rehabilitationstechnik. Berlin: De Gruyter, 2015: 53–105
- Winter DA. Concerning the scientific basis for the diagnosis of pathological gait and for rehabilitation protocols. Physiotherapy Canada, 1985, 37: 245–252
- Perry J. Gait Analysis, Normal and Pathological Function. New York: Slack, 1992
- Herzog W. The role of titin in eccentric muscle contraction. J Exp Biol, 2014; 217 (16): 2825–2833
- De Luca CJ. The use of surface electromyography in biomechanics. J Appl Biomechanics, 1997; 13 (2): 135–163
- von Werder S, Kleiber T, Disselhorst-Klug C. A method for a categorized and probabilistic analysis of the surface electromygram in dynamic contractions. Frontiers in Physiology, 2015; 6: 30
- von Werder S, Kleiber T, Disselhorst-Klug C. A method for a categorized and probabilistic analysis of the surface electromygram in dynamic contractions. Frontiers in Physiology, 2015; 6: 30
- Kleiber T, Popovic N, Bahm J, Disselhorst-Klug C. A modeling approach to compute modification of net joint forces caused by coping movements in obstetric brachial plexus palsy. Journal of Brachial Plexus and Periphal Nerve Injury, 2013; 8: 10
- von Werder SC, Disselhorst-Klug C. The role of biceps brachii and brachioradialis for the control of elbow flexion and extension movements. Journal of Electromyography and Kinesiology, 2016; 28: 67–75
- Basmajian JV, De Luca CJ. Muscles alive: their functions revealed by electromyography. 5th edition. Baltimore: Williams & Wilkins, 1985
- Disselhorst-Klug C, Schulte E, Rau G. Assessment of the muscular co-ordination pattern using fuzzy-logic. Gait Posture, 2003; 14 (Suppl. 2): 167–169
- Schmidt-Rohlfing B, Bergamo F, Williams S, Erli H, Rau D, Niethard FU, Disselhorst-Klug C. Interpretation of Surface EMGs in Children with Cerebral Palsy: An Initial Study Using a Fuzzy Expert System. J Orthop Res, 2006; 24 (3): 438–447
- Disselhorst-Klug C, Schulte E, Rau G. Assessment of the muscular co-ordination pattern using fuzzy-logic. Gait Posture, 2003; 14 (Suppl. 2): 167–169
- Schmidt-Rohlfing B, Bergamo F, Williams S, Erli H, Rau D, Niethard FU, Disselhorst-Klug C. Interpretation of Surface EMGs in Children with Cerebral Palsy: An Initial Study Using a Fuzzy Expert System. J Orthop Res, 2006; 24 (3): 438–447
- Schmidt-Rohlfing B, Bergamo F, Williams S, Erli H, Rau D, Niethard FU, Disselhorst-Klug C. Interpretation of Surface EMGs in Children with Cerebral Palsy: An Initial Study Using a Fuzzy Expert System. J Orthop Res, 2006; 24 (3): 438–447