Das Krankheitsbild Spina bifida
Unter dem Begriff „Spina bifida“ versteht man eine Neuralrohrfehlbildung in unterschiedlicher Ausprägung. Zwischen dem 21. und dem 28. Tag der Embryonalentwicklung differenziert sich das Neuralrohr. Bleibt diese Differenzierung aus oder ruptiert das geschlossene Neuralrohr, bildet sich eine Spina bifida (geteilte Wirbelsäule). In 75 % aller Fälle ist die lumbosakrale Region betroffen. Durch den Austritt von Nervenbahnen treten in der betroffenen Region Muskellähmungen, Sensibilitätsverlust und Störungen der Blasen-Darm-Funktion auf 1 2.
Formen der Spina bifida
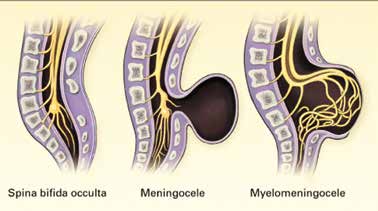
Die Spina bifida kann unterschiedlich stark ausgeprägt sein. Unterschieden werden Spina bifida occulta und Spina bifida aperta, die nochmals in Myelocele und Meningomyelocele differenziert wird (Abb. 1). Die Spina bifida occulta ist der mildeste Ausprägungsgrad der Krankheit, bei der lediglich ein Wirbelbogenschluss ausbleibt. Äußerlich kann an der betroffenen Stelle häufig vermehrtes Haarwachstum festgestellt werden. Meist wird die okkulte Form nur durch einen radiologischen Zufallsbefund erkannt und bleibt oft ein Leben lang ohne Symptome.
Bei der Spina bifida aperta sind neben dem Ausbleiben des Wirbelbogenschlusses auch die Rückenmarkshäute und das Rückenmark in die Spaltbildung mit einbezogen. Von einer Meningocele spricht man, wenn sich durch das Wirbelloch eine von außen sichtbare Zyste am Rücken bildet. Die Rückenmarkshäute wölben sich hierbei durch den Wirbelbogenspalt unter der Haut hervor. Das Rückenmark bleibt in seiner physiologischen Lage. Diese Ausprägung findet man in 6 bis 10 % der Fälle. Von einer Meningomyelocele spricht man, wenn neben den Rückenmarkshäuten auch das Rückenmark selbst durch das Loch im Wirbelbogen in die Zyste austritt. Dies ist die schwerste Form der Spina bifida aperta und mit einer Inzidenz von ca. 90 % auch die häufigste 3 4 5.
Symptome
Die Symptome der Spina bifida sind sehr unterschiedlich. Sie hängen mit der Läsionshöhe und der Schwere der Ausprägung zusammen. Da bei der Spina bifida occulta das Rückenmark nicht beteiligt ist, treten hier meist keine Symptome auf. Bei der Spina bifida aperta können die resultierenden Einschränkungen stark variieren: Von einer leicht eingeschränkten Gehfähigkeit bis hin zur Querschnittlähmung mit gestörter Magen- und Darmfunktion sowie dem Verlust der Gefühls- und Schmerzempfindung kann hier alles vertreten sein. Infolge muskulärer Ungleichgewichte kann es zu Fehlstellungen von Gelenken und Extremitäten kommen. Bei einer Einschränkung der Blasenfunktion kommt es häufig zu Infekten der Harnwege und Entleerungsstörungen. So kann es sein, dass die Betroffenen an Inkontinenz leiden oder keinen Urin ablassen können. Der schwere Verlauf der Spina bifida kann mit der Chiari-Fehlbildung einhergehen. Hierbei führt die Aussackung des Rückenmarks dazu, dass das Kleinhirn und die Verbindung zwischen Gehirn und Rückenmark durch das Hinterhauptsloch nach unten in Richtung Wirbelkanal gezogen sind, wodurch die Zirkulation der Hirn- und Rückenmarksflüssigkeit gestört wird. Darum kann die Spina bifida zusammen mit einem Hydrocephalus (Wasserkopf) auftreten, der sich durch den gestörten Rückstrom des Liquors zum Rückenmark ausbildet. Folgen sind hierbei beispielsweise Lernstörungen und epileptische Anfälle 6 7.
Tethered Cord
Beim Tethered Cord ist das Rückenmark gehindert, in der Wachstumsphase im Rückenmarkskanal nach oben zu wandern. Bei Spina-bifida-Patienten liegt es nahezu regelmäßig durch Vernarbung als Folge der operativen Erstversorgung nach der Geburt vor. Durch eine Zugbelastung des im Wirbelkanal nicht mehr frei beweglichen Rückenmarks entstehen bei fortschreitendem Wachstum zusätzliche Schäden am Nervengewebe. Die Symptome reichen von der Verschlechterung der sensiblen oder motorischen Querschnittsituation über eine Verschlimmerung von Fuß- oder Wirbelsäulenfehlstellungen bis hin zu auftretenden Spastiken, Schmerzen und Änderungen der Blasen- und Mastdarmfunktion 8.
Therapie
Je nach Art und Umfang der Wirbelsäulenfehlbildung muss die Therapie individuell gestaltet werden. Die okkulte Form der Spina bifida bedarf oft gar keiner Therapie, da hier keine Ausfallerscheinungen bzw. Auswirkungen vorhanden sind. Bei der Spina bifida aperta ist eine Operation innerhalb von 48 Stunden nach der Geburt dringend erforderlich, da sich sonst eine Meningitis ausbilden kann. Dies führt häufig zum Tode des Neugeborenen. Bei Ausbildung eines Hydrocephalus ist es notwendig, einen Shunt zu legen, der die Hirnflüssigkeit in die Bauchhöhle (Peritoneum) ableitet. Bei Gelenkdeformitäten werden Operationen, Physiotherapie und orthopädische Hilfsmittel angewendet 9 10.
Patientenvorstellung
Der vorgestellte Patient ist 16 Jahre alt. Er wurde mit Spina bifida in Form einer Myelomeningocele auf Höhe TH12/L1 geboren. Resultierende Erkrankungen sind eine Arnold-Chiari-Malformation sowie ein Hydrocephalus, der mit einem Shunt versorgt wurde.
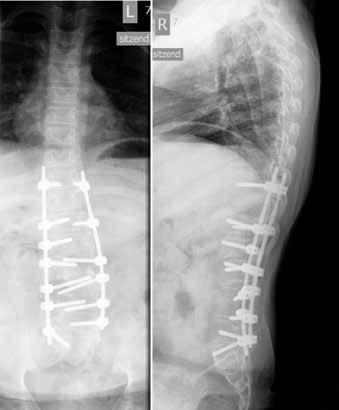
Im Alter von zwei Jahren kam es zu einem Tethered Cord. Die Wirbelsäule wurde im Alter von vier Jahren aufgrund einer thorakalen Gibbusdeformität nach Kyphektomie und Revision nach Stabbruch bis auf Höhe TH10 versteift (Abb. 2). Des Weiteren liegt eine neurogene Blasen- und Darmentleerungsstörung vor. Aufgrund von Shunt-Fehlfunktionen kam es immer wieder zu starken Kopfschmerzen und Gleichgewichtsstörungen. Vertikalisierende Orthesenversorgungen konnten in diesem Zeitraum kaum genutzt werden. Nach zwei vollständigen Shuntrevisionen konnten die Symptome behoben werden, sodass eine Neuversorgung mit einer Orthese wieder möglich war.
Bei der Zustandserhebung des Patienten musste festgestellt werden, dass die Muskeleigenreflexe der Beine durchgehend erloschen sind. Es liegt eine Paraplegie beider Beine vor. Auch die Sensibilität ist beidseits stark eingeschränkt; ab der Mitte des Oberschenkels ist sie nach distal komplett ausgefallen. Gelenkbeweglichkeiten sind mit Ausnahme von OSG und rechtem Kniegelenk in uneingeschränktem Rahmen vorhanden. Die Extension des rechten Knies ist aufgrund einer Kniebeugekontraktur von 10° nicht komplett möglich. Der Bewegungsumfang wurde mit 0/10/130 beziffert. Die Bewegungsumfänge der oberen Sprunggelenke wurden beidseits mit 5/0/15 beziffert. Auffallend ist allerdings eine stark nach außen rotierte Gelenkachse beider Sprunggelenke.
Der Patient wurde nach GMFCS in die Stufe IV eingeteilt, die wie folgt definiert ist: „Die Jugendlichen benutzen in den meisten Situationen einen Aktivrollstuhl. Sie benötigen Sitzadaptionen für Becken- und Rumpfkontrolle. Physische Unterstützung von einer oder zwei Personen wird für Transfers benötigt. Innerhalb des Hauses können die Jugendlichen unter Umständen mit physischer Unterstützung eine kurze Strecke gehen, einen Rollstuhl benutzen oder eine Becken-Rumpf unterstützende Gehhilfe benutzen, wenn sie hingestellt werden. Jugendliche können selbstständig einen E‑Rollstuhl benutzen. Wenn ein E‑Rollstuhl nicht sinnvoll oder vorhanden ist, werden die Jugendlichen in einem Aktiv-Rollstuhl gefahren. Die Einschränkungen in der Mobilität machen Anpassungen nötig, um an körperlichen Aktivitäten oder Sport teilzunehmen, einschließlich physischer Unterstützung und/ oder Powered mobility“ 11.
Hilfsmittelnutzung und Therapieziel
Der Patient nutzt die Orthese als Therapiehilfsmittel. Therapieziel ist das Ermöglichen der Vertikalisierung, um die Ausbildung der Organe, das Wachstum und den Körperkreislauf positiv zu beeinflussen. Die orthetische Versorgung muss die gelähmte Muskulatur kompensieren, die strukturelle Beinlängendifferenz aufgrund von Skoliose und eingeschränkten Gelenkbeweglichkeiten ausgleichen und Fehlstellungen der Gelenke soweit möglich korrigieren. Aufgrund des hohen Lähmungsniveaus ist es dem Patienten nicht möglich, das Becken aktiv anzuheben, um so einen Schritt auszuführen.
Fertigung
Um die fehlende Aktivität der Hüftgelenkmuskulatur zu kompensieren, wurden zweiachsige Hüftgelenke eingebaut, die über eine Beckenwippe reziprok geführt werden. Das statische Orthesensystem verhindert im Stehen das Einbeugen des Hüftgelenks bzw. das Vorkippen des Oberkörpers und ermöglicht so das Stehen. Durch Aufrichten des Oberkörpers und entsprechende Gewichtsverlagerung unter Zuhilfenahme eines Rollators ist es dem Patienten möglich, Schritte auszuführen. Hier erlaubt das Orthesengelenk durch seine schräg gelagerte Laufachse den sogenannten Zirkelgang, d. h. die Innenrotation des Hüftgelenks in Schrittrücklage sowie die Außenrotation in Schrittvorlage. Der Rumpf bleibt in Fortbewegungsrichtung ausgerichtet. Das Sitzen wird ebenfalls durch die Orthesenversorgung unterstützt.
Das Orthesenhüftgelenk kann per Knopfdruck aus der reziproken Einheit gelöst werden und erlaubt nun über die zweite Achse das Einbeugen. Die Knie- und Knöchelgelenke wurden unilateral eingebaut, um Gewicht einzusparen und einen filigranen Aufbau der Orthese zu erreichen. Als Kniegelenk wurde ein sperrbares Kniegelenk mit Fallschloss eingebaut. Dieses verhindert im Stehen das ungewollte Einbeugen des Kniegelenks und kann zum Sitzen vom Patienten entriegelt werden.
Die Orthesenknöchelgelenke wurden gesperrt eingebaut, da die pathologisch veränderten Knöchelgelenkachsen des Patienten eine Inkongruenz zum Orthesengelenk aufweisen und dadurch Schäden am Gelenk verursacht werden könnten. Die Beinlängendifferenz beträgt 20 mm. Um diese auszugleichen, wurde der rechte Fuß in 10° Plantarflexion aufgebaut. Die Sperrung der Knöchelgelenke erzeugt außerdem einen wirksamen Vor- und Rückfußhebel, die in Verbindung mit der starr gestalteten Sohle für das Laufen mit der Orthese unabdingbar sind.
Orthesendesign
Beim Bau der reziproken Gehorthese ist neben der korrekten Passform eine hohe Steifigkeit der Gesamtkonstruktion von höchster Priorität. Wird diese nicht erreicht, ist es dem Patienten unmöglich, einen Schritt auszuführen, da der Körperschwerpunkt bei einem labilen Rahmenaufbau im Einbeinstand aufgrund einer ungewollten Adduktion des Standbeines außerhalb der Unterstützungsfläche gerät und so das Gleichgewicht nicht zu halten ist. Hierzu wurden die Systemschienen der Orthesengelenke zueinander überlappend angerichtet und mit in Kraftrichtung ausgerichtetem Carbonfaserverbund ummantelt.
Gleichzeitig war das Ziel der Versorgung, eine zirkuläre Fassung der Beine und des Rumpfes unter Berücksichtigung großer Anlageflächen zu erreichen, um die Blutzirkulation nicht einzuschränken und das Sicherheitsgefühl des Patienten zu erhöhen. Der stabile Rahmen wurde hierzu mit einer flexiblen Harzmischung übergossen. Die Orthese wurde frontal geöffnet, um das Anziehen der Orthese zu ermöglichen. Der Beckenkorb wurde mit einer starren Sitzkante konstruiert, damit der Patient sicher sitzen kann, ohne sich seitlich mit den Händen abzustützen zu müssen (Abb. 3).
Versorgungsergebnis
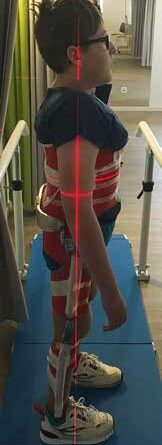
Die Versorgung wird vom Patienten gut toleriert. Die Tragedauer beträgt laut Patient im Schnitt 2 Stunden täglich. Die Orthese ist mit einem Gewicht von 7 Kilogramm zwar vergleichsweise schwer; dies verspürt der Patient allerdings nur wenig. Betrachtet man zudem den therapeutischen Nutzen der Orthese, so rechtfertigt dieser die Versorgung zweifellos: Erst die Orthese ermöglicht das freie Stehen ohne weitere Hilfsmittel und das Gehen mit Rollator (Abb. 4).
Fazit
Die reziproke Gehorthese wird gut in den Alltag integriert. Das Versorgungsziel der regelmäßigen Vertikalisierung und das Ermöglichen von selbstständigem Gehen und Stehen konnte zufriedenstellend erreicht werden. Für den gesunden Menschen scheinbare Kleinigkeiten wie die Teilnahme am Tischfußball mit Freunden oder die Entnahme eines Buches aus dem Bücherregal wurde für den Patienten durch die Orthesenversorgung erstmals realisiert und mit großer Dankbarkeit aufgenommen. Auf einen Rollstuhl kann im Alltag allerdings nicht verzichtet werden, da er zur schnellen Fortbewegung unerlässlich ist. Das Laufen mit Orthese ist mühsam und erfordert viel Konzentration. Sie kann also nur als Therapiehilfsmittel angesehen werden, das stundenweise getragen wird.
Der Autor:
Johannes Ehmer
F. Gottinger Orthopädietechnik GmbH
Höhenbergstraße 55
83229 Aschau im Chiemgau
johannes.ehmer@gottinger.de
Begutachteter Beitrag/reviewed paper
Ehmer J. Die reziproke Gehorthese (RGO) als Versorgungsoption bei Spina bifida. Orthopädie Technik, 2018; 69 (6): 42–45
- Easypreg – ein Faserverbundwerkstoff zum Tiefziehen — 9. März 2026
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Arbeitsgemeinschaft Spina Bifida und Hydrocephalus e. V. (ASBH) (Hrsg.). Mobilität (ASBH-Ratgeber, Band 10). Dortmund: ASBH e. V., 2003
- Biedermann R. Orthopädisches Management der Spina bifida. Orthopäde, 2014; 43 (7): 603–610
- Arbeitsgemeinschaft Spina Bifida und Hydrocephalus e. V. (ASBH) (Hrsg.). Mobilität (ASBH-Ratgeber, Band 10). Dortmund: ASBH e. V., 2003
- Biedermann R. Orthopädisches Management der Spina bifida. Orthopäde, 2014; 43 (7): 603–610
- Kindernetzwerk e. V. (Hrsg.). Krankheitsübersicht Spina bifida. Aschaffenburg: Kindernetzwerk e. V. https://www.kindernetzwerk.de/images/Krankheitsuebersichten/Krankheitsuebersichten-spina-bifida.pdf (Zugriff am 07.05.2018)
- Arbeitsgemeinschaft Spina Bifida und Hydrocephalus e. V. (ASBH) (Hrsg.). Mobilität (ASBH-Ratgeber, Band 10). Dortmund: ASBH e. V., 2003
- Biedermann R. Orthopädisches Management der Spina bifida. Orthopäde, 2014; 43 (7): 603–610
- Arbeitsgemeinschaft Spina Bifida und Hydrocephalus e. V. (ASBH) (Hrsg.). Tethered cord. Dortmund: ASBH e. V., 2009. https://asbh.de/download/spina_bifida/Tethered%20Cord.pdf (Zugriff am 07.05.2018)
- Arbeitsgemeinschaft Spina Bifida und Hydrocephalus e. V. (ASBH) (Hrsg.). Tethered cord. Dortmund: ASBH e. V., 2009. https://asbh.de/download/spina_bifida/Tethered%20Cord.pdf (Zugriff am 07.05.2018)
- Palisano R, Rosenbaum P, Walter S, Russell D, Wood E, Galuppi B. Development and reliability of a system to classify gross motor function in children with cerebral palsy. Dev Med Child Neurol, 1997; 39: 214–223
- Palisano R, Rosenbaum P, Walter S, Russell D, Wood E, Galuppi B. Development and reliability of a system to classify gross motor function in children with cerebral palsy. Dev Med Child Neurol, 1997; 39: 214–223