Einleitung
Als die Erstbeschreiber des Lipödems im Jahr 1940 versuchten, die Pathophysiologie dieser Erkrankung zu erläutern, erwarteten sie vermutlich nicht, dass sich viele Jahrzehnte später ein Großteil der Therapie auf die zweite Worthälfte – auf das Ödem und seine Beseitigung – konzentrieren würde. Dabei hatten E. V. Allen und E. H. Hines in der Literatur explizit die Entstehung eines orthostatischen Ödems beschrieben, das in einigen Fällen in Zusammenhang mit einer beschriebenen disproportionalen Fettgewebevermehrung bei Frauen aufgefallen war. Auch in ihrer zweiten Publikation im Jahr 1951, für die die beiden Forscher 119 Patientinnen mit Lipödem untersucht und die Ergebnisse ausgewertet hatten, wurde ein orthostatisches Ödem im Tagesverlauf nur bei etwa einem Viertel der Patientinnen festgestellt. Dieses Ergebnis erschien den beiden Erstuntersuchern aber klinisch als nicht so bedeutsam, dass es die Schwellung oder die Beschwerden bei den Frauen hätte erklären können 1. Vielmehr finden sich in den ersten Ergebnissen deutliche Hinweise auf bedeutsame psychische Aspekte der Erkrankung, auf die abgehoben wurde („associated neurosis“; assoziierte Neurose). Symptome wie eingeschränkte Selbstakzeptanz, veränderte Schmerzwahrnehmung und depressive Reaktionen stellen somit schon bei den Erstveröffentlichungen zum Lipödem auch eine psychologische Therapienotwendigkeit in den Vordergrund.
„Dicke Beine“ bei ansonsten gesunden Frauen wurden in den 80er Jahren nach langer wissenschaftlicher Ruhezeit in der Gynäkologie wiederentdeckt und von Schmitz 2 beschrieben. Auch in dieser Phase lag der Fokus auf der Störung der Fettgewebeverteilung in der Subkutis und nicht auf einer interstitiellen Flüssigkeitsvermehrung. Vielmehr beschrieb Brunner 3, dass eine „Dellbarkeit der Schwellung“ über dem Schienbein wie bei einem Lymphödem nicht bestand, und beschrieb stattdessen einen „sulzigen Fettmantel“ der Beine. Dieser Begriff wurde von Gregl aufgenommen, der die Schwellung als „mukoides Pseudödem“ beschrieb 4.
Therapiekonzepte im Wandel
Im Rahmen der gewachsenen Erfahrungen in der Lymphologie war es naheliegend, Ödeme mittels Komplexer oder Kombinierter Physikalischer Entstauung (KPE) zu behandeln. Das bei lymphostatischen, fibrosierenden Ödemen gut funktionierende Therapiekonzept versprach auch eine Besserung oder sogar Beseitigung „nicht-dellbarer“ Beinschwellungen des Lipödems. Kompression, Hautpflege und Bewegungstherapie wurden durch die Manuelle Lymphdrainage (MLD) komplettiert. Diese Therapie wurde beim Lipödem standardmäßig und intensiv empfohlen und konsequent angewendet. So findet sich in der Leitlinie aus dem Jahr 2015 5 eine Empfehlung zur langfristigen Anwendung der MLD beim Lipödem. Dies wurde von der Kassenärztlichen Bundesvereinigung auch gesundheitspolitisch befürwortet – im Sinne einer Langzeitverordnungsfähigkeit wie beim Lymphödem des Stadiums II 6. Letztlich galt die Langzeitverordnungsfähigkeit für einige Kostenträger sogar als Conditiosine qua non zur Erlangung einer Kostenübernahme bei Liposuktion im Stadium III des Lipödems.
In Bezug auf diese notwendige Ödembeseitigung entwickelt sich aber spätestens seit 2016 im Hinblick auf die notwendige Entstauung ein Paradigmenwechsel: Es finden sich zunehmend Hinweise, dass eine MLD bei der Behandlung des Lipödems mit nur geringem oder gar keinem Effekt verbunden ist. Selbst Patientinnen mit orthostatischer Ödemkomponente sprächen auf eine MLD hinsichtlich einer Entstauung gar nicht an 7. In den „Best practice guidelines for the management of lipoedema“ findet sich zuletzt der Begriff „Lipödem“ nur noch beschrieben als „fat swelling“ 8. Somit erscheint es notwendig, das Krankheitsbild „Lipödem“ aus gegenwärtiger Sicht und unter wissenschaftlichen, möglichst evidenzbasierten Kriterien neu zu beurteilen und geeignetere Therapiestrategien dafür zu entwickeln.
Das Lipödem
Das Lipödem ist eine chronische, unheilbare Erkrankung, die schwere Auswirkungen auf die Lebensqualität der Betroffenen hat und die deren physisches und psychisches Wohlbefinden nachhaltig beeinträchtigt. Symptome und klinische Kriterien für die Diagnosestellung sind:
- seitengleiche disproportionale Fettgewebevermehrung der Extremitäten;
- Hände und Füße sind von der Fettgewebevermehrung nicht betroffen, so bilden sich entsprechende sogenannte Cuffs an Knöcheln und Handgelenken;
- Hinweise auf eine chronische lymphostatische Fibrosierung mit positivem Stemmer-Hautfaltenzeichen fehlen;
- Schwere‑, Druck‑, Spannungs- und Berstungsgefühl der betroffenen Extremitäten;
- Druck- und Berührungsschmerzhaftigkeit der Haut in den betroffenen Arealen;
- übermäßige Hämatomneigung bei oft unbemerkten Bagatelltraumata;
- Beschwerdezunahme im Tagesverlauf;
- abnormes Gangbild und eingeschränkte Mobilität, schwache Muskulatur;
- nichtproportionale Umfangsminderung der betroffenen Extremitäten bei Gewichtsreduktion;
- Ausbildung von Teleangiektasien in den betroffenen Hautarealen;
- Hypothermie der Haut in Teilen der Fettgewebevermehrung;
- bei Ödem verstrichene Retromalleolargruben.
Eine Klassifikation des Erscheinungsbilds kann bei Bedarf anhand der betroffenen Extremitäten (Typ I–V) und der Art der Fettgewebevermehrung („columnar“ und „lobar“) erfolgen 9 10. Die „Schweregradeinteilung“ orientiert sich lediglich an morphologischen, nicht aber an klinischen Parametern 11 12 13:
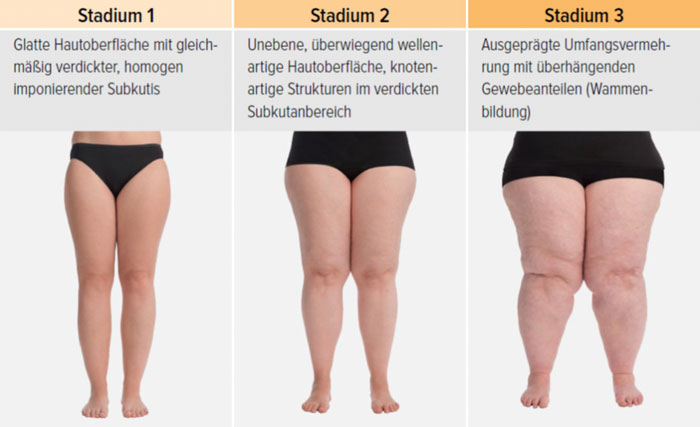
- Stadium I: Hautoberfläche glatt, kleine Knötchen in der verdickten Unterhaut
- Stadium II: Hautoberfläche wellig, walnuss- bis apfelgroße Knoten, Orangenhaut
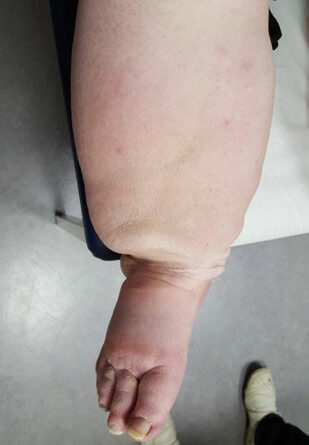
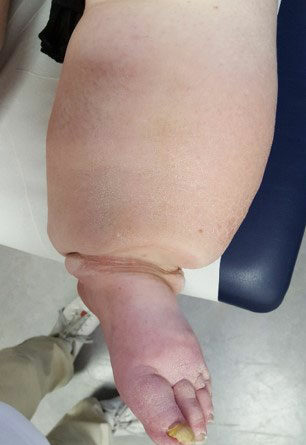
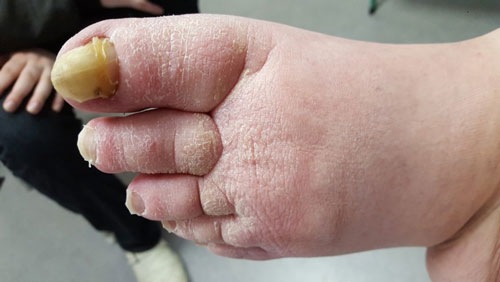
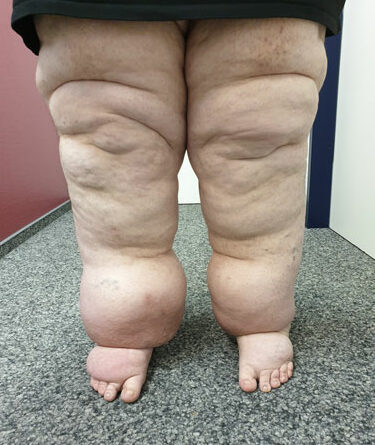
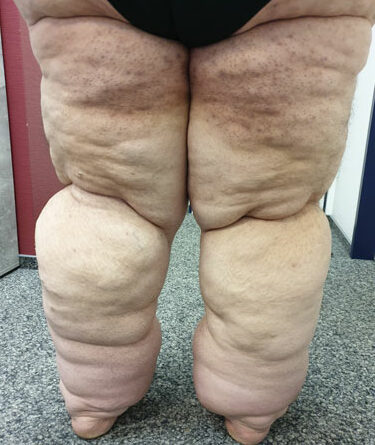
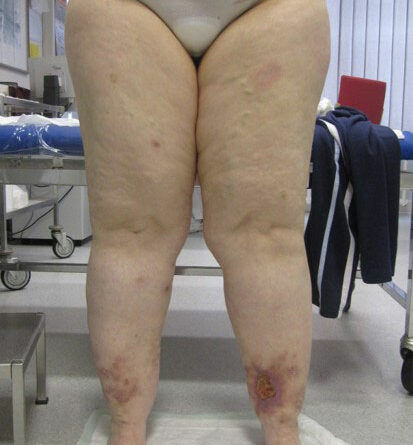
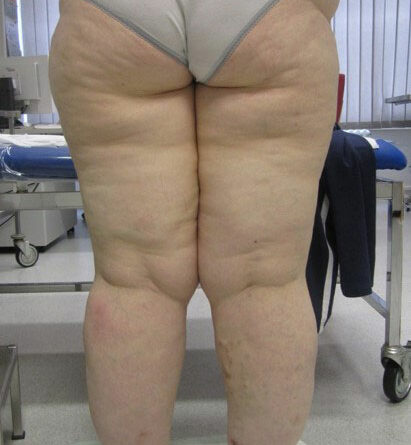
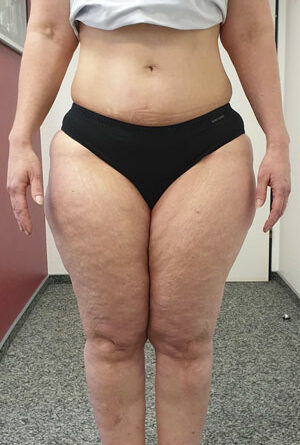
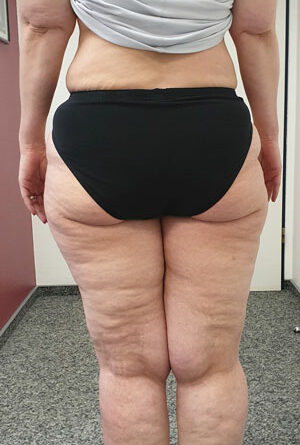
- Stadium III: verdickte Haut, Sklerose, deformierende Fettdepots, großknotige Veränderungen („Wammen“ an Knie und Knöcheln), Verzerrung des Beinprofils (Abb. 1)
Wie viele Frauen (sehr selten auch Männer) tatsächlich von dieser Erkrankung betroffen sind, ist unklar. Schätzungen schwanken zwischen 1 pro 72.000 14 und bis zu 11 % der Frauen im postpubertären Alter 15. Die ausgeprägten zahlenmäßigen Unterschiede lassen sich zum Teil dadurch erklären, dass in allen Erhebungen offenbar Fehldiagnosen und Verwechslungen mit Adipositas und/oder Lymphödem mitgezählt wurden bzw. dass ein kombiniertes Auftreten aller drei Entitäten nicht berücksichtigt wurde. Ebenso unklar wie die Häufigkeit bleibt die Ursache der Erkrankung; vermutlich besteht aber eine multifaktorielle Genese 16. Zum einen steht der Beginn der Fettgewebevermehrung oft in Zusammenhang mit hormonellen Wechseln wie Pubertät, oraler Antikonzeption, Schwangerschaft oder Menopause 17, zum anderen scheint aber auch eine signifikante Zunahme des Körpergewichts als Trigger zu fungieren 18. Eine genetische Prädisposition ist ebenfalls wahrscheinlich; vermutlich besteht ein autosomal-dominanter Erbgang mit inkompletter Penetranz und Auslassen männlicher Nachkommen, die aber möglicherweise als „Genträger“ fungieren 19. Auch ein erstes mutiertes Gen (AKR1C1) ist in einer Familie mit primären Lipödemen identifiziert worden 20.
Die disproportionale Zunahme des Fettgewebes resultiert vermutlich sowohl aus einer Hypertrophie (Größenzunahme ohne Zellvermehrung) als auch aus einer Hyperplasie (Zunahme der Anzahl) der Fettzellen. Beide Vorgänge werden sowohl einzeln als auch in Kombination beschrieben; vollständig geklärt ist diese These allerdings ebenfalls nicht 21. Eine weitere Hypothese beschreibt eine Veränderung der Verteilungsmuster von Alpha- und Beta-Östrogen-Rezeptoren am betroffenen weißen Fettgewebe 22. Auch eine erhöhte Rate an absterbenden Fettzellen in betroffenen Geweben – möglicherweise aufgrund einer Hypoxie, bedingt durch das schnelle Wachsen des Fettgewebes ohne ausreichende Versorgung durch das langsamer mitwachsende Kapillarstromgebiet – ist festgestellt worden 23 24. Die hieraus resultierende lokale Inflammation, getriggert u. a. durch die Makrophagenaktivität, ist ebenfalls pathophysiologisch relevant 25 26. Die vermehrte Bildung dieser fragilen Kapillaren und die beschriebene Hypoxie sind ebenso als Ursache der typischen vermehrten lokalen Hämatombildung bei Bagatelltraumata wahrscheinlich 27. Dabei scheint auch eine Verminderung der Elastizität von Haut und Bindegewebe eine Rolle zu spielen 28.
Zur Genese der Schmerzhaftigkeit, über die sehr unterschiedlich geklagt wird (von Druckgefühl bis hin zu Berstungsschmerzen), sowie zur Berührungsempfindlichkeit der betroffenen Körperareale existieren verschiedene, einander möglicherweise ergänzende pathophysiologische Modelle. Diese beschreiben eine vermehrte Kompression sensibler Nervenfasern durch eine rasche Gewebevermehrung. Dieses Modell der Umfangsvermehrung gilt allerdings als unwahrscheinlich, da andere Entitäten mit Gewebevermehrung jenseits des Lipödems (Lipohypertrophie, Lymphödem, Adipositas) nicht schmerzhaft sind. Im Vordergrund der Hypothesen stehen eine lokale Nervenreizung und eine Schmerzentstehung durch vermehrte und dysregulierte inflammatorische Mediatoren sowie die Entwicklung eines zentralen chronischen Schmerzsyndroms 29 30 31 32 33.
Exkurs: Das Ödem
Die Ausbildung eines möglichen orthostatischen Ödems der Beine bis hin zur umstrittenen Etablierung eines „lipödembedingten Lymphödems“ beschäftigt die Geister der Gelehrten und erregt die Gemüter aller Betroffenen und Behandler. Daher werden im Folgenden einige grundlegende Aspekte der Ödematologie und der Lymphologie erörtert.
Unter einem Ödem versteht man allgemein eine sicht- und tastbare Schwellung durch Vermehrung des Flüssigkeitsgehalts im Interstitium – lokal oder generalisiert. Somit handelt es sich beim Ödem lediglich um ein Symptom vieler Krankheiten und auch physiologischer Veränderungen im Zwischenzellwasserhaushalt. Aus lymphologischer Sicht entsteht ein Ödem letztlich dadurch, dass das über die Kapillarmembran austretende Ultrafiltrat im interstitiellen Raum über die Lymphabflusswege nicht in ausreichender Menge zeitgerecht abtransportiert werden kann. Die vier wesentlichen Ödemfaktoren lassen sich wie folgt zusammenfassen
A) Erhöhte Filtration durch:
- erhöhten Druck in den Kapillaren (arteriell: Dilatation der vorgeschalteten Arteriole, erhöhte Muskelaktivität, Wärme; venös: Abflussstörungen Abflussstörungen bei CVI, Herzinsuffizienz, Hindernissen);
- verringerte kolloidonkotische Kraft des Plasmas (Eiweißmangel nutritiv oder beim nephrotischen Syndrom);
- erhöhte Permeabilität der Kapillarwand durch z. B. Histamin, Bradykinin, Zytokine bei Entzündung/Allergie).
B) Verminderter Lymphabfluss durch:
- Schädigung des Lymphsystems.
Das so entstandene Überschussvolumen wird bei hoher funktioneller Reserve des Lymphgefäßsystems abtransportiert, sodass ein Ödem erst sichtbar wird, wenn alle Kompensationsmechanismen des Abtransports erschöpft sind („Sicherheitsventilinsuffizienz“). Dies kann auftreten, wenn die Menge des Ultrafiltrats zu stark steigt („Hochvolumen- oder dynamische Insuffizienz“) oder der Abtransport durch mechanische Hindernisse beeinträchtigt ist („Niedrigvolumen- oder mechanische Insuffizienz“). In der Regel finden sich beide Insuffizienzformen in Kombination – nacheinander oder auch gleichzeitig.
Laut der Definition nach Földi ist unter einem Lymphödem ein durch eine mechanische Insuffizienz des Lymphgefäßsystems verursachtes chronisch-entzündliches lymphostatisches Krankheitsbild zu verstehen. Lymphödemkombinationsformen sind Folgen einer Sicherheitsventilinsuffizienz des Lymphgefäßsystems; Kennzeichen sind eine nichtinfektiöse chronische Entzündung, die Ansammlung von Flüssigkeit und Eiweiß im Interstitium sowie eine Proliferation des Bindegewebes mit Fibrosierung 34.
Aus der oben genannten Definition lassen sich die Kriterien zur Diagnostik eines Lymphödems im Stadium II und III sinnvoll ableiten:
- ein spontan nicht reversibles, fibrosierendes Ödem ohne Dellbarkeit,
- häufig mit positivem Stemmer’schem Hautfaltenzeichen,
- beginnenden Hautveränderungen und
- fehlender spontaner Rückbildung im Liegen über Nacht.
Im Stadium I ist das Ödem demgegenüber tief dellbar und ohne Fibrose. Es ist spontan reversibel und weist keine Veränderungen an der Haut auf. Insofern ist es als eiweißreiches, mechanisch bedingtes Ödem klinisch noch nicht zu erkennen und ähnelt den lokalen, eiweißarmen, nichtfibrosierenden Ödemen, zum Beispiel bei Herzinsuffizienz, Eiweißmangelsyndromen oder auch den häufigen orthostatischen Ödemen.
Dennoch unterscheiden sich die Therapieansätze in diesem klinischen Stadium je nach Grunderkrankung wesentlich. Demnach wird ein Ödem bei Herzinsuffizienz nicht primär physikalisch entstaut und ein typisches postoperatives mechanisches Lymphödem nicht mittels Diuretikagaben behandelt. Somit ist die exakte Diagnose der Grunderkrankung entscheidend und eine Therapie erst anschließend erfolgversprechend. Dem erfahrenen Untersucher ist das Stadium II des Lymphödems präsent, in dem eine Physikalische Entstauung mit Manueller Lymphdrainage, Kompressionsbehandlung, Hautpflege und Bewegungstherapie nach bekannten Zweiphasen-Schemata begonnen werden muss (KPE). Eine Entscheidung zugunsten einer KPE bereits im Stadium I kann daher erst nach kritischer Prüfung von Indikation und Diagnose und nach Ausschluss von Kontraindikationen fallen. Eine Entscheidungshilfe kann im Stadium I die begründete Vermutung sein, dass es sich mit hoher Wahrscheinlichkeit um ein mechanisches, im Verlauf fibrosierendes Ödem handeln wird. Somit lassen sich durch die MLD vor allem der Proteinstau und die Reakkumulation von Proteinen verhindern und die fibrösen Veränderungen beseitigen.
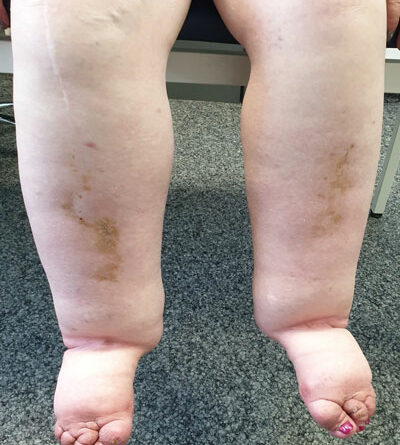
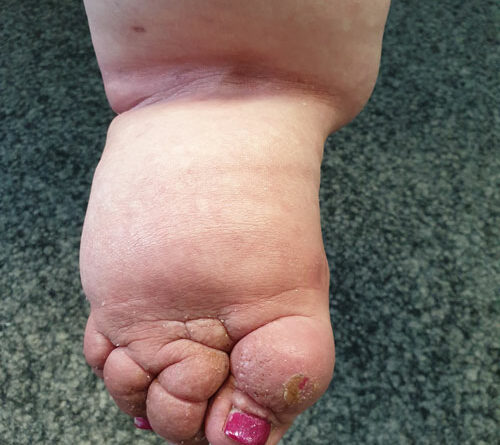
Therapieziel der KPE ist das Erreichen eines Stadiums 0, des sogenannten Latenzstadiums, da eine Restitutiovad integrum nicht möglich erscheint. In diesem Stadium liegt zwar eine Erkrankung des Lymphgefäßsystems vor, ein Ödem ist aber nicht sichtbar. In diesem Stadium ist eine KPE nicht indiziert 35 (Abb. 2a–d).
Lymphödem vs. Lipödem
Betrachtet man das Lipödem mit „lymphologischen Augen“, gibt es durchaus Parallelen zu den aktuellen pathophysiologischen Modellen der Ödem-Entstehung beim Lipödem. Eine Hypothese in diesem Zusammenhang vermutet eine primäre mikrovaskuläre Störung der Blutkapillaren und der initialen Lymphgefäße bzw. des Lymphsinus und eine daraus resultierende mechanische Alteration des Lymphabflusses 36. Die dadurch bewirkte Kapillarschädigung mit nachfolgendem vermehrtem Proteinübertritt ins Interstitium („capillary leak“) entspricht somit einem der oben genannten vier Ödemfaktoren und kann theoretisch auch zur Ausbildung eines fibrosierenden Lymphödems führen, sofern die Sicherheitsventilfunktion tatsächlich erschöpft wird. Störungen der Lymphtransportkapazität beim Lipödem wurden durchaus beschrieben 37.
Welche lymphologische Therapieoption ergibt sich nun aber aus diesenErkenntnissen, wenn kein Ödem nachweisbar ist, wenn also ein Lymphödem im Latenzstadium (Stadium 0) besteht? In der Mehrheit der klinisch untersuchten Patientinnen mit Lipödem – und nach Ausschluss weiterer möglicher Ödemursachen – fanden sich im Patientenkollektiv der Studie der Földiklinik nur selten dellbare Ödeme 38. Dem Eindruck einer „Überschwemmung des Fettgewebes durch Lymphe“ 39 wird entgegnet, dass weder in klinischen Befundungen noch in hochauflösenden Ultraschalluntersuchungen ein Ödemnachweis bei den Patientinnen gelang. Darüber hinaus konnten auch bei anderen Studien weder per CT-Diagnostik noch per Isotopenlymphographie vermehrte interstitielle Flüssigkeiten oder Lymphabflussstörungen festgestellt werden 40 41 42.
MLD als Therapie beim Lipödem
Wenn aber kein Ödem nachweisbar ist – auf welcher Grundlage erfolgt dann die dogmatische Entstauungstherapie zur Ödembeseitigung? Wie kann ein nicht nachweisbares Ödem die Beschwerden, vor allem die Schmerzen der Patientinnen, bedingen?
Zweifelsfrei besteht ein Nutzen der MLD auch beim Lipödem, allerdings nicht als entstauende, sondern als beschwerdelindernde Maßnahme zur Reduzierung von Stress, Erschöpfung, Angst und Depressionen im Sinne der nachgewiesenen Wertigkeit einer Massage für das psychische Wohlbefinden 43. Darüber hinaus ist selbstverständlich eine MLD auch in den Fällen eines klinischen Ödemnachweises möglich. Diese Ödeme werden vor allem nach langzeitigem Stehen, in heißer Umgebung, bei schwülwarmem Wetter oder nach Flugreisen mit dellbaren Knöchelödemen und Zunahme des Schweregefühls beschrieben. Allerdings stellen die krankheitsimmanenten Druck- und Berührungsschmerzen der Haut häufig einen selbstlimitierenden Anwendungsfaktor dar und lassen eine korrekt durchgeführte MLD schmerzbedingt gar nicht zu.
Anspruchsvoller werden Diagnostik und Therapieentscheidung, wenn andere ödembildende Begleiterkrankungen hinzutreten. Im Vordergrund stehen dabei begleitendes Übergewicht und Adipositas. In lymphologischen Ambulanzen fanden sich laut den Veröffentlichungen aus der Földiklinik von T. Bertsch 44, den Publikationen der britischen Arbeitsgruppe um Child und Gordon 45 sowie in denen der niederländischen Gruppe um Bosman 46 folgende Gruppen von Lipödempatientinnen:
- 3–5 % normalgewichtige Lipödempatientinnen (BMI < 25 kg/m²);
- 10–15 % übergewichtige Patientinnen (BMI 25–30 kg/m²);
- die restlichen 80–85 % der erkrankten Frauen wiesen eine manifeste Adipositas (BMI > 30 kg/m²) in Bezug auf den gemessenen BMI auf.
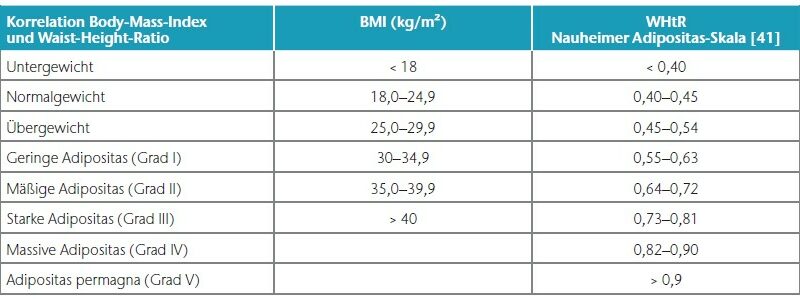
Gerade für Frauen im übergewichtigen Bereich und mit manifestem Lipödem ist der BMI allerdings nur eingeschränkt geeignet, ein reales Übergewicht zu detektieren. Denn die Frauen dieser relativ kleinen Patientengruppe weisen zwar eine schlanke Taille auf; eine übermäßig ausgeprägte Fettgewebevermehrung an den Extremitäten erhöht aber das Körpergewicht in Bezug auf die Körpergröße unverhältnismäßig, sodass ein „BMI-Übergewicht“ vorgetäuscht wird.
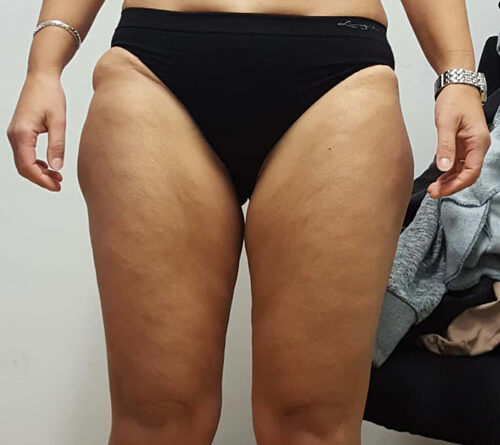
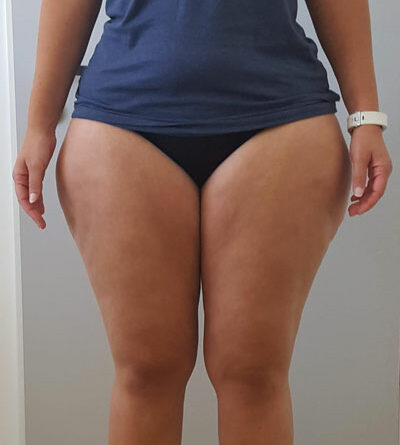
In allen und speziell diesen grenzwertigen Fällen mit einem BMI von 25 bis 30 kg/m² empfiehlt sich gleichzeitig die Bestimmung der sogenannten Waist-to-Height-Ratio (WHtR), auch Bauch-Größen-Quotient (BGQ) genannt, die – korrekt gemessen – diese Disproportionalität berücksichtigt (Nauheimer Adipositas-Skala) 47. Ein Beispiel: Bei einer 30-jährigen Frau mit disproportionaler Fettgewebevermehrung an den Oberschenkeln und am Gesäß wird eine Größe von 170 cm, ein Gewicht von 90 kg, ein Taillenumfang von 75 cm sowie ein Hüftumfang von 110 cm gemessen. Das ergibt gemäß BMI-Formel eine leichtgradige Adipositas (BMI 31 kg/ m²). Nach der Nauheimer Adipositas-Skala dagegen ergibt sich eine WHtR von nur 0,44, also gemäß Definition ein Normalgewicht (WHtR 0,40– 0,45). Bei derselben Patientin mit einem angenommenen Taillenumfang von 100 cm beträgt die WHtR dann aber 0,59 – nun besteht also auch hier formal eine leichtgradige Adipositas (WHtR 0,55–0,63) (Tab. 1) (Abb. 3–5).
Liegt bei manifestem Lipödem eine Adipositas vor, ergeben sich allein dadurch mindestens drei weitere Ursachen einer Ödembildung:
- So steigt das Risiko der Entstehung eines adipositasassoziierten Lymphödems ab einem BMI von 40 kg/m² bei zugrundeliegenden Ödemerkrankungen wie Diabetes mellitus, Herzinsuffizienz, Immobilität oder postthrombotischem Syndrom auch schon bei deutlich geringerem BMI 48. Aktuell scheinen etwa 50 % der sekundären Lymphödeme auf eine Adipositas zurückzuführen zu sein. Da wie geschildert auch mehr als die Hälfte der Lipödempatientinnen adipös sind, finden sich die entstehenden Lymphödeme ebenfalls eher als Folge der Adipositas als der geschilderten orthostatischen Ödemereignisse 49.
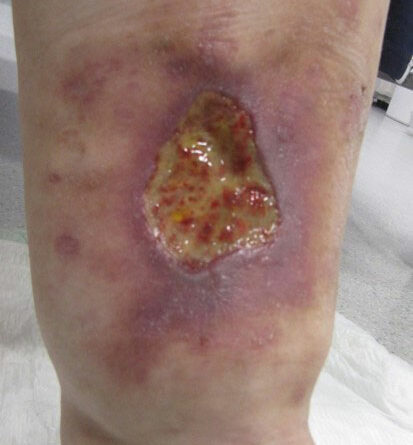
- Eine weitere adipositasassoziierte Ödemursache ist die funktionelle venöse Insuffizienz oder auch das adipositasassoziierte Dependency-Syndrom. Dabei finden sich bei intakten Stammvenen ohne nachweisbaren Reflux oder Obstruktion der Venen erhöhte Mengen der Ultrafiltratbildung aufgrund einer daraus resultierenden Druckerhöhung im venösen Schenkel der Mikrozirkulation. Dies mündet möglicherweise in die Ausbildung hydrostatischer Ulzera 50.
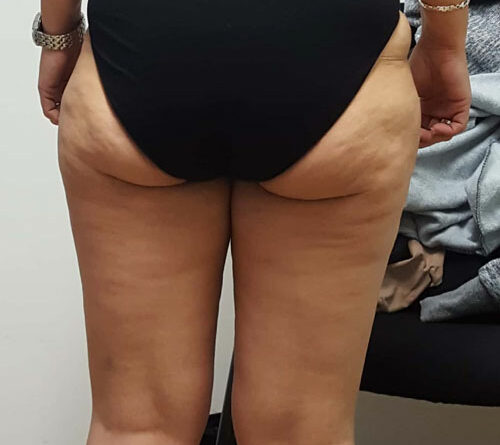
- Schließlich bedingen auch die durch Adipositas und Lipödem eingeschränkte Mobilität und die Veränderung des Gangbilds mit Reduzierung der Muskelvenenpumpen und Fehlstellung der Beinachsen eine vermehrte Ödembildung. Auch die Atmung ist flacher, woraus eine eingeschränkte Leistung der thorakoabdominellen Druck-Saug-Pumpe resultiert. Der venöse Rückfluss ist durch einen hohen Venendruck in den Leisten und im Viszeralraum beeinträchtigt. So werden auch die sogenannten Hilfsmechanismen des Lymphtransports nachhaltig eingeschränkt und die lymphologischen Sicherheitsventile weiter insuffizient – mit Verstärkung eines fibrosierenden Ödems. Somit ist es sehr wahrscheinlich, dass bei den vielen adipösen Patientinnen mit Lipödem ein sekundäres, adipositasassoziiertes Lymphödem entsteht bzw. bereits besteht. Es ist aber genauso unwahrscheinlich, dass diese fibrosierenden Ödeme auch bei normgewichtigen Patientinnen eine direkte Folge des Lipödems im Sinne einer fettgewebeinduzierten mechanischen lymphologischen Abflussstörung sind (Abb. 6a–c).
Bezüglich der Problematik „Lipödem und Adipositas“ sehen sich Behandler in der täglichen lymphologischen Praxis unmittelbar mit zwei weiteren Problemen konfrontiert:
- Zwei Drittel der Männer (67 %) und die Hälfte der Frauen (53 %) in Deutschland sind übergewichtig. Ein Viertel der Erwachsenen (23 % der Männer und 24 % der Frauen) ist stark übergewichtig (adipös), Tendenz rasch steigend 51.
- Aussagen wie „Ich bin nur aufgrund des Lipödems so dick geworden“ und „Ich kann machen, was ich will – ich nehme an Armen und Beinen nicht ab“ finden sich so oder ähnlich formuliert regelmäßig zu Beginn der Patientinnengespräche. Allerdings gibt es hierfür keine bestätigende wissenschaftliche Evidenz. In den Medien und in Internetforen werden aber gerade solche Aussagen der Betroffenen häufig populistisch genutzt und verbreitet. Es ist weniger belastend und gesellschaftlich besser akzeptiert, wenn man nicht als „schuldhaft übergewichtig“ erscheint, sondern „schicksalhaft Lipödempatientin“ ist 52.
Wie T. Bertsch und andere aber überzeugend formulierten, gibt es für die Gegenthesen „Ein Lipödem führt nicht zur Gewichtszunahme“ und „Eine Gewichtsabnahme hilft mir zur Beschwerdelinderung auch nicht“ ebenfalls keine überzeugende Datenlage 53. Zumindest aber findet sich eine empirische Evidenz dafür, dass bei vorhandener disproportionaler Fettgewebevermehrung der Beine und Arme im Sinne einer indolenten Lipohypertrophie in jungem Alter bei ernährungsbedingter Gewichtszunahme bis hin zur Adipositas auch die Arm- und Beinumfänge disproportional weiter zunehmen und die typischen Symptome des Lipödems bei entsprechender genetischer Disposition hinzutreten.
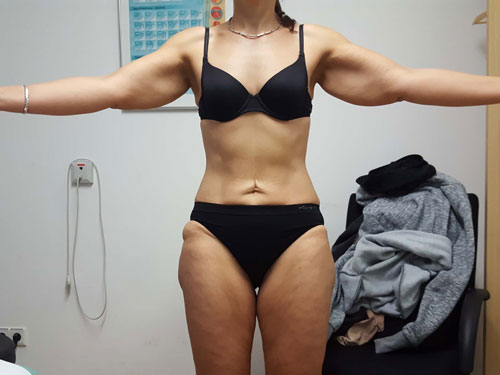
Betrachtet man die Effekte einer Gewichtsabnahme bei adipösen Lipödempatientinnen, lässt sich bereits in den Erstveröffentlichungen aus den Jahren 1940 und 1951 die Feststellung finden, dass in Fällen einer vorliegenden Adipositas eine deutliche Gewichtsabnahme helfe 54. Die weit verbreitete These, dass sich das Lipödem-Fettgewebe an Armen und Beinen durch eine Gewichtsreduktion ja gar nicht verringern könne, ist im klinischen Alltag nicht haltbar. Die Aussage, dass eine Verbesserung der Beschwerden durch Diät und Sport nicht möglich sei, widerspricht den geschilderten Erfahrungsberichten großer lymphologischer Ambulanzen. Ein pathophysiologisches Konzept zur Erklärung dieser „Diät-Resistenz“ gibt es bisher nicht 55. Vielmehr lässt sich empirisch eine deutliche Beschwerdebesserung bei Lipödempatientinnen bei nachhaltiger Gewichtsreduktion mit reduzierter Schmerzhaftigkeit, besserer Selbstakzeptanz, Umfangsabnahme an den betroffenen Extremitäten und hierdurch größerer Bewegungsmöglichkeit feststellen 56 (Abb. 7 u. 8).
Konsequenzen für die Therapie des Lipödems
Experten des Europäischen Lipödemforums 57 haben in diesem Zusammenhang zunächst die zentralen Beschwerden zusammengestellt, unter denen Lipödempatientinnen in unterschiedlicher Ausprägung leiden:
- Schmerzen und andere Beschwerden im Unterhautfettgewebe der Arme und Beine;
- hohe psychologische Verletzlichkeit, die das Schmerzerleben verstärken kann;
- fehlende Selbstakzeptanz, insbesondere im Hinblick auf das aktuelle Schönheitsideal;
- Übergewicht und Adipositas trotz mehrfacher Diäten;
- fehlende ausreichende physische Fitness und Trainingsmöglichkeit, vor allem bei Adipositas.
Hieraus wurde ein Therapieansatz entwickelt, der auf sechs Säulen ruht:
- Bewegungstherapie, Physiotherapie
- Kompressionstherapie
- Psychosoziale Therapie
- Gewichtsmanagement
- Liposuktion
- Selbstmanagement
Auf drei dieser – im orthopädietechnischen Kontext besonders wichtige – Therapieansätze wird im Folgenden detaillierter eingegangen: Bewegungs- und Physiotherapie (1), Kompressionstherapie (2) sowie Lymphbahnschonende Liposuktion (5).
Bewegungstherapie, Physiotherapie
In diesem Zusammenhang ist eine sehr individuelle Anpassung der Therapie an die Bedürfnisse, an die Erwartungshaltung und auch an die körperlichen Möglichkeiten der Patientin entscheidend. Persönliche Ziele müssen erreichbar formuliert und der Weg dahin vertretbar geplant sein. Verhaltensänderungen im Tagesablauf, Motivationstraining und Vermeidung frustrierender Überforderungen – physisch und psychisch – müssen vermittelt werden. Ziel ist es, das allgemeine Aktivitätsniveau langsam zu steigern, die Muskelkraft zu erhöhen sowie die Ausdauer zu erhalten und zu steigern. Hierzu ist es für die Patientinnen notwendig, gut über das Krankheitsbild informiert zu sein. Vor allem sollte die Erkenntnis bestehen, dass es sich um eine chronische Krankheit handelt, die sich durch Gewichtszunahme und Verringerung der körperlichen Aktivität verschlechtern kann. Auch die oben geschilderten „Mythen“ rund um das Lipödem sollten der Patientin bewusst gemacht werden.
Die Rolle der körperlichen Aktivitätssteigerung ist unschätzbar hoch, da hierdurch die pathologischen inflammatorischen Prozesse im Fettgewebe nachhaltig positiv beeinflusst werden, die wie geschildert vermutlich die wesentlichen Faktoren der Schmerzentstehung beim Lipödem darstellen. Es konnte gezeigt werden, dass ein regelmäßiges körperliches Training eine Reduzierung der proinflammatorischen Adipokine bewirkt 58. Bei Hunger nehmen entzündungshemmende Adipokine zu und entzündungsfördernde ab; bei Gewichtszunahme ist es genau umgekehrt. Ebenso führt die körperliche Aktivität zu einer verbesserten Durchblutung auch im Fettgewebe und verringert dadurch die Hypoxie. Jeder, der regelmäßig körperlich aktiv Sport betreibt, wird erlebt haben, dass Bewegung antidepressiv und stimmungsbessernd wirkt. Das gilt insbesondere für ängstliche und frustriert-depressive Lipödempatientinnen 59.
Die Manuelle Lymphdrainage hat selbst keinen Einfluss auf die Ausprägung und den Verlauf des Lipödems. Wie oben dargestellt kann sie aber im Fall eines nachgewiesenen Lymphödems im Rahmen der Komorbiditäten je nach Schmerzhaftigkeit des Gewebes eingesetzt werden. Ebenso kann sie zu Beginn einer Behandlung aufgrund ihrer geschilderten zentral schmerzlindernden Wirkung zur Besserung des Allgemeinbefindens vorübergehend und zeitlich begrenzt verordnet werden. Die Notwendigkeit einer entstauenden Therapie besteht nicht; eine langfristige Behandlung zur Erlangung der Kostenübernahme einer Liposuktion erscheint unter diesen Aspekten absurd.
Kompressionstherapie
Auch die Betrachtung der Versorgung mit unzweifelhaft notwendigen Kompressionsstrümpfen verändert sich: Da es beim Lipödem in der Regel kein Ödem zu entstauen gibt, erfolgt die Kompression hierbei langfristig aufgrund ihrer antiinflammatorischen Wirkung auf das subkutane Fettgewebe und zur damit verbundenen Schmerzlinderung. Dieser Kompressionseffekt wird ausdrücklich auch bei der KPE zur Behandlung des Lymphödems zur Verringerung der chronisch entzündlichen Fibrosierung genutzt 60 61. Ebenso wird dadurch die Mikrozirkulation der Subkutis gesteigert und der oxidative Stress nachweislich verringert. Die Beine fühlen sich in Kompression subjektiv fester und stabiler an, die Knie-Innenseiten scheuern weniger aneinander, was die Mobilität und das Wohlbefinden der Patientinnen verbessert. Bereits zu Anfang der Kompressionsbehandlung sollte aber darauf hingewiesen werden, dass die Kompression keine Umfangsminderung der Extremitäten bewirkt und auch nicht einer Fettgewebezunahme entgegenwirkt.
Die Versorgung mit rund- oder flachgestrickter Ware orientiert sich an der Beinform; in der Regel wird aber eine Rundstrickversorgung technisch nicht passend herstellbar sein, um den Beinumfängen und Disproportionen gerecht zu werden. Nach Expertenmeinung ist eine Flachstrickversorgung aufgrund der besseren Passform und somit höherer Patientenakzeptanz zu bevorzugen. Die Experten des Europäischen Lipödemforums hatten ebenfalls befunden, dass eine Armstrumpfkompression beim Lipödem nur wenig Bedeutung hat. Insbesondere in Kombination mit körperlicher Aktivität lassen sich diese antientzündlichen Effekte der Kompression im Fettgewebe addieren. Dabei ist Aquafitness und die damit verbundene Nutzung des Kompressionseffekts des Wassers sowie des Auftriebs zur gelenkschonenden Mobilität unbedingt empfehlenswert.
Lymphbahnschonende Liposuktion
Durch eine dauerhafte operative Reduktion des Fettgewebes beim Lipödem konnten in mehreren Anwendungsbeobachtungen signifikante Symptomlinderungen bei nur geringer Komplikationsrate erreicht werden 62 63 64 65 66. Diese Besserungen betrafen subjektiv die Schmerzwahrnehmung, das Spannungsgefühl, die Hämatomneigung und auch die Lebensqualität. Beinumfänge wurden messbar reduziert. Relevante, histologisch nachweisbare Zerstörungen von Lymphabflusswegen fanden sich in den Untersuchungen nicht. Der G‑BA (Gemeinsamer Bundesausschuss) sieht allerdings für diese Methode noch keinen hinreichend belegten Nutzen und daher derzeit auch keine Aufnahmemöglichkeit in den Leistungskatalog der Krankenkassen 67. Auch das Bundessozialgericht hält bisher die dauerhafte Wirksamkeit für nicht ausreichend gesichert 68. Allerdings wird das Potenzial dieser Behandlungsalternative durchaus gesehen, und es hat in diesem Zusammenhang eine randomisierte prospektive Multicenter-Studie im Auftrag des G‑BA begonnen.
Auch hier haben die Experten des Europäischen Lipödemforums Kriterien aufgelistet, die zur Entscheidung hinsichtlich einer Liposuktion genutzt werden können 69:
- fortbestehende Beschwerden auch nach 12 Monaten konservativer Behandlung gemäß den oben geschilderten Kriterien;
- erhebliche funktionelle Einschränkungen der Patientin;
- Gewichtsstabilität in den letzten 12 Monaten zur Vermeidung eines postoperativen „Jo-Jo-Effekts“;
- präoperatives psychologisches Assessment zum Ausschluss von Essstörungen und von psychischen Erkrankungen, die einem langfristigen Therapieerfolg im Wege stehen könnten;
- im Falle eines BMI > 35 kg/m² und einer WHtR > 0,5 sollte keine Liposuktion erfolgen.
Insgesamt ist es bei der Indikationsstellung zur Liposuktion essenziell, letztlich keine Behandlung einer Adipositas durchzuführen, sondern die geeigneten Lipödempatientinnen trotz der hohen Koinzidenz mit Adipositas herauszufiltern, die – unabhängig vom morphologischen Krankheitsstadium – möglicherwiese von einer Liposuktion profitieren.
Fazit
Der Stellenwert der dogmatisch lebenslang verordneten Manuellen Lymphdrainage und der Kompressionstherapie zur Behandlung des „Ödems im Lipödem“ ist im Rahmen neuer Erkenntnisse von Experten in ein anderes Licht gerückt worden. Im Vordergrund steht nicht mehr die Notwendigkeit einer Entstauung des Gewebes, sondern die Verbesserung der vielfältigen inflammatorischen Reaktionen im betroffenen Fettgewebe durch die Kombination von verbesserter Mobilität und Kompressionstherapie. Ein wesentlicher Aspekt ist eine Gewichtsreduktion im Falle einer häufig begleitenden Adipositas zur Vermeidung der Entwicklung eines sekundären adipositasassoziierten Lymphödems sowie einer funktionellen CVI, die das Gewebebild dramatisch verschlechtern und die Beschwerden zunehmen lassen können.
Zudem rücken die Selbstakzeptanz der betroffenen Frauen sowie ihre psychische Verletzlichkeit weiter in den Vordergrund. Die veröffentlichte Streitschrift für eine „European Best Practice of Lipoedema“ einer Expertenkommission aus neun europäischen Ländern mit und um T. Bertsch von der Földiklinik Hinterzarten ist Vorbote des erwarteten Konsensus-Papiers, das vermutlich die aktuelle S1-Leitlinie „Lipödem“ 70, die nur bis zum 30. Juni 2020 gültig war, ablösen wird.
Der Autor:
Dr. med. Hans-Walter Fiedler
Arzt für Chirurgie, Gefäßchirurgie
Endovasculärer Chirurg (DGG);
Dozent an der Bundesfachschule für
Orthopädie-Technik, Dortmund;
Gefäßmedizin Südwestfalen -
Praxis für Chirurgie, Gefäßchirurgie,
Phlebologie, Lymphologie,
ambulantes Operieren
Senator-Schwartz-Ring 8
59494 Soest
info@gch-soest.de
Begutachteter Beitrag/reviewed paper
Fiedler HW. Paradigmenwechsel in der Behandlung des Lipödems. Orthopädie Technik, 2020; 71 (11): 32–41
- Wold LE, Hines EA, Allen EV. Lipedema of the legs; a syndrome characterized by fat legs and edema. Ann Intern Med, 1951; 34 (5): 1243–1250
- Schmitz R. Lipödem – das dicke Bein der gesunden Frau. Phlebologie und Proktologie, 1980; 9: 81–85
- Brunner U. [Vascular diseases in lipedema of the legs. Special symptoms, common therapeutic results, viewpoint on vascular surgery]. Schweiz Med Wochenschr, 1982; 112 (33): 1130–1137
- Gregl A. Lipedema. Z Lymphol, 1987; 11 (2): 41–43
- Deutsche Gesellschaft für Phlebologie e. V. (DGP) (Hrsg.). S1-Leitlinie „Lipödem“ (AWMF-Leitlinienregister Nr. 037–012). Stand: 31.10.2015 (in Überarbeitung), gültig bis 30.06.2020. https://www.awmf.org/uploads/tx_szleitlinien/037–012l_S1_ Lipoedem_2016-01-abgelaufen.pdf (Zugriff am 02.10.2020)
- Kassenärztliche Bundesvereinigung. Langfristiger Heilmittelbedarf/ besonderer Verordnungsbedarf. 2020: 14–15. https:// www.kbv.de/media/sp/Diagnoseliste_Heilmittelbedarf_2020.pdf (Zugriff am 04.10.2020)
- Peled AW, Kappos EA. Lipedema: Diagnostic and management challenges. International Journal of Women’s Health, 2016; 8: 389–395
- Hardy D, Williams A. Best practice guidelines for the management of lipoedema. British Journal of Community Nursing, 2017; 22 (Sup10): S44–S48
- Meier-Vollrath I, Schmeller W. [Lipoedema – current status, new perspectives]. JDDG, 2004; 2 (3): 181–186
- Langendoen SI, Habbema L, Nijsten TEC, Neumann HAM. Lipoedema: From clinical presentation to therapy. A review of the literature. British Journal of Dermatology, 2009; 161 (5): 980–986
- Deutsche Gesellschaft für Phlebologie e. V. (DGP) (Hrsg.). S1-Leitlinie „Lipödem“ (AWMF-Leitlinienregister Nr. 037–012). Stand: 31.10.2015 (in Überarbeitung), gültig bis 30.06.2020. https://www.awmf.org/uploads/tx_szleitlinien/037–012l_S1_ Lipoedem_2016-01-abgelaufen.pdf (Zugriff am 02.10.2020)
- Szolnoky G, Varga E, Varga M, Tuczai M, Dósa-Rácz E, Kemény L. Lymphedema treatment decreases pain intensity in lipedema. Lymphology, 2011; 44 (4): 178–182
- Schmeller W, Meier-Vollrath I. [Lipoedema – new facts of a fairly unknown disease]. Aktuelle Dermatologie, 2007; 33 (7): 251–260
- Child AH, Gordon KD, Sharpe P, Brice G, Ostergaard P, Jeffery S, et al. Lipedema: An inherited condition. Am J Med Genet Part A, 2010; 152A (4): 970–976
- Szél E, Kemény L, Groma G, Szolnoky G. Pathophysiological dilemmas of lipedema. Med Hypotheses, 2014; 83 (5): 599–606
- Okhovat JP, Alavi A. Lipedema: A Review of the Literature. Int J Low Extrem Wounds, 2015; 14 (3) : 262–767
- Fonder MA, Loveless JW, Lazarus GS. Lipedema, a frequently unrecognized problem. J Am Acad Dermatol, 2007; 57 (2 Suppl): S1–3
- Bertsch T, Erbacher G. Lipödem – Mythen und Fakten Teil 3. Phlebologie, 2018; 47 (4): 188–197
- Child AH, Gordon KD, Sharpe P, Brice G, Ostergaard P, Jeffery S, et al. Lipedema: An inherited condition. Am J Med Genet Part A, 2010; 152A (4): 970–976
- Michelini S, Chiurazzi P, Marino V, Dell’Orco D, Manara E, Baglivo M, et al. Aldo-Keto Reductase 1C1 (AKR1C1) as the First Mutated Gene in a Family with Nonsyndromic Primary Lipedema. Int J Mol Sci, 2020; 21 (17): 6264
- Priglinger E, Wurzer C, Steffenhagen C, Maier J, Hofer V, Peterbauer A, et al. The adipose tissue–derived stromal vascular fraction cells from lipedema patients: Are they different? Cytotherapy, 2017; 19 (7): 849–860
- Wiedner M, Aghajanzadeh D, Richter DF. [Lipedema – basics and current hypothesis of pathomechanism]. Handchir Mikrochir Plast Chir, 2018; 50 (6): 380–385
- Brunner U. [Vascular diseases in lipedema of the legs. Special symptoms, common therapeutic results, viewpoint on vascular surgery]. Schweiz Med Wochenschr, 1982; 112 (33): 1130–1137
- Amann-Vesti BR, Franzeck UK, Bollinger A. Microlymphatic aneurysms in patients with lipedema. Lymphology, 2001; 34 (4): 170–175
- Suga H, Araki J, Aoi N, Kato H, Higashino T, Yoshimura K. Adipose tissue remodeling in lipedema: Adipocyte death and concurrent regeneration. J Cutan Pathol, 2009; 36 (12): 1293–1298
- Schneble N, Wetzker R, Wollina U. Lipedema – Lack of evidence for the involvement of tyrosine kinases. J Biol Regul Homeost Agents, 2016; 30 (1): 161–163
- Fife CE, Maus EA, Carter MJ. Lipedema: a frequently misdiagnosed and misunderstood fatty deposition syndrome. Advances in Skin & Wound Care, 2010; 23 (2): 81–92; quiz 93–94
- Jagtman BA, Kuiper JP, Brakkee AJ. [Measurements of skin elasticity in patients with lipedema of the Moncorps “rusticanus” type]. Phlebologie, 1984; 37 (3): 315–319
- Brenner E. What causes pain in lipedema? Lymphforsch, 2017; 21(1): 40–47
- Pou KM, Massaro JM, Hoffmann U, Vasan RS, Maurovich-Horvat P, Larson MG, et al. Visceral and subcutaneous adipose tissue volumes are cross-sectionally related to markers of inflammation and oxidative stress: The Framingham Heart Study. Circulation, 2007; 116 (11): 1234–1241
- Rutkowski JM, Davis KE, Scherer PE. Mechanisms of obesity and related pathologies: The macro- and microcirculation of adipose tissue. FEBS J, 2009; 276 (20): 5738–5746
- Mancuso P. The role of adipokines in chronic inflammation. Immunotargets Ther, 2016; 5: 47–56
- Crescenzi R, Marton A, Donahue PMC, Mahany HB, Lants SK, Wang P, et al. Tissue Sodium Content is Elevated in the Skin and Subcutaneous Adipose Tissue in Women with Lipedema. Obesity, 2018; 26 (2): 310–317
- Földi E, Földi M. Földi’s Textbook of Lymphology. München: Elsevier GmbH, 2006
- Gesellschaft Deutschsprachiger Lymphologen e. V. (GDL) (Hrsg.). S2k-Leitlinie „Diagnose und Therapie der Lymphödeme“ (AWMF-Leitlinienregister Nr. 058–001). Stand: 23.05.2017, gültig bis 22.05.2022. https://www.awmf.org/uploads/tx_szleitlinien/058–001l_S2k_Diagnostik_und_Therapie_der_Lymphoedeme_2019-07.pdf (Zugriff am 02.10.2020)
- Al-Ghadban S, Cromer W, Allen M, Ussery C, Badowski M, Harris D, Herbst KL. Dilated Blood and Lymphatic Microvessels, Angiogenesis, Increased Macrophages, and Adipocyte Hypertrophy in Lipedema Thigh Skin and Fat Tissue. J Obes, 2019. https://www.hindawi.com/journals/jobe/2019/8747461/ (Zugriff am 02.10.2020)
- Weissleder H, Brauer JW, Schuchhardt C, Herpertz U. [Value of functional lymphoscintigraphy and indirect lymphangiography in lipedema syndrome]. Z Lymphol, 1995; 19 (2): 38–41
- Bertsch T, Erbacher G. Lipödem – Mythen und Fakten Teil 2. Phlebologie, 2018; 47 (3): 120–126
- Cornely M. Das Lipödem an Armen und Beinen. Phlebologie, 2011; (1): 21–25
- Peled AW, Kappos EA. Lipedema: Diagnostic and management challenges. International Journal of Women’s Health, 2016; 8: 389–395
- Monnin-Delhom ED, Gallix BP, Achard C, Bruel JM, Janbon C. High resolution unenhanced computed tomography in patients with swollen legs. Lymphology, 2002; 35 (3): 121–128
- Tiedjen K‑U, Schultz-Ehrenburg U. Isotopenlymphographische Befunde beim Lipödem. In: Holzmann H, Altmeyer P, Hör G, Hahn K (Hrsg.). Dermatologie und Nuklearmedizin. Berlin, Heidelberg: Springer, 1985: 432–438
- Baumgart S, Müller-Oerlinghausen B, Schendera CFG. Wirksamkeit der Massagetherapie bei Depression und Angsterkrankungen sowie bei Depressivität und Angst als Komorbidität – Eine systematische Übersicht kontrollierter Studien. Physikalische Medizin Rehabilitationsmedizin Kurortmedizin, 2011; 21(04): 167–182
- Bertsch T, Erbacher G. Lipödem – Mythen und Fakten Teil 3. Phlebologie, 2018; 47 (4): 188–197
- Child AH, Gordon KD, Sharpe P, Brice G, Ostergaard P, Jeffery S, et al. Lipedema: An inherited condition. Am J Med Genet Part A, 2010; 152A (4): 970–976
- Bosman J. Lipoedema: Poor knowledge, neglect or disinterest? Journal of Lymphoedema, 2011: 6 (2): 109–111
- Herpertz U. Adipositas-Diagnostik in der Lymphologie. Warum der BMI bei Ödemen unsinnig sein kann! Lymphforsch, 2009; 13 (2): 34–37
- Reich-Schupke S. Besonderheiten der Kompressionstherapie bei adipösen Patienten. Adipositas – Ursachen, Folgeerkrankungen, Therapie, 2015; 09 (02): 81–86
- Faerber G. Adipositas und chronische Inflammation bei phlebologischen und lymphologischen Erkrankungen. Phlebologie, 2018; 47(02): 55–65
- Doerler M, Altmeyer P, Stücker M. Ulcus cruris venosum auf dem Boden eines Adipositas-assoziierten Dependency-Syndroms. Fallbericht mit Diskussion zur Pathogenese und Therapie. Phlebologie, 2013; 42 (04): 205–208
- Mensink GBM, Schienkiewitz A, Haftenberger M, Lampert T, Ziese T, Scheidt-Nave C. Übergewicht und Adipositas in Deutschland: Ergebnisse der Studie zur Gesundheit Erwachsener in Deutschland (DEGS1). Bundesgesundheitsbl, 2013; 56: 786–794
- Hilbert A, Ried J, Zipfel S, de Zwaan M. Stigmatisierung bei Adipositas. Adipositas – Ursachen, Folgeerkrankungen, Therapie, 2013; 07 (03): 150–153
- Bertsch T, Erbacher G. Lipödem – Mythen und Fakten Teil 3. Phlebologie, 2018; 47 (4): 188–197
- Wold LE, Hines EA, Allen EV. Lipedema of the legs; a syndrome characterized by fat legs and edema. Ann Intern Med, 1951; 34 (5): 1243–1250
- Bertsch T, Erbacher G. Lipödem – Mythen und Fakten Teil 3. Phlebologie, 2018; 47 (4): 188–197
- Michelini S, Chiurazzi P, Marino V, Dell’Orco D, Manara E, Baglivo M, et al. Aldo-Keto Reductase 1C1 (AKR1C1) as the First Mutated Gene in a Family with Nonsyndromic Primary Lipedema. Int J Mol Sci, 2020; 21 (17): 6264
- Bertsch T, Erbacher G, Corda D, Damstra RJ, Van Duinen K, Elwell R, et al. Lipoedema – myths and facts, Part 5: European Best Practice of Lipoedema – Summary of the European Lipoedema Forum consensus. Phlebologie, 2020; 49: 31–49
- Ringseis R, Eder K, Mooren FC, Krüger K. Metabolic signals and innate immune activation in obesity and exercise. Exercise Immunology Review, 2015; 21: 58–68
- Wegner M, Helmich I, Machado S, Nardi A, Arias-Carrion O, Budde H. Effects of Exercise on Anxiety and Depression Disorders: Review of Meta-Analyses and Neurobiological Mechanisms. CNS Neurol Disord Drug Targets, 2014; 13 (6): 1002–1014
- Konschake W, Valesky E, Stege H, Jünger M. Evidenz der Kompressionstherapie. Hautarzt, 2017; 68: 625–631
- Dissemond J, Kröger K, Stücker M. Evidenz der Kompressionstherapie unter besonderer Berücksichtigung der medizinischen adaptiven Kompressionssysteme. Hautarzt, 2020; 71: 301–308
- Baumgartner A, Hueppe M, Schmeller W. Long-term benefit of liposuction in patients with lipoedema: A follow-up study after an average of 4 and 8 years. Br J Dermatol, 2016; 174 (5): 1061–1067
- Wollina U, Heinig B. Treatment of lipedema by low-volume microcannular liposuction in tumescent anesthesia: Results in 111 patients. Dermatol Ther, 2019; 32 (2): e12820
- Dadras M, Mallinger PJ, Corterier CC, Theodosiadi S, Ghods M. Liposuction in the treatment of lipedema: A longitudinal study. Arch Plast Surg, 2017; 44 (4): 324–331
- Rapprich S, Baum S, Kaak I, Kottmann T, Podda M. Treatment of lipoedema using liposuction: Results of our own surveys. Phlebologie, 2015; 44 (03): 121–132
- Sandhofer M, Hanke CW, Habbema L, Podda M, Rapprich S, Schmeller W, et al. Prevention of Progression of Lipedema With Liposuction Using Tumescent Local Anesthesia: Results of an International Consensus Conference. Dermatol Surg, 2020; 46 (2): 220–228
- Gemeinsamer Bundesausschuss (G‑BA). Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Richtlinie über Maßnahmen zur Qualitätssicherung nach § 136 Absatz 1 Satz 1 Nummer 2 Fünftes Buch Sozialgesetzbuch (SGB V) bei Verfahren der Liposuktion bei Lipödem im Stadium III (QSRL Liposuktion): Erstfassung. Vom 19. September 2019. https:// www.g‑ba.de/downloads/40–268-6045/2019–09-19_QSMassnahmen_Liposuktion-Lipoedem-III_TrG.pdf (Zugriff am 02.10.2020)
- Wiedner M, Aghajanzadeh D, Richter DF. [Lipedema – basics and current hypothesis of pathomechanism]. Handchir Mikrochir Plast Chir, 2018; 50 (6): 380–385
- Bertsch T, Erbacher G, Corda D, Damstra RJ, Van Duinen K, Elwell R, et al. Lipoedema – myths and facts, Part 5: European Best Practice of Lipoedema – Summary of the European Lipoedema Forum consensus. Phlebologie, 2020; 49: 31–49
- Deutsche Gesellschaft für Phlebologie e. V. (DGP) (Hrsg.). S1-Leitlinie „Lipödem“ (AWMF-Leitlinienregister Nr. 037–012). Stand: 31.10.2015 (in Überarbeitung), gültig bis 30.06.2020. https://www.awmf.org/uploads/tx_szleitlinien/037–012l_S1_Lipoedem_2016-01-abgelaufen.pdf (Zugriff am 02.10.2020)