Einleitung
Herkömmliche Prothesensteuerung
Prothesen für die oberen Extremitäten müssen nicht nur viele Bewegungsmöglichkeiten bereitstellen, sondern auch exzellente Steuerbarkeit, Zuverlässigkeit und Anwenderfreundlichkeit bieten, um akzeptiert zu werden 1. Ein großer Teil dieser Prothesen sind Fremdkraftprothesen mit elektromyographischer (EMG) Mensch-Technik-Anbindung. Die Steuersignale werden durch einfache Ermittlung der Leistung des EMG gebildet 2. In einer typischen Prothese für Unterarmamputierte werden 2 EMG-Sensoren verwendet, je einer auf den Flexoren und Extensoren des Unterarms. Mit diesem Paar von unabhängigen, antagonistischen Signalen kann ein Prothesengelenk gesteuert werden, z. B. eine Hand mit den Bewegungen „Öffnen” und „Schließen”. Diese Platzierung erfüllt folgende Anforderungen:
- Unabhängigkeit: Das gemessene EMG soll unabhängig voneinander proportional steuerbar sein, um eine ungewollte (Ko-)Aktivierung von Prothesenfunktionen zu verhindern.
- Signalstärke: Die Leistung des verstärkten EMG muss für den (proportionalen) Aussteuerbereich der Prothese genügen.
- Störsicherheit: Laterale Sensorplatzierung im Prothesenschaft senkt Störungen durch Gleichtaktsignale und Abheben bei Belastung der Prothese im Alltag im Vergleich zur Platzierung im Ellenbeugen- oder Ulnabereich.
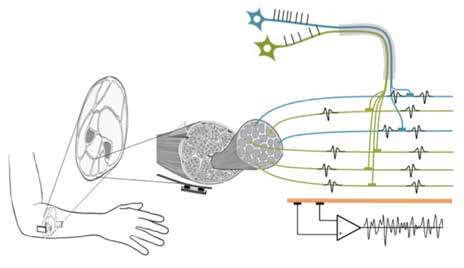
Da schon Probleme bei nur einer dieser Anforderungen die Steuerbarkeit stark erschweren können, ist es im Allgemeinen schwierig, eine den Anwender zufriedenstellende Prothesenversorgung zu erstellen. Zur Erzeugung der Steuersignale versucht der Anwender seine nicht (mehr) vorhandene Gliedmaße zu bewegen, wodurch ein oder mehrere Muskeln synergistisch vom zentralen Nervensystem angesteuert werden. Die von den aktivierten Motoreinheiten dieser Muskeln erzeugten Aktionspotenziale sind durch Volumenleitung als Summen-EMG an der Hautoberfläche messbar (Abb. 1). Die darin enthaltenen neuralen Steuersignale können auch wieder sehr genau ermittelt werden 3. Im Standardschema werden typischerweise Flexion und Extension des Handgelenks (HG) gewählt, da deren Synergismen die geforderte Unabhängigkeit gewährleisten. Somit wird eine bestimmte Prothesenbewegung wie „Hand-Öffnen” zumeist durch eine andere Steuerbewegung wie z. B. HG-Extension gesteuert. Sollen zusätzliche Prothesengelenke angesteuert werden, ergibt sich ein Problem: Es gibt mit den zwei Sensoren zu wenige Steuersignale. Die gängige Lösung ist, dass die Prothesengelenke sequenziell gesteuert werden. Hierbei ist immer nur ein Gelenk aktiv. Das nächste Gelenk wird aktiviert, indem Flexoren und Extensoren gleichzeitig kontrahiert werden. Es entstehen mehrere zusätzliche Bürden für den Anwender:
- Eine Bewegung mehrerer Gelenk
a. ist nicht simultan möglich und daher unnatürlich; damit wird das Handicap explizit sichtbar gemacht
b. muss vorher gut in Form sequenzieller Teile geplant werden
c. dauert unnötig lange. - Die zusätzliche Muskelkontraktion für das Schaltsignal ergibt eine weitere Verzögerung.
- Direkte, reaktive Bewegungen wie schnelles Loslassen in Gefahr sind nicht mehr möglich, da ggf. zuvor umgeschaltet werden muss.
Prothesensteuerung mit Mustererkennung
Unter der Annahme, dass die Restmuskulatur im Stumpf genügend Informationen über weitere Steuerbewegungen liefert, kann eine intuitive Prothesensteuerung mit Mustererkennung (ME) durchgeführt werden 4. Dabei wird aus mehrkanaligem EMG ein Satz von Merkmalen im Zeit- und Frequenzbereich extrahiert, der indirekt die Steuersignale der Motoreinheiten charakterisiert. Mathematisch bildet der Satz ein Muster in einem hochdimensionalen Raum, das mit ME in eine der vorgesehenen Bewegungen klassifiziert wird. Somit kann schließlich das gewünschte Gelenk der Prothese bewegt werden. Das Anpassen der ME an die individuellen Muster von Steuerbewegungen wird als „ME-Training” bezeichnet. Es ist für dieses Verfahren nicht notwendig, unabhängige starke Signale zu haben. Diese müssen aber unterschiedlich und reproduzierbar sein. Der ME-Ansatz überwindet die oben angegebenen Nachteile der direkten Leistungssteuerung, entspricht dem akademischen Stand der Technik 5 und wurde seit 1960 in einer Vielzahl von algorithmischen Varianten untersucht 6. Meist werden unter Laborbedingungen erfolgversprechende Erkennungsraten > 95 % für viele Bewegungen angegeben 7. Praxistauglichkeit ist allerdings bis jetzt kaum gegeben, da die Robustheit unter variierenden Anwendungsbedingungen stark abnimmt:
- Kontraktionsstärke: proportionale Steuerung;
- Elektrodenposition: Anlegen der Prothese;
- Armstellung: Alltagsaktivitäten (Activities of Daily Living, ADL).
Scheme gibt eine gute Übersicht zu diesen durch die Anwendung der Prothese gegebenen Einflussfaktoren auf das EMG und deren Kompensation durch ME 8.
Im Gegensatz zu den Anwendungsbedingungen sind die Steuerbewegungen vom Anwender bestimmt. Sie definieren, welche Motoreinheiten neural angesteuert werden, und folglich, welche Muskeln im Stumpf kontrahieren. Dies bestimmt das räumliche innere EMG und damit auch das Oberflächen-EMG (Abb. 1). Die Steuerbewegung hat den potenziell größten Einfluss auf die erzielbare Erkennungsrate und Robustheit. Entscheidend ist, dass sich die (Muster der) Steuerbewegungen ausreichend unterscheiden und mit geringer synergistischer Varianz reproduzierbar sind. Neben der muskulären Anatomie hängt dies vor allem von der neuralen Ansteuerung durch den Anwender ab. Wird dies nicht berücksichtigt und davon ausgegangen, dass die Kontraktionen von Beginn an differenziert und exakt reproduzierbar sind, wären Fehler ausschließlich auf unzureichende ME zurückzuführen und folglich durch deren Verbesserung behebbar („einfacher Ansatz”). Da einem Amputierten seine Gliedmaße fehlt, kann er deren Bewegung lediglich versuchen. Wenn die zuständige Muskulatur noch vorhanden und innerviert ist, wird diese kontrahieren und dabei ein EMG entstehen. Einem Amputierten fehlt jedoch im Vergleich zum Unversehrten visuelles Feedback durch die Bewegung der Gliedmaße. Darüber hinaus fehlt die afferente Kopplung teilweise. Deshalb ist analog zum offenen Regelkreis davon auszugehen, dass die neurale Ansteuerung und damit das EMG undifferenzierter als bei einer intakten Gliedmaße sind. In einem Vergleich wurde eine fast doppelt so hohe Fehlerrate von Amputierten gegenüber Unversehrten ermittelt 9.
Idealerweise kann eine Prothese nach dem Anlegen sofort benutzt werden, ohne sie davor mit den gerade aktuellen Signalen zu kalibrieren. Die Prothese soll zuverlässig und vorhersagbar auf Steuerbewegungen reagieren, auch wenn ADL das EMG beeinflussen. Die ME könnte entweder durch neues Training für eine Situation spezialisiert werden oder demgegenüber invariant sein. Im Fehlerfall aufgrund temporärer Signalstörungen würde die spezialisierte ME den Fehler gelernt haben und möglicherweise nicht mehr ohne die Störungen funktionieren. Die invariante ME hingegen zeigt immer dieselbe Reaktion auf EMG, allerdings auf Kosten eines höheren anfänglichen Trainingsaufwandes.
In einer Langzeitfallstudie wurde untersucht, ob ME trotz EMG-Varianz durch die oben genannten Anwendungsbedingungen robust über mehrere Monate funktioniert. Dazu wurden die Steuerbewegungen optimiert und die Anwendungsbedingungen im ME-Training berücksichtigt.
Methoden und Ergebnisse
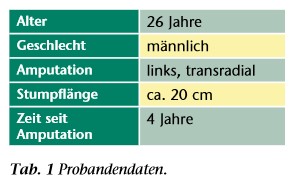
Der Proband (Tab. 1) hatte eine elektive Amputation der oberen Extremität nach einer erfolglosen plastischen Rekonstruktion aufgrund eines Starkstromunfalls 10. Durch den Unfall musste ein Großteil der Flexoren im Unterarm entfernt werden. Der Stumpf weist keine sichtbaren Atrophien in der erhaltenen Muskulatur auf. Im Elektrodenbereich ist teilweise einzugsfreies Narbengewebe auf der Haut vorhanden, das aber auch bei Kontraktion keinen Elektrodenkontaktverlust verursacht.
Prothese
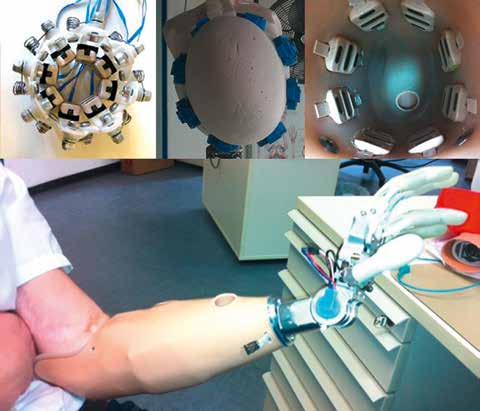
Obwohl für ME 4 optimal platzierte EMG-Sensoren ausreichend sind 11, werden 8 Stück verwendet, gleichmäßig als Ring verteilt. Abbildung 2a–c zeigt das in der Bewegungsanalysephase verwendete, sich automatisch an den Stumpf anpassende Array und die Innenansicht der Prothese. Das Array wurde ca. 10 cm distal vom Olecranon platziert, um möglichst viele Muskeln abzudecken und um starke Signale zu bekommen. Die verwendeten EMG-Sensoren sind aktive Trockenelektroden mit differentieller Ableitung und eigenem Referenzkontakt (3 Pole, siehe Abb. 2c).
Die Prothese (Abb. 2d) ist mit Rotationseinheit, Flexionseinheit und einer Michelangelo-Hand von Otto Bock aufgebaut. Integriert sind 8 EMG-Sensoren, die Einheit für die Ausführung der ME sowie der Akkumulator. Der komplette Aufbau entspricht gewichtsmäßig einer Alltagsprothese.
Obwohl eine Vielzahl von aufwendigen EMG-Merkmalen und ME-Verfahren untersucht wurde, bilden Hudgins-Merkmale und Lineare Diskriminanzanalyse (LDA) nach wie vor einen robusten und leistungsfähigen Ansatz für die Bewegungserkennung 12. Die Hudgins-Merkmale beinhalten neben der Signalleistung noch die Anzahl der Nulldurchgänge, die Signalkurvenlänge und die Anzahl der Extrema. Das Roh-EMG wurde mit 1,8 kHz, 10 Bit Auflösung und 500 Hz Bandbegrenzung digitalisiert. Die Merkmale wurden aus EMG-Fenstern von 150 ms Länge alle 100 ms berechnet, wodurch sich eine Überlappung von 50 ms ergibt. Diese Wahl ist ein Kompromiss aus Erkennungsrate und Echtzeitfähigkeit. Bei 8 Signalen ergibt sich ein 32-dimensionaler Merkmalsvektor, der mit LDA in eine Bewegungsvorhersage klassifiziert wird. Dem Prothesenaufbau entsprechend ist diese eine von 8 Klassen: 7 Bewegungen und keine Bewegung.
Zwischen dem Anlegen des Arrays bzw. der Prothese zu Beginn einer Sitzung und dem Start der EMG-Aufzeichnung wurde ein Zeitraum von 10 Minuten eingehalten. Dadurch sind die Hautübergangswiderstände niedrig gegenüber der Verstärkereingangsimpedanz. Nach Herstellung der galvanisch getrennten Verbindung zum PC mit der Aufzeichnungssoftware wurde die Signalqualität auf Störungen durch Bewegungsartefakte und Netzbrummen geprüft.
Optimierung der Steuerbewegungen
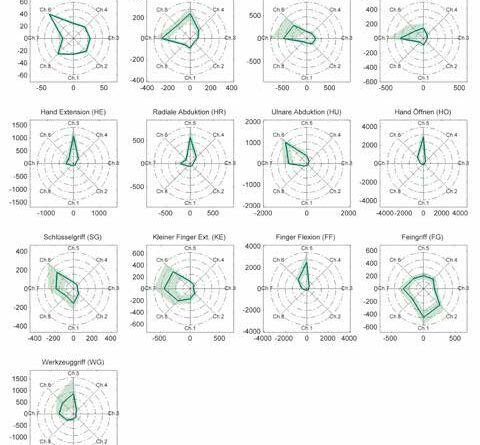
Im Gegensatz zu Unversehrten sind bei Amputierten zusätzlich zur abweichenden Anatomie oft Defizite in der neuralen Ansteuerung von Steuerbewegungen vorhanden. Der Proband und weitere Amputierte berichteten, sie könnten „nicht sehen, was sie tun”. Initiale Tests entsprechend dem erwähnten „einfachen Ansatz” ergaben hohe Performance, die aber nicht in Live-Tests umgesetzt werden konnte. Ursachen waren primär in geringer Unterschiedlichkeit und sekundär in geringer Reproduzierbarkeit der neuralen Ansteuerung zu finden. Zur Differenzierung und Festigung der Motorprogramme wurde das fehlende intrinsische Feedback durch ein visuelles ersetzt. Eine Möglichkeit, dies umzusetzen, sind Kontraktionsprofile mit Feedback der Kontraktionsstärke und dimensionsreduzierte Punktwolkendarstellungen 13. Die ausschließliche Darstellung der Kontraktionsstärke als Signalleistungssumme lässt jedoch kaum eine Aussage darüber zu, welche Muskeln aktiv sind. Das Feedback sollte für gleiche Steuerbewegungen gleich aussehen, auch wenn eine andere Bewegung geändert oder die ME neu trainiert wird. Diese scheinbar triviale Anforderung kann mit Punktwolkendarstellungen durch Dimensionsreduktion mit Principal Components Analysis (PCA) oder LDA nicht eingehalten werden, da die Projektionsrichtung datenabhängig ist. Die gewählte Lösung bestand darin, die Muster der Steuerbewegungen ohne Projektion als Sterndiagramm aller 8 Signalleistungen darzustellen (Abbildung 4 zeigt normierte Muster). Darin erhält jede Steuerbewegung eine Zuordnung zu einer bestimmten, charakteristischen Form (Polygon), die durch variierende Kontraktionsstärke zwar skaliert, aber kaum verändert wird. Neben dem Probanden kann auch der Experimentator bzw. Therapeut vom Sterndiagramm profitieren: Durch Zuordnung des Sensorringes zum Sterndiagramm und wiederum dessen Zuordnung zum muskulären Unterarmquerschnitt (Abb. 1) ist eine Interpretation der aktiven Muskeln möglich. Dadurch kann einfach erkannt werden, ob der Proband die physiologisch richtigen Muskeln nutzt, wie stark die Kontraktion ist und ob unerwünschte Ko-Kontraktionen vorliegen.
Vor Durchführung der Langzeituntersuchung wurde mit Blick auf die bereits erwähnten fehlerverstärkenden Anwendungsbedingungen versucht, eine robuste Basis von sicher trennbaren Bewegungen für die Steuerung der Prothese zu finden. Durch Feedback-Training wurden die Motorprogramme der Bewegungen differenziert und gefestigt. Somit konnte eine zuverlässige Offline-Analyse durchgeführt werden. Wie in Abbildung 4 dargestellt wurden 7 intuitive, d. h. den Bewegungen der Prothese entsprechende Bewegungen untersucht:
- Hand-Supination (HS)
- Hand-Pronation (HP)
- HG-Flexion (HF)
- HG-Extension (HE)
- Hand-Öffnen (HO)
- Schlüsselgriff (SG)
- Feingriff (FG)
Zudem wurden 5 alternative Bewegungen untersucht:
- Hand-Ulnarabduktion (HU)
- Hand-Radialabduktion (HR)
- Kleinfinger-Extension (KE)
- Flexion der Finger II bis V im Metacarpophalangealgelenk (FF)
- Ring- und Kleinfingerflexion (Werkzeuggriff, WG)
Mit den alternativen Bewegungen konnten bei Bedarf problematische intuitive ersetzt werden. Es wurde nur mit Variation der Kontraktionsstärke aufgezeichnet, um Fehler möglichst eindeutig auf die Trennbarkeit der Bewegungen zurückführen zu können.
Der Proband berichtete von einem unangenehmen Gefühl, einem Kribbeln, bei der Flexion. Diese wies auch eine niedrige EMG-Amplitude (Abb. 2) sowie geringe Reproduzierbarkeit auf. Bei Betrachtung der erläuterten Amputationsdaten erscheint dies plausibel. Ähnlich dazu variierte der Schlüsselgriff stark und wurde mit dem Feingriff verwechselt, obwohl der Proband hier kein unangenehmes Gefühl anführte. Tabelle 2 zeigt alle Bewegungen aus Abbildung 4 und die daraus gebildeten Bewegungssätze. Der intuitive Bewegungssatz hat eine relativ hohe AER von 7,4 % (TER 7,9 %). Die alternativen Bewegungssätze 1 bis 3 weisen AER von 2,9 bis 7,8 % auf. „Alternativ 1″ ersetzt die problematische Flexion mit Ulnarabduktion, eine physiologisch naheliegende und vom Probanden als angenehm beschriebene Lösung. Der Schlüsselgriff wurde mit dem Werkzeuggriff ersetzt, da dieses Griffmuster den größten Unterschied zum Feingriff aufweist. Aus Sicht der geringen AER von 2,9 % ist dieser Ansatz sinnvoll. Hinter „Alternativ 2″ steht die Absicht, den Fehler durch alternative Griffmuster mit Finger-Flexion und Finger-Extension zu reduzieren. Leider ist die AER mit 7,8 % hoch. Auch „Alternativ 3″ (wie „Alternativ 1″, nur mit Radial- statt Ulnarabduktion) bringt mit 6,8 % AER keine nennenswerte Verbesserung. Die TER ist nur wenig höher als die AER (ähnlich 14). Um eine Prothese auch unter dem Einfluss von Anwendungsbedingungen zuverlässig zu steuern, ist es entscheidend, gut trennbare Muster zu verwenden. Es wurde der Bewegungssatz „Alternativ 1″ gewählt, da dieser weniger als 50 % der Fehlerraten aller anderen aufwies.
Kompensation peripherer Einflüsse mit Mustererkennung
Ein Hauptziel dieser Arbeit war die Untersuchung, wie stark die Fehler unter Einfluss von Anwendungsbedingungen zunehmen und wie weit sich diese durch Berücksichtigung im ME-Training reduzieren lassen.
Als Fehlermetrik wurde die Rate der falschen Bewegungen („Active Error Ratio”, AER) verwendet 15. Da die AER nur ungewollte Bewegungen der Prothese erfasst, muss für den Fall, dass sich die Prothese gar nicht bewegt, noch die Gesamtfehlerrate („Total Error Ratio”, TER) angegeben werden, die in diesem Fall 100 % betragen würde. Die AER wird hier als primärer Indikator für die Brauchbarkeit der Prothese verwendet.
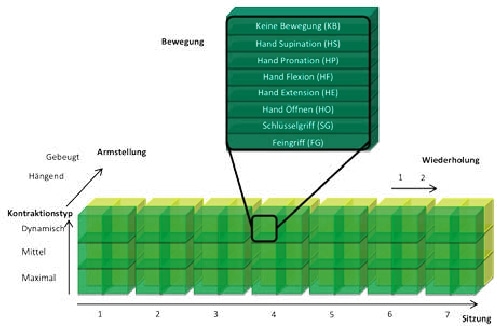
Für die Langzeituntersuchung wurde, wie in Abbildung 3 dargestellt, eine 8×3×2×2×7‑Matrix mit in Summe 672 Kontraktionen zu je 3 s Dauer in 6 Monaten aufgenommen. Zu Beginn jeder der 7 Sitzungen wurde die Prothese angelegt und erst nach Aufnahme aller 8 Bewegungen, 3 Kontraktionstypen, 2 Wiederholungen und 2 Armstellungen wieder abgelegt. Dazu wurde dem Probanden von der Aufzeichnungssoftware ein Bild einer unversehrten Gliedmaße mit der durchzuführenden Bewegung gezeigt. Die Kontraktionsstärke wurde vom Probanden subjektiv eingehalten und durch den Experimentator anhand des rohen EMG auf Plausibilität geprüft. Nach jeder Kontraktion wurde eine kurze Pause zur Vermeidung übermäßiger muskulärer Ermüdung und zur Vorbereitung auf die nächste Kontraktion eingehalten.
Zur Ermittlung der Fehlerraten wurden die zu analysierenden Kontraktionen in Test- und Trainingsdaten aufgeteilt. Mit Letzteren wird die ME trainiert und gegen Erstere getestet. Für jene Untersuchungen, in denen Test- und Trainingsdaten gleich waren, z. B. die Fehlerrate in einer Sitzung, wurde Kreuzvalidierung angewendet. Dabei wird jede Kontraktion einzeln gegen alle restlichen getestet und anschließend gemittelt. Kontraktionen wurden nicht zerteilt, um Ergebnisverfälschung durch ähnliche Test- und Trainingsdaten auszuschließen. Das ME-Training unter Laborbedingungen wurde mit statischer Kontraktion, hängendem Arm, allen Wiederholungen und einer Sitzung durchgeführt. Die AER unter Laborbedingungen ist die Referenz für die folgenden Messungen und wurde mit dem gleichen EMG wie beim Training mit Kreuzvalidierung ermittelt. Dies wurde für alle Sitzungen wiederholt, um die finalen Fehlerraten als Sitzungsmittelwert zu erhalten. Um den Einfluss der Anwendungsbedingungen zu ermitteln, wurden bei unveränderter ME (gleichbedeutend mit Laborbedingungen) sukzessive mehr Anwendungsbedingungen getestet. Für den Einfluss der Kontraktionsstärke wurden zum Test alle Kontraktionen verwendet. Für den Einfluss der Armstellung wurden zusätzlich alle Armstellungen verwendet, womit alle vorhandenen Kontraktionen pro Sitzung getestet wurden. Für den Einfluss des Anlegens der Prothese wurden schließlich alle Sitzungen außer der trainierten getestet („trainiere 1″). Dies entspricht dem Praxisfall, dass eine Prothese angelegt wird, ohne dass die ME neu trainiert wird. Daher können keine Kontraktionen aus einer Testsitzung in der Trainingssitzung vorhanden sein.
Die sich daraus ergebende Frage ist, ob die verglichen mit Laborbedingungen erhöhte Varianz im EMG kompensiert werden kann. Für diese Analyse wurden alle Kontraktionen vom jeweiligen Test auch in das ME-Training integriert. Nur für die Kompensation des Anlegens gilt – in umgekehrter Analogie zur erwähnten Konvention beim Training unter Laborbedingungen –, dass alle Sitzungen außer der getesteten trainiert („trainiere 6 restliche”) werden.
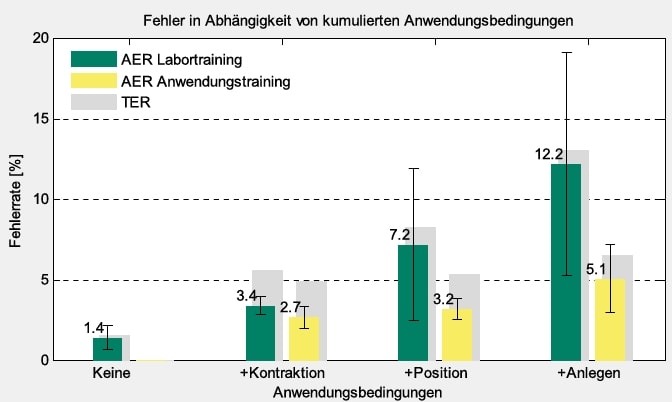
Das Ansteigen der AER bei zunehmendem Einfluss von Anwendungsbedingungen wird in Abbildung 5 gezeigt. Der Ausgangswert ergibt für ME-Training unter Laborbedingungen 1,4 % AER. Lediglich durch Hinzunahme der dynamischen Kontraktion erhöht sich die AER auf mittlere 3,4 % mit niedriger Varianz. Der hohe TER-Zuwachs lässt sich durch die schwachen Anteile bei Beginn und am Ende erklären, die überwiegend als keine Bewegung klassifiziert werden. Kommt zusätzlich der abgewinkelte Arm dazu, verdoppelt sich die AER auf 7,2 % mit viel höherer Varianz. Wird dann noch die Prothese neu angelegt, ergibt sich nochmals eine AER-Verdopplung auf 12,2 %. Werden hingegen Anwendungsbedingungen mit ME trainiert (Abb. 5 gelbe Balken), kann der Einfluss durch Kontraktionstyp und Armstellung auf 3,2 % bei niedriger Varianz begrenzt werden, wenn jedes Anlegen der Prothese trainiert wird. Wird die Prothese hingegen vor dem Anlegen mit den restlichen 6 Sitzungen trainiert, kann mit 5,1 % ein immer noch niedriger Wert erreicht werden, obwohl die getesteten Sitzungen zur Gänze unbekannt sind.
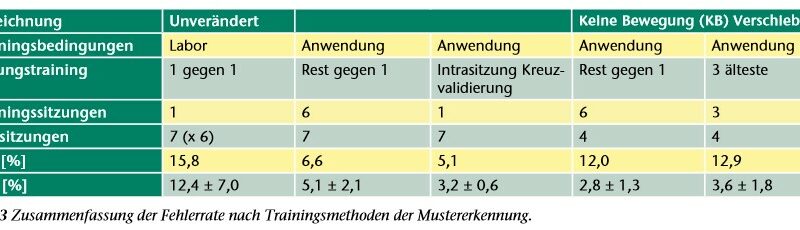
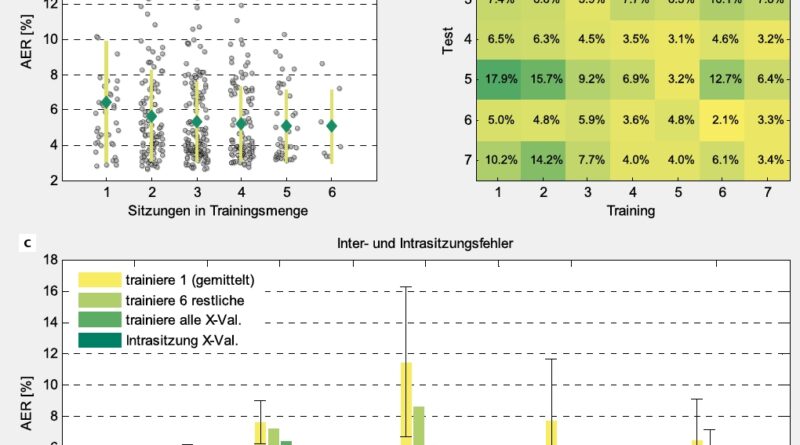
Inter- und Intrasitzungsfehler werden in Abbildung 6 abhängig vom Trainingsaufwand dargestellt. Die Hauptdiagonale in Abbildung 6b zeigt die Intrasitzungsfehler. Wenn die Prothese also nach jedem Anlegen mit allen Anwendungsbedingungen trainiert wird, ist die AER nie größer als 4 %. Felder abseits der Hauptdiagonale entsprechen dem Intersitzungsfehler und werden in a) bei x = 1 gesammelt dargestellt. Bei ME-Training vor dem Anlegen reichen maximale Fehler bis 18 %, können jedoch durch Verwenden größerer Trainingssets auf 8 % bei 6 Sitzungen begrenzt werden. Der mittlere Fehler lässt sich dadurch aber nur von 6,5 auf 5,1 % verringern. Wird die aktuelle, d. h. die getestete, Sitzung hinzugenommen („trainiere alle X‑Val.”), sinkt der mittlere Fehler auf 4,3 % und kommt damit nicht unter den Intrasitzungsfehler (Mittelwert der Hauptdiagonale) von 3,2 %.
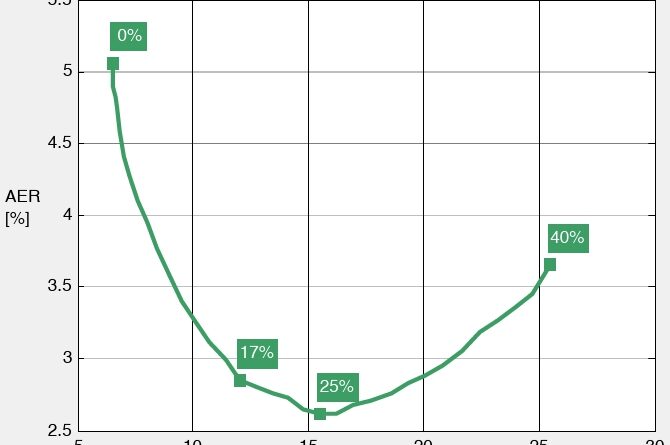
Es ist aus Anwendersicht vorteilhaft, wenn die Prothese im Zweifelsfall statt einer falschen Bewegung keine macht 16. Da die Fehlerrate bei schwachen Kontraktionen tendenziell höher als bei kräftigen ist 17, kann die AER (auf Kosten höherer TER) potenziell gesenkt werden, indem die Prothese bei sehr schwachen Kontraktionen keine Bewegung ausführt. Dies kann im ME-Training durch Verschiebung von Bewegungsanteilen unterhalb eines Leistungsschwellwertes in die „Keine-Bewegung”-Klasse umgesetzt werden. Abbildung 7 zeigt den Zusammenhang aus AER und TER, wenn beginnend von 0 % EMG immer mehr schwaches EMG verschoben wird. Der erste Punkt bei 5,1 % AER und 0 % Verschiebung entspricht den „Trainiere-6-restliche”-Fällen aus Abbildung 5 und Abbildung 6. Die AER fällt steil ab und erreicht bei 16 % TER ihr Minimum von 2,6 %. Eine Verschiebung von 17 % reduziert die AER auf 2,8 % und wurde als Kompromiss bei einer verdoppelten TER von 12 % gewählt. Demzufolge reagiert die Prothese bei den schwächsten 9,4 % der Kontraktionen mit keiner Bewegung.
Da die Sitzungen im Wesentlichen eine Zeitreihe sind, stellt sich die Frage der Abhängigkeit der Fehlerrate von zeitlichen Aspekten. Dafür wurde der Unterschied zwischen einem einmal zum Start der Betrachtung mit den 3 ältesten Sitzungen trainierten System und einem immer mit den letzten 3 Sitzungen trainierten System ermittelt. 3 Trainingssitzungen liefern bereits eine niedrige Fehlerrate (vgl. Abb. 6a). Bei diesen „kausalen” Methoden ist das Training immer älter als der Test – so wie es real umsetzbar ist. Zum Test verblieben nur die letzten 4 Sitzungen. Das einmal trainierte System liefert mit 3,6 % AER eine sehr akzeptable Performance, verglichen mit 3,0 % der aufwendigeren Methode des viermal mit den je 3 letzten Sitzungen trainierten Systems. Beide kausalen Methoden sind nur geringfügig schlechter als der nichtkausale Vergleichswert von 2,5 % (Mittel der letzten 4 Sitzungen der „Trainiere-6-restliche”-Methode mit 17 % Verschiebung aus Abb. 6c).
Schlussfolgerung
Die Fehlerrate der Steuerung verschlechtert sich unter Anwendungsbedingungen wie unterschiedlichen Kontraktionsstärken, Armstellungen und Anlegen der Prothese maßgeblich (9‑fach). Durch ME-Training können diese Einflüsse – inklusive Anlegen – zwar nicht vollständig, aber zu mehr als 50 % kompensiert werden (siehe Abb. 5). Der bei optimaler Kompensation minimal erzielbare Fehler hängt wesentlich von den Steuerbewegungen ab (siehe Tab. 2). Falls diese nicht gut gewählt werden, könnte die Fehlerrate zu hoch für ADL-Tauglichkeit sein. Intuitives Echtzeitfeedback des Bewegungsmusters (siehe Abb. 4) dient als essenzielles Werkzeug für die Entwicklung und Analyse der neuralen Motorsteuerung. Durch Ersetzen von 2 Bewegungen wurde die Basis für robusten Betrieb unter Anwendungsbedingungen geschaffen. Mit KB-Verschiebung konnte die Rate der falschen Bewegungen (AER) auf Kosten der Sensitivität für sehr schwache Kontraktionen annähernd halbiert werden. Mit 2,8 % war sie sogar niedriger als bei vollständigem Training nach jedem Anlegen (Tab. 3). Wird die ME gar nur einmal zu Beginn trainiert, führt dies zu einer nur moderaten Fehlerzunahme, vor allem in Anbetracht des viel geringeren Aufwands. Eine Reduktion des ME-Trainingsaufwands, d. h. der Anzahl abzudeckender Kontraktionstypen und Armstellungen, ist wünschenswert, jedoch bei täglichem Training wesentlich bedeutsamer als bei einmaligem. Eine mögliche Strategie für praktische Anwendung wäre die (einmalige) Erstellung einer umfassenden Grundeinstellung der ME, die vom Anwender, falls notwendig, durch kurze Kalibration anpassbar ist.
Nutzen für den Prothesenträger
Eine qualitative Bewertung der Ergebnisse wird hier durch eine Probandenaussage gegeben. Bei AER < 3 % wurden unterbrechungsfreie, kontinuierliche Bewegungen beobachtet. Der Proband bewertete die Steuerbarkeit als brauchbar. Durch KB-Verschiebung verringerte Sensitivität wurde vom Probanden wahrgenommen, aber gegenüber ungewollten Bewegungen bevorzugt. Mit klassifizierender ME sind zwar per definitionem keine simultanen Bewegungen mehrerer Gelenke möglich, aber auch ungewollte simultane Bewegungen ausgeschlossen. Diese sind eine Herausforderung in Regressionsansätzen und auch in TMR-Versorgungen mit mehrkanaliger, direkter Leistungssteuerung. Der Alltagsnutzen einer Prothese hängt jedoch noch von weiteren Faktoren außerhalb des Bereichs dieser Untersuchung ab. So wünschte sich der Proband ein mechanisch flexibles Handgelenk. Für diese Ergebnisse muss berücksichtigt werden, dass der Proband die Prothese nicht täglich genutzt hat. Man kann davon ausgehen, dass durch das Feedback der täglichen Nutzung – in Analogie zum beschriebenen EMG-Feedback – eine Festigung der Motorprogramme auftritt. Es müssten dann nur noch physikalische Effekte, z. B. Elektrodenversatz nach dem Anlegen, durch die ME kompensiert werden.
Obwohl es sich bei dieser Untersuchung um eine Fallstudie handelt, zeigen die Ergebnisse dennoch, welche Verbesserungen bei Prothesensteuerung mit ME, unabhängig vom eingesetzten ME-Verfahren, möglich sind. Für den vorliegenden Fall muss das teilweise Fehlen der Flexoren erschwerend berücksichtigt werden. Tests mit Probanden mit vollständiger Unterarmmuskulatur zeigen, dass robuste Performance schneller und einfacher erreichbar ist. Im Gegensatz zu technisch und funktional komplexeren Ansätzen ist die vorliegende Multikanal-EMG-Mensch-Maschine-Schnittstelle gut untersucht und mit der heutigen Mikroprozessortechnik platz- und energieeffizient realisierbar. Die Autoren sind überzeugt, dass die direkte, umschaltfreie und intuitive Steuerung in alltagstauglichen Prothesen ein neues Kapitel der Extremitätenrekonstruktion eröffnen wird.
Für die Autoren:
Dipl.-Ing. (FH) Georg Brandmayr
Otto Bock Healthcare Products GmbH
Kaiserstraße 39
A‑1070 Wien
georg.brandmayr@ottobock.com
Begutachteter Beitrag/reviewed paper
Brandmayr G, van Vliet HW. Zuverlässigkeitsanalyse intuitiver Prothesensteuerungen der oberen Extremität. Berücksichtigung essenzieller Einflussfaktoren für erfolgreiche prothetische Anwendung. Orthopädie Technik, 2015; 66 (5): 20–29
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- iOrt – Entwicklung einer überwachenden Orthese mit neuartigem optischen Sensorsystem — 11. Februar 2026
- Atkins DJ, Heard DCY, Donovan WH. Epidemiologic Overview of Individuals with Upper-Limb Loss and Their Reported Research Priorities. J Prosthet Orthot, 1996; 8 (1): 2–11
- Parker P, Englehart K, Hudgins B. Myoelectric Signal Processing for Control of Powered Limb Prostheses. J Electromyogr Kinesiol, 2006; 16 (6): 541–548
- Holobar A, Farina D. Blind Source Identification from the Multichannel Surface Electromyogram. Physiol Meas, 2014; 35: R143-165
- Hargrove LJ, Englehart K, Hudgins B. A Comparison of Surface and Intramuscular Myoelectric Signal Classification. IEEE Trans Biomed Eng, 2007; 54: 847–853
- Parker P, Englehart K, Hudgins B. Myoelectric Signal Processing for Control of Powered Limb Prostheses. J Electromyogr Kinesiol, 2006; 16 (6): 541–548
- Jiang N, Dosen S, Muller KR, Farina D. Myoelectric Control of Artificial Limbs: Is There a Need to Change Focus? [In the Spotlight]. IEEE Signal Process Mag, 2012; 29: 150–152
- Hargrove LJ, Englehart K, Hudgins B. A Comparison of Surface and Intramuscular Myoelectric Signal Classification. IEEE Trans Biomed Eng, 2007; 54: 847–853
- Scheme E, Englehart K. Electromyogram Pattern Recognition for Control of Powered Upper-Limb Prostheses: State of the Art and Challenges for Clinical Use. J Rehabil Res Dev, 2011; 48: 643
- Scheme EJ, Englehart KB, Hudgins BS. A One-versus-One Classifier for Improved Robustness of Myoelectric Control. Proceedings of the 18th Congress of the International Society of Electrophysiology and Kinesiology, 2010
- Aszmann OC. Bionische Rekonstruktion der oberen Extremität. Orthopädie-Technik, 2013; 64 (6): 34–39
- Hargrove LJ, Englehart K, Hudgins B. A Comparison of Surface and Intramuscular Myoelectric Signal Classification. IEEE Trans Biomed Eng, 2007; 54: 847–853
- Hargrove LJ, Englehart K, Hudgins B. A Comparison of Surface and Intramuscular Myoelectric Signal Classification. IEEE Trans Biomed Eng, 2007; 54: 847–853
- Göbel P, Honeder JL, Erber S, van Vliet H‑W. Visuelles Biofeedback für anwenderorientiertes Training und Steuerung von multifunktionalen Oberflächen-EMG Prothesen. Orthopädie Technik, 2013; 64 (2): 38–44
- Scheme EJ, Englehart KB, Hudgins BS. A One-versus-One Classifier for Improved Robustness of Myoelectric Control. Proceedings of the 18th Congress of the International Society of Electrophysiology and Kinesiology, 2010
- Scheme E, Englehart K. Electromyogram Pattern Recognition for Control of Powered Upper-Limb Prostheses: State of the Art and Challenges for Clinical Use. J Rehabil Res Dev, 2011; 48: 643
- Scheme E, Englehart K. Electromyogram Pattern Recognition for Control of Powered Upper-Limb Prostheses: State of the Art and Challenges for Clinical Use. J Rehabil Res Dev, 2011; 48: 643
- Rossacher J. Comparison of Different Training Strategies for EMG Based Pattern Recognition. FH-Technikum Wien, 2012