Einleitung
Bisher gibt es keine Berichte über die Wiederherstellung des sensorischen Feedbacks durch Nervenimplantate bei Menschen mit Ober- oder Unterschenkelamputation. Diese Prothesenträger sind folgenden Erschwernissen ausgesetzt:
- einem erhöhten Sturzrisiko 1,
- einem erhöhten Energieverbrauch 2,
- einer allgemein reduzierten Mobilität 3,
- einem erhöhten kognitiven Aufwand beim Gehen 4
- sowie zu einem hohen Anteil wiederkehrenden Phantomschmerzen 5.
Neueste Fortschritte demonstrieren ein sensorisches Feedback mit nichtinvasiven Methoden wie permanenter zeitdiskreter 6 7, vibrierender oder elektrokutaner Stimulation 8. Allerdings wurden diese Methoden bei Menschen mit einer Unterschenkelamputation eingesetzt und zeigten nur geringe Effekte auf Gangsymmetrie und Standstabilität 9 10. Eine direkte Nervenstimulation durch „transversale intrafaszikuläre Mehrkanal-Elektroden“ („transversal intrafascicular multichannel electrodes”; TIMEs) wurde in Langzeitstudien bei Menschen mit einer Amputation der oberen Extremität eingesetzt und konnte den Tastsinn wieder nachbilden. Für Betroffene mit einer Amputation der unteren Gliedmaßen konnten die wenigen Veröffentlichungen dagegen noch keinen klaren, signifikanten Nutzen nachweisen 11 12. Ziel der hier vorgestellten Studien ist es somit zu zeigen, dass die Funktion eines homologen, somatotopischen sensorischen Feedbacks bei Betroffenen mit Oberschenkelamputation wiederhergestellt werden kann und dass dies die Mobilität mit der Prothese verbessert und zur Förderung der Integration ins Körperschema beiträgt.
Methodik
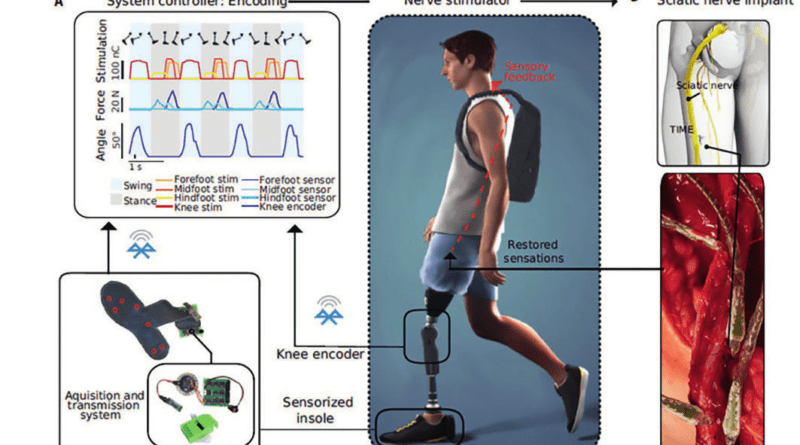
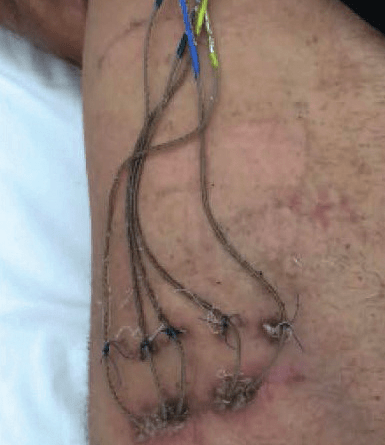
Bei drei Probanden mit einseitiger Oberschenkelamputation (S1–S3) wurden vier TIMEs für 90 Tage am distalen Ende des Tibianervs des Stumpfes implantiert (Abb. 1). Eine individuell angepasste Oberschenkelprothese, bestehend aus den Elementen „TF Direct Socket“, „Iceross Seal-In X5 TF Liner“, „Rheo Knee XC“ und einem Fuß „Pro-Flex XC“ des isländischen Passteilherstellers Össur wurde 2 bis 3 Wochen nach der Implantierung angefertigt und als alltägliche und einzige Prothesenversorgung getragen. Das „Rheo Knee XC“ verfügt über einen integrierten Encoder, der den Kniewinkel mit einer Auflösung von 1° erfasst und ihn bei einer Frequenz von 50 Hz per Bluetooth übermitteln kann. Der Knie-Encoder und eine speziell für diese Aufgabe entwickelte Druckmesssohle (SensArs Neuroprosthetics, Lausanne, Schweiz), die unter dem Prothesenfuß platziert wurde, übermitteln ihre Signale via Bluetooth an ein externes Steuergerät (Controller). Dieses verrechnet diese Informationen und gibt sie über den Stimulator an die TIMEs weiter, wo sie entsprechende Nervenstimuli auslösen (Abb. 2). Die Daten aus dem integrierten Encoder im „Rheo Knee XC“ und aus drei von sieben Sensoren der Druckmesssohle werden als Steuerimpulse für die vier angeschlossenen Nervenstellen genutzt. Bei allen Probanden übermitteln drei der Nervenansatzstellen das Gefühl von Berührung, Druck oder Vibration im Bereich des Vorfußes, des Mittelfußes und des Fersenbereichs, die vierte Nervenansatzstelle die Anregung der Wadenmuskulatur zur Wahrnehmung des Kniegelenkwinkels (bei S1 und S2 durch das Gefühl von Kontraktion des Gastrocnemius, bei S3 durch ein Druckgefühl auf den Gastrocnemius). Die Wahrnehmung von Bodenkontakt und Kniegelenksbewegung durch direkte Nervenstimulation wurde sofort und ohne zusätzliches Training bei jedem Probanden hervorgerufen und beim Gehen eingebunden.
In den ersten vier Wochen, beginnend am 2. Tag nach der Implantation der Elektroden, wurde die Reaktion der drei Probanden auf Nervenstimulation täglich von Montag bis Freitag bestimmt. Über jede Elektrode wurden unterschiedliche elektrische Impulse, die sich in Dauer, Intensität und Frequenz unterschieden, eingeleitet. Die Probanden beschrieben, was sie fühlten, sowie die Position, den Ausbreitungsgrad und die Intensität der Stimulation. Die Beschreibungen ähnelten denen, wie man sie von Menschen ohne Amputation kennt, d. h., genannt wurden Berührung, Druck, Vibration und Muskelanspannung.
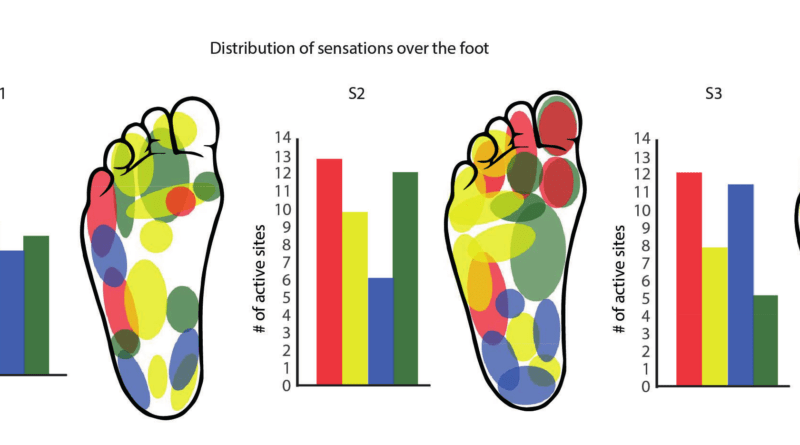
Auch andere Beschreibungen, die physiologisch weniger nützlich erschienen, z. B. Kribbeln, Pulsieren und das Gefühl von Elektrizität wurden berichtet, jedoch nicht für die im folgenden beschriebenen Neuroprothesen- und Schmerztests herangezogen. Die Intensität der Wahrnehmung und die Intensität des eingeleiteten Stimulus verhielten sich proportional. Die Probanden ordneten die Stimuli entsprechend ihrer gefühlten Wahrnehmung bestimmten Regionen an Fußsohle und Unterschenkel der amputierten Seite zu. Auf diese Weise entstand eine probandenspezifische „Wahrnehmungskarte“ der Fußsohle und des Unterschenkels. Die individuelle Kalibrierung des Neuroprothesensystems nutzte die Informationen der „Wahrnehmungskarten“ (Abb. 3).
Passive Tests
Um die Effektivität und die Verlässlichkeit des sensorischen EchtzeitFeedbacks durch die Druckmesssohle und der Kniegelenksbewegung zu testen, wurden drei passive Experimente mit den Probanden durchgeführt:
- eine Tastsinnaufgabe,
- eine Propriozeptionsaufgabe sowie
- eine kombinierte Aufgabe.
Tastsinnaufgabe: Die Probanden lagen dazu mit verbundenen Augen und akustisch abgeschottet mit dem Rücken auf einer Liege; die Prothese war ausgezogen. Für die Tastsinnaufgabe wurden die Probanden gebeten, unterschiedliche Stellen auf der Fußsohle zu bestimmen. Der Tester berührte dazu in zufälliger Abfolge verschiedene Bereiche der Sensorsohle (mediale, mittlere und laterale Metatarsalen und Ferse). Der Proband wurde gebeten, die Positionen der gefühlten Berührung auf einer Attrappe anzuzeigen. Die Probanden mussten auch erkennen, wenn keine Berührung erfolgte.
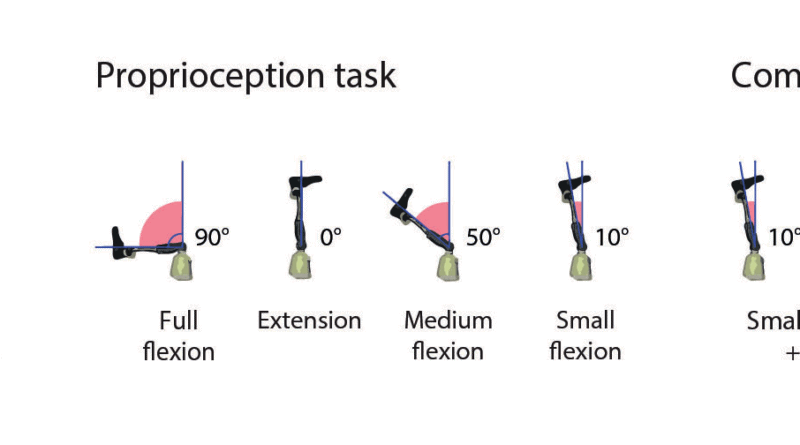
Propriozeptionsaufgabe: Für die Propriozeptionsaufgabe wurden die Probanden gebeten, vier unterschiedliche Kniewinkelstellungen in zufälliger Reihenfolge zwischen 0° und 95° zu erkennen.
Kombinierte Aufgabe: Um auszuschließen, dass die Probanden ähnliche Wahrnehmungen über die Verbindung von Stumpf und Prothese empfinden, wurden die Aufgaben zudem mit angezogener Prothese und ausgeschaltetem neuronalem Feedback durchgeführt.
In der kombinierten Aufgabe mussten der Kniewinkel und die berührte(n) Stelle(n) an der Fußsohle bestimmt werden (Abb. 4a–c).
Klinische Tests
Einen Monat nach der Implantation der Elektroden wurden die Gehgeschwindigkeit, das Sicherheitsempfinden, der Stoffwechselverbrauch und die mentale Anstrengung getestet, während die Phantomschmerzbehandlung im ersten Monat nach der Implantation durchgeführt wurde.
Gehgeschwindigkeit und Sicherheitsempfinden
Zum Nachweis eines klinischen Nutzens wurden zwei Studienteilnehmer gebeten, unterschiedliche Aufgaben beim Gehen mit und ohne zugeschaltetes sensorisches Feedback zu absolvieren. Der dritte Teilnehmer konnte aufgrund seiner beruflichen Verpflichtungen nicht an allen klinischen Tests teilnehmen. Ganggechwindigkeit und Sicherheitsempfinden wurden auf einem Außenparcours im Sand gemessen. Das Sicherheitsempfinden wurde durch Nummernangabe auf einer Skala von 1 bis 10 ermittelt. Mit sensorischem Feedback waren die Gehgeschwindigkeit und das Sicherheitsempfinden für beide Probanden signifikant höher.
Physische Anstrengung
Zur Bewertung der physischen Anstrengung mit und ohne Neuroprothese wurden die Teilnehmer gebeten, auf dem Laufband zu gehen. Dabei wurde die Gehgeschwindigkeit jede Minute um 0,5 km/h gesteigert, bis die Probanden die maximale Gehgeschwindigkeit erreicht hatten, bei der sie sich noch wohlfühlten. Mit sensorischem Feedback erreichten beide Teilnehmer eine um 0,5 km/h höhere Gehgeschwindigkeit. Die durchschnittliche Sauerstoffaufnahme wurde für verschiedene Geschwindigkeitsbereiche mit und ohne sensorisches Feedback während der klinischen Tests ermittelt. Bei gleicher Gehgeschwindigkeit war der Sauerstoffverbrauch mit sensorischem Feedback bei den meisten Vergleichen signifikant geringer.
Die Messung der Sauerstoffaufnahme wurde sodann auf den Außenbereich auf Sand und Gras ausgedehnt. Dabei hatte Proband 1 eine geringere Sauerstoffaufnahme bei gleicher Gehgeschwindigkeit; Proband 2 wies eine höhere Gehgeschwindigkeit bei gleicher Sauerstoffaufnahme mit sensorischem Feedback auf.
Eine traumatische Oberschenkelamputation erhöht das Risiko einer kardiovaskulären Insuffizienz und beeinträchtigt die Lebenserwartung 13 um das 2,2‑Fache im Vergleich zu Menschen ohne Amputation 14. Bei Senkung des Sauerstoffverbrauchs sinkt auch die kardiorespiratorische Belastung, was von Bedeutung sein könnte, um diesem Problem zu begegnen. Beim Vergleich zweier mikroprozessorgesteuerter Knieglenke („C‑Leg“ und „Rheo Knee“) und eines mechanisch-passiven Prothesenkniegelenks („Mauch Knee SNS hydraulisch“) zeigte das „Rheo Knee“ bei selbstgewählter Gehgeschwindigkeit beim Gehen in der Ebene eine Reduktion der Sauerstoffverbrauchsrate um 5 % gegenüber dem „Mauch SNS“ und um 3 % im Vergleich zum „C‑Leg“ 15. In der hier vorgestellten Studie wurde festgestellt, dass durch die Wiederherstellung des sensorischen Feedbacks die Sauerstoffverbrauchsrate mit „Rheo Knee XC“ noch weiter (um 12 % bzw. 17,6 % für Teilnehmer 2 und 1) gesenkt werden konnte.
Daraus kann geschlossen werden, dass der Sauerstoffverbrauch mit MPK (d. h. dem „Rheo Knee XC“) in Kombination mit sensorischem Feedback sinkt. Die Autoren vermuten, dass die Wiederherstellung der Gangsymmetrie und die Erhöhung der selbstgewählten Gehgeschwindigkeit ursächlich für den reduzierten Sauerstoffbedarf sind. Durch das symmetrischere Gangbild nähern sich die Probanden dem Energieverbrauch von Menschen ohne Amputation an, der niedriger ist 16.
Mentale Anstrengung
Die mentale Anstrengung wurde nach der Methodik von Wickens et al. gemessen 17. Dabei mussten die Probanden gehen (erste Aufgabe), leise Zieltöne zählen und andere Töne ignorieren, die über einen Kopfhörer zugespielt wurden (zweite Aufgabe). Die Post-hoc-Analyse zeigte signifikant bessere Resultate bei Zuschaltung des sensorischen Feedbacks, nicht aber ohne die Aktivierung des sensorischen Feedbacks. Daraus lässt sich schließen, dass die mentale Belastung beim Gehen ohne sensorisches Feedback für die Teilnehmer höher war und dass sie der zusätzlichen Aufgabenstellung weniger Aufmerksamkeit widmeten.
Mit mikroprozessorgesteuerten Kniegelenken wurde bereits eine um 8 % höhere selbstgewählte Gehgeschwindigkeit gegenüber mechanischen Kniegelenken nachgewiesen 18. In der hier vorgestellten Studie wurde durch das sensorische Feedback eine um mehr als 10 % erhöhte Gehgeschwindigkeit im Außenbereich mit dem „Rheo Knee XC“ gemessen. Weitere Untersuchungen wären notwendig, um festzuellen, welche Parameter in direkter Verbindung mit dem sensorischen Feedback und einer Steigerung der Gehgeschwindigkeit stehen. Die Probanden berichteten von mehr Vertrauen in die Prothese und weniger benötigter Aufmerksamkeit beim Gehen im Außenbereich mit sensorischem Feedback. Die Ergebnisse deuten darauf hin, dass die Wiederherstellung eines plausiblen physiologisch-sensorischen Gefühls intuitiv vom zentralen Nervensystem der Probanden verarbeitet wurde.
Einfluss auf Phantomschmerzen
Um festzustellen, ob eine niederfrequente neurale Stimulation effektiv zur Reduzierung von Phantomschmerzen eingesetzt werden kann 19, wurden zwei unterschiedliche Methoden angewandt: die frequenzinvariante und die frequenzvariante Stimulation. Unter der Voraussetzung, dass die frequenzvariante Stimulation der Poisson-Verteilung in afferenten Fasersignalen gleicht 20, folgte die Hypothese der Annahme, dass eine frequenzvariante Stimulation angenehmere und physiologisch plausiblere Wahrnehmungen hervorrufe und dadurch eine effektivere Schmerzlinderung bewirke 21 22.
Um dies zu testen, wurden 10-minütige Sitzungen mit und ohne Stimulation durchgeführt. Die Entwicklung von Phantomschmerzen wurde mittels des Fragebogens „Neuropathic Pain Syndrom Inventory“ (NPSI, von 0 bis 100) 23 und der visuellen Analogskala (VAS, von 0 bis 40) 24 vor und nach den 10-minütigen Sitzungen ermittelt. Das Schmerzniveau reduzierte sich signifikant für beide Probanden – sowohl nach der frequenzinvarianten als auch der frequenzvarianten Stimulation. Vor und nach den Kontrollmessungen (ohne Stimulation) wurde kein Unterschied bezüglich Schmerzniveau und Wirkung festgestellt. Eine Schmerzreduzierung von 30 % auf einer Skala von 0 bis 10 wird als klinisch signifikantes Ergebnis betrachtet 25. Die hier ermittelten Verbesserungen betrugen mehr als 80 %.
Die vorübergehende Schmerzreduktion (nach Explantation wurde nicht mehr gemessen) könnte mittels Gate-Theorie (d. h. die durch große Afferenzen ausgeübte Hemmung auf die nozizeptiven spinothalamischen Bahnen) erklärt werden. Die schrittweise Reduzierung von Schmerzen bis zum völligen Verschwinden kann auf sensorisches Feedback zurückzuführen sein, das positive neuroplastische Veränderungen im Nervensystem ausgelöst hat 26 27. Die frequenzvariante Stimulation war im Ergebnis ebenso wirksam wie die frequenzinvariante Stimulation und hatte daher keinen Einfluss auf die Linderung von Schmerzen. Dies legt nahe, dass die Frequenzvariation keinen Einfluss auf das Ergebnis der Schmerztherapie hat. In dieser Studie wurden jedoch nur zwei Frequenzvariationen verglichen (beide lösen physiologisch plausibel lokalisierte Empfindungen aus). Weitere Untersuchungen mit mehr Frequenzvariationen sollten durchgeführt werden, um den Parameter der neuronalen Stimulation zu bestimmen, der die Schmerzreduktion beeinflusst.
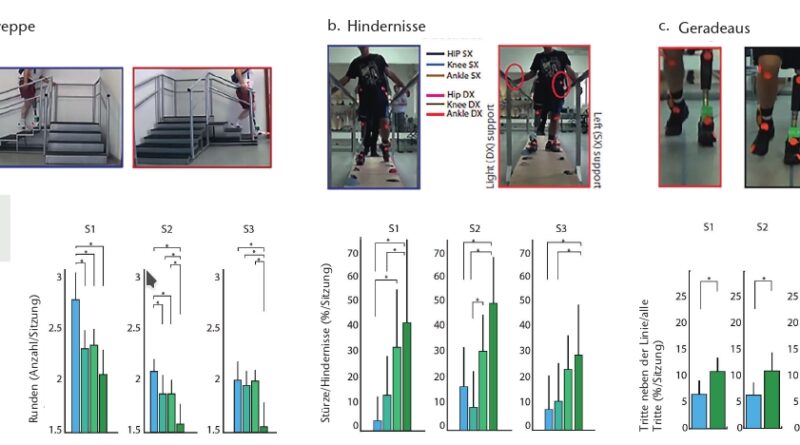
Überwinden von Hindernissen
Um zu überprüfen, ob die Neuroprothese die Gehfähigkeit verbessert, wurden drei Tests durchgeführt:
- Treppe auf- und absteigen: 4 Stufen und 6 Stufen, die über Eck miteinander verbunden sind.
- Hindernislauf: Überwinden zufällig angeordneter Hindernisse unterschiedlicher Größe innerhalb eines Doppelbarrens ohne Zuhilfenahme der Holme. Stürze sowie die Benutzung der Holme, nachdem auf ein Hindernis getreten wurde, wurden als Fehler gewertet, Hängenbleiben an einem Hindernis in der Schwungphase und daraus resultierende Stürze jedoch nicht. Die Fehleranzahl wurde als das Verhältnis zwischen Stürzen und der Anzahl der insgesamt mit den Füßen berührten Hindernisse (mit der Prothese) berechnet.
- Gehen auf einer 5 m langen geraden Linie 28 29: Das Verlassen der Linie wurde als Fehler gewertet (nur Prothesenseite).
Je Terrain wurden die Stimulationen NF (ohne Feedback), T (Tastsinn = Sohlenfeedback), P (propriozeptives Feedback vom Gastrocnemius = Wahrnehmung des Knieflexionswinkels) und PT (P und T gleichzeitig) randomisiert getestet. Test 3 wurde nur unter den beiden Bedingungen NF und PT durchgeführt, da die Probanden diesen Test als sehr anstrengend empfanden. Die Tests 1 und 2 wurden in 12 Sitzungen von 30 Sekunden pro Feedbacksituation durchgeführt; Test 3 (auf und ab gehen) wurde neunmal, randomisiert nach Feedbacksituationen, wiederholt.
Mit PT-Stimulation war die Mobilität (Anzahl der Runden) für alle Probanden höher als ohne Stimulation. Die Anzahl der in Relation zu den insgesamt mit den Füßen berührten Hindernissen reduzierte sich für alle Probanden signifikant mit T- und PT-Stimulation im Vergleich zu NF. Die Gehgeschwindigkeit und die Anzahl der berührten Hindernisse waren für alle Testbedingungen ähnlich, was ausschließt, dass die geringere Zahl von Stürzen auf eine geringere Gehgeschwindigkeit zurückzuführen sein könnte. Beim Gehen auf der Linie machten alle Probanden signifikant weniger Fehler mit PT als mit NF.
Basierend auf diesen Ergebnissen vermuten die Autoren, dass die Wahrnehmung über die Positionierung der Prothese – z. B. beim Treten auf ein Hindernis – den Probanden hilft, sich rechtzeitig zu stabilisieren. Dies gilt ebenso beim Treppensteigen: Den Kniewinkel und die Positionierung des Fußes zu kennen ist für die Probanden wichtig und hilfreich zugleich (Abb. 5). Darüber hinaus nehmen die Autoren an, dass das sensorische Feedback die Probanden befähigt, sich wieder mehr auf visuell-vestibuläre Sinne zu konzentrieren, da sich die zur Prothesenkontrolle notwendige mentale Belastung reduziert.
Fazit
Das hier vorgestellte Projekt war ein Proof-of-Concept-Test, der erste Ergebnisse zu den Vorteilen eines sensorischen Feedbacks durch intraneurale Stimulation für Menschen mit Amputation aufzeigt. Weitere Tests sind notwendig, um nachzuweisen, ob ein weiter proximal eingebrachtes Implantat (bei höherem Amputationsgrad) ähnliche Ergebnisse liefern könnte. Es sollten weitere Untersuchungen über einen längeren Zeitraum und mit einer größeren Probandenanzahl durchgeführt werden. Dazu sollten Implantate ohne transkutane Kabel entwickelt werden. Insgesamt ebnet diese Arbeit den Weg für eine sicherlich langwierige Entwicklung eines Medizinprodukts, das allerdings erheblich zur Verbesserung der Gesundheit und Lebensqualität von Menschen mit Amputation beitragen kann.
Hinweis
Dieser Artikel ist eine Zusammenfassung der beiden folgenden Veröffentlichungen:
- Petrini FM, Bumbasirevic M, Valle G, Ilic V, Mijovic P, Cvancara P, Barberi F, Katic N, Bortolotti D, Andreu D, Lechler K. Sensory feedback restoration in leg amputees improves walking speed, metabolic cost and phantom pain. Nature Medicine, 2019; 25 (9): 1356–1363
- Petrini FM, Valle G, Bumbasirevic M, Barberi F, Bortolotti D, Cvancara P, Hiairrassary A, Mijovic P, Sverrisson AÖ, Pedrocchi A, Divoux JL. Enhancing functional abilities and cognitive integration of the lower limb prosthesis. Science Translational Medicine, 2019; 11 (512): eaav8939
Für die Autoren:
Knut Lechler
Medical Director Prosthetics
Össur hf., R & D
110 Reykjavik/Island
klechler@ossur.com
Begutachteter Beitrag/reviewed paper
- Easypreg – ein Faserverbundwerkstoff zum Tiefziehen — 9. März 2026
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Miller WC, Speechley M, Deathe B. The prevalence and risk factors of falling and fear of falling among lower extremity amputees. Arch Phys Med Rehabil, 2001; (82) 8: 1031–1037. doi: 10.1053/ apmr.2001.24295
- Esquenazi A, DiGiacomo R. Rehabilitation after amputation. J Am Podiatr Med Assoc, 2001; 91 (1): 13–22
- Esquenazi A, DiGiacomo R. Rehabilitation after amputation. J Am Podiatr Med Assoc, 2001; 91 (1): 13–22
- Williams JMG, Duggan DS, Crane C, Fennell MJV. Mindfulness-based cognitive therapy for prevention of recurrence of suicidal behavior. J Clin Psychol, 2006; 62 (2): 201–210. doi: 10.1002/ jclp.20223
- Dijkstra PU, Geertzen JHB, Stewart R, van der Schans CP. Phantom Pain and Risk Factors: A Multivariate Analysis. J Pain Symptom Manage, 2002; 24 (6): 578–585. doi: 10.1016/S0885-3924(02)00538–9
- Rusaw D, Hagberg K, Nolan L, Ramstrand N . Can vibratory feedback be used to improve postural stability in persons with transtibial limb loss? J Rehabil Res Dev, 2012; 49 (8): 1239–1254. doi: 10.1682/jrrd.2011.05.0088
- Crea S, Edin BB, Knaepen K, Meeusen R, Vitiello N. Time-Discrete Vibrotactile Feedback Contributes to Improved Gait Symmetry in Patients With Lower Limb Amputations: Case Series. Phys Ther, 2017; 97 (2): 198–207. doi: 10.2522/ptj.20150441
- Dietrich C et al. Leg Prosthesis With Somatosensory Feedback Reduces Phantom Limb Pain and Increases Functionality. Front Neurol, 2018; 9: 270. doi: 10.3389/fneur.2018.00270
- Rusaw D, Hagberg K, Nolan L, Ramstrand N . Can vibratory feedback be used to improve postural stability in persons with transtibial limb loss? J Rehabil Res Dev, 2012; 49 (8): 1239–1254. doi: 10.1682/jrrd.2011.05.0088
- Crea S, Edin BB, Knaepen K, Meeusen R, Vitiello N. Time-Discrete Vibrotactile Feedback Contributes to Improved Gait Symmetry in Patients With Lower Limb Amputations: Case Series. Phys Ther, 2017; 97 (2): 198–207. doi: 10.2522/ptj.20150441
- Charkhkar H, Shell CE, Marasco PD, Pinault GJ, Tyler DJ, Triolo RJ. High-density peripheral nerve cuffs restore natural sensation to individuals with lower-limb amputations. J Neural Eng, 2018; 15 (5): 056002. doi: 10.1088/1741–2552/aac964
- Clippinger FW, Seaber AV, McElhaney JH, Harrelson JM, Maxwell GM. Afferent sensory feedback for lower extremity prosthesis. Clin Orthop, 1982; (169): 202–206
- Naschitz JE, Lenger R. Why traumatic leg amputees are at increased risk for cardiovascular diseases. QJM Mon J Assoc Physicians, 2008; 101 (4): 251–259. doi: 10.1093/qjmed/hcm131
- Modan M et al. Increased cardiovascular disease mortality rates in traumatic lower limb amputees. Am J Cardiol, 1998; 82 (10): 1242–1247. doi: 10.1016/s0002-9149(98)00601–8
- Johansson JL, Sherrill DM, Riley PO, Bonato P, Herr H. A clinical comparison of variable-damping and mechanically passive prosthetic knee devices. Am J Phys Med Rehabil, 2005; 84 (8): 563–575. doi: 10.1097/01.phm.0000174665.74933.0b
- Genin JJ, Bastien GJ, Franck B, Detrembleur C, Willems PA. Effect of speed on the energy cost of walking in unilateral traumatic lower limb amputees. Eur J Appl Physiol, 2008; 103 (6): 655–663. doi: 10.1007/s00421-008‑0764‑0
- Wickens CD, Isreal J, Donchin E. The Event Related Cortical Potential as an Index of Task Workload. Proc Hum Factors Soc Annu Meet, 1977; 21 (4): 282–286. doi: 10.1177/107118137702100404
- Dietrich C et al. Leg Prosthesis With Somatosensory Feedback Reduces Phantom Limb Pain and Increases Functionality. Front Neurol, 2018; 9: 270. doi: 10.3389/fneur.2018.00270
- Cruccu G et al. EFNS guidelines on neurostimulation therapy for neuropathic pain. Eur J Neurol, 2007; 14 (9): 952–970. doi: 10.1111/j.1468–1331.2007.01916.x
- Burkitt AN. A review of the integrate-and-fire neuron model: I. Homogeneous synaptic input. Biol Cybern, 95 (1): 1–19. doi: 10.1007/s00422-006‑0068‑6
- Valle G et al. Biomimetic Intraneural Sensory Feedback Enhances Sensation Naturalness, Tactile Sensitivity, and Manual Dexterity in a Bidirectional Prosthesis. Neuron, 2018; 100 (1): 37–45.e7. doi: 10.1016/j.neuron.2018.08.033
- Melzack R, Casey K. Sensory, motivational, and central control determinants of pain: a new conceptual model.In: Kenshalo DR (ed.). The Skin Senses. Proceedings of the First International Symposium on the Skin Senses, Held at the Florida State University in Tallahassee, Florida, March, 1966. Springfield, Illinois: Charles C Thomas, 1968: 423–436
- Bouhassira D et al. Development and validation of the Neuropathic Pain Symptom Inventory. Pain, 2004; 108 (3): 248–257. doi: 10.1016/j.pain.2003.12.024
- Wewers ME, Lowe NK. A critical review of visual analogue scales in the measurement of clinical phenomena. Res Nurs Health, 1990; 13, (4): 227–236. doi: 10.1002/nur.4770130405
- Farrar JT, Young JP, LaMoreaux L, Werth JL, Poole RM. Clinical importance of changes in chronic pain intensity measured on an 11-point numerical pain rating scale. Pain, 2001; 94 (2): 149–158. doi: 10.1016/s0304-3959(01)00349–9
- Flor H, Nikolajsen L, Staehelin Jensen T. Phantom limb pain: a case of maladaptive CNS plasticity? Nat Rev Neurosci, 2006; 7 (11): 873–881. doi: 10.1038/nrn1991
- Makin TR, Scholz J, Filippini N, Henderson Slater D, Tracey I, Johansen-Berg H. Phantom pain is associated with preserved structure and function in the former hand area. Nat Commun, 2013; 4: 1570. doi: 10.1038/ncomms2571
- Howe JA, Inness EL, Venturini A, Williams JI, Verrier MC. The Community Balance and Mobility Scale – a balance measure for individuals with traumatic brain injury. Clin Rehabil, 2006; 20 (10): 885–895. doi: 10.1177/0269215506072183
- Inness EL, Howe J‑A, Niechwiej-Szwedo E, Jaglal SB, McIlroy WE, Verrier MC. Measuring Balance and Mobility after Traumatic Brain Injury: Validation of the Community Balance and Mobility Scale (C B & M). Physiother Can, 2011; 63 (2): 199–208. doi: 10.3138/ptc.2009–45