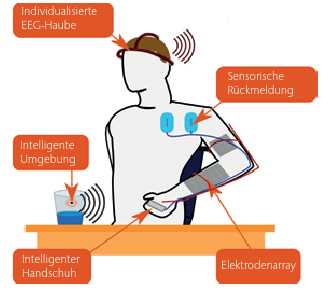
Einleitung
In Deutschland erleiden jährlich zwischen 1.500 und 1.800 Menschen eine Querschnittlähmung infolge eines Verkehrs‑, Arbeits- oder Freizeitunfalls, aber auch zunehmend aufgrund nichttraumatischer Ursachen wie Entzündungen, Rückenmarksinfarkten oder Tumoren. Speziell der Verlust der Greiffunktion beider Hände – etwa die Hälfte der geschätzt 60.000 bis 80.000 Querschnittgelähmten in Deutschland sind Menschen mit einer Tetraplegie – wird von den Betroffenen als besonders behindernd empfunden und resultiert in einem dramatischen Verlust an persönlicher Lebensqualität 1 2. Bis heute existiert keine ursächliche Therapie der Querschnittlähmung, sodass vor allem kompensatorische Rehabilitationsmaßnahmen zur Erhöhung der Selbstständigkeit eingesetzt werden. Für die Wiederherstellung der Greiffunktion können noch unter Willkürkontrolle befindliche Muskeln operativ transferiert werden 3. Stehen allerdings nicht genügend kräftige, noch willkürlich kontrollierbare Muskeln an Hand und Arm für Transferoperationen zur Verfügung, stellen Greifneuroprothesen auf Basis der Funktionellen Elektrostimulation (FES) die einzige Möglichkeit zur Verbesserung einer vollständig ausgefallenen Hand- und Fingerfunktion dar. Bei der FES werden mittels kurzer, niederfrequenter Stromimpulse Aktionspotenziale auf Nerven generiert, deren Summenaktivität wiederum tetanische Muskelkontraktionen erzeugt, die dann für die Ausführung koordinierter Greifbewegungen genutzt werden können 4
Stimulationstechnik nichtinvasiver Greifneuroprothesen
Die aus technischer Sicht einfachste Implementierung einer Greifneuroprothese basiert auf Oberflächenelektroden, die über eine selbstklebende, leitfähige Gelschicht verfügen und auf den Unterarm aufgeklebt werden. Nichtinvasive Systeme haben gegenüber invasiven Greifneuroprothesen den Vorteil, dass sie Nutzern bereits in der Frühphase der Rehabilitation angeboten werden können, da sie an den sich verändernden neurologischen Status angepasst werden können. Nichtinvasive Neuroprothesen sind erheblich preiswerter als implantierbare Systeme 5 und benötigen keine risikobehaftete Operation für die Erstversorgung oder im Falle des Ausfalls von Komponenten, vor allem der Kabel. Allerdings sind nichtinvasive Neuroprothesen komplizierter in der Handhabung, und die damit erzeugten Greifmuster sind anfällig gegenüber Gelenkbewegungen und den damit assoziierten Weichteilverschiebungen.
Aktuell sind keine kommerziellen nichtinvasiven Greifneuroprothesen erhältlich, mittels derer eine alltagstaugliche Wiederherstellung der Greiffunktion erreicht werden kann. Das kommerziell erhältliche System NESS-H200 (Bioness Inc., Valencia, CA, USA; früher auch unter dem Namen „Handmaster“ geführt) ist hauptsächlich für Trainingszwecke und nicht für die Ausführung von Alltagsaufgaben konzipiert 6.
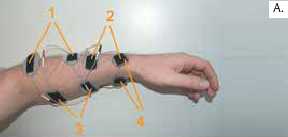
Das grundsätzliche Ziel einer Neuroprothese ist die Wiederherstellung eines Schlüssel- und Zylindergriffs. Während mit dem Schlüsselgriff flache Gegenstände wie eine Gabel oder ein Stift zwischen Daumen und gebeugten Zeigefingern gegriffen werden können, ist der Zylindergriff mit dem Daumen in Abduktionsstellung zum Greifen großer Gegenstände wie eines Glases geeignet. Diese Griffmuster können mittels maximal sieben Elektroden auf dem Unterarm erzeugt werden – ohne die Notwendigkeit einer Platzierung von sich leicht lösenden Elektroden auf der Handinnenfläche bzw. des Thenars. Der Schlüsselgriff kann mittels Stimulation der Finger- (M. ext. digitorum communis, Elektrodenpaar [EP] 1 in Abb. 1A) und Daumenextensoren (M. ext. pollicis longus, EP 2 in Abb. 1A) für die Handöffnung, der Fingerflexoren (M. flex. digitorum superficialis, M. flex. digitorum profundus) für den Fingerschluss und des Daumenflexors (M. flex. pollicis longus) zum eigentlichen Greifen erzeugt werden. Bei vielen Nutzern kann eine Stimulation der Finger- und Daumenflexoren über dasselbe Elektrodenpaar erreicht werden (EP 3 in Abb. 1A). Durch die Verwendung eines speziellen Elektrodenaktivierungsmusters kann mittels Co-Kontraktion der Daumenflexoren und ‑extensoren ein Greifzustand erreicht werden, bei dem die Finger nahezu vollständig flektiert sind und der Daumen sich noch in einer ausreichend extendierten Stellung zum Umschließen des Gegenstandes befindet. Für die Erzeugung des Zylindergriffs wird ein Ast des Nervus medianus, der den M. opponens pollicis innerviert, selektiv über ein Elektrodenpaar auf der medialen Seite des Unterarms angesteuert (EP 4 in Abb. 1A). Aufgrund des beengten Raums bietet sich die Verwendung einer gemeinsamen Elektrode für die Stimulation der Daumenextensoren und des Daumenabduktors an (EP 2 und EP 4 in Abb. 1A).
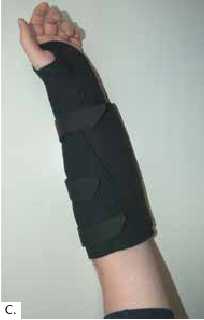
Ein offensichtlicher Nachteil der Oberflächenelektroden besteht in der Schwierigkeit, die sieben Elektroden täglich neu korrekt zu platzieren 7. Um den Nutzern und ihren Pflegepersonen das umständliche Anbringen der Elektroden zu erleichtern, kommt eine aus Neopren gefertigte Unterarmorthese zum Einsatz. Nach dem ersten Einrichten der Elektrodenpositionen wird ein Stück selbstklebendes Klettband auf die kommerziell erhältlichen Klebeelektroden aufgeklebt (Abb. 1A) und anschließend der an die individuelle Anatomie des Nutzers angepasste Handschuh angezogen. Bei diesem Anziehvorgang werden die Elektroden an den korrekten Stellen im Handschuh fixiert und können so täglich neu einfach, schnell und effizient über den Handschuh platziert werden (Abb. 1B). Der Handschuh wiegt ca. 100 g und belastet daher den Unterarm nicht relevant. Er hat ein Loch für den Daumen und eine Markierung am proximalen Ende, um eine korrekte Platzierung des gesamten Handschuhs zu erreichen. Um einen kräftigen Griff zu erzielen, muss sich das Handgelenk in Neutralstellung befinden. Oftmals ist aber der M. ext. carpi radialis bei den Nutzern denerviert und daher nicht über die FES aktivierbar, sodass das Handgelenk mittels einer in den Handschuh palmarseitig eingelassenen Aluminiumschiene in Neutralstellung gehalten werden kann (Abb. 1C).
Individuelle Anpassung aller Komponenten zwingend notwendig
Neben der individuellen Festlegung der Elektrodenpositionen und der personalisierten Anfertigung des Elektrodenhandschuhs muss auch die Benutzerschnittstelle an die individuellen Wünsche und Gegebenheiten des Nutzers angepasst werden. Die Personalisierung aller Komponenten der Greifneuroprothese ist zwar aufwendig, aber von entscheidender Bedeutung für die spätere Nutzerakzeptanz. Beim aktuellen Stand kommen Greifneuroprothesen eigentlich nur für Nutzer mit noch erhaltener Schulterfunktion und der Fähigkeit zur Platzierung der Hand im Raum in Frage. Daher besteht die Standardbenutzerschnittstelle in einem extern aufgeklebten Schulterpositionssensor (Abb. 2A), sodass der Nutzer seinen Griff selbstständig über Bewegungen der gegenüberliegenden Schulter steuern kann. Je nach Benutzerpräferenz wird der Grad der Handschließung/-öffnung über Vor-/ Zurückbewegungen oder Auf-/Abwärtsbewegungen der Schulter beeinflusst. Eine Umschaltung zwischen Schlüsselund Zylindergriff oder das Ein-/Ausschalten erfolgen durch unterschiedlich langen Druck auf das Endstück des Schultersensors. Da diese unnatürliche Art der Steuerung von den Nutzern erst erlernt werden muss, sollten – wann immer möglich – noch erhaltene, direkt an der Handfunktion beteiligte Bewegungen für eine Kontrolle herangezogen werden. Bei erhaltener Dorsalextension im Handgelenk bietet sich anstatt der Verwendung eines Schulterpositionssensors ein Biegesensor über dem Handgelenk an (Abb. 2B). Der durch diesen Sensor gemessene Grad der Handhebung steuert dann in intuitiver Weise den Daumen- und Fingerschluss; ein Druck auf dessen Oberfläche schaltet zwischen den Griffen um. Auch eine EMG-Steuerung über schwache, aber in die eigentliche Greiffunktion eingebundene Muskulatur ist möglich, allerdings mit einer gegenüber mechanischen Bewegungssensoren geringeren Robustheit und Stabilität 8.
Erste Anwendungsergebnisse der personalisierten Neuroprothese
Seit September 2013 wird eine prospektive klinische Studie durchgeführt, mit der standardisiert Daten hinsichtlich Effektivität und Praktikabilität der nichtinvasiven Greifneuroprothese erhoben werden. Seit Studienbeginn wurden 14 mögliche Neuroprothesennutzer gescreent. Zum jetzigen Zeitpunkt (Februar 2016) konnten bisher sieben Teilnehmer in die Studie eingeschlossen werden, wovon drei Teilnehmer die Studie abgeschlossen haben. Die Daten des ersten Teilnehmers erwiesen sich als unbrauchbar, da bei abschließender Betrachtung die Voraussetzungen (ausreichendes aktives Bewegungsausmaß der Schulter und des Oberarmes) für einen Gebrauch der Greifneuroprothese nicht erfüllt waren. Sieben Studienbewerber konnten aufgrund von Anzeichen starker Denervation nicht in die Studie aufgenommen werden. Die Denervation von Muskeln tritt als Folge der Rückenmarkschädigung auf, bei der nicht nur die weiße Substanz, in der sich die auf- und absteigenden Rückenmarksbahnen befinden, sondern auch die graue Substanz geschädigt wird, sodass als Folge die motorischen Neurone und deren periphere, die Armmuskeln versorgende Axone zugrunde gehen. Durch den Wegfall der peripheren axonalen Nervenstrukturen können die denervierten Muskelanteile nicht über die Stromimpulse der Neuroprothese zu einer ausreichend kraftvollen Kontraktion stimuliert werden.
Das Alter der bisherigen Studienbewerber variiert zwischen 18 und 53 Jahren, das durchschnittliche Alter beträgt 37 Jahre. In drei Fällen liegt der Tetraplegie eine nichttraumatische Ursache zugrunde. Die übrigen elf Ursachen umfassen Unfälle im Straßenverkehr (5), Sturz (1), Badeunfall (4) und Unfall mit dem Mountainbike (1). Das neurologische Niveau beträgt zwischen C3 und C6, wobei sich bei der Mehrheit (5) das neurologische Niveau bei C4 befindet. Bei drei Teilnehmern liegt der Zeitraum seit der Verletzung bei unter zwei Jahren, bei fünf Teilnehmern reicht das Ereignis mehr als fünf Jahre zurück.
Alle Teilnehmer, die in die Studie eingeschlossen werden konnten, absolvierten ein bis zu zwölfwöchiges häusliches Elektrostimulationstraining, um die atrophierte und schnell ermüdende Muskulatur aufzubauen und eine höhere Ermüdungsresistenz zu erzielen. Danach wurde die Neuroprothese angepasst, und die Studienteilnehmer konnten diese 16 Wochen in ihrem Alltagsleben nutzen.
Bei allen sieben eingeschlossenen Teilnehmern konnten die beiden Griffmuster des Schlüssel- und Zylindergriffs erfolgreich generiert werden, wobei eine mit einem Dynamometer gemessene Maximalkraft von 0,83 kg für den Schlüsselgriff und von 1,5 kg für den Zylindergriff erreicht werden konnte. Diese Werte bewegen sich im Rahmen der mit invasiven Systemen erreichten Griffstärken 9. Selbst der niedrigste erreichte Wert von 0,33 kg (Schlüsselgriff) und 0,20 kg (Zylindergriff) war ausreichend, um funktionsfähige Griffe zu erzeugen, und korrelierte nicht mit der Qualität des Griffes selbst, wie die Ergebnisse der Funktionstests zeigen.
Der funktionelle Gewinn durch die Neuroprothese wurde mit dem Graspand-Release-Test (GRT) 10 11 und dem Van-Lieshout-Test Short Version (VLT-SV) 12 quantifiziert (Abb. 3), die am Ende der Trainingszeit, nach 8 Wochen und nach 16 Wochen Anwendung jeweils sowohl mit als auch ohne Neuroprothese durchgeführt wurden.
Der GRT wurde entwickelt, um Funktionsverbesserungen nach Implantation einer Greifneuroprothese bei Menschen mit einer Tetraplegie auf Höhe des 5. oder 6. Halsmarksegments zu quantifizieren. Während des Tests werden die Neuroprothesennutzer aufgefordert, Gegenstände verschiedenen Gewichts und unterschiedlicher Form (Plexiglaszylinder, Briefbeschwerer, Videokassette, simuliertes Einstechen einer Gabel in eine gekochte Kartoffel, Holzstäbchen, Holzwürfel) so oft wie möglich in 2 Minuten zu greifen, zu transferieren und auf einer leicht erhöhten Ablage wieder abzulegen. Der VLT dient der Erfassung der gesamten Arm- und Handfunktion. Die Kurzform des VLT-SV besteht aus 10 Einzeltests, bei denen in standardisierter Weise die Fähigkeit zum Armausstrecken, zur Armextension gegen die Schwerkraft, zum Daumenschluss, zum kräftigen Fingerschluss, zum Halten eines Stiftes, zum Anzünden eines Streichholzes, zum Öffnen einer Flasche mit Kronkorken mittels Flaschenöffner und zum Einschenken von Wasser in ein Glas aus einem 1‑Liter-Wasserkrug eingestuft wird.
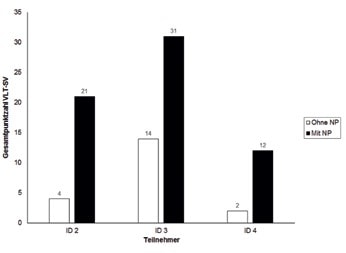
Im GRT konnten alle Teilnehmer bereits ohne Neuroprothese erfolgreich leichte Objekte wie Würfel transferieren, jedoch variierte die Anzahl der in 2 Minuten transferierten Objekte zwischen den Teilnehmern erheblich: Das Maximum von 76 erreichte ein Teilnehmer, der eine Funktionshand (passiver Finger- und Daumenschluss aufgrund kräftig erhaltener Handgelenksextension) aufwies, der kleinste Wert lag bei 3 bei einem Teilnehmer ohne Hand- und Fingerfunktion. Während zwei Teilnehmer in der Lage waren, Holzstäbchen ohne Neuroprothese zu transferieren, gelang der Transfer eines 250 g schweren Briefbeschwerers nur einem Teilnehmer. Bei Ausführung des Tests mit der Neuroprothese konnten alle Teilnehmer sich beim Transferieren schwerer bzw. größerer Objekte wie des Zylinders, des Briefbeschwerers, der Videokassette oder auch beim Gabel-Test verbessern. So konnte ein Teilnehmer, der normalerweise lediglich die leichten Würfel greifen und transferieren konnte, mit Hilfe der Neuroprothese vier weitere Aufgaben (Stäbchen, Zylinder, Gabel-Test, Videokassetten) bewältigen. Ein weiterer Teilnehmer schaffte es, ausgehend von drei ausführbaren Aufgaben ohne Neuroprothese (Würfel, Stäbchen, Briefbeschwerer) alle sechs Aufgaben mit Neuroprothese auszuführen; er verbesserte sich erheblich bei der Würfel- (von 6 auf 70 transferierte Objekte) und bei der BriefbeschwererAufgabe (von 20 auf 48). Alle drei Teilnehmer erreichten im VLT-SV eine erheblich höhere Gesamtpunktzahl bei Nutzung der Neuroprothese (Abb. 4). Am Ende der 16-wöchigen Anwendung verbesserten sich Teilnehmer 2 und 3 in neun von insgesamt zehn Aufgaben, Teilnehmer 4 in fünf.
Am meisten profitierten die Nutzer bei Aufgaben, die auf eine adäquate Daumenabduktion angewiesen sind, wie zum Beispiel das Greifen, Anheben und sichere Abstellen von Dosen oder Zylindern. Ebenso ermöglichte die Neuroprothese allen Teilnehmern, einen Stift selbstständig in die Hand zu nehmen und ihren Namen zu schreiben. Es konnte bei allen Teilnehmern genügend Greifkraft generiert werden, um einen Krug Wasser anzuheben und sich ein Glas Wasser einzuschenken (Abb. 3).
Direkte Gehirnsteuerung einer Greifneuroprothese – das europäische More-Grasp-Projekt
Bereits beim heutigen Stand kann Menschen mit zervikalem Querschnittsyndrom und erhaltener Schulterfunktion und Ellenbogenbeugung, aber fehlender Finger- und ggf. Handfunktion die Wiederherstellung eines Schlüssel- und Zylindergriffes mittels einer nichtinvasiven Greifneuroprothese ermöglicht werden. Ein integraler Bestandteil der Systemauslegung ist die Möglichkeit zur Personalisierung des Elektrodenhandschuhs, der Elektrodenaktivierungsmuster und der Benutzerschnittstelle an die noch vorhandenen Restfunktionen und Prioritäten des Nutzers.
Bei allem Erreichten bleibt dennoch eine Reihe nicht gelöster Probleme: Allen voran bereitet das alltägliche Anziehen und korrekte Platzieren des Elektrodenhandschuhs den Nutzern Schwierigkeiten. Bei Rotationsbewegungen des Handgelenks verschieben sich Elektroden, und es kann zu unerwünschten Fingerstellungen bzw. Kraftverlust aufgrund des geänderten Stromflusses im Körper kommen, insbesondere bei der Daumenfunktion. Da eine Querschnittlähmung neben den motorischen Einschränkungen auch zu einem Sensibilitätsverlust in der Hand führt, spüren Betroffene nicht, wie stark sie zugreifen. Darüber hinaus bestehen Verbesserungsmöglichkeiten von Seiten der Bedienung, die nur zum Teil intuitiv ist und dem Nutzer ständig eine hohe Aufmerksamkeit abverlangt.
Mit dem im März 2015 begonnenen MoreGrasp-Projekt (www.moregrasp. eu) versucht ein europäisches Konsortium aus drei Universitäts- und zwei Firmenpartnern unter Leitung der Technischen Universität Graz diese Probleme in den Griff zu bekommen (Abb. 5). In MoreGrasp wird ein Elektroden-Array entwickelt, bei dem eine Vielzahl von Elektroden in den Handschuh integriert wird, die situationsangepasst elektronisch zu größeren Elektrodenverbünden zusammengeschaltet werden können 13 14. Damit hoffen die Wissenschaftler, Elektrodenfehlplatzierungen beim Anlegen und Elektrodenverschiebungen während der Anwendung dynamisch kompensieren zu können. Mittels auf Alltagsgegenstände aufklebbarer Folienkraftsensoren, deren Daten von einem Low-Energy-Bluetooth-Modul (LE-Bluetooth) an eine Kontrollstation übertragen werden, können Greifkräfte registriert und für eine semiautonome Griffsteuerung verwendet werden. Durch Zuordnung eindeutiger IDs zu den LE-Bluetooth-Einheiten kann eine automatische Umschaltung auf das für diesen Gegenstand vordefinierte, am besten geeignete Griffmuster erfolgen, sobald sich die Hand des Nutzers dem entsprechenden Gegenstand nähert. Durch zusätzliche Elektroden in Körperregionen mit erhaltener Sensibilität können dem Nutzer Rückmeldungen über die aufgebrachten Greifkräfte vermittelt werden. Aus der Prothetik ist bekannt, dass diese sensible Rückmeldung einen wesentlichen Faktor hinsichtlich einer erhöhten Nutzerakzeptanz darstellt.
Um einem Benutzer eine intuitivere Steuerung der Hand zu ermöglichen, sollen Gehirnsignale zur Erkennung der Benutzerintention in das Steuerungskonzept miteinbezogen werden [15, 16]. Dies geschieht mittels sogenannter Hybrid-Brain-Computer-Interfaces, bei denen ein auf Bewegungsvorstellungen basierendes Brain-Computer-Interface (BCI) mit traditionellen Benutzerschnittstellen kombiniert wird. Damit soll auf Basis der Modulation des Elektroenzephalogramms (EEG) über den motorischen Gehirnarealen erkannt werden, ob ein Benutzer z. B. die Signale eines Schulterjoysticks zur Steuerung des Grads der Handschließung oder der Handgelenksrotation verwenden will. Um eine hohe Alltagstauglichkeit zu erreichen, werden an die Benutzeranatomie angepasste EEG-Kappen entwickelt, die auf Elektroden ohne Leitgel basieren und ihre Daten mittels eines Bluetooth-Funkinterface an eine Kontrolleinheit übermitteln. Mit der Einführung von Gel-losen Elektroden kann die Vorbereitungszeit zur Nutzung des BCI-Systems auf ein Minimum reduziert und eine der Hauptschwierigkeiten aktueller BCIs für Alltagsanwendungen beseitigt werden. Im Rahmen von MoreGrasp sollen erste Hinweise gewonnen werden, inwieweit eine Dekodierung unterschiedlicher Greif- bzw. Armbewegungen mittels BCIs in Echtzeit möglich ist. Im Erfolgsfall könnte damit erstmalig die bilaterale Wiederherstellung der Greiffunktion beider Hände umgesetzt und damit ein weiterer Schritt in Richtung Normalität für die Betroffenen vollzogen werden.
Für die Autoren:
Dr.-Ing. Rüdiger Rupp
Universitätsklinikum Heidelberg
Klinik für Paraplegiologie
Experimentelle Neurorehabilitation
Schlierbacher Landstraße 200a
69118 Heidelberg
Ruediger.Rupp@med.uni-heidelberg.de
Begutachteter Beitrag/reviewed paper
Rupp R, Franz S, Berberich M, Rohm M, Schneiders M, Hessing B, Weidner N, Müller-Putz G. R. Ich (be)greife, also bin ich – Möglichkeiten und Herausforderungen nichtinvasiver Greifneuroprothesen für Hoch-Querschnittgelähmte. Orthopädie Technik, 2016; 67 (5): 56–61
- Compliance in der Skoliose-Korsettversorgung – Einflussfaktoren und Herausforderungen einer erfolgreichen Therapie — 5. Juli 2025
- Elektrische Anregung eines Teleskop-Phantoms – Fallstudie an einer beinamputierten Patientin — 4. Juli 2025
- Dynamische Hüftabduktions-Lagerungsorthese zur Behandlung pathologisch veränderter Hüften bei neuromuskulären Erkrankungen in der Kinderorthopädie — 5. Juni 2025
- Anderson KD. Targeting recovery: priorities of the spinal cord-injured population. J Neurotrauma, 2004; 21 (10): 1371–1383
- Snoek GJ, IJzerman MJ, Hermens HJ, Maxwell D, Biering-Sorensen F. Survey of the needs of patients with spinal cord injury: impact and priority for improvement in hand function in tetraplegics. Spinal Cord, 2004; 42 (9): 526–532
- Hentz VR, LeClerq C. Surgical Rehabilitation of the Upper Limb in Tetraplegia. London, Edinburgh, New York: WB Saunders, 2002
- Rupp R, Gerner HJ. Neuroprosthetics of the upper extremity–clinical application in spinal cord injury and challenges for the future. Acta Neurochir Suppl, 2007; 97: 419–426
- Peckham PH, Keith MW, Kilgore KL, Grill JH, Wuolle KS, Thrope GB, Gorman P, Hobby J, Mulcahey MJ, Carroll S, et al. Efficacy of an implanted neuroprosthesis for restoring hand grasp in tetraplegia: a multicenter study. Arch Phys Med Rehabil, 2001; 82: 1380–1388
- Snoek GJ, IJzerman MJ, in ’t Groen FA, Stoffers TS, Zilvold G. Use of the NESS handmaster to restore handfunction in tetraplegia: clinical experiences in ten patients. Spinal Cord, 2000; 38: 244–249
- Kilgore KL, Scherer M, Bobblitt R, Dettloff J, Dombrowski DM, Godbold N, Jatich JW, Morris R, Penko JS, Schremp ES, Cash LA. Neuroprosthesis consumers’ forum: consumer priorities for research directions. J Rehabil Res Dev, 2001; 38: 655–660
- Rupp R, Müller-Putz GR, Pfurtscheller G, Gerner HJ, Vossius G. Evaluation of control methods for grasp neuroprostheses based on residual movements, myoelectrical activity and cortical signals. Biomed Tech (Berl), 2008; 53: 54–55
- Rupp R, Kreilinger A, Rohm M, Kaiser V, Müller-Putz GR. Development of a non-invasive, multifunctional grasp neuroprosthesis and its evaluation in an individual with a high spinal cord injury. Conf Proc IEEE Eng Med Biol Soc, 2012; 1835–1838
- Mulcahey MJ, Smith BT, Betz RR. Psychometric rigor of the Grasp and Release Test for measuring functional limitation of persons with tetraplegia: a preliminary analysis. J Spinal Cord Med, 2004; 27: 41–46
- Wuolle KS, Van Doren CL, Thrope GB, Keith MW, Peckham PH. Development of a quantitative hand grasp and release test for patients with tetraplegia using a hand neuroprosthesis. J Hand Surg Am, 1994; 19 (2): 209–218
- Spooren AI, Janssen-Potten YJ, Post MW, Kerckhofs E, Nene A, Seelen HA. Measuring change in arm hand skilled performance in persons with a cervical spinal cord injury: responsiveness of the Van Lieshout Test. Spinal Cord, 2006; 44: 772–779
- Malesevic NM, Popovic Maneski LZ, Ilic V, Jorgovanovic N, Bijelic G, Keller T, Popovic DB. A multi-pad electrode based functional electrical stimulation system for restoration of grasp. J Neuroeng Rehabil, 2012; 9: 66
- Popovic-Maneski L, Kostic M, Bijelic G, Keller T, Mitrovic S, Konstantinovic L, Popovic DB. Multi-pad electrode for effective grasping: design. IEEE Trans Neural Syst Rehabil Eng, 2013; 21: 648–654