Einleitung
In Deutschland werden jährlich 40.000 bis 60.000 Beinamputationen und 10.000 bis 15.000 Armamputationen durchgeführt. Die Ursachen sind verschieden, hauptsächlich aber bedingt durch arterielle Durchblutungsstörungen (87 %), Unfälle (4 %), Infektionen (2 %), Tumoren (2 %) und angeborene Fehlbildungen (0,2 %). In den letzten Jahrzehnten wurden vor allem für die untere Extremität Prothesen entwickelt, die ein nahezu physiologisches Gangbild ermöglichen. Durch neuentwickelte Funktionsprinzipien werden mehr Sicherheit und Energieersparnis angestrebt. Dies macht sich in längeren Gehstrecken bemerkbar.
Einige Studien untersuchten diese Knie-Prothesen hinsichtlich ihres Aufbaus, Funktionsweise und Nutzen für den Amputierten 1 2 3. Vor allem ganganalytische Vergleiche von C‑Leg und nicht mikroprozessorgesteuerten Knieprothesen 4 5 6 7 8 9 standen im Fokus. In Arbeiten von Schmalz et al. 10 und Johansson et al. 11 erfolgten zudem elektromyographische Untersuchungen beim Gehen mit mechanischen bzw. mikroprozessorgesteuerten Prothesen. In nahezu allen Studien zeigte die C‑Leg Prothese die besten Ergebnisse. Diese wurde als energiesparende, sicherheitssteigernde Knieprothese bewertet, durch welche ein der Physiologie entsprechendes Gangbild erzielt werden kann. Konträr dazu stehen Ergebnisse von Johansson et al. 12, welche das Rheo Knee parameterbezogen überordnen. Unilateral transfemoral amputierte Patienten zeigen Asymmetrien in der Kinetik des Gehens 13. Verkürzte Standzeiten auf der Prothesenseite sowie reduzierte vertikale und horizontale Impulse wurden festgestellt.
Der Rumpf nimmt eine zentrale Funktion beim Gehen ein. Die Rumpfmuskelaktivität wurde bei Prothesenträgern bisher kaum in diesem Zusammenhang untersucht. Durch die Rumpf-Becken-Koordination werden potenziell destabilisierende Rumpfbewegungen verringert. Da etwa zwei Drittel der gesamten Körpermasse oberhalb der Taille liegen, ist die Rumpfkontrolle vor allem für die aufrechte Haltung sowie den Erhalt des Gleichgewichtes notwendig 14.
Beim Gehen selbst rotiert der Rumpf um ca. 5° in der Transversalebene. Dadurch wird eine Rotation der Schultern und folglich das reaktive Armpendeln ausgelöst. Die Rotationsrichtung der Schultern ist der Beckenrotation entgegengesetzt. Der M. obliquus externus und internus abdominis arbeiten mit geringer Aktivität während des gesamten Gangzyklus und stabilisieren den Rumpf in seiner aufrechten Position. Die bilateralen tiefen Rumpfextensoren und ‑rotatoren (Mm. multifidi) unterstützen die Rumpfstabilisation in der Stoßdämpfungsphase, da in dieser Phase das Flexionsdrehmoment am höchsten ist. Der ipsilaterale M. erector spinae ist besonders in der Vorschwungphase aktiv, während das kontralaterale Bein belastet wird 15. Die Aktivität der Rumpfmuskulatur steigt mit zunehmendem Fortbewegungstempo und kann vom Geschlecht abhängen 16 17.
Gerade bei Menschen mit Amputationen der unteren Extremität kommt der Rumpfmuskulatur eine besondere Aufgabe zu. Durch den Einsatz einer Prothese sind der Gangzyklus sowie auch das Zusammenspiel der Muskulatur von Bein, Becken und Rumpf verändert. Dadurch muss die Rumpfmuskulatur mehr Ausgleichs‑, Kompensations- und Stabilisationsarbeit leisten 18. In Folge können sich funktionelle Skoliosen und Hyperlordosen Jahre nach der Amputation entwickeln 19.
Aufgrund des aufgezeigten Erkenntnisdefizits bedarf es weiterer Untersuchungen, die die Wirkung von Prothesen auf die Rumpfmuskulatur in den Vordergrund rücken. Ziel dieser Studie war es, die Aktivität der Rumpf- und Beinmuskulatur sowie den Sauerstoffverbrauch in Abhängigkeit von der Gehgeschwindigkeit und der Prothesenart zu untersuchen.
Methoden
Es wurden sechs männliche, unilateral transfemoral amputierte Probanden (42,7 ± 8,1 Jahre, 1,77 ± 0,07 m, 82,7 ± 10,6 kg, 26,4 ± 3,6 kg/m2, Amputationsdauer 19 ± 7 Jahre) untersucht. Bei fünf Probanden war die betroffene Seite links und bei einem rechts. Die Amputation erfolgte bei allen Patienten aufgrund eines Traumas. Die ursprüngliche Versorgung erfolgte mittels C‑Leg Prothese. Die Probanden hatten eine physiologische Stumpfbeschaffenheit sowie den Mobilitätsgrad IV. Der Schaft wurde viermal mittels MAS-Schaft und zweimal mittels längsovalem (tuberumgreifendem) Schaft mit Vakuumhaftung versorgt. Ein Proband gab Phantomschmerzen an, alle anderen waren beschwerdefrei. Alle Probanden berichteten über anspruchsvolle Freizeitaktivitäten (Ski, Rad, Schwimmen, Inline-Skaten). Das nicht betroffene Bein war beschwerdefrei.
Untersuchungsablauf
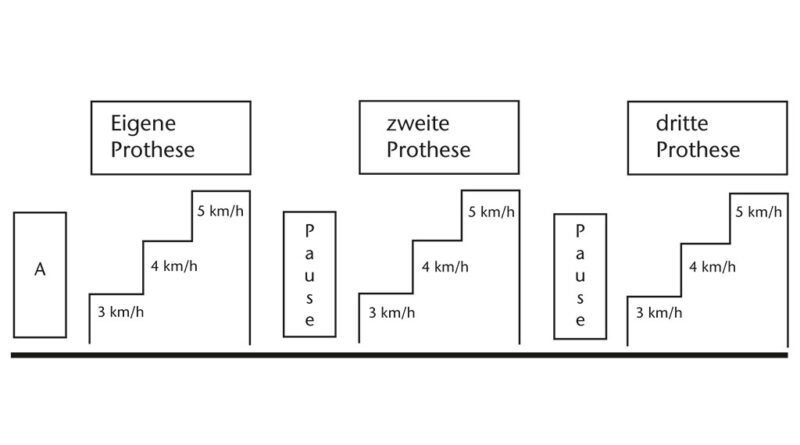
Die Messungen erfolgten im Rahmen eines dreistufigen Tests auf einem Woodway® Laufband (Abb. 1). Die Probanden sollten mit jeder der drei Prothesen mit 3 km/h, 4 km/h und 5 km/h für jeweils fünf Minuten gehen. Begonnen wurde mit der eigenen Prothese (C‑Leg). Die Zuordnung der Prothese zwei und drei (Rheo Knee 2, Kinegen 3A2000) erfolgte randomisiert mittels Losziehen. In der letzten Minute jeder Stufe wurden elektrophysiologische Signale der untersuchten Muskeln erfasst, da somit eine Eingewöhnungszeit berücksichtigt wurde. Die Sauerstoffaufnahme (VO2) wurde permanent mittels mobiler Spirometrie erfasst (Cortex Metamax 3B). Zwischen den einzelnen Stufentests mit den drei Prothesen hatten die Probanden eine erholende 45-minütige Pause. In dieser brachte ein Orthopädie-Techniker die neue Prothese an und stellte sie adäquat ein. Angebrachte Oberflächenelektroden wurden zwischen den Tests nicht entfernt.
Datenerfassung
Die Messung der neuromuskulären Aktivität erfolgte mittels Oberflächen-EMG (Noraxon, Abtastrate 1500Hz, Highpass 50, Lowpass 500, RMS 100 ms). Es wurde bilateral der M. obliquus externus abdominis und an der nicht betroffenen Extremität wurden M. gluteus maximus, M. rectus femoris, M. biceps femoris und M. gastrocnemius erfasst.
Triggerung
Mit bilateralen FSR-Fußschaltersohlen (B&L Engineering USA) fand eine Triggerung der Gangzyklen statt. Das dadurch entstandene Rechtecksignal erlaubte eine Zuordnung der Stand- und Schwungbeinphase.
Die statistische Auswertung erfolgte mittels SPSS Version 16.0. Die Parameter (mittlere Amplitude, Integral, Maximum) wurden als Mittelwert und Standardabweichung dargestellt. Signifikante Unterschiede zwischen den Stufen und Prothesen wurden mittels nicht parametrischem Test geprüft (nicht signifikant p>0,05; signifikant p≤0,05; hochsignifikant p<0,01).
Ergebnisse
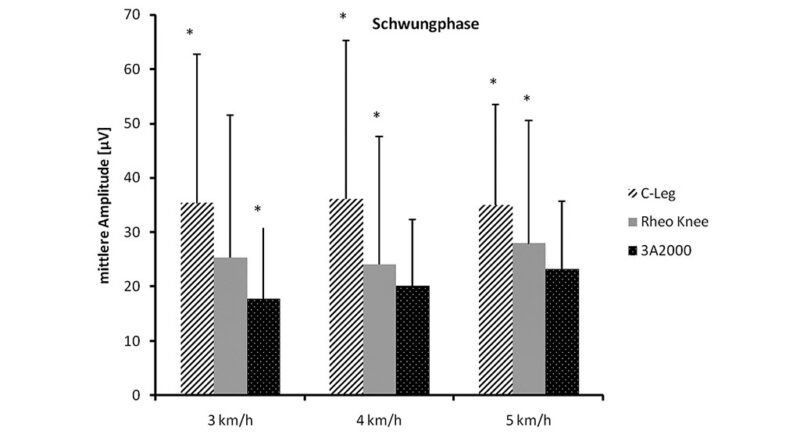
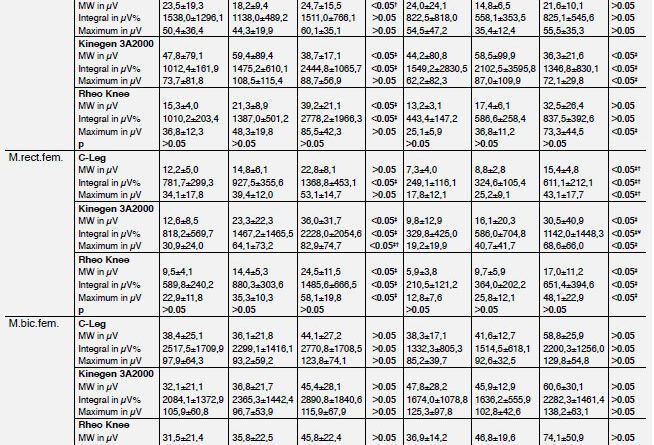
Alle Ergebnisse wurden in Tabelle 1 in Abhängigkeit der Gehgeschwindigkeit und Prothese dargestellt (Tab. 1). Die Geschwindigkeit zeigte einen signifikanten Effekt auf die Aktivität des M. oblic. ext. abd., M. gluteus max. und M. rectus femoris (p<0,05). Es kam mit steigender Geschwindigkeit zu einer kontinuierlichen Zunahme der Muskelaktivität, welche bei den anderen Muskeln nur tendenziell war (M. biceps fem., M. gastrocn. med.). Jedoch zeigte sich beim M. gluteus maximus zwischen den Geschwindigkeiten ein heterogenes Muster. Es wurde beobachtet, dass beim Kinegen die Aktivität bei Geschwindigkeitsänderung von 3 auf 4 km/h tendenziell zunahm und zu 5 km/h wieder abnahm. Hingegen sank die Aktivität dieses Muskels von 3 auf 4 km/h, um dann signifikant bei 5 km/h in der Schwungphase sich zu erhöhen.
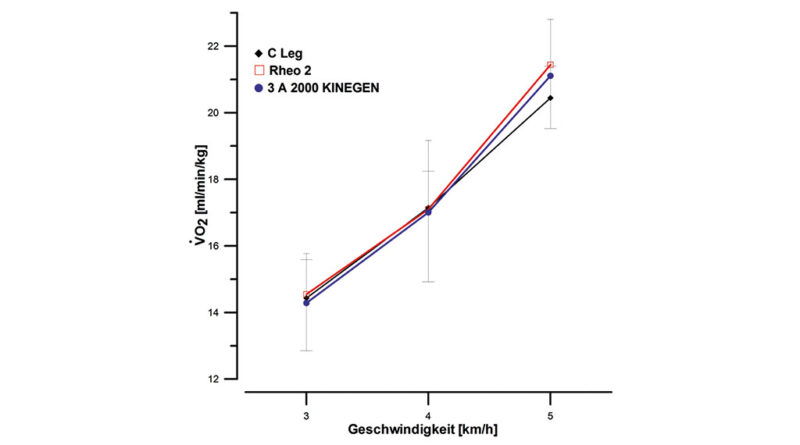
Beim Rheo 2 stieg die Aktivität des M. glut. max. in der Standphase von 3 auf 5 km/h signifikant an. Der M. rectus fem. zeigte eine signifikante Zunahme der Aktivität über die Geschwindigkeitsstufen (p<0,05). Für den M. obliquus externus abdominis konnte auf der nicht betroffenen Körperseite dies beim C‑Leg und Kinegen in der Standbeinphase beobachtet werden. Beim Rheo Knee 2 wurden diese Aktivitätserhöhungen des M. obliquus externus abdominis bei fünf km/h auf der Amputationsseite in der Schwungbeinphase festgestellt. Eine deutliche Zunahme zeigte sich im relativen Sauerstoffverbrauch (p<0,05) (Abb. 2).
Hinsichtlich des Einflusses der Prothese auf die Muskelaktivität konnte nur für den M. obliquus externus abdominis ein signifikanter Effekt festgestellt werden (p<0,05). Alle anderen Muskeln scheinen davon nur gering beeinflusst worden zu sein (p>0,05) (Abb. 3). Ebenso zeigte die Prothese keinen signifikanten Effekt auf den Sauerstoffverbrauch (p>0,05). Im Vergleich der Prothesen war die Muskelaktivität für alle drei Geschwindigkeiten beim Kinegen am geringsten. Beim Gehen mit dem Rheo Knee 2 konnte bei gleicher Geschwindigkeit eine leicht höhere Muskelaktivität gemessen werden. Die höchsten Aktivitäten lagen beim Gehen mit der C‑Leg-Prothese vor. Die eben beschriebene Verteilung der Muskelaktivität für die drei Prothesen zeigte sich auf der Amputationsseite in beiden Gangphasen für alle Parameter. Dabei war beim Gehen mit dem mechanischen Kniegelenk eine signifikant geringere Aktivität des M. obliquus externus abdominis gegenüber den mikroprozessorgesteuerten Kniegelenken zu verzeichnen.
Diskussion
Mikroprozessorgesteuerte Prothesen erzeugen aufgrund der Technologie ein erhöhtes Sicherheitsempfinden für den Patienten. Dies ermöglicht für Patienten höheren Mobilitätsgrades mehr Flexibilität hinsichtlich der Alltagsaktivitäten. Bisher wird von einer verbesserten Kinematik durch diese Technologie ausgegangen. Ziel der Untersuchung war, zu überprüfen, inwiefern sich dies an physiologischen Größen wie der neuromuskulären Aktivität und dem Sauerstoffverbrauch zeigen lässt. Dazu wurde hier an einer kleinen aber homogenen Probandengruppe, die einen hohen Mobilitätsgrad besitzt und aufgrund der langen Amputationszeit viel Erfahrung mit dieser Technologie hat, ein stufenförmiger Gehtest durchgeführt.
Einfluss der Geschwindigkeit
Es zeigte sich mit steigender Geschwindigkeit eine kontinuierliche Zunahme der Muskelaktivität in den meisten Muskeln. Zu einem ähnlichen Ergebnis kamen auch Chin et al. 20. Höhere Geschwindigkeiten verursachen mehr Scherkräfte auf den Rumpf. Der M. obliquus externus abdominis muss aufgrund der Geschwindigkeitszunahme während der Standbeinphase den Rumpf vermehrt stabilisieren und in der Schwungbeinphase die anteriore Beckenrotation verstärkt durchführen. An einzelnen Muskeln wie dem M. rectus fem. und dem M. glut. maximus lag aufgrund der schnelleren Schrittfrequenz bei höheren Geschwindigkeiten eine höhere neurophysiologische Beanspruchung vor.
Mit zunehmender Geschwindigkeit kann eine verstärkte Seitneigung des Rumpfes auftreten und eine Aktivitätssteigerung des M. obliquus externus abdominis bewirken 21 22. Diese Seitneigung kann beispielweise in der Standbeinphase von Patienten mit Kontraktur der Hüftgelenksadduktoren eintreten. Dabei wird das Becken auf der kontralateralen Seite abgesenkt und die verkürzten Hüftgelenksadduktoren verschieben den Körperschwerpunkt vom Standbein weg. Der Rumpf neigt sich zur Standbeinseite, um die entstehende Dysbalance auszugleichen 23. Eine Seitneigung des Rumpfes kann auch bei einer zu kurzen Standbeinphase als Kompensation eingesetzt werden. Durch die Seitneigung wird das Becken auf der Schwungseite angehoben und damit das Durchschwingen des Beines ermöglicht. Bei höheren Geschwindigkeiten steigt die Krafteinwirkung auf den Rumpf und es kommt folglich zu einer stärkeren Aktivierung 24. Mit zunehmender Geschwindigkeit kann eine verstärkte Vorneigung des Rumpfes angenommen werden. Dies kann bei einer zu schwachen Aktivität des M. quadriceps der Fall sein, wenn das Kniegelenk in Extension zu stabilisieren ist.
Des Weiteren konnte für einen Teil der Messwerte innerhalb dieser Versuchsreihe beobachtet werden, dass sich die Muskelaktivität von drei zu vier km/h nicht signifikant veränderte, erst bei fünf km/h deutlich zunahm und dann gleichzeitig am höchsten war. Möglich scheint ein neurophysiologischer Steady State der Muskulatur bei günstigen Massenträgheitsverhältnissen, welcher sich anhand der Sauerstoffaufnahme hier nicht zeigte.
Einfluss der Prothese
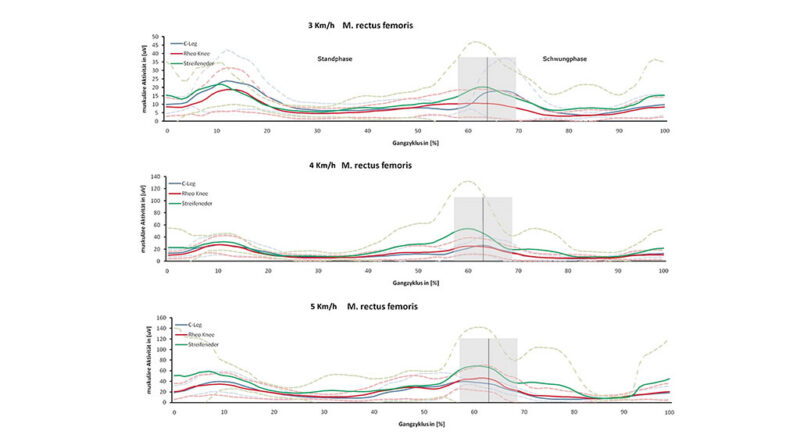
Bezüglich des Prothesentyps wurde nur beim M. obliquus externus abdominis ein signifikanter Effekt der Prothese auf die Muskelaktivität gezeigt (p<0,05). Dabei besaß das mechanische Kniegelenk (Kinegen) eine signifikant geringere Aktivität des M. obliquus externus abdominis gegenüber den mikroprozessorgesteuerten Kniegelenken (C‑Leg und Rheo Knee 2) (Abb. 4). Bisher zeigte sich eine deutlich geringere Muskelaktivität (M. gluteus med. et max.) gegenüber mechanischen Gelenken 25. Im Hinblick auf kinematische und kinetische Parameter wie Stützzeit und Landeimpuls liegen zwischen mechanischen und prozessorgestützten Kniegelenken kaum Unterschiede vor 26. Neurophysiologisch betrachtet, könnten die hydraulischen und magnetorheologischen Eigenschaften beider mikroprozessorgesteuerten Prothesen die Ursache sein.
Hauptziel dieser Prothesen ist, die Sicherheit in der Standphase zu erhöhen. Die Abtastrate (50 Hz) beim C‑Leg scheint eine verzögerte hydraulische Adaption zu verursachen. In der frühen Schwungphase der Prothesenseite könnte trotz geringer Reaktionszeit der Elektronik (ca. 20 ms) eine Restspannung im Gelenk zurückbleiben bzw. über die Schwungphase vorliegen. Der M. obliquus externus abdominis muss während der Schwungbeinphase gegen diese Strömungswiderstände arbeiten. Betroffene Patienten geben beim Umsteigen von mechanischer auf eine mikroprozessorgestützte Prothese (C‑Leg) an, dass das Einleiten der Schwungphase anfangs bedeutend schwerer fällt. Ein ausreichendes Durchschwingen der Prothese erhöht dadurch den Krafteinsatz. Aufgrund der hohen Abtastrate (1000 Hz) des Rheo Knee 2 ist dieser Effekt ähnlich dem der Kinegen-Prothese.
Im Gegensatz dazu arbeiten mechanische Prothesen eher wie ein frei schwingendes Pendel. Dadurch zeigte sich hier beim Gehen wohl die geringste Muskelaktivität im Rumpf. Mit Blick auf das Prothesengewicht könnte auch dessen Effekt vorliegen. Die Kinegen-Prothese hat das geringste Eigengewicht, wodurch der M. obliquus externus abdominis möglicherweise weniger arbeiten muss. Die Funktionsweise der Prothesen kann ebenso Einfluss auf die Muskelaktivität haben. Durch die integrierte Pneumatikkammer beim Kinegen wird ein progressiver Federeffekt erzeugt, welcher den Unterschenkel in Extension beschleunigt. In der initialen Schwungbeinphase bewirkt das Kinegen durch seine Mehrachsigkeit eine schnellere und stärkere Beugung als mikroprozessorgesteuerte Prothesen 27. Nicht unerheblich scheint die veränderte Muskellänge des M. rectus femoris zu sein, welcher aufgrund seiner anatomischen Verkürzung eine Kompensation durch den M. obliquus externus abdominis erfährt.
In Bezug auf den Einfluss der Schaftversorgung lassen die Daten keine Rückschlüsse auf dessen Effekt zu. Aufgrund des hohen Mobilitätsgrades der Probanden wurden die meisten mit MAS-Schaft, welcher eine hohe aktive Muskelspannung im Gangzyklus voraussetzt, versorgt. Ein großer Vorteil des MAS-Schaftsystems ist die Bewegungsfreiheit im Hüftgelenk 28. Tuberumgreifende Schäfte zeichnen sich durch geringeren Prothesenhub in der Schwungphase sowie geringere ventrale Druckkräfte im Schaft und geringere Beckenneigung aus 29. Der reduzierte Prothesenhub lässt eine geringere Aktivität der ventralen und sagittalen Rumpfmuskulatur vermuten. Zur Klärung diverser Effekte der Schaftform müssten größere Fallzahlen und möglicherweise andere Mobilitätsgrade mit einbezogen werden.
Abschließend bleibt festzuhalten, dass die Rumpfmuskelaktivität bei mechanischen Kniegelenken neuromuskulär geringer erscheint. Eine Prothesenabhängigkeit in Bezug zur Muskulatur der unteren Extremität lag hier nicht vor. Dies könnte bei Umstellung des Prothesenträgers von mechanischem auf mikroprozessorgestütztes Gelenk relevant sein und bei trainingstherapeutischen Interventionen berücksichtigt werden.
Für die Autoren:
Dr. Nico Nitzsche
Hs Lausitz / University of Applied
Sciences
Fakultät für Ingenieurwissenschaften
und Informatik
Großenhainer Straße 57
01968 Senftenberg
nico.nitzsche@hs-lausitz.de
Begutachteter Beitrag/Reviewed paper
Nitzsche N, Gerber M, Rehor J. Gehen mit mechanischer und mikroprozessorgesteuerter Knieprothese – Eine Studie über die physiologische und neurophysiologische Beanspruchung. Orthopädie Technik, 2013; 64 (3): 20–26
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 11. Februar 2026
- iOrt – Entwicklung einer überwachenden Orthese mit neuartigem optischen Sensorsystem — 11. Februar 2026
- Bunce DJ, Breakey JW. The impact of C‑Leg on the physical and physiological adjustment to transfemoral amputation. JPO. 2007; 19: 7–14
- Kahle JT, Highsmith MJ, Hubbard SL. Comparison of nonmicroprocessor knee mechanism versus C‑Leg on Prosthesis Evaluation Questionnaire stumbles, falls, walking tests, stair descent, and knee preference. J Rehabil Res Dev 2008; 45: 1–44
- Orendurff MS, Segal AD, Klute GK, McDowell ML, Pecoraro P, Czerniecki J. Gait efficiency using the C‑Leg. J Rehabil Res Dev 2006; 43: 239–246
- Chin T, Machida K, Sawamura S, et al. Comparison of different microprocessor controlled knee joints on the energy consumption during walking in trans-femoral amputees: Intelligent Knee (IP) versus C‑Leg. Prosthet Orthot Int 2006; 30: 73–80
- Hafner BJ, Smith DG. Differences in function and safety between Medicare Functional Classification Level‑2 and ‑3 transfemoral amputees and influences of prosthetic knee joint control. J Rehabil Res Dev. 2009; 46: 417–434
- Kahle JT, Highsmith MJ, Hubbard SL. Comparison of nonmicroprocessor knee mechanism versus C‑Leg on Prosthesis Evaluation Questionnaire stumbles, falls, walking tests, stair descent, and knee preference. J Rehabil Res Dev 2008; 45: 1–44
- Kastner J, Nimmervoll R, Wagner P. Was kann das C‑Leg? – Ganganalytischer Vergleich von C‑Leg, 3R45 und 3R80. Med. Orth. Tech. 1999; 119: 131–137
- Orendurff MS, Segal AD, Klute GK, McDowell ML, Pecoraro P, Czerniecki J. Gait efficiency using the C‑Leg. J Rehabil Res Dev 2006; 43: 239–246
- Segal AD, Orendurff MS, Klute GK, et al. Kinematic and kinetic comparison of transfemoral amputee gait using C‑Leg and Mauch SNS prosthetic knees. J Rehabil Res Dev 2006; 43: 857–870
- Schmalz T, Blumentritt S, Marx B. Biomechanical analysis of stair ambulation in lower limb amputees. Gait Posture. 2007; 25: 267–278
- Johansson JL, Sherrill DM, Riley PO, Bonato P, Herr H. A clinical comparison of variable-damping and mechanically passive prosthetic knee devices. AM J Phys Rehabil. 2005; 84: 563–575
- Johansson JL, Sherrill DM, Riley PO, Bonato P, Herr H. A clinical comparison of variable-damping and mechanically passive prosthetic knee devices. AM J Phys Rehabil. 2005; 84: 563–575
- Schaarschmidt M, Lipfert SW, Meier-Gratz C, Scholle HC, Seyfarth A. Functional Gait asymmetry of unilateral transfemoral amputees. Human Movement Science 2012; 4: 907–917
- Krebs DE, Wong D, Jevsevar D, Riley PO, Hodge WA. Trunk kinematics during locomotor activities. Physical Therapy. 1992; 72: 505–514
- Krebs DE, Wong D, Jevsevar D, Riley PO, Hodge WA. Trunk kinematics during locomotor activities. Physical Therapy. 1992; 72: 505–514
- Anders C, Wagner H, Puta C, Grassme R, Petrovitch A, Scholle HC. Trunk muscle activation patterns during walking at different speeds. J Electromyogr Kinesiol 2007; 17 (2): 245–252
- Anders C, Wagner H, Puta C, Grassme R, Scholle HC. Healthy humans use sex-specific coordination patterns of trunk muscles during gait. Eur J Appl Physiol 2009; 105 (4): 585–594
- Goujon-Pillet H, Scapin E, Fodé P, Lavaste F. Three-dimensional motion of trunk and pelvis during transfemoral amputee gait. Arch Phys Med Rehabil. 2008; 89: 87–94
- Götz-Neumann K. Gehen verstehen. Stuttgart: Thieme Verlag, 2011
- Chin T, Machida K, Sawamura S, et al. Comparison of different microprocessor controlled knee joints on the energy consumption during walking in trans-femoral amputees: Intelligent Knee (IP) versus C‑Leg. Prosthet Orthot Int 2006; 30: 73–80
- Götz-Neumann K. Gehen verstehen. Stuttgart: Thieme Verlag, 2011
- Goujon-Pillet H, Scapin E, Fodé P, Lavaste F. Three-dimensional motion of trunk and pelvis during transfemoral amputee gait. Arch Phys Med Rehabil. 2008; 89: 87–94
- Goujon-Pillet H, Scapin E, Fodé P, Lavaste F. Three-dimensional motion of trunk and pelvis during transfemoral amputee gait. Arch Phys Med Rehabil. 2008; 89: 87–94
- Anders C, Wagner H, Puta C, Grassme R, Petrovitch A, Scholle HC. Trunk muscle activation patterns during walking at different speeds. J Electromyogr Kinesiol 2007; 17 (2): 245–252
- Johansson JL, Sherrill DM, Riley PO, Bonato P, Herr H. A clinical comparison of variable-damping and mechanically passive prosthetic knee devices. AM J Phys Rehabil. 2005; 84: 563–575
- Schaarschmidt M, Lipfert SW, Meier-Gratz C, Scholle HC, Seyfarth A. Functional Gait asymmetry of unilateral transfemoral amputees. Human Movement Science 2012; 4: 907–917
- Belitz G. Überflieger. HANDICAP Das Magazin für Lebensqualität 2010; (1)
- Ortiz RM. M.A.S.-Konstruktion für Oberschenkelprothesen. Orthopädie Technik 2007; 58 (4): 240–247
- Wühr J, Linkemeyer K, Barsch K, Drerup B, Wetz HH. Vergleich tuberumgreifender und tuberunterstützender Schäfte: klinische und biomechanische Untersuchungen. Orthopädie Technik 2008; 59 (11): 826–833