Einleitung
Formgedächtnismaterialien werden aufgrund ihrer einzigartigen Materialeigenschaften in vielfältigen technischen, aber auch in medizintechnischen Anwendungen eingesetzt. Für medizinische Anwendungen sind solche Materialien außerdem durch gute Korrosions- und Biegefestigkeit sowie Biokompatibilität und MTR-Tauglichkeit interessant 1 2. Durch entsprechende Beschichtungen beispielsweise mit Kalziumphosphat, Hydroxylapatit oder eine gezielte Oberflächenkorrosion kann die Biokompatibilität weiter verbessert beziehungsweise einem möglichen Austreten von Nickelionen vorgebeugt werden 3.
Neben der Nutzung der superelastischen Eigenschaften in Form von Stents oder Führungsdrähten kommen in den letzten Jahren vermehrt auch aktive Komponenten zum Einsatz. Prädestiniert sind hierbei Anwendungen, bei denen entweder eine situative Veränderung der Lastverhältnisse durch externe Energiezufuhr oder die dauerhafte Aufbringung einer konstanten Kraft ohne externe Energiezufuhr erwünscht ist. Der sogenannte Einweg-Formgedächtniseffekt ist besonders im Bereich der Implantate und Klammern zur Osteosynthese sowie bei Instrumenten verbreitet, die je nach Bedarf individuell verbogen werden können und nach dem Sterilisationsprozess wieder ihre ursprüngliche Form annehmen 4. Knochenfixierungselemente werden bspw. im gekühlten Zustand implantiert. Bei Erwärmung ändern sie entsprechend ihre Geometrie und verspannen bzw. fixieren somit aktiv Brüche oder andere Verletzungen im Bereich der knöchernen Strukturen 5.
Aber auch für den Bereich Endoprothetik wird NiTi (Nitinol, eine Nickel-Titan-Legierung) immer interessanter. Im Vergleich mit anderen Konstruktionswerkstoffen ist der E‑Modul (Kennwert des Widerstandes eines Materials gegenüber seiner Verformung) von NiTi dem Knochen am ähnlichsten. Seine hohe Dämpfungskapazität könnte z. B. für die Dämpfung von Spitzenbelastungen zwischen Knochen und Implantat nützlich sein 6.
Formgedächtnismaterial
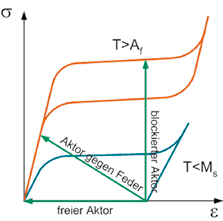
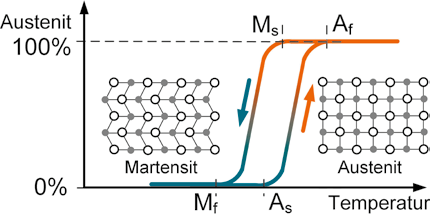
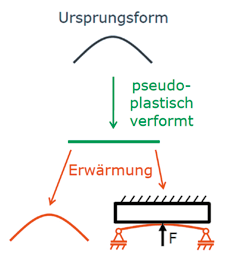
Thermische Formgedächtnislegierungen (FGL) gehören zu den aktiven Werkstoffen und haben die besondere Eigenschaft, nach großer, scheinbar plastischer Deformation ihre Ausgangsform durch Temperaturerhöhung wieder einzunehmen. Wird der Formgedächtniseffekt unterdrückt, indem die Rückstellung verhindert wird, entfaltet das Material entsprechend Abbildung 1 eine externe Kraft und wirkt als Aktor. Häufig kommt Nickel-Titan (NiTi) zum Einsatz, da es biokompatibel eingesetzt werden kann und kommerziell verfügbar ist. Der Temperaturbereich, in dem die Phasenumwandlung vorkommt, wird über das Verhältnis der Legierungsbestandteile und eine Wärmebehandlung eingestellt und kann durch vier charakteristische Temperaturen (Ms, Mf, As, Af) beschrieben werden (Abb. 2) 7.
Typische Aktorgeometrien aus FGL sind Federn, Rohre, Drähte und Bleche. Entsprechend den anwendungstypischen Anforderungen kommen bei den folgenden Beispielen Drähte und Bleche zum Einsatz. Drähte sind in Kombination mit Textilien geeignet, um die vorhandene Verarbeitungstechnologie zu adaptieren und aktive Verbundstrukturen herzustellen. Die Aktivierung von FGL-Drähten kann über Joule’sche Wärme und die dafür erforderliche Leistungselektronik erfolgen. Alternativ ist ein autark wirksames System möglich, wie im zweiten Beispiel, dem adaptiven Implantat, gezeigt wird.
Aktive Verbundstrukturen
Motivation
In Kompressionstherapie und Orthetik kommen vorrangig textile Hilfsmittel mit vordefiniertem Spannungs-Dehnungs-Verhalten zum Einsatz. Aus medizinischer Sicht ist eine Struktur günstig, die sich patienten- und situationsspezifisch anpassen kann 8. Ein Verbund aus textilem Grundmaterial und thermisch aktivierbaren Drähten aus Formgedächtnislegierung bietet großes Potenzial bei der Realisierung einer adaptiven Hybridstruktur, die eine bedarfsgerechte Beeinflussung der Kraft- und Wegverläufe ermöglicht 9.
Material und Methoden
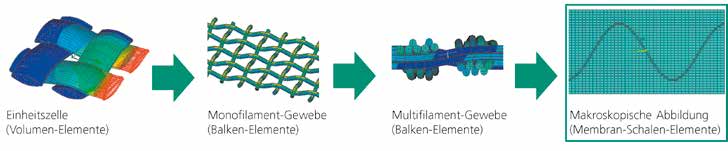
Um eine gezielte Anpassung der mechanischen Eigenschaften der Hybridstrukturen an unterschiedliche therapeutische Anforderungen zu bewirken, sind theoretische Betrachtungen und praktische Versuche erforderlich. Zur Gewinnung geeigneter Berechnungsgrundlagen wurden auf der Basis der Finite-Elemente-Methode mikroskopische und makroskopische Ansätze untersucht.
Die Einheitszelle besteht aus Volumen-Elementen und einem repräsentativen Ausschnitt des gesamten Textils. Komplexere Lastzustände lassen sich mit diesem Modellansatz nicht beschreiben 10. Ein größerer Ausschnitt und damit auch mehrachsige Beanspruchungen lassen sich mit dem Monofilament-Gewebe aus Balken-Elementen berechnen 11.
Unterschiedliche textile Verarbeitungstechniken kamen bei der Entwicklung der Hybridstrukturen aus Textil und FGL zum Einsatz. Sowohl elastische Flächengewirke als auch steifere Leinwand-Gewebe wurden gefertigt, vermessen und prüftechnisch charakterisiert. Dabei wurde FGL in Form von Drähten einerseits als Fadenersatz in Kettrichtung verwoben, andererseits mittels Soutagetechnologie aufgestickt (Abb. 3).
Ergebnisse und Anwendung
Beide Betrachtungsweisen (numerisch und experimentell) führten nach einer Gegenüberstellung zu einem Berechnungsmodell, das eine effiziente Simulation der komplexen strukturmechanischen Zusammenhänge von FGL-Textil-Verbünden ermöglicht. Eine flächige Betrachtungsweise des Textils auf Basis biegeweicher Schalenelemente stellt zusammen mit einem anisotrop hyperelastischen Materialansatz einen geeigneten Ansatz dar, um das strukturmechanische Verhalten zu simulieren. Durch Federelemente erfolgt die Anbindung des Formgedächtnisaktors an die textile Basisstruktur.
Zur Simulation der Wechselwirkung zwischen Textil und Aktor und zur Abbildung des komplexen Verhaltens des Aktors ist das Materialgesetz für die Formgedächtnislegierung entscheidend. Die fertigungstechnische Verarbeitung der NiTi-Legierung konnte beim Projektpartner TITV Greiz in gewebter und gestickter Form unter definierten Randbedingungen erfolgreich umgesetzt werden (Abb. 4). Dabei muss das hochgradig temperaturabhängige Spannungs-Dehnungs-Verhalten berücksichtigt werden.
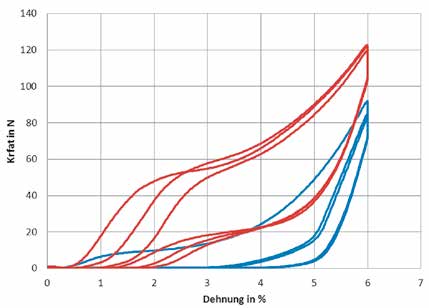
Der Kraft-Dehnungs-Verlauf in Abbildung 5 zeigt den Einfluss der FGL-Drähte im Textilverbund, der aus einem Zugversuch experimentell bestimmt wurde. Im aktivierten Zustand (roter Werteverlauf) sind deutlich höhere Kräfte erforderlich, um die Struktur zu dehnen, als beim inaktiven Verbund (blauer Werteverlauf). Dieses stark unterschiedliche mechanische Verhalten kann einerseits dazu eingesetzt werden, die Steifigkeit einer textilen Stützstruktur situationsabhängig einzustellen, andererseits dazu, eine Kompressionskraft zu variieren 12.
Einsatz aktiver Materialien am Beispiel eines adaptiven Implantats
Motivation
In Deutschland wird jährlich rund 400.000 Patienten ein künstliches Gelenk eingesetzt. Weit mehr als 90 Prozent davon entfallen auf die Implantation von künstlichen Hüft- und Kniegelenken. Laut Barmer-GEK-Report Krankenhaus 2010 wurden in Deutschland im Jahr 2010 etwa 210.000 Erstimplantationen am Hüftgelenk sowie 175.000 am Kniegelenk durchgeführt. Der Anteil an Revisions-Operationen, die aufgrund auftretender Lockerungen der Endoprothese durchgeführt werden müssen, beträgt dabei ca. 14 %.
Bei zementfreien Hüftimplantaten wird die Lockerung im Schaft hauptsächlich durch den veränderten Kraftfluss und die hierdurch mangelhafte Lastübertragung zwischen Implantat und knöchernem Verankerungslager hervorgerufen. Die Ursache sind ausgeprägte Unterschiede in der mechanischen Festigkeit und Elastizität von Knochen und Implantat. Beim zementfreien Verfahren besteht nach dem Einschlagen des Implantatschaftes in die geraspelte oder gefräste Aushöhlung im Oberschenkelknochen eine sogenannte „Pressfit”-Verbindung. Aufgrund der Anpassungsfähigkeit des Knochens wird bei Über- oder Fehlbelastung die Pressverbindung zwischen Implantat und Knochen relativ schnell abgebaut, wodurch eine feste Verankerung der Endoprothese verhindert wird.
Material und Methoden
Gemeinsam mit dem Projektpartner Fraunhofer FEP wurde ein Lösungsansatz zur Herstellung einer optimalen Lastverteilung im Knochen unter Einsatz von FGL-Elementen im Hüftschaft in Verbindung mit einer biokompatiblen Beschichtung entwickelt. Hierdurch soll ein krafthomogener Kontakt an der Implantat-Knochen-Schnittstelle erzielt werden. Nach dem Einschlagen des adaptiven Schaftimplantates in das vorbereitete Implantatlager kommt es infolge der Erwärmung auf Körpertemperatur zur thermischen Aktivierung der integrierten FGL-Blechstreifen (Abb. 6). Diese Formänderung wird in Abhängigkeit von der Steifigkeit des periprothetischen Femur bei der Aktivierung behindert. Dieses Materialverhalten wird als „unterdrücktes Formgedächtnis” bezeichnet, da die Rückbildung in eine zuvor eingeprägte Ursprungsform durch die hier vorliegende Reaktionskraft des Knochens nicht möglich ist. Bei der mechanischen Unterdrückung wird demzufolge eine Kraft aufgebaut, die genutzt werden kann, um den Kraftschluss im Kontaktbereich einer zementfrei verankerten Schaftprothese mit dem Oberschenkelknochen zu unterstützen.
Ergebnisse und Anwendung
Für eine bestmögliche Nachbildung der physiologischen Lastverhältnisse eines intakten Hüftgelenkes ist die Hüftgelenkskraft möglichst im proximalen Bereich des Schaftimplantates in den umliegenden Oberschenkelknochen einzuleiten. Zur Unterstützung des proximalen Pressfits wurden Prinzipmodelle von Schaftprothesen mit integrierten FGL-Elementen unterschiedlicher Geometrie entworfen (Abb. 7). Gemeinsam mit Medizinern wurde ein Prothesenmodell mit FGL-Blechstreifen auf mindestens drei Seiten des proximalen Schaftbereiches favorisiert, das eine Wirkung sowohl ventral und dorsal als auch medial und lateral erzielen kann. Das entwickelte Implantatkonzept stellt eine Möglichkeit dar, die Kontaktkraft im proximalen Schaftbereich gleichmäßig zu erhöhen und dabei einen unstetigen Kraftverlauf zu vermeiden 13.
Diese Verankerungstechnologie wurde mit den Projektpartnern der Universität Leipzig und des Universitätsklinikums Dresden auf ein Wirbelsäulenimplantat, eine sogenannte Pedikelschraube, übertragen 14. Im konkreten Fall wurde ein Schraubenkonzept entwickelt, das zukünftig eine Alternative zu Knochenzement bei der spinalen Versorgung darstellt und wesentliche Vorteile besonders bei der Revisionsfähigkeit bietet. Die FGL-Aktoren wurden direkt an der Knochen-Implantat-Schnittstelle integriert und sollen durch die Oberflächenvergrößerung insbesondere im Wirbelkörperfortsatz eine verbesserte Verankerungsstabilität auch in geschädigten bzw. degenerativ veränderten Knochenstrukturen ermöglichen (Abb. 8). Eine Steigerung der Auszugskraft aus Knochenersatzmaterial um 25 % konnte bereits nachgewiesen werden. Erste Untersuchungen an Humanpräparaten bestätigten die Wirkung der FGL-Aktoren in Bezug auf die erzielbare Erhöhung der Verankerungsstabilität (Abb. 9).
Danksagung
Wir danken unseren Projektpartnern Dr. Hanno Steinke (Universität Leipzig, Institut für Anatomie), Dr. Mario Leimert (Universitätsklinikum Carl Gustav Carus Dresden, Klinik und Poliklinik für Neurochirurgie), Dr. Fred Fietzke und Dr. Christiane Wetzel (Fraunhofer FEP) sowie Heike Oschatz und Volkmar Reichmann (Textilforschungsinstitut Thüringen-Vogtland e. V.– TITV Greiz).
Für die Autoren:
Dipl.-Ing. (FH) Christian Rotsch
Fraunhofer-Institut für Werkzeugmaschinen und Umformtechnik IWU
Gruppenleiter Medizintechnik
Nöthnitzer Straße 44
01187 Dresden
Christian.Rotsch@iwu.fraunhofer.de
Begutachteter Beitrag/Reviewed paper
Rotsch C, Senf B, Werner M, Bucht A. Einsatz aktiver Materialien in medizintechnischen Anwendungen. Orthopädie Technik, 2014; 65 (5): 80–84
- Dynamische Unterschenkelorthese in Prepreg-Technik nach Hafkemeyer – Konstruktionsmerkmale, Indikationen, Variationsmöglichkeiten — 3. April 2024
- Bringt die Stand- und Schwungphasenkontrolle einen Vorteil bei KAFO-Trägern? Ergebnisse einer internationalen randomisiert-kontrollierten Studie — 3. April 2024
- Dynamische CDS-Knieredressionsorthesen bei Kindern und Jugendlichen mit Cerebralparese GMFCS-Level II–III — 3. April 2024
- Schmid PS. Biokompatibilität von Nitinol-Stapesprothesen. Universität Zürich, Dissertation, 2010
- Trépanier C et al. In Vivo Biocompatibility Study of NiTi Stents. In: Pelton A, Hodgson D et al. (eds.). Proceedings of the 2nd Int’l Conference on Shape Memory and Superelastic Technologies, Pacific Grove, CA (USA), 1997
- Budilon F, Gries T. Untersuchung der Verarbeitungseigenschaften von Nitinol zur Herstellung textiler Strukturen. Bericht zum Forschungsvorhaben AiF 103 ZN, Institut für Textiltechnik der RWTH Aachen, 2005
- Petrini L, Migliavacca F. Biomedical Applications of Shape Memory Alloys. Journal of Metallurgy, 2011; Article ID 501483, doi:10.1155/2011/501483
- Umanski E. Der Einfluss von Nickel-Titan-Formgedächtnislegierungen auf die Zytokinfreisetzung und Proliferation von humanen Leukozyten und humanen osteoblastenartigen Osteosarkomazellen in vitro. Universität Bochum, Dissertation, 2004
- Nasab MB, Hassan MR. Metallic Biomaterials of Knee and Hip – A Review. Trends Biomater Artif Organs, 2010; 24 (1): 69–82
- Lagoudas DC. Shape memory alloys: Modeling and engineering applications. New York: Springer, 2008
- Esfahani TE. Developing an Active Ankle Foot Orthosis Based On Shape Memory Alloys. University of Toledo, Master Thesis, 2007
- Villa E, Arnaboldi S, Tuissi A, Giacomelli M, Turco E. Mechanical Analysis of Hybrid Textile Composites with NiTi Wires. Journal of Materials and Engineering and Performance, 2009; 18 (5–6): 517–521
- McBride TM, Chen J. Unit-Cell Geometry in Plain-Weave Fabrics during Shear Deformations. Journal of Composites Science and Technology, 1997; 57: 345
- Tarfaoui M. Numerical study of the mechanical behaviour of textile structures. Journal of Clothing Science and Technology, 2001; 13: 166
- Rotsch C, Senf B, Oschatz H, Drossel W‑G. Adaptive Hybridstrukturen aus Textil und Formgedächtnislegierung für die medizinische Therapie und Rehabilitation. In: Füssel J, Koch E, Malberg H, Vonau W (Hrsg.). Forschungsgesellschaft für Messtechnik, Sensorik und Medizintechnik: Innovationen in Medizintechnik und medizinischer Mess- und Sensortechnik: 03. Dezember 2012 – 05. Dezember 2012, Dresden. Dresden: TUDpress, 2012: 217–221
- Neugebauer R, Rotsch C, Scherer S, Werner M, Böhm A, Töppel T, Bräunig J. Topology-Optimized Implants: Medical Requirements and Partial Aspects of a Design Engineering Process Chain. In: Schuh G, Neugebauer R, Uhlmann E (eds.). Future Trends in Production Engineering. Proceedings of the First Conference of the German Academic Society for Production Engineering (WGP), Berlin, Germany, 8th-9th June 2011. Berlin: Springer Verlag, 2013: 33–46
- Werner M, Rotsch C, Senf B, Bucht A, Steinke H, Leimert M. Einsatz aktiver Materialien am Beispiel eines adaptiven Implantates für die Wirbelsäule. In: Füssel J, Koch E, Malberg H, Vonau W (Hrsg.). Forschungsgesellschaft für Messtechnik, Sensorik und Medizintechnik: Innovationen in Medizintechnik und medizinischer Mess- und Sensortechnik: 03. Dezember 2012 – 05. Dezember 2012, Dresden. Dresden: TUDpress, 2012: 152–156