Das Diabetische Fußsyndrom ist eine schleichend fortschreitende, komplexe Schädigung des Fußes in Form von Funktions- und Organteilverlusten unterschiedlicher Ausprägungen und Kompensationsmöglichkeiten. Veränderungen der einzelnen anatomischen Fußstrukturen in Verbindung mit dem gestörten lokalen Stoffwechsel führen zu unterschiedlichen Beschwerden, die sich beim Überschreiten eines Grenzpunktes zu bedrohlichen bis fatalen Komplikationen entwickeln.
Das Diabetische Fußsyndrom ist die häufigste Ursache für Beinamputationen. Nach Angaben des Statistischen Bundesamtes werden in Deutschland jedes Jahr ca. 30.000 bis 40.000 Majoramputationen durchgeführt. Zur Reduzierung der Amputationsrate ist es notwendig, die komplexen Zusammenhänge von Struktur, Funktion und Stoffwechsel zu erkennen, um frühzeitig individuellen Komplikationen in Form von Ulzerationen, Nekrosen und Infektionen als Hauptursache (85 %) der Amputationen entgegen wirken zu können.
Ursachen und Versorgung des DFS
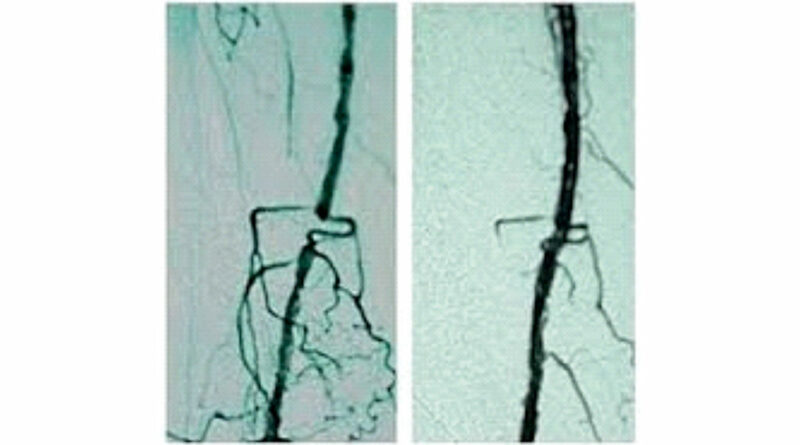
Eine Versorgung des Diabetischen Fußsyndroms erfolgt vorrangig durch die Gefäßchirurgie. Aber nur etwa 30 bis 40 % dieser Füße haben ein wirkliches therapeutisch anzugehendes Gefäßproblem (Angiopathie), welches durch verschiedene operative Maßnahmen wie das Ausschälverfahren (Desobliteration), die Bypasschirurgie (Vene oder Kunstprothese) und/oder die Kombination mit einem endovasculären Verfahren (z. B. Ballonerweiterung) korrigiert werden sollte (Abb. 1). Vorrangig sind beim Diabetes Veränderungen der Gefäße im Unterschenkel-Fußbereich charakteristisch, sodass insbesondere solche Verfahren eingesetzt werden sollten, die eine verbesserte Durchströmung in den kleinen Gefäßen erzielen (perkutane transluminale Angioplastie), ohne dabei einen zusätzlichen Weichteilschaden im Fuß-Unterschenkel zu erzeugen.
Die Erfahrung des Autors zeigt aber auch, dass das Gefäßproblem nicht allein verantwortlich ist für die hohe Amputationsrate. In der weiteren Betrachtung des Diabetischen Fußsyndroms ist besonders die Neuropathie, das heißt die fortschreitende Zerstörung der peripheren sensiblen, sensomotorischen und/oder autonomen Nerven in den Beinen interessant. Diese Nerven sind unter anderem verantwortlich für die Sensorik, Gleichgewichtsfunktion, Schweißproduktion, autonome Durchblutungsregulation und den Haut‑, Muskel- und Weichteilturgor. Mit der zunehmenden Funktionseinschränkung der Nerven werden die auftretenden Fußbeschwerden oder Fußdruckveränderungen nicht bewusst wahrgenommen, sodass im Falle der Grenzpunktüberschreitung plötzlich die Fülle der Komplikationen unter Beteiligung aller Fußstrukturen eine katastrophale Form und Dynamik annimmt.
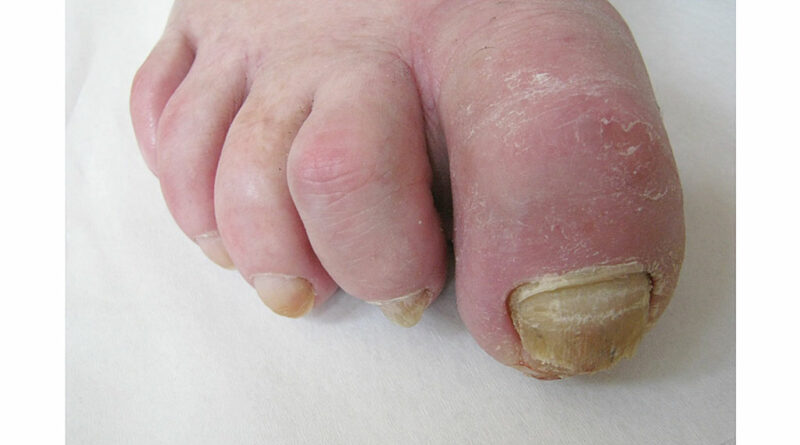
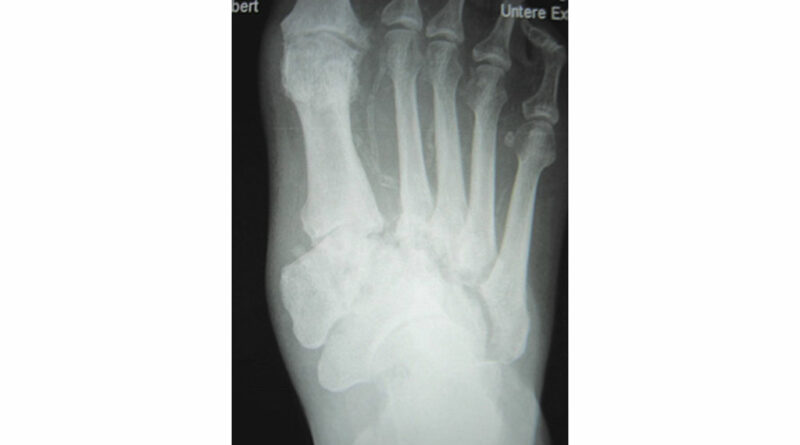
Ebenso werden die diabetogen bedingten Veränderungen im Bereich der Sehnen im Zusammenspiel zwischen Agonisten/Antagonisten, augenscheinlich insbesondere bei den Streck- und Beugesehnen im Zehenbereich (Krallenzehe, Hammerzehe, Halluxvalgus etc.), aber auch die unter besonderer statischer Belastung stehende Achillessehne und Tibialis-anterior-Sehne überhaupt nicht mitbetrachtet. Bezüglich ihrer Pathomorphologie besteht oft völlige Unkenntnis über Funktionsstörungen durch die zunehmende Rigidität oder Schrumpfung unter der diabetogenen Stoffwechselsituation, die dann zu Fußform- und Druckveränderungen (im Sinne des Knick-Klump-Sichelfußes u. a.) führen können (Abb. 2 u. 3).
Der Charcotfuß wird als eine besondere Form des Diabetischen Fußsyndroms angesehen. Die Diabetisch-Neuropathische Osteoarthropathie (DNOAP) ist Ausdruck einer weitaus größeren komplexen und multifaktoriellen Störung des Knochenstoffwechsels, der Angiologie (Gefäßweitstellung) und der Neuropathie. Die Folge sind Knochennekrosen bis hin zur Knochenauflösung und Knochendefekten mit Ausbildung von gigantischen Fußverformungen und Knochendefekten in verschiedenen Ebenen und Ausprägungen des Fußskelettes.
In ca. 50 bis 60 % der Fälle ist die Neuropathie verantwortlich für die Pathologie beim diabetischen Fuß. Hier sind insbesondere diagnostische Sekundärzeichen in Form der Schweißlosigkeit (Anhydrosis) sowie massive punktuelle Hornhautbildung (Hyperkeratose) – gleichzusetzen mit dem letzten „Aufschrei“ des Fußes – anzutreffen. Ulzerationen und Infektionen unter den Hornhautschwielen kombiniert mit Zehenfehlstellungen (Hallux rigidus, Hallux valgus, Digitus rigidus, Digitus malleolus), die einhergehen mit einer Verstärkung der Druckbelastung (hoher „Intrinsic“), sind die Vorstufen zur Amputation.
Einfache diagnostische Möglichkeiten zur Differenzierung des gefäßbedingten vom nervenbedingten Komplexschaden beim diabetischen Fuß sind die Beurteilung von Hautfarbe, Temperatur, Puls, Schweiß, Verhornung, Unterhautfett, Venenzeichnung, Schmerzreaktion und Wundcharakter. Während sich die Angiopathie durch eine blasse Hautfarbe, kühle Temperatur, ein Pulsdefizit (bzw. Pulslosigkeit), eine deutliche Schweißproduktion, geringe Verhornung, ein geringes Unterhautfettgewebe, spärliche Venenzeichnung und deutliche, teils therapieresistente Durchblutungsschmerzen auszeichnet, zeigt sich bei der neuropathisch betonten Komplexsituation des diabetischen Fußes eine rosige und warme Haut bzw. Temperatur. Dies ist kombiniert mit einem kräftigen Puls, Schweißlosigkeit, einer massiven Verhornung, einer dick wulstigen Hautsituation, einer kräftigeren Venenzeichnung, einer Schmerzlosigkeit und einer lokal bedingten Drucknekrose bzw. eines Ulcus.
Klassifikation der Wundsituation nach Wagner/Armstrong
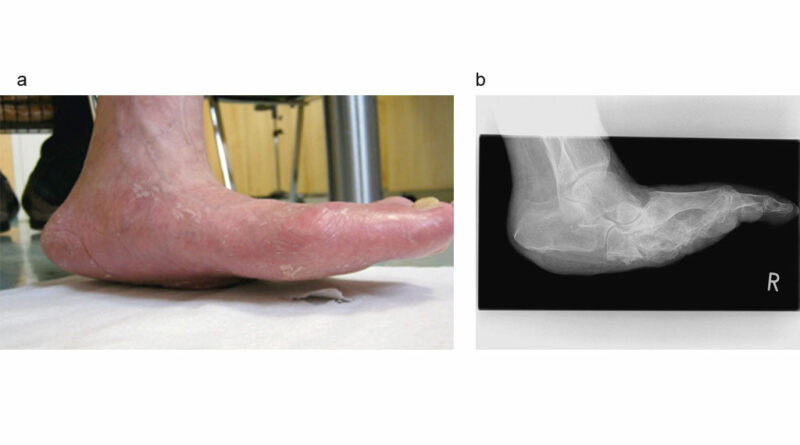
Während bei der gesunden Fußstellung durch Druckumverteilung die Belastung im Bereich der Zehenspitzen und im Bereich der Mittelfußköpfchen bei intaktem Quer- und Längsgewölbe auf die gesamte Fußsohle übertragen wird, erfolgt beim diabetischen Fuß durch Gefäß‑, Sehnen- und Knochenveränderungen eine Veränderung der normalen Fußstellung. Dabei wird vorrangig über einen neurogenen Hohlfuß und weitere Mittelfußveränderungen die punktuelle Belastung dramatisch beeinflusst. Im Ergebnis bricht das Fußgewölbe innerhalb einer zeitlichen Komponente allmählich komplett in sich zusammen und aus dem neurogenen Hohlfuß entsteht ein deformierter und instabiler Stempelfuß (Abb. 4a u. b).
Dieser „Risikofuß“ lässt sich durch konservative Maßnahmen wie medizinische Fußpflege, durch konsequentes Abtragen der Hornhaut (Podologie) und durch Entlastung in Form von geeignetem Schuhwerk (spezialisiertes Schuhhandwerk) dahingehend beeinflussen, dass die Schädigungen des Fußes stationär bleiben.
Sind die Fehlfunktionen soweit ausgeprägt, dass eine Kompensation nicht mehr möglich ist, muss mit einer Verlustsituation durch Amputation von Teilen des Fußes (Nekrose, Gangrän) gerechnet werden.
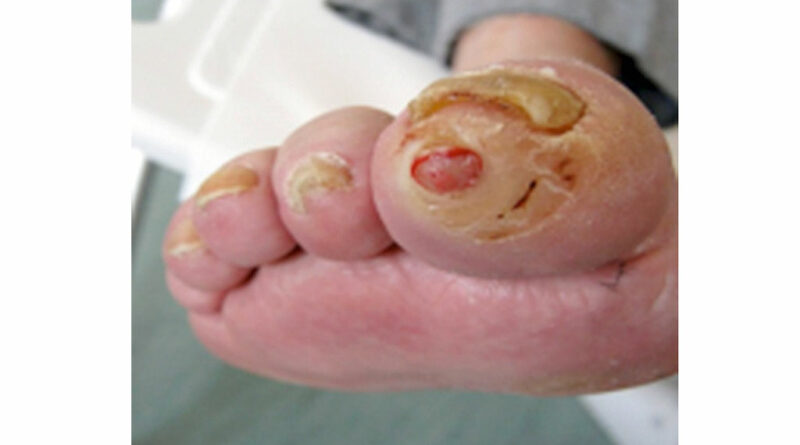
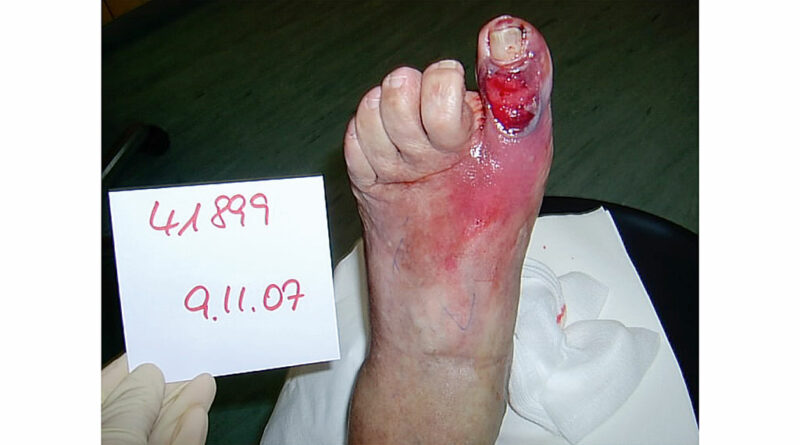
Sind beim diabetischen Fuß Fußverformungen eingetreten, die zu einer erheblichen punktuellen Druckbelastung („Intrinsic“) und der Ausbildung von Druckgeschwüren geführt haben, so sind diese im Rahmen der Leitlinienempfehlungen beim diabetischen Fuß bis vor Kurzem noch durch eine Amputation gefährdet gewesen, insbesondere dann, wenn durch eine Infektion im Zehenbereich (Abb. 5), durch einen freiliegenden Knochen oder ein freiliegendes Gelenk die Heilungsmöglichkeiten eingeschränkt waren. Diese Vorgehensweise ist in vielen Fällen nicht mehr notwendig. Durch minimalinvasive chirurgische Eingriffe lassen sich die Fehlstellungen der Zehen und die dadurch bedingte Fehlbelastung korrigieren. Im Ergebnis heilen Ulzerationen spontan ab. Gleichzeitig ist hierbei eine schuhtechnische Druckentlastung erforderlich. Selbst bei entzündlicher Beteiligung der Knochen (Osteomyelitis/Ostitis) lässt sich durch chirurgische Ausräumung des krankhaften Befundes am Knochen kombiniert mit der Einlage von Septopalketten und Stabilisierungsmaßnahmen (Bohrdraht) der Infekt bekämpfen.
Bei eingetretener Infektion im Fußbereich besteht die chirurgische Behandlungsstrategie in der Einleitung einer Breitbandantibiose zur Infektbekämpfung, einer Minimalinzision zur Entlastung des Gewebes, einer Abklärung der Durchblutungssituation im Verlauf und einer Optimierung der Stoffwechselsituation. Über ein adaptiertes Wundmanagement ist die Weichteilsituation in ihrer Heilung zu unterstützen und ein ausreichendes Exsudatmanagement sicherzustellen.
In dieser Initialphase gewinnt der Behandelnde Zeit, um wichtige Dinge hinsichtlich der Ursachenabklärung vornehmen zu können (MR-Angiographie, CT/MRT des Knochens, Mikrobiologie, u. a.).
Während dieser Akutphase müssen unbedingt chirurgische Fehler vermieden werden. Dazu zählen insbesondere radikale Weichteilmanöver, operative Verletzungen der Fußsohle oder Einbrüche in benachbarte Zehen- oder Mittelfußgelenke. Der exakten Bestimmung des Operationszeitpunktes kommt eine große Bedeutung zu.
Ist die Akutsituation behoben und der Fuß hinsichtlich seiner Weichteile stabil, können geplante operative Maßnahmen zur Perfusionsverbesserung gemäß den individuellen Erfordernissen vorgenommen werden. Beim therapieresistenten Ulcus in Folge der Neuropathie bzw. Fußfehlstellung sind unter speziellen Gesichtspunkten zur Minimierung der Druckverhältnisse Korrekturoperationen am Vor-/Mittelfuß vorzunehmen.
Wichtig für die Prognose des Fußes ist es, dass dieser zur Vermeidung weiterer Läsionen mit speziellem Schuhwerk und mit speziellen fußpflegerischen Behandlungen kontinuierlich versorgt wird.
Sonderfall Charcotfuß
Der Charcotfuß stellt vorrangig eine komplexe, multifaktoriell bedingte Schädigung des Fußes dar. Die Ursache für die typische Knochendestruktion, die zu einem Knochenkollaps mit völliger Zerstörung der Fußstatik führt, ist vorrangig die Neuropathie. Der Charcotfuß weist eine hohe Inzidenz der Nichterkennung auf. Der Erstbeschreiber war der französische Neurologe Jean Martin Charcot (1825–1893), der diesen Fuß erstmalig 1883 bei Syphiliserkrankten beobachtete.
Die Diagnostik des Charcotfußes wird erschwert durch unspezifische Symptome mit schmerzfreier Schwellung, Rötung sowie Hyperthermie und erfolgt vorrangig durch das konventionelle Röntgen. Hier lassen sich anhand des Röntgenbefundes im Anfangsstadium Knochenauflösungen im Basisbereich des 1. und 2. Strahls nachweisen, die eine typische Deviation (Auseinanderweichung) zueinander zur Folge haben (Abb. 6).
Aber auch im Mittelfuß/Fußwurzelbereich sind Osteonekrosen darstellbar. Auch typische Spontanfrakturen im Mittelfußbereich sowie Luxationen im Lisfranc- und Chopartbereich treten auf.
Eine weitere Möglichkeit zur Diagnostik ist das MRT, welches ein unspezifisches Knochenödem zeigt. Ein Abgleich mit der Klinik ist zwingend erforderlich, um Fehlinterpretationen von Traumafolgen oder der hämatogenen Osteomyelitis vermeiden zu können.
Die Stadieneinteilung erfolgt nach den beiden Amerikanern Levin und Sanders. Stadium 1 ist das akute Stadium. Der Fuß ist hochrot geschwollen und überwärmt. Der Röntgenbefund kann unter Umständen normal sein. Der Patient verspürt keine Schmerzen, es besteht möglicherweise eine Unförmigkeit des Fußes. Im Zusammenhang mit einem bestehenden Diabetes oder Langzeitalkoholkonsum ist an ein Erststadium des Charcotfußes unbedingt zu denken. Knochen- und Gelenkveränderungen, aber auch Frakturen durch Minimaltraumata, sind im Stadium 2 nachweisbar. Stadium 3 ist gekennzeichnet durch Fußdeformitäten mit Gelenkkollaps in Form von Plattfuß und Stempelfuß mit Gelenkzerstörung und Degeneration. Im Stadium 4 sind zusätzliche plantare Fußläsionen durch Knochendurchbruch mit gestörten lokalen Druckpunktverteilungsverhältnissen der Fußsohle dominierend (Abb. 7).
Eine weitere Einteilung des Charcotfußes kann nach Sanders erfolgen. Hier wird die Lokalisation der Knochen- und Gelenkzerstörung zugeordnet. Sanders 1 befindet sich im Bereich der Zehen- und Mittelfußknochen, Sanders 2 im Lisfranc-Bereich, Sanders 3 im Chopartgelenk und Sanders 4 im oberen und unteren Sprunggelenk. Beschrieben sind auch Veränderungen im Bereich des Fersenbeines und des Kniegelenkes (Sanders 5).
Die erste Maßnahme bei diagnostischer Sicherung eines Charcotfußes im Akutstadium ist die sofortige Druckentlastung entweder in Form eines Air- bzw. eines Diabetikwalkers oder einer 2‑Schalen-Orthese. Diese dienen dazu, die Knochenerweichung in der akuten Phase solange zu stützen und zu schützen, bis eine sich festigende Remineralisation des Knochens einsetzt.
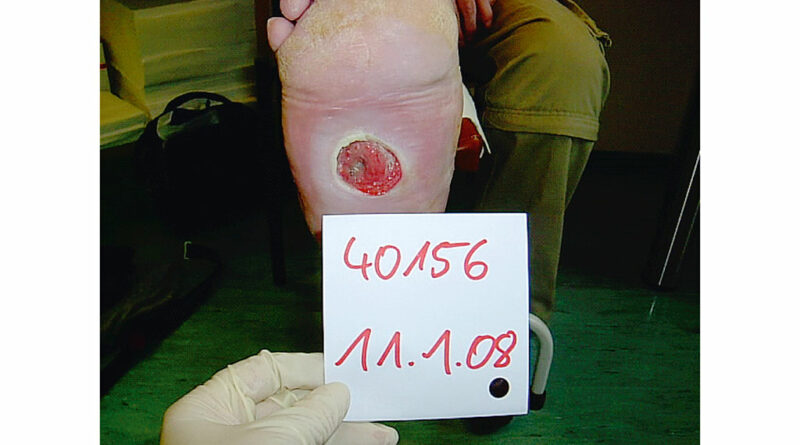
Bei Existenz eines Fußsohlenulcus ist die Indikation zur Operation immer gegeben, falls durch einen TCC oder orthopädieschuhtechnische Maßnahmen das Ulcus nicht innerhalb von 6 bis 8 Wochen zur Abheilung gebracht werden kann. Die Gefahr des Druckulcus besteht immer aufgrund der punktuellen Belastung. Diese wird nicht durch das Körpergewicht allein verursacht, sondern durch den inneren Knochendruck („Intrinsic-Druck“).
Dadurch ist neben der Druckbelastung der Weichteile auch immer eine hohe Infektionsgefahr bei Knochenbeteiligung – gleichzeitig verbunden mit einer hohen Amputationsgefahr – gegeben (Abb. 7).
Die Zielstellung der operativen Maßnahmen beim Charcotfuß muss immer darin bestehen, eine korrigierende Versteifung zur Minimierung bzw. kompletten Entlastung des Intrinsicdruckes im Bereich der einzelnen Knochenverformungen zu erreichen.
Dazu sind Versteifungsoperationen im Großzehengrundgelenk, im Lisfrancbereich und im Chopartgelenk mit Aufrichtung des Längs- und Quergewölbes absolut indiziert. Mit der Existenz eines Ulcus sind innere Osteosynthesematerialien kontraindiziert. Die Aufrichtung erfolgt stets über einen äußeren Knochenhalter (Fixateur externe). Mit der Aufrichtung der Knochenstruktur zur Sicherung des Langzeitergebnisses ist in jedem Fall auch eine Korrektur der verkürzten Sehnen (Achillessehne, Tibialis-anterior-Sehne) vorzunehmen.
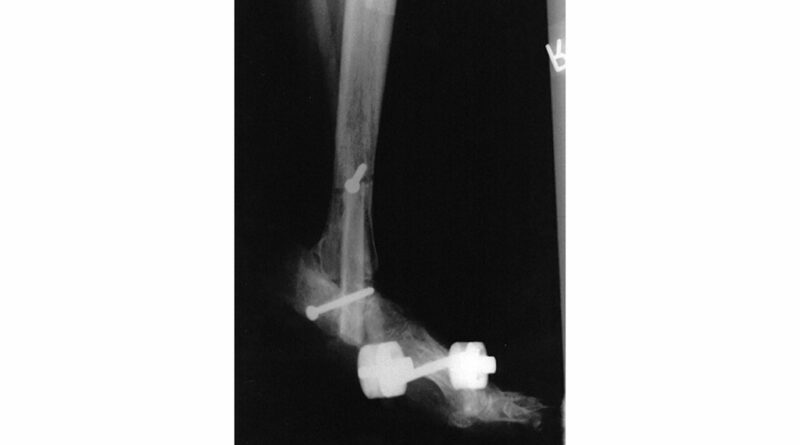
Bei drohenden Ulzerationen durch Knick‑, Klump- oder Sichelfuß sind auch innere Osteosynthesen durch Markraumnagel oder AO-Schrauben geeignet. Bei wiederholten Infekten nach Osteosynthesen infolge von Instabilität bzw. Infekten des Osteosynthesematerials ist alternativ auch eine biologische Arthrodese mittels autologem Fibulaspan möglich (Abb. 8).
Eigene Ergebnisse
In den Jahren 2004 – 2012 wurden vom Autor 174 Charcotfüße im Stadium Levin 4 operiert. Ziel der Operationen war es, die entsprechend verkürzten Sehnen zu verlängern, eine komplexe Rekonstruktion im Chopart- und Lisfrancgelenk zur Herstellung des Längsgewölbes zu erreichen, eine sparsame Retention über K‑Drähte vorzunehmen sowie bei Wunden immer einen äußeren Fixateur einzusetzen, um dann in 8 bis 12 Wochen über einen Knochenspann den entsprechenden Knochendefekt auszugleichen.
Im Ergebnis ist es immer zu einer kompletten Wundabheilung gekommen. Der Stempelfuß wurde zu einem Platt- oder leicht aufgerichteten Hohlfuß korrigiert, damit er dauerhaft belastungsstabil und wundfrei blieb. Nach insgesamt ca. 20 Wochen mit zwischenzeitlichem Belastungsschutz über einen Walker wurde dann der Arthrodesestiefel bei mindestens 25 cm Schaftlänge eingesetzt. In 6 Fällen war die Amputation wegen einer nicht beherrschbaren Osteomyelitis notwendig.
Zusammenfassend muss festgestellt werden, dass die Amputation beim Diabetischen Fußsyndrom nur bei Totalverlust des Gewebes (Gangrän), beim therapieresistenten Schmerz oder bei einer nicht beherrschbaren Knocheninfektion zwingend erforderlich ist.
Dem Extremitätenerhalt, insbesondere im Zehen- und Mittelfußbereich, sollte unbedingt durch geeignete chirurgische Maßnahmen der Vorrang eingeräumt werden, da vor allem bei Teilverlusten von Zehen und Fußanteilen die bedeutsame und wichtige Statik und Balancefunktion des Fußes eingeschränkt wird und weitere Amputationsschritte die Folge sind.
Nur durch ein individuelles und interdisziplinäres Zusammenwirken von fachspezifischen Ärzten, Podologen und Orthopädie(schuh)-Technikern ist dieses Ziel zu erreichen.
Ziel der Behandlung muss es sein, die Lebensqualität des Patienten mit einem Diabetischen Fußsyndrom langfristig zu erhalten und seine gesellschaftliche Integration zu sichern.
Der Autor:
Dr. Hartmut Pralow
Gemeinschaftspraxis für Chirurgie/
Unfallchirurgie
Breiter Weg 252
39104 Magdeburg
chirurgie-pralow@t‑online.de
Literatur beim Verfasser.
Begutachteter Beitrag/Reviewed paper
Pralow H. Chirurgie des Diabetischen Fußsyndroms – Möglichkeiten und Grenzen. Orthopdädie Technik, 2013; 64 (7): 12–17
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Ein engagierter Leistungssportler mit Hemiparese und der Einsatz sensomotorischer Fußorthesen (SMFO) — 12. Februar 2026