Einige Fakten zu Schlaganfällen
Die zerebrovaskuläre Störung (ZVS) durch Schlaganfall, Hirntrauma oder Gehirnlähmung gehört weltweit zu den häufigsten Ursachen für langfristige Behinderungen in der Bewegungsfähigkeit. In mehr als 85 % der Fälle tritt ein funktionales Defizit in der Bewegungskontrolle auf 1. Physiotherapie ist die Standardmethode zur Rehabilitation von Schlaganfallpatienten. Die Wirksamkeit aktueller Rehabilitationsverfahren ist jedoch begrenzt, und die Langzeiteffekte sind umstritten 2. Für Patienten mit starker Beeinträchtigung des Bewegungsapparats stehen nur äußerst begrenzte Therapiemöglichkeiten zur Verfügung; diese Patienten bleiben oftmals lebenslang behindert 3.
Es gibt also einen offensichtlichen Bedarf an einer größeren Anzahl besserer randomisierter klinischer Studien zur motorischen Rehabilitation, bei denen die Intervention frühzeitig nach dem Schlaganfall ansetzt, um die neuroplastischen Mechanismen auszunutzen, die in den ersten Wochen nach dem Vorfall aktiv sind 4. Gleichwohl werden in der wissenschaftlichen Literatur auch neue Therapiekonzepte vorgeschlagen, in denen die funktionalen Plastizitätsmechanismen im Gehirn reaktiviert werden, um die neuronale Wiederherstellung und die Regeneration in den beschädigten neuronalen Netzwerken zu fördern. Diese neuen Methoden können in zelluläre Therapien 5 und neurotechnologische Ansätze 6 unterteilt werden. Letztere sind Gegenstand dieses Artikels.
Schlaganfallrehabilitation
In Bezug auf die Reorganisation im Gehirn nach einem Schlaganfall geht man heute davon aus, dass die übermäßige Nutzung der kontraläsionalen und die Nichtnutzung der ipsiläsionalen Gehirnhälfte zu einer Erhöhung des inhibitorischen Einflusses der kontraläsionalen auf die ipsiläsionale Gehirnhälfte führt. Die Erhöhung der inhibitorischen Aktivität blockiert die exzitatorische Reorganisation der verbleibenden intakten Areale rund um die Schädigung und hemmt so die Heilung des betroffenen Bewegungssystems. Diese Annahme erklärt den Erfolg der Constraint-Induced Movement Therapy (CIMT), die von Edward Taub (1999) für die Anwendung bei chronischer Lähmung nach Schlaganfall mit vorhandener Restbewegungsfähigkeit entwickelt wurde 7. Durch die Einschränkung der Bewegungsfreiheit der gesunden Gliedmaße über längere Zeiträume wird der Patient dazu gezwungen, den gelähmten Arm und die gelähmte Hand zu benutzen und die exzitatorische neuronale Aktivität in der betroffenen Gehirnhälfte zu verstärken.
Die heute üblichen Rehabilitationsstrategien implementieren sogenannte Bottom-up-Ansätze. Derartige Methoden versuchen, motorische Regeneration durch Manipulation auf distaler Ebene zu erzeugen, um hierdurch Veränderungen in den neuronalen Netzwerken hervorzurufen. Beispiele hierfür sind das bilaterale Armtraining und Constraint-Induced-Therapien. Für einen Vergleich der Methoden sei auf Lin et al. 2009 verwiesen 8. Patienten ohne Restbewegungsfähigkeit zeigten ein Jahr nach dem Schlaganfall jedoch keine Verbesserungen durch CIMT 9. Für diese Patienten sind die verfügbaren Behandlungen und Rehabilitationsstrategien ineffizient. Infolgedessen konzentrieren sich modernere Ansätze für die Schlaganfallrehabilitation zunehmend auf Top-down-Ansätze. Diese Therapiekonzepte versuchen die verbleibenden intakten neuronalen Netzwerke bei der Reorganisation zu unterstützen, um so zur Genesung der motorischen Funktion beizutragen 10.
Eine Reihe von Studien hat bereits die Vorteile der roboterbasierten Therapie bei chronischer Lähmung nach Schlaganfall im direkten Vergleich mit konventionellen Therapien dargestellt 11. In diesen Studien wurden jedoch nur passive Bewegungen der Roboter benutzt, wodurch die Kontingenz zwischen Absicht und Aktion verlorengeht. Dies führt zu einer starken Reduzierung des Potenzials der Intervention, neuroplastische Veränderungen hervorzurufen 12. Obwohl Schlaganfallpatienten auf unterschiedliche Rehabilitationsstrategien verschiedenartige Reaktionen zeigen, kann bei der Behandlung von Patienten mit schwerer Hemiparese mit konventionellen Ansätzen im Allgemeinen nur begrenzte bis gar keine Genesung erzielt werden 13. Jüngste Entwicklungen auf dem Gebiet der modernen Rehabilitationsmethoden, insbesondere der sogenannten Brain-MachineInterfaces (BMI), speziell in Kombination mit robotischen Aktoren, könnten jedoch eine alternative Strategie für die Behandlung schwerbehinderter Patienten darstellen 14.
Funktionsweise von Brain-Machine-Interfaces (BMI)
BMI-Systeme zeichnen messbare neurophysiologische Signale auf, entschlüsseln deren Informationsgehalt und verwenden diese Informationen zur Steuerung von Effektoren und Verhalten. BMI-Systeme, die restaurativ agieren oder über das Prinzip des Biofeedbacks wirken, versuchen ausgewählte neurophysiologische Aktivität zu normalisieren, indem sie als Trainingsgerät fungieren und nutzungsabhängige Gehirnplastizität aktivieren 15.
In den letzten 15 Jahren wurde eine stetig steigende Zahl von BMI-Systemen entwickelt. All diese Systeme zeichnen messbare neurophysiologische Signale auf, entschlüsseln deren Informationsgehalt und verwenden sie zur Steuerung von Effektoren und Verhalten. Mit Hilfe implantierbarer BMI-Systeme, die invasive Mikroelektroden zur Aufzeichnung von Spike-Aktivität und lokalen Feldpotenzialen verwenden, konnten menschliche Probanden bereits Roboterarme 16 und funktionale elektrische Stimulatoren 17 steuern. Mit Hilfe ebenfalls invasiver subduraler Arrays konnten Elektrokortikogramme abgeleitet werden, sogar beim chronischen Schlaganfallpatienten 18. In nichtinvasiven Ansätzen wurden Elektroenzephalografie (EEG), Magnetoenzephalografie (MEG), blutoxigenierungsabhängige, funktionelle Magnetresonanztomografie (fMRT) und funktionelle Nahinfrarotspektroskopie (fNIRS) verwendet 19.
Das übliche Verfahren bei der Vermessung der Spontanaktivität des Gehirns ist jedoch die Positionierung mehrerer Elektroden auf der Kopfhaut für einen begrenzten Zeitraum, üblicherweise 30 bis 60 Minuten, bekannt als Elektroenzephalogramm (EEG). Die entsprechenden Aufzeichnungsgeräte finden flächendeckende Verwendung in der Neurologie. Als passives Aufnahmeverfahren ist EEG sicher für den Patienten und erfordert von diesem lediglich das Aufsetzen einer EEG-Kappe, unter Umständen täglich. Daher scheint EEG nach wie vor die beste Messtechnologie für die Entwicklung nichtinvasiver BMI-Systeme zu sein.
Das Erlernen der Steuerung nichtinvasiver künstlicher neuronaler Verbindungen wie Brain-Machine-Interfaces kann verschiedene Veränderungen nach sich ziehen, z. B. die Verstärkung langsamer Hirnpotenziale, die verstärkte Ausprägung des sensorischmotorischen Rhythmus und der BOLD-Topologien (BOLD = „blood oxygenation level dependent“, betrifft den Sauerstoffverbrauch im Gehirn) 20; sie können funktionale Verbindungen verändern und sogar strukturelle Veränderungen im Gehirn hervorrufen 21. Obwohl wir also wissen, dass wir die neuronalen Netzwerke, die an der motorischen Genesung beteiligt sind, beeinflussen könnten, bedarf es weiterer experimenteller Arbeiten, um die neurophysiologischen Veränderungen mit der motorischen Genesung auf der Verhaltensebene zu verbinden.
Beim Erlernen der Steuerung über eine Neuroprothese verändert das Gehirn die Verbindungen zu den am BMI beteiligten Neuronen (diejenigen, die kausal mit der Bewegungsausführung verbunden sind) und versucht, den Fehler in der motorischen Leistung durch die Plastizität im Cortex zu minimieren. Das Schlüsselelement bei der Aktivierung des motorischen Gedächtnisses ist die Stabilität des BMI-Kreislaufs, d. h., sowohl die afferenten Verbindungen (das neurale Eingangs signal des Decoders) als auch die Übertragungsfunktionen sollten sich nicht ändern. Diese Hypothese wurde in einer vorherigen Arbeit getestet 22, in der gezeigt wurde, dass das Primatengehirn in der Lage ist, die Steuerung eines BMI über einen Computercursor stabil zu erlernen, und zwar auf eine Art und Weise, die dem natürlichen motorischen Lernen sehr ähnlich ist.
BMIs als Auslöser von Neuroplastizität nach Schlaganfall
Neuroplastizität wird als die Fähigkeit eines Nervensystems definiert, auf ex trinsische und intrinsische Veränderungen zu reagieren und sich daran anzupassen 23. Im Erwachsenenalter bezeichnet Neuroplastizität eine Vielzahl verschiedener Reorganisationsprozesse, die auf verschiedenen zeitlichen und räumlichen Ebenen stattfinden. Sie dienen zur Erhöhung der Wirksamkeit des Informationsaustauschs innerhalb des Nervensystems, zur Steigerung von Steuerungseffizienz und ‑genauigkeit oder zur Bewältigung von Verletzungen. Dabei kommen Veränderungen synaptischer Verbindungsstärken, die Bildung neuer synaptischer Verbindungen und selbst die Bildung neuer Neuronen vor 24. Trotz der verschiedenen molekularen, zellulären und physiologischen Veränderungen, die während des Genesungsprozesses beobachtet wurden 25, ist deren Beitrag zu den funktionalen neuroplastischen Mechanismen noch unklar.
Der Schlüsselmechanismus, durch den neuronale Aktivität zu Plastizität führt, wird Donald Hebb (1945) zugeschrieben, der davon ausging, dass „ein Wachstumsprozess oder eine metabolische Veränderung“ die physische Verbindung zwischen zwei Neuronen genau dann stärkt, wenn deren Aktivitäten eine dauerhafte kausale Verbindung aufweisen („cells that fire together wire together“) 26. Dieser Prozess beinhaltet sowohl synaptische Potenzierung als auch strukturelle Veränderungen wie z. B. axonale Verästelung und die Bildung und Stabilisierung dendritischer Dornfortsätze.
Im Zentrum des BMI-Paradigmas steht die willentliche Steuerung der neuronalen Aktivität. Fetz und Mitarbeiter 27 wiesen in vivo kortikospinale, synaptische Plastizität auf der Ebene einzelner Neurone nach, die bei freiem Verhalten durch normale Aktivitätsmuster ausgelöst wurden. Dieses Ergebnis wurde mit Hilfe eines autonomen, rückläufigen neuronalen Interface erzielt, das eine elektrische Stimulation des Rückenmarks von nichtmenschlichen Primaten in Abhängigkeit von der Aktivität kortikospinaler Zellen durchführt, während sich diese frei bewegen. Darüber hinaus konnten Lucas und Fetz (2013) zeigen 28, dass eine künstliche afferente Rückkopplung zu einer Reorganisation der Ausgabe des motorischen Cortex führen kann, und deuteten an, dass die kortikospinalen Zusammenhänge unter normalen Bedingungen von ebensolchen physiologischen Rückkopplungskreisläufen aufrechterhalten werden. Diese Ergebnisse legen nahe, dass neuroplastische Effekte durch künstliche neuronale Verbindungen sowohl mit afferenter als auch mit efferenter Kontingenz (bilaterale Konsistenz) ausgelöst werden. Unter der Annahme, dass zumindest einige neuronale Netzwerke und Nervenbahnen nach dem Schlaganfall weiterhin bestehen und noch in der Lage sind, sensorische Signale ins Gehirn hinein- und motorische Signale aus diesem herauszuleiten, könnten Lernregeln, die auf Synapsen basieren, helfen, nach dem Schlaganfall kompensatorische Verschaltungen zu erzeugen. Diese Lernregeln lassen sich in zwei Kategorien aufteilen: Homöostatische Plastizitätsmechanismen balancieren den synaptischen Eingang der Neurone aus, während Hebb’sche Plastizitätsmechanismen synaptische Verbindungsstärken zugunsten der gleichzeitig aktiven Verbindungen neu verteilen. Sobald die homöostatischen Mechanismen greifen, um sowohl die synaptische Struktur als auch deren Funktion auf das angestrebte Niveau zu bringen, können Hebb’sche bzw. korrelative Mechanismen die richtigen präsynaptischen und postsynaptischen Elemente verstärken. Hebb’sche Mechanismen werden aktiviert, wenn präsynaptische und postsynaptische Neurone zeitlich koordiniert aktiv sind und wenn die Freisetzung von Neurotransmittern innerhalb eines Zeitfensters von wenigen Millisekunden nach einem postsynaptischen Aktionspotenzial stattfindet, das über Stimulation durch mehrere Eingangssignale stimuliert wurde. Eine länger anhaltende sensorisch induzierte Depolarisierung in der Periinfarktregion könnte beteiligte Neurone nah an ihrem jeweiligen Schwellwert halten und so die Aktivität, die vom Aktionspotenzial abhängig ist, und andere funktional verwandte Eingangssignale unterstützen, was letztlich einer kontingenten Aktivierung gleichkommt. Diese gleichzeitig aktiven Verbindungen bilden zusammen eine verhaltensrelevante Verschaltung und werden zur Speicherung und Verstärkung ausgewählt. Auf der anderen Seite sind synaptische Verbindungen, die außerhalb der Phase aktiv sind, wahrscheinlich falsch verschaltet und werden abgeschwächt. Langsamere, konstant aktive Schaltkreise, die bei genesenden Tieren gefunden wurden, könnten die Wahrscheinlichkeit steigern, dass Periinfarktverbindungen durch gleichzeitige Aktivität verstärkt werden 29. Die regelmäßige Anwendung BMSCI-basierter Neuroprothesen (BMSCI = Brain-Machine-Spinal-Cord-Interface) könnte die synaptische Stärke der verbleibenden neuronalen Verbindungen im Rückenmark über die Verletzung hinaus verstärken 30. Die Verstärkung der Synapsen funktioniert nach einem Konzept, das als „spike-time-dependent plasticity“ (STDP) bekannt ist. Sofern eine Rückenmarkstimulation innerhalb eines engen Zeitfensters nach der Erkennung der kortikalen Bewegungsabsicht durchgeführt wird, kann bei nichtmenschlichen Primaten 31 und Menschen 32 eine STDP ausgelöst werden. Auch konnte gezeigt werden, dass auf STDP basierende Rehabilitationsstrategien die langzeitige funktionale Genesung verbessern können 33.
Einschränkungen und zukünftige Arbeiten
Neuere Daten chronischer Schlaganfallpatienten mit Schwerbehinderung deuten darauf hin, dass eine kontingente neuronale Verbindung zwischen Gehirnaktivität und Bewegung der gelähmten Extremität durch eine robotische Orthese eine signifikante, aber begrenzte funktionale motorische Wiederherstellung hervorrufen kann 34. Jüngste Studien konnten diese Ergebnisse bestätigen 3536. Dennoch lassen Probleme der nichtinvasiven Technik (siehe unten) die invasiven Alternativen Elektrokortikografie (EcoG) und kortikale Mikroelektrodenarrays als die besseren Kandidaten erscheinen, um neue neuronale Verbindungen aufzubauen und mittels des Paradigmas des instrumentalen Lernens und der Spike-Time-Plastizität (STDP) durch kontingente Verbindung kortikaler und peripherer Elemente des ZNS zur funktionalen motorischen Rehabilitation beizutragen. Zu den Problemen der nichtinvasiven Technik zählen:
1. das Anbringen des EEGs,
2. der Rauschabstand im EEG-Signal,
3. die deutlich geringere Rekonstruierbarkeit der beabsichtigten Bewegung im Vergleich zu invasiven Techniken (dort sogar Decodierung dreidimensionaler Bewegungen möglich),
4. das Problem des Transfers zwischen Sitzungen (nichtstationäre, veränderliche Signaleigenschaften),
5. die größere Feedbackverzögerung,
6. die begrenzte Trainingsintensität (Trainingsdauer), bedingt durch den ermüdenden Aufbauprozess,
7. die verminderte Signalqualität mobiler Lösungen und 8. der fehlende Zugriff auf Informationen über einzelne Zellen.
Verbesserung der Decodierung von Bewegungsabsichten
Um einen Großteil der Beschränkungen der bereits klinisch getesteten nichtinvasiven Systeme aufzuheben, könnten intrakranielle Mikroelektroden zur Ableitung der Gehirnpotenziale eingesetzt werden. Solche Systeme wurden bereits erfolgreich zur Steuerung von Mobilitätshilfen bei gelähmten Patienten eingesetzt und verblieben dabei für mehr als fünf Jahre im Körper der Patienten. In einigen Fällen gelang eine kontinuierliche Decodierung von hochdimensionalen Greifbewegungen und die Steuerung von 25 Gelenken bei Hand- und Armbewegungen 37.
In letzter Zeit wurden auch ECoG-Aufzeichnungen für BMI-Experimente benutzt, basierend entweder auf subduralen oder auf epiduralen 38 Elektroden. Es liegen sogar Studien mit ECoG bei Schlaganfallpatienten vor 39. Die implantierten ECoG-Elektrodenmatrizen sind weniger empfindlich gegenüber Artefakten und weisen eine höhere Frequenz- und Raumauflösung als das EEG auf, sind zugleich aber weniger invasiv als implantierte Mikroelektrodenarrays. Nichtsdestotrotz sind sie zur Zeit nur für den übergangsweisen Einsatz beim Menschen freigegeben und erfordern eine große Öffnung in der Schädeldecke zur Implantierung. Vollständig implantierbare, kabellose Varianten werden zur Zeit entwickelt 40 oder warten auf Freigabe durch amerikanische oder europäische Zertifizierungsbehörden (CE/FDA) 4142.
Einzelzellableitungen wurden im Labor ebenfalls erfolgreich in BMI-Experimenten verwendet. Dabei konnten von den Patienten sowohl ein Computercursor als auch ein robotischer Arm im Closed-Loop-Paradigma bewegt werden 4344. Trotz der ermutigenden Erfolge in der klinischen Anwendung dieser Methode hat sie bislang nur begrenzten Erfolg außerhalb der Laborumgebung, hauptsächlich bedingt durch ungelöste Probleme mit der Stabilität der Signalaufzeichnung über lange Zeit und dem angestrebten Einsatz als assistive Technologie im Alltag, was eine permanente Implantierbarkeit und stabile Leistungsfähigkeit über Jahrzehnte voraussetzt.
Es ist wichtig, an dieser Stelle festzuhalten, dass die meisten Studien mit implantierten Geräten auf kurze Implantationszeiträume beschränkt waren und zumeist mit Patienten durchgeführt wurden, welche die Implantation im Rahmen der präoperativen Epilepsiediagostik erhalten hatten. Nur bei sehr wenigen Studien wurde eine Implantation speziell zum Zwecke einer BMI-Steuerung durchgeführt. Der Grund hierfür liegt sicherlich in den technischen Herausforderungen, die mit der Entwicklung und Erprobung von implantierbaren, aktiven Medizinprodukten einhergehen. In einer Umfrage zum Thema Brain-Machine-Interfaces gaben die Nutzer an, dass für sie die „Nichtinvasivität“ ein entscheidendes Designkriterium für BMIs sei. Mehr als die Hälfte der Befragten gab aber ebenfalls an, dass sie sich einer chirurgischen Prozedur unterziehen würden, um die BMI-Elektroden zu implantieren 45. Zusätzlich zur Nichtinvasivität wurden die Zeitdauer der täglichen Anbringung, die unabhängige Bedienbarkeit, die Kosten des Systems, das Funktionsspektrum und die Reaktionszeit als wichtigste Designkriterien für BMIs identifiziert. Als weniger wichtig wurde die initiale Trainingszeit eingeordnet; die Gesamtzeit für Interventionen und Trainings soll hingegen möglichst gering gehalten werden.
Die verhältnismäßig geringe Akzeptanz für implantierte, intrakranielle Arrays resultiert hauptsächlich aus den medizinischen Bedenken in Bezug auf den neurochirurgischen Eingriff und das Implantat selbst. Diese Risiken sind sicherlich nicht vernachlässigbar, werden im Allgemeinen aber überbewertet. Anhand der Erfahrungen bei der Validierung von DBS lässt sich zeigen, dass Komplikationen selten sind und dass sich mit den entsprechenden Prozeduren transiente Beeinträchtigungen auf 0,9 % reduzieren lassen, während permanente Beeinträchtigungen überhaupt nicht mehr auftreten 46. Selbst bei so invasiven Prozeduren wie der multiplen subpialen Transsektion, bei der eine Reihe von längeren Schnitten in die graue Substanz z. B. des Motorcortex durchgeführt wird, um Epilepsie zu behandeln, leiden die Patienten danach nicht unter motorischen Einschränkungen 47. Im Vergleich zu dieser Prozedur erscheint die Implantation von Elektrodenarrays für invasive motorische BMIs harmlos. Diese Systeme finden nun schon viele Jahre Anwendung in Labors weltweit, und die medizinischen Bedenken sollten sich mit besserer Kenntnis der Faktenlage reduzieren.
Auf der anderen Seite könnten auch nichtinvasive Systeme einige ihrer Nachteile überwinden, beispielweise durch den Einsatz kabelloser Übertragung und trockener Elektroden (ohne leitfähiges Gel) mit ausreichendem Rauschabstand. Des Weiteren könnte die Einbeziehung weiterer neurophysiologischer Signale, beispielsweise der Elektromyografie (EMG) von Muskelpotenzialen, die Decodierungsbandbreite nichtinvasiver BMIs verbessern.
Kortikomuskuläre BMIs
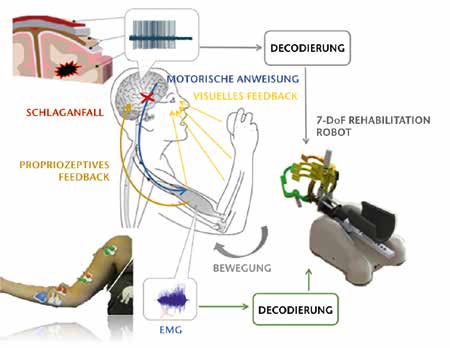
Die Mehrzahl der existierenden neuronalen Interfaces wird ausschließlich dazu verwendet, die Kinematik (Ort und Geschwindigkeit), nicht aber die Kinetik (Kraft und Beschleunigung) der beeinträchtigten Gliedmaße zu steuern. Durch eine kontingente Verknüpfung der ipsiläsionalen kortikalen Areale mit Bewegungen der gelähmten Hand nach dem Schlaganfall (rekurrentes, afferentes Feedback) kann eine funktionale Reorganisation ausgelöst werden. Wird in diesem Kreislauf aber ausschließlich die Hirnaktivität verwendet, gibt es keinerlei Einbeziehung der Muskeln. Dieser Umstand kann potenziell die funktionale Reorganisation des an den visuell-motorischen Aufgaben beteiligten neuronalen Netzwerks beeinträchtigen und so die BMI-Steuerung zur einfachen Unterstützungstechnologie degradieren, die den Patienten auf seinen vorherigen Behinderungsgrad zurückfallen lässt, sobald sie abgeschaltet oder entfernt wird.
Darüber hinaus sind aktuelle nichtinvasive BMI-Systeme auf die Steuerung zweidimensionaler Bewegungen beschränkt 48. Des Weiteren lässt sich auch die verbleibende EMG-Aktivität, die sich bei etwa 45 % der schwerbehinderten, chronischen Schlaganfallpatienten nachweisen lässt, zur Decodierung der Bewegungsabsicht verwenden. Diese Aktivität könnte so zur Verbesserung der Steuerung der Rehabilitationsroboter eingesetzt werden 49. Der Einsatz hochauflösender EMG-Arrays am Unterarm ermöglicht dabei die Decodierung einzelner Fingerbewegungen 50. Ein kortikomuskuläres BMI wird auf diesen Ergebnissen aufbauend entwickelt (Abb. 1). Die verbleibende Muskelaktivität wurde bereits in die kontingente Verbindung zwischen periläsionalen kortikalen Arealen und dem bewegungsabhängigen, afferenten Feedback integriert 51.
Fazit
Die Wirksamkeit von Brain-Machine-Interfaces in der Schlaganfallrehabilitation von Patienten mit chronischer Schwerbehinderung wurde experimentell nachgewiesen, und die Ergebnisse konnten verlässlich reproduziert werden. Die existierenden Systeme sind jedoch nur wissenschaftliche Werkzeuge, und es mangelt ihnen hauptsächlich an Robustheit, einfacher Anwendbarkeit und Signalstabilität. Es ist kein Geheimnis, dass viele kleine, mittlere und große Unternehmen sowie diverse Start-ups im Gesundheitssektor in neuronale Interfaces und deren Innovationspotenzial auf dem florierenden Markt der Neurotechnologien investieren. Bald schon werden BMIs so günstig und einfach zu bedienen sein, dass sie einen festen Platz im klinischen Umfeld einnehmen. Sie werden ein essenzielles Werkzeug für Neurologen, Psychiater, Neurochirurgen und Physiotherapeuten bilden. Das neuronale Interfacing erlaubt es, Experimente voranzutreiben und jenseits etablierter Dogmen der Wissenschaft zu erforschen, wie das Gehirn Verhalten erzeugt. Es sollte dabei als Werkzeug sowohl für die klinische als auch für die wissenschaftliche Praxis verstanden werden, insbesondere zur Anwendung bei Patienten mit Lähmungen nach einem Schlaganfall.
Danksagung
Der Autor bedankt sich bei Michaela Walcker, Florian Helmhold und Andreas Ray für die Hilfe bei der sprachlichen Ausarbeitung des Textes.
Der Autor:
Dr. Ander Ramos-Murguialday
Universitätsklinikum Tübingen
Institut für Medizinische Psychologie
und Verhaltensneurobiologie
Silcherstraße 5
72076 Tübingen
ander.ramos-murguialday@unituebingen.de
Begutachteter Beitrag/reviewed paper
Ramos-Murguialday A. Brain-Machine-Interfaces bei Patienten mit Lähmungen nach Schlaganfall. Orthopädie Technik, 2017; (68): 40–45
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Ein engagierter Leistungssportler mit Hemiparese und der Einsatz sensomotorischer Fußorthesen (SMFO) — 12. Februar 2026
- Langhorne P, Bernhardt J, Kwakkel G. Stroke rehabilitation. Lancet, 2011; 377 (9778): 1693–1702
- Bell JA, Wolke ML, Ortez RC, Jones TA, Kerr AL. Training Intensity Affects Motor Rehabilitation Efficacy Following Unilateral Ischemic Insult of the Sensorimotor Cortex in C57BL/6 Mice. Neurorehabil Neural Repair, 2015; 29 (6): 590–598
- Byblow WD, Stinear CM, Barber PA, Petoe MA, Ackerley SJ. Proportional recovery after stroke depends on corticomotor integrity. Ann Neurol, 2015; 78 (6): 848–859
- Stinear CM, Byblow WD. Predicting and accelerating motor recovery after stroke. Curr Opin Neurol, 2014; 27 (6): 1
- Krakauer JW, Carmichael ST, Corbett D, Wittenberg GF. Getting Neurorehabilitation Right. Neurorehabil Neural Repair, 2012; 26 (8): 923–931
- Ramos-Murguialday A, Broetz D, Rea M, Läer L, Yilmaz Ö, Brasil FL, Liberati G, Curado MR, Garcia-Cossio E, Vyziotis A, Cho W, Agostini M, Soares E, Soekadar S, Caria A, Cohen LG, Birbaumer N. Brain-machine interface in chronic stroke rehabilitation: A controlled study. Ann Neurol, 2013; 74 (1): 100–108
- Taub E. Foreword for neuroplasticity and neurorehabilitation. Front Hum Neurosci, 2014; 8: 544
- Lin KC, Chang YF, Wu CY, Chen YA. Effects of Constraint-Induced Therapy Versus Bilateral Arm Training on Motor Performance, Daily Functions, and Quality of Life in Stroke Survivors. Neurorehabil Neural Repair, 2009; 23 (5): 441–448
- Wolf SL, Winstein CJ, Miller JP, Taub E, Uswatte G, Morris D, Giuliani C, Light KE, Nichols-Larsen D; EXCITE Investigators. Effect of Constraint-Induced Movement Therapy on Upper Extremity Function 3 to 9 Months After Stroke. JAMA, 2006; 296 (17): 2095
- Belda-Lois J‑M, Mena-del Horno S, Bermejo-Bosch I, Moreno JC, Pons JL, Farina D, Iosa M, Molinari M, Tamburella F, Ramos A, Caria A, Solis-Escalante T, Brunner C, Rea M. Rehabilitation of gait after stroke: a review towards a top-down approach. J Neuroeng Rehabil, 2011; 8 (1): 66
- Klamroth-Marganska V, Blanco J, Campen K, Curt A, Dietz V, Ettlin T, Felder M, Fellinghauer B, Guidali M, Kollmar A, Luft A, Nef T, Schuster-Amft C, Stahel W, Riener R. Three-dimensional, taskspecific robot therapy of the arm after stroke: a multicentre, parallelgroup randomised trial. Lancet Neurol, 2014; 13 (2): 159–166
- Turner DL, Ramos-Murguialday A, Birbaumer N, Hoffmann U, Luft A. Neurophysiology of robot-mediated training and therapy: A perspective for future use in clinical populations. Front Neurol, 2013; 4 : 1–11
- Caria A, Weber C, Brötz D, Ramos A, Ticini LF, Gharabaghi A, Braun C, Birbaumer N. Chronic stroke recovery after combined BCI training and physiotherapy: a case report. Psychophysiology, 2011; 48 (4): 578–582
- Chaudhary U, Birbaumer N, Ramos-Murguialday A. Brain-computer interfaces for communication and rehabilitation. Nat Rev Neurol, 2016; 12 (9): 513–525
- Chaudhary U, Birbaumer N, Ramos-Murguialday A. Brain-computer interfaces for communication and rehabilitation. Nat Rev Neurol, 2016; 12 (9): 513–525
- Collinger JL, Wodlinger B, Downey JE, Wang W, Tyler-Kabara EC, Weber DJ, McMorland AJ, Velliste M, Boninger ML, Schwartz AB. High-performance neuroprosthetic control by an individual with tetraplegia. Lancet, 2013; 381 (9866): 557–564
- Ajiboye AB, Willett FR, Young DR, Memberg WD, Murphy BA, Miller JP, Walter BL, Sweet JA, Hoyen HA, Keith MW, Peckham PH, Simeral JD, Donoghue JP, Hochberg LR, Kirsch RF. Restoration of reaching and grasping movements through brain-controlled muscle stimulation in a person with tetraplegia: a proof-of-concept demon stration. Lancet, 2017; 389 (10081): 1821–1830
- Spüler M, Walter A, Ramos Murguialday A, Naros G, Birbaumer N, Gharabaghi A, Rosenstiel W, Bogdan M. Decoding of motor intentions from epidural ECoG recordings in severely paralyzed chronic stroke patients. J Neural Eng, 2014; 11 (6): 66008
- Chaudhary U, Birbaumer N, Ramos-Murguialday A. Brain-computer interfaces for communication and rehabilitation. Nat Rev Neurol, 2016; 12 (9): 513–525
- Ramos-Murguialday A, Broetz D, Rea M, Läer L, Yilmaz Ö, Brasil FL, Liberati G, Curado MR, Garcia-Cossio E, Vyziotis A, Cho W, Agostini M, Soares E, Soekadar S, Caria A, Cohen LG, Birbaumer N. Brain-machine interface in chronic stroke rehabilitation: A controlled study. Ann Neurol, 2013; 74 (1): 100–108
- Song J, Young BM, Nigogosyan Z, Walton LM, Nair VA, Grogan SW, Tyler ME, Farrar-Edwards D, Caldera KE, Sattin JA, Williams JC, Prabhakaran V. Characterizing relationships of DTI, fMRI, and motor recovery in stroke rehabilitation utilizing brain-computer interface technology. Front Neuroeng, 2014; 7: 31
- Ganguly K, Carmena JM. Emergence of a stable cortical map for neuroprosthetic control. PLoS Biol, 2009; 7 (7): e1000153
- Ganguly K, Byl NN, Abrams GM. Neurorehabilitation: motor recovery after stroke as an example. Ann Neurol, 2013; 74 (3): 373–381
- Sampaio-Baptista C, Khrapitchev AA, Foxley S, Schlagheck T, Scholz J, Jbabdi S, DeLuca GC, Miller KL, Taylor A, Thomas N, Kleim J, Sibson NR, Bannerman D, Johansen-Berg H. Motor Skill Learning Induces Changes in White Matter Microstructure and Myelina tion. J Neurosci, 2013; 33 (50): 19499–19503
- Ganguly K, Byl NN, Abrams GM. Neurorehabilitation: motor recovery after stroke as an example. Ann Neurol, 2013; 74 (3): 373–381
- Hebb DO. The organization of behavior: a neuropsychological theory. New York: Psychology Press, 2005
- Nishimura Y, Perlmutter SI, Fetz EE. Restoration of upper limb movement via artificial corticospinal and musculospinal connections in a monkey with spinal cord injury. Front Neural Circuits, 2013; 7: 57
- Lucas TH, Fetz EE. Myo-cortical crossed feedback reorganizes primate motor cortex output. Ann Intern Med, 2013; 158 (6): 5261– 5274
- Murphy TH, Corbett D. Plasticity during stroke recovery: from synapse to behaviour. Nat Rev Neurosci, 2009; 10 (12): 861–872
- Nishimura Y, Perlmutter SI, Fetz EE. Restoration of upper limb movement via artificial corticospinal and musculospinal connections in a monkey with spinal cord injury. Front Neural Circuits, 2013; 7: 57
- Nishimura Y, Perlmutter SI, Fetz EE. Restoration of upper limb movement via artificial corticospinal and musculospinal connections in a monkey with spinal cord injury. Front Neural Circuits, 2013; 7: 57
- Edwardson MA, Avery DH, Fetz EE. Volitional muscle activity paired with transcranial magnetic stimulation increases corticospinal excitability. Front Neurosci, 2014; 8: 442
- McPherson JG, Miller RR, Perlmutter SI. Targeted, activitydependent spinal stimulation produces long-lasting motor recovery in chronic cervical spinal cord injury. Proc Natl Acad Sci, 2015; 112 (39): 12193–12198
- Ramos-Murguialday A, Broetz D, Rea M, Läer L, Yilmaz Ö, Brasil FL, Liberati G, Curado MR, Garcia-Cossio E, Vyziotis A, Cho W, Agostini M, Soares E, Soekadar S, Caria A, Cohen LG, Birbaumer N. Brain-machine interface in chronic stroke rehabilitation: A controlled study. Ann Neurol, 2013; 74 (1): 100–108
- Ang KK, Chua KS, Phua KS, Wang C, Chin ZY, Kuah CW, Low W, Guan C. A Randomized Controlled Trial of EEG-Based Motor Imagery Brain-Computer Interface Robotic Rehabilitation for Stroke. Clin EEG Neurosci, 2014; 46 (4): 310–320
- Ono T, Shindo K, Kawashima K, Ota N, Ito M, Ota T, Mukaino M, Fujiwara T, Kimura A, Liu M, Ushiba J. Brain-computer interface with somatosensory feedback improves functional recovery from severe hemiplegia due to chronic stroke. Front Neuroeng, 2014; 7: 19
- Vargas-Irwin CE, Shakhnarovich G, Yadollahpour P, Mislow JMK, Black MJ, Donoghue JP. Decoding complete reach and grasp actions from local primary motor cortex populations. J Neurosci, 2010; 30 (29): 9659–9669
- Ramos-Murguialday A, Hill J, Bensch M, Martens S, Halder S, Nij boer F, Schoelkopf B, Birbaumer N, Gharabaghi A. Transition from the locked in to the completely locked-in state: a physiological analysis. Clin Neurophysiol, 2011; 122 (5): 925–933
- Spüler M, Walter A, Ramos Murguialday A, Naros G, Birbaumer N, Gharabaghi A, Rosenstiel W, Bogdan M. Decoding of motor intentions from epidural ECoG recordings in severely paralyzed chronic stroke patients. J Neural Eng, 2014; 11 (6): 66008
- Schuettler M, Kohler F, Ordonez JS, Stieglitz T. Hermetic electronic packaging of an implantable brain-machine-interface with transcutaneous optical data communication. 2012 Annual International Conference of the IEEE Engineering in Medicine and Biology Society 2012, 2012: 3886–3889
- Charvet G, Sauter-Starace F, Foerster M, Ratel D, Chabrol C, Porcherot J, Robinet S, Reverdy J, D’Errico R, Mestais C, Benabid AL. WIMAGINE(©): 64-channel ECoG recording implant for human applications. 35th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC), 2013; 2013: 2756–2759
- Borton DA, Yin M, Aceros J, Nurmikko A. An implantable wire less neural interface for recording cortical circuit dynamics in moving primates. J Neural Eng, 2013; 10 (2): 26010
- Collinger JL, Wodlinger B, Downey JE, Wang W, Tyler-Kabara EC, Weber DJ, McMorland AJ, Velliste M, Boninger ML, Schwartz AB. High-performance neuroprosthetic control by an individual with tetraplegia. Lancet, 2013; 381 (9866): 557–564
- Ajiboye AB, Willett FR, Young DR, Memberg WD, Murphy BA, Miller JP, Walter BL, Sweet JA, Hoyen HA, Keith MW, Peckham PH, Simeral JD, Donoghue JP, Hochberg LR, Kirsch RF. Restoration of reaching and grasping movements through brain-controlled muscle stimulation in a person with tetraplegia: a proof-of-concept demon stration. Lancet, 2017; 389 (10081): 1821–1830
- Collinger JL, Boninger ML, Bruns TM, Curley K, Wang W, Weber DJ. Functional priorities, assistive technology, and brain-computer interfaces after spinal cord injury. J Rehabil Res Dev, 2013; 50 (2): 145–160
- Zrinzo L, Foltynie T, Limousin P, Hariz MI. Reducing hemorrhagic complications in functional neurosurgery: a large case series and systematic literature review. J Neurosurg, 2012; 116 (1): 84–94
- Blount JP, Langburt W, Otsubo H, Chitoku S, Ochi A, Weiss A, Snead OC, Rutka JT. Multiple subpial transections in the treatment of pediatric epilepsy. J Neurosurg Pediatr, 2004; 100 (2): 118–124
- Wolpaw JR. Brain-Computer Interface Research Comes of Age: Traditional Assumptions Meet Emerging Realities. J Mot Behav, 2010; 42(6): 351–353
- Ramos-Murguialday A, García-Cossio E, Walter A, Cho W, Broetz D, Bogdan M, Cohen LG, Birbaumer N. Decoding upper limb residual muscle activity in severe chronic stroke. Ann Clin Transl Neurol, 2015; 2 (1): 1–11
- Sarasola-Sanz A, Irastorza-Landa N, Shiman F, López-Larraz E, Spüler M, Birbaumer N, Ramos-Murguialday A. EMG-based multijoint kinematics decoding for robot-aided rehabilitation therapies. 14th International Conference on Rehabilitation Robotics, 2015
- Sarasola-Sanz A, Irastorza-Landa N, Shiman F, López-Larraz E, Spüler M, Birbaumer N, Ramos-Murguialday A. EMG-based multijoint kinematics decoding for robot-aided rehabilitation therapies. 14th International Conference on Rehabilitation Robotics, 2015