Einleitung
Ein Brain-Computer Interface (BCI) bietet Menschen wie Schlaganfallpatienten oder Hochquerschnittgelähmten Möglichkeiten, mit ihrer Umwelt trotz körperlicher Beeinträchtigung zu kommunizieren 1. Dies wird durch das Auslesen von Signalen direkt vom Gehirn und deren Umsetzung in Signale zur Steuerung von assistierenden Technologien ermöglicht. In dem Artikel von Kaiser et al. 2 wurden bereits einige wichtige Forschungsarbeiten zum Einsatz von BCIs und deren Verbesserung in der Anwendbarkeit demonstriert. Diese Forschungsarbeiten befassen sich hauptsächlich mit der Steuerung von Neuroprothesen auf der Basis der funktionellen Elektrostimulation (FES) bei querschnittgelähmten Anwendern durch auf BCIs aufbauende Benutzerschnittstellen (hybride BCIs 3 4 5). Ein besonders wichtiger Aspekt der Arbeit von Kaiser et al. 6 besteht im Aufzeigen von Möglichkeiten, wie BCIs in bestehende assistierende Systeme sinnvoll integriert werden können.
Dieser Artikel soll an die Übersicht von Kaiser et al. anknüpfen und aktuelle Weiterentwicklungen im Bereich Neuroprothesensteuerung und Schlaganfallrehabilitation dokumentieren und einen Blick in die zukünftigen Möglichkeiten von BCIs wagen.
Insbesondere im Bereich der Neuroprothesensteuerung wird während der Arbeit mit Anwendern schnell offensichtlich, wie groß der Bedarf für ein individualisiertes Hilfsmittel ist, welches speziell auf die Bedürfnisse und Möglichkeiten für den jeweiligen Benutzer zugeschnitten ist. Je nach Grad der Einschränkung eines Querschnittgelähmten ändern sich die Erwartungen an die assistiven Technologien. Verfügen die Anwender z. B. über keinerlei motorische Restfunktionen in der Hand, ist eine Wiedererlangung der Greiffunktion das wesentlichste Bedürfnis. Mit zunehmend rostralem neurologischen Level der Rückenmarksschädigung liegen auch Einschränkungen der Ellenbogen- und Schulterfunktion vor. Ohne eine ausreichende Schulter- und Ellenbogenkontrolle kann auch eine durch eine Neuroprothese vollständig wiederhergestellte Greiffunktion nicht sinnvoll eingesetzt werden.
Bei den Betroffenen sinkt gegenläufig zu der Zahl der wiederherzustellenden Funktionen die Anzahl der verbliebenen Steuermöglichkeiten. Eine gebräuchliche Möglichkeit zur analogen Kontrolle der Griffstärke der Hand ist die Verwendung eines Positionssensors auf der gegenüberliegenden Schulter. Dies ist natürlich nur für Anwender sinnvoll, die noch eine ausreichend stabile Schulterfunktion zur Verfügung haben. Bei stärkeren Beeinträchtigungen können Schulterbewegungen nicht mehr zur Steuerung herangezogen werden, sei es durch mangelnden Bewegungsumfang oder durch eine zu hohe Anstrengung während der Verwendung. In diesem Fall bietet sich das BCI als alternative oder unterstützende Technologie an 7 8. Hierbei kann das BCI als ausschließliche Steuerungsquelle verwendet werden, oder nur einen zusätzlichen Freiheitsgrad zur Steuerung zur Verfügung stellen, um muskuläre Ermüdung zu verlangsamen oder gar nicht erst entstehen zu lassen.
Anwendungsszenarien für BCI-kontrollierte Neuroprothesen
Im Folgenden sollen anhand verschiedener Einzelbeispiele die Möglichkeiten zur Integration eines BCIs in das Steuerungskonzept einer Neuroprothese bei Querschnittgelähmten mit unterschiedlich ausgeprägten Funktionseinschränkungen der oberen Extremität aufgezeigt werden.
Schulterbewegungsbasierte Neuroprothesensteuerung mit Griffumschaltung durch das BCI
Als erstes Beispiel wird die Umschaltung des Griffs einer Handneuroprothese erläutert. Das BCI wird in dieser Art der Steuerung als binärer „Brain-Switch“ eingesetzt und der Grad der Handöffnung/-schließung über einen Schulterpositionssensor vorgegeben. Die BCI-basierte Griffumschaltung wurde zusammen mit der Neuroprothese an zwei männlichen querschnittgelähmten Anwendern (ES und TS, 31 und 37 Jahre alt) getestet, beide mit einer kompletten Querschnittlähmung auf Höhe von C5 ohne Finger- und Handfunktion.
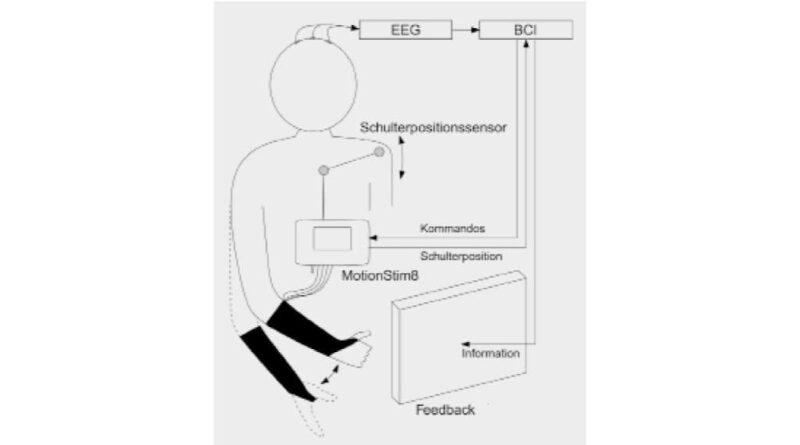
Durch Anbringen von vier Elektrodenpaaren am Unterarm der Anwender ist es möglich, zwei verschiedene Greifmuster mittels FES zu generieren: den Palmargriff (auch Zylindergriff) und den Lateralgriff (auch Schlüsselgriff) 9. Durch die Verwendung einer gemeinsamen Elektrode für zwei Elektrodenpaare konnte die Anzahl der platzierten FES-Elektroden reduziert werden, was aufgrund der limitierten Oberfläche am Unterarm notwendig wurde. Diese Anordnung wird in Abbildung 1 demonstriert.
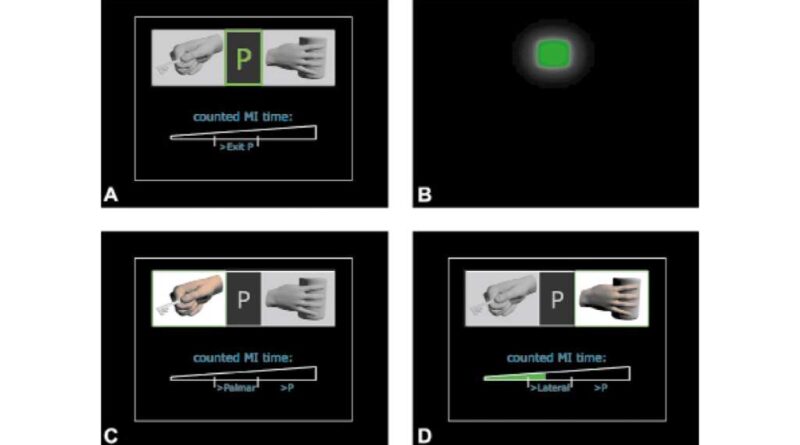
Im Stimulationsgerät (MotionStim, Medel, Hamburg) gespeicherte Stimulationsparameter sorgten dafür, dass ein analoger Wert den Öffnungsgrad der Hand steuerte. Diesen analogen Wert konnten die Anwender durch Heben und Senken der Schulter selbst beeinflussen. Die Möglichkeit zur Griffumschaltung wurde über ein asynchrones BCI umgesetzt. Hier konnten die Anwender entweder den Griffmodus wechseln oder in einen Pausemodus schalten. Die Anwender wurden durch ein diskretes (aktueller Modus) und kontinuierliches (aktuelle BCI-Aktivität) graphisches Feedback informiert. Als BCI-Kanal wurde ein zeitkodierendes BCI verwendet, das auf der Bewegungsvorstellung (motor imagery, MI) basiert 10 11. Mittels kurzer Bewegungsvorstellungen der Füße konnte zwischen Griffmustern hin- und hergeschaltet werden, mit Langen wurde der Pausemodus aktiviert. Um diese Vorstellungen mit ausreichender Genauigkeit detektieren zu können, wurde ein BCI-Training durchgeführt, um einerseits die Anwender mit der Bewegungsvorstellung vertraut zu machen und andererseits genug Daten für die Erstellung von Klassifikatoren zu sammeln. Das Schema der Applikation wird in Abbildung 2 dargestellt. Bilder, die die graphische Oberfläche zeigen und Fotos, die während der Ausführung gemacht wurden, werden in Abbildung 3 und 4 gezeigt.
Die Applikation wurde bei der Durchführung von zwei verschiedenen Aufgaben getestet. In Aufgabe A sollten die Probanden das System starten, indem sie die Pause mit einer Bewegungsvorstellung beendeten, um dann im ersten aktiven Griff Objekte zu bewegen. Nach drei Minuten wurden sie dazu aufgefordert, den Griff zu wechseln und Objekte, die für diesen Griff besser greifbar waren, zu bewegen. Nach drei Minuten sollte noch einmal der Griff gewechselt werden, um ein letztes Mal drei Minuten lang Objekte zu bewegen. Zuletzt sollten die Anwender in den Pausemodus zurückkehren. In Aufgabe B hatten die Probanden drei Minuten Zeit, alternierend den Griff zu wechseln und ein dazu passendes Objekt zu bewegen. Es wurden auch Prinzipien des hybriden BCIs verwendet, indem aktuelle Bewegungen des Schulterjoystick bei eventuellen BCI-Schaltvorgängen berücksichtigt wurden. Es kann z. B. davon ausgegangen werden, dass bei bewegter Schulter zum Öffnen und Schließen der Hand nicht auf einen anderen Griff umgeschaltet werden soll. Daher wurde eine Fehlererkennungsroutine in den Stimulator implementiert, die alle BCI-Schaltvorgänge während Schulterbewegungen verwarf. Mit dieser Maßnahme konnte die Zahl unbeabsichtiger Griffwechsel in erheblichem Maß reduziert werden. Beide Anwender führten den Versuch zum Nachweis der Wiederholbarkeit zweimal aus.
Anwender ES benötigte im Schnitt 16,9 ± 12,2 s, um zu einem Griff oder zwischen den Griffen hin- und herzuschalten, 51,3 ± 59,1 s, um in den Pausemodus zu schalten. Er schaffte es, 215 Objekte während der 24 Minuten in Aufgabe A zu bewegen und 31 Objekte während der 12 Minuten in Aufgabe B. Es wurden dank der Fehlererkennungsroutine 53 ungewollte Aktivierungen unterdrückt. Anwender TS benötigte 25,5 ± 27,9 s für Griffumschaltungen und 22,3 ± 15,6 s, um in die Pause zu wechseln. 253 Objekte wurden von ihm während Aufgabe A, 28 Objekte während Aufgabe B bewegt. 29 Schaltungen wurden verhindert. Beide Anwender hätten die Gegenstände ohne Neuroprothese nicht mit einer Hand zielgerichtet transferieren können.
BCI-Steuerung einer Hybrid-Neuroprothese für kontinuierliche und diskrete Ellenbogen-/Handbewegungen
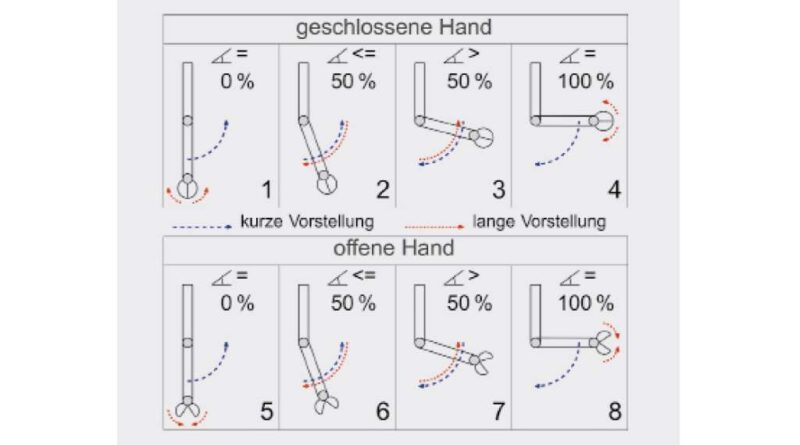
In einer zweiten Konfiguration wird das BCI als einzige Steuermodalität verwendet, um eine Arm- und Handneuroprothese sowohl kontinuierlich als auch diskret zu kontrollieren 12. Diese Konfiguration wurde mit neun gesunden Probanden und dem querschnittgelähmten Anwender ES evaluiert. In Anlehnung an die zuvor beschriebene Konfiguration wurde ebenfalls ein zeitkodierendes BCI verwendet, allerdings wird hier nicht nur zwischen kurzen und langen Kommandos unterschieden. Kurze Kommandos (Bewegungsvorstellung zwischen 0,75 und 1,5 s) werden als diskrete Kommandos behandelt: In Abhängigkeit der Position des Arms und der Hand kann die Hand geöffnet oder geschlossen werden oder das Ellbogengelenk in maximale Flexion oder Extension bewegt werden. Ein langes Kommando wird als solches nach 1,5 Sekunden erkannt und bewegt den Unterarm in Richtung des Endwinkels, welcher am weitesten von der aktuellen Position entfernt ist.
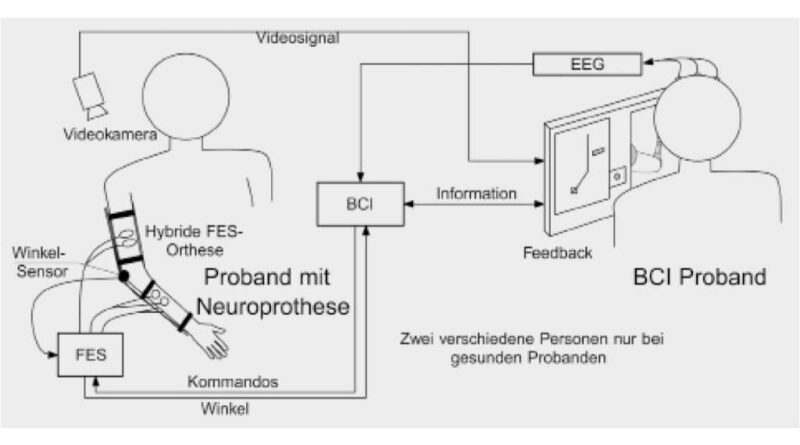
Für diese Art der Steuerung wurden zusätzlich zu den Elektroden am Unterarm noch Elektroden am Oberarm platziert. Zusätzlich wurde eine elektrisch blockierbare Ellenbogenorthese zu Stabilisierungszwecken und zur Messung des Ellenbogenwinkels montiert 13. Über die Messung des Ellenbogenwinkels und Anpassung der Stimulationspulsweite der Oberarmelektroden wird der gewünschte Sollwinkel eingeregelt. Bei Erreichen des Zielwinkels wird das Gelenk mit einem magnetischen Mechanismus verriegelt, um eine Dauerstimulation und die damit verbundene vorzeitige Muskelermüdung abzuwenden.
Der Versuchsablauf war für die gesunden und den querschnittgelähmten Probanden unterschiedlich: Während gesunde Probanden zur Minimierung von stimulationsbedingten Einflüssen die Aufgabe hatten, die Neuroprothese an einer zweiten Person zu bewegen, führte der querschnittgelähmte Anwender den Versuch einmal ohne Neuroprothese und einmal mit der Neuroprothese am eigenen Arm durch (Abb. 5). Ziel war die zehnmalige Durchführung einer vorgegebenen Bewegungsabfolge. Es sollten je nach aktueller Hand- und Armposition kurze und lange Kommandos richtig abgerufen werden, um ein Objekt in maximaler Extension zu greifen, es in maximaler Flexion loszulassen und abschließend in die Anfangsposition zurückzukehren. Für die Durchführung der gesamten Sequenz standen allen Probanden jeweils drei Minuten Zeit zur Verfügung. Diese war unterbrochen von einer einminütigen Pause, in welcher unbeabsichtigte Kommandos (false positives, FPs) gezählt wurden. Eine Übersicht von konzeptbezogenen Befehlskonstellationen von langen und kurzen Kommandos in Abhängigkeit von verschiedenen Hand- und Armpositionen sind in Abbildung 6 erläutert.
Im Mittel konnten die gesunden Probanden 60,2 ± 11,4 % richtige Kommandos erzeugen, je nach aktueller Hand- und Armposition. Die Zahl der ausgeführten Kommandos pro Minute während aktiver Sequenzen war mit 8,2 ± 1,3 bedeutend größer als die Zahl der falsch positiven Kommandos pro Minute während der Ruhephasen mit 4,7 ± 2,6. Im Durchschnitt wurden nur 22,6 ± 6,5 min von den 30 Minuten benötigt, um alle 10 Sequenzen zu beenden (positive oder negative). Es konnten 55,5 ± 36,2 % dieser 10 Sequenzen erfolgreich absolviert werden. Hervorzuheben ist, dass der Anwender ES mit einer Rate von richtigen Kommandos (TP) von 73,7 % und mit 80 % erfolgreicher Sequenzen in unter 20 Minuten das System besser als der Durchschnitt der nicht behinderten Probanden bedienen konnte. Damit war er der zweitbeste Teilnehmer bei diesem Experiment.
BCIs zur Unterstützung der Handfunktion nach Schlaganfall
Auch im Bereich der Schlaganfallrehabilitation konnten weitere Fortschritte erzielt werden. Bisherigen Erkenntnissen zufolge geht nach unilateralem Schlaganfall insbesondere eine Aktivierung noch intakter motorischer Areale in der geschädigten Hemisphäre mit funktionalen Verbesserungen einher 14. Mithilfe des BCIs können diese Aktivierungsmuster detektiert und durch gezielte Rückmeldung (Feedback) positiv verstärkt werden. In dem Beitrag von Kaiser et al. 15 wurde anhand einer Stichprobe von 29 Schlaganfallpatienten gezeigt, dass die Stärke und Lokalisation spezifischer Komponenten des EEG-Signals bei Bewegungsvorstellung und ‑ausführung mit dem Ausprägungsgrad der motorischen Beeinträchtigung in Zusammenhang stehen. Diese Erkenntnisse stellen eine wesentliche Grundlage für die erfolgreiche Anwendung der BCI-Technologie in der Schlaganfallrehabilitation dar. Bislang ist nämlich noch unzulänglich geklärt, welche messbaren neurophysiologischen Korrelate mit funktionalen Verbesserungen oder Verschlechterungen in Verbindung gebracht werden können und demnach positiv verstärkt oder aber abgeschwächt werden sollen.
Ein zunehmend verfolgter Ansatz im Kontext der Schlaganfallrehabilitation ist die Nutzung einer BCI getriggerten FES. Die Basis für diese Therapieform besteht in der Annahme, dass die direkte Kopplung der Bewegungsintention mit einer tatsächlich auftretenden Bewegung und die damit verbundene sensible, propriozeptive Rückmeldung in besonderem Maße geeignet sein könnte, um entsprechende Aktivierungsmuster zu verstärken und neuroplastische Veränderungen in der geschädigten Hemisphäre zu stimulieren. Bei einer FES-induzierten Bewegung wird nämlich der motorische Kortex in ähnlicher Weise aktiviert wie bei aktiv ausgeführten Bewegungen 16. Bei der getriggerten FES geht man einerseits davon aus, dass durch den sensorischen Input die Plastizität des ZNS gefördert wird. Andererseits weiß man, dass ein motorisches Training nur bei aktiver Partizipation der Betroffenen erfolgreich sein kann 17. Hier leistet das BCI einen wichtigen Beitrag, weil es speziell bei Schwerbetroffenen kortikale Aktivitätsmuster erkennen und in eine FES getriggerte motorische Reaktion mit einhergehender sensorischer Rückmeldung im Sinne eines geschlossenen Regelkreises überführen kann. Erste Anwendungen der Kopplung eines BCI mit einer FES stellen eine vielversprechende Ergänzung zu üblichen Trainingsprogrammen dar 18.
Vergleich von FES- und Video-Feedback während einer BCI-Kontrolle
In der Arbeit von Hiebel 19 wurde der Einfluss zweier Arten von Feedback auf sensomotorische Aktivierungsmuster im EEG während einer BCI-gesteuerten Anwendung untersucht. 15 gesunde, rechtshändige Personen sollten sich entweder Bewegungen ihrer rechten Hand vorstellen (motor imagery) oder sich entspannen und keine aktive Aufgabe ausführen (Ruhebedingung). Wurden die mit der Bewegungsvorstellung assoziierten Aktivierungsmuster richtig detektiert, löste dies entweder eine FES-induzierte Bewegung der rechten Hand aus oder initiierte ein Video, welches dieselbe zuvor individuell gefilmte Handbewegung auf einem Computermonitor zeigte. Während des Feedbacks sollten die Personen die entsprechende Bewegung beobachten sowie sich weiterhin mental vorstellen, die Bewegung selbst auszuführen.
Der experimentelle Aufbau wurde derart gewählt, dass in der FES-Bedingung die eigene rechte Hand sichtbar auf einem Tisch vor den Personen neben dem horizontal platzierten Monitor lag. In der Video-Bedingung wurde der Monitor so positioniert, dass sich die im Video gezeigte Hand an derselben Position befand wie die eigene Hand in der FES-Bedingung. Auf diesem Weg sollte der Einfluss des multisensorischen FES-Feedbacks (visuelle Bewegungsbeobachtung und propriozeptive Rückmeldung) gezielt mit dem Einfluss des Video-Feedbacks (visuelle Beobachtung derselben Bewegung) verglichen werden. Die aufgezeichneten EEG-Aktivierungsmuster wurden zwischen beiden Feedback-Bedingungen verglichen, wobei der Schwerpunkt auf der Analyse „korrekter Bewegungssequenzen“, in denen das entsprechende Feedback tatsächlich ausgelöst worden war, lag.
Die Ergebnisse zeigen eine deutlich stärkere Aktivierung des sensomotorischen Kortex während des zusätzlichen FES-Feedbacks, welche am stärksten über den sensomotorischen Repräsentationsarealen der Hände ausgeprägt war. Die schon bei vorangehender Bewegungsvorstellung vorhandene Aktivierung nahm während des FES-Feedbacks deutlich zu, hingegen zeigte sich kein Anstieg während der Beobachtung des Video-Feedbacks. Im Gegensatz zur Video-Bedingung waren die Aktivierungsmuster in der FES-Bedingung denen aktiv ausgeführter Bewegungen sehr ähnlich. Zudem wurde im Mittel eine höhere Online-Klassifikationsgenauigkeit in der FES-Bedingung (82,6 %) als in der Video-Bedingung (75,3 %) erzielt.
Dekodierung von Bewegungen mittels BCI
Ein Nachteil der aktuellen BCI-Technologie ist die unzulängliche Natürlichkeit der mentalen Strategien. So werden z. B. Fußbewegungsvorstellungen verwendet, um eine Neuroprothese der Hand zu steuern, falls die messbaren Effekte einer solchen Fußbewegungsvorstellung denen einer Handbewegungsvorstellung überlegen sind. Es wäre zweifellos intuitiver, wenn die Funktion einer Extremität über Bewegungsvorstellungen der gleichen Extremität gesteuert werden könnte. Darüber hinaus ist die Art der vorgestellten Bewegung meistens nicht mit der tatsächlich ausgeführten Aktion identisch, was eine zusätzliche Abstrahierung zur Folge hat. Die nächste Evolutionsstufe in BCI-gesteuerten Neuroprothesen wird es demnach sein, Bewegungsvorstellungen direkt in exakt entsprechende tatsächliche Bewegungen umzusetzen. Diese Möglichkeit einer einfach zu erlernenden, intuitiven Kontrolle würde als positiven Nebeneffekt das Erlernen von mentalen Strategien überflüssig machen und die Trainingszeit erheblich verkürzen. Zur Umsetzung eines solchen Kontrollschemas befassen sich verschiedene Forschergruppen vermehrt mit Gehirnsignalen im niederfrequenten Zeitbereich (< 5 Hz), welche ein hohes Potenzial zur nichtinvasiven Dekodierung von Bewegungsvorstellungen bieten. In einer Studie von Waldert et al. 20 wurden Handbewegungsrichtungen aus der 3 Hz tiefpassgefilterten MEG-Aktivität über bilateralen Motorarealen dekodiert. Erste Schritte in diese Richtung unter Verwendung des EEGs wurden von Bradberry et al. 21 unternommen. Hier wurde gezeigt, dass Frequenzen unter 1 Hz mit der Geschwindigkeit der Hand während tatsächlich ausgeführten Armbewegungen in allen drei Raumrichtungen korrelieren. In der Studie von Ofner und Müller-Putz 22 wurde unter Verwendung von niederfrequenten EEG-Anteilen auch die Hand-Position während einer selbstständig ausgeführten Bewegung (keine externe Zielvorgabe) dekodiert.
Unter Verwendung der Dekodierungsprinzipien der Studien von Bradberry et al. und Ofner/Müller-Putz 23 24 wurde in einer weiteren Untersuchung von Ofner und Müller-Putz 25 gezeigt, dass Armbewegungsvorstellungen in der Sagittal- und Transversalebene voneinander unterschieden werden können. In dieser Studie stellten sich neun gesunde Testpersonen eine rhythmische Armbewegung in diesen zwei Ebenen vor, während die Bewegungsvorstellung mithilfe eines Metronoms getaktet wurde. Unter Annahme einer sinusförmigen Bewegung wurden die Positionen der Hand in beiden Ebenen dekodiert. Hierzu wurden die EEG-Signale der letzten 180 ms in vier Zeitschritten bandpassgefiltert (0,2 – 0,8 Hz), anschließend wurden die Positionen in beiden Ebenen mit multiplen linearen Regressionen berechnet und mit einer Sinusschwingung korreliert. Die Bewegungen wurden nun der Ebene zugeordnet, die eine höhere Korrelation aufwies. Im Mittel über alle neun Testpersonen wurde eine Klassifikationsgenauigkeit von 70 % erreicht.
Diskussion
Die beiden Experimente mit unterschiedlich starker BCI-Integration konnten erfolgreich durchgeführt werden und zeigen, dass die hochquerschnittgelähmten Endanwender Funktionen der Hand oder des Ellenbogens kontrollieren können, zu denen sie ohne Unterstützung durch die bereitgestellten assistierenden Technologien nicht in der Lage gewesen wären. Die unterschiedliche Verwendung des BCIs in diesen Beispielen verdeutlicht, dass bei der Konfiguration von BCI-basierenden assistierenden Technologien die individuellen Anforderungen der Anwender im Sinne eines „User Centered Design (UCD)“ beachtet werden müssen.
Im ersten Szenario der Griffumschaltung wird das BCI als zusätzlicher Eingabekanal verwendet. Diese moderate Einbindung dient dazu, einer vorzeitigen Muskelermüdung vorzubeugen, da die auf muskulären Restfunktionen basierende Schultersteuerung nur bei Bedarf verwendet wird. Durch die BCI-gesteuerten Modi kann der Anwender die Stimulation ohne jeglichen muskulären Aufwand aktivieren und deaktivieren bzw. das aktuelle Griffmuster verändern.
Das zweite Beispiel zeigt die Verwendung von BCI bei sehr stark motorisch beeinträchtigten Menschen und verzichtet gänzlich auf muskuläre Restfunktionen zur Steuerung. Die Ergebnisse von nicht motorisch beeinträchtigen Probanden zeigen, dass ein auf Bewegungsvorstellungen basiertes BCI schwierig zu bedienen ist. Der Grund dafür ist die Schwierigkeit, die Bewegungsvorstellung über verschieden lange Zeiträume gezielt aufrechtzuerhalten und bei Bedarf wieder zu beenden. Manche Probanden konnten sich vorwiegend kurze Bewegungen besser vorstellen, manche fanden es einfacher, längere Vorstellungen durchzuführen. Die jeweils anderen Bewegungsvorstellungsarten waren dafür schwieriger zu bewerkstelligen.
Der an dem Experiment teilnehmende tetraplegisch Querschnittgelähmte konnte das BCI sowohl mit kurzen als auch mit langen Bewegungsvorstellungen sehr gut bedienen. Er hatte mit montierter Neuroprothese mit 73,7 % die zweitbeste TP-Rate aller Teilnehmer und konnte 8 von 10 Sequenzen innerhalb des gesetzten Zeitlimits erfolgreich absolvieren. Ob diese Einzelfallergebnisse auf ein größeres Patientenkollektiv generalisierbar sind, müssen weitere Untersuchungen mit Hoch-Querschnittgelähmten zeigen. Allerdings zeigen die Ergebnisse, dass Ergebnisse aus Untersuchungen mit Nichtgelähmten weder in positiver noch in negativer Richtung auf Querschnittgelähmte übertragbar sind.
Beide Neuroprothesensteuerungen verwendeten für eine zuverlässigere Benutzung des üblicherweise nicht fehlerfreien BCIs Prinzipien des hybriden BCIs. Bei der Griffumschaltung werden durch Überwachung der Schulterbewegung viele falsch positive BCI-Schaltvorgänge verhindert. Bei der kombinierten Hand- und Ellenbogensteuerung wird die Ellenbogenbewegung gemessen und je nach Höhe werden nur spezielle BCI-Kommandos zugelassen.
Die Ergebnisse unserer Forschung zeigen, dass sensorisches Feedback in Form einer FES-induzierten Bewegung entsprechende sensomotorische Gehirnregionen deutlich stärker aktiviert als Feedback in Form von ausschließlich visueller Beobachtung derselben Bewegung. Die mithilfe des BCIs durch Bewegungsvorstellung initiierten FES-vermittelten Bewegungen waren mit kortikalen Aktivierungsmustern assoziiert, wie sie auch bei aktiv ausgeführten Bewegungen auftreten. Bei visuellem Feedback über ein Video der eigenen Hand traten diese Aktivierungsmuster in deutlich geringerem Ausmaß auf.
Basierend auf diesen Erkenntnissen scheint eine Nutzbarkeit einer BCI-gesteuerten FES-Neuroprothese im Kontext der Schlaganfallrehabilitation aussichtsreich. Die intensive Aktivierung sensomotorischer Regionen durch propriozeptive Afferenzen in Verbindung mit der Triggerung über eine willkürliche Aktivierung des entsprechenden Motorareals könnte zu einer erhöhten kortikalen Reorganisation und damit Wiederherstellung motorischer Funktion führen. Die Klassifikationsergebnisse deuten darauf hin, dass die wiederholte somatosensorische Wahrnehmung der FES-induzierten Bewegung Personen in stärkerem Maße als das pure Beobachten die Vorstellung der entsprechenden Bewegung erleichtert.
Zuverlässige Aussagen über die Effizienz dieses Feedbacktrainings können jedoch erst nach weiteren BCI-Trainingsstudien getroffen werden. Im Rahmen zukünftiger Forschungsarbeiten wird die prinzipielle Frage geklärt werden, inwieweit überhaupt bei Schlaganfallpatienten noch verbliebene Aktivität in der geschädigten Hemisphäre detektiert und zur Steuerung einer FES-Neuroprothese genutzt werden kann. Darauf aufbauend müssen klinische Studien zeigen, welche kortikalen Veränderungen mittels FES-BCI-Training im Vergleich zu konventionellen Rehabilitationsmaßnahmen erzielt werden können und inwieweit diese mit erhöhten motorischen Funktionsverbesserungen einhergehen.
In weiteren Versuchen mit Nichtgelähmten konnten wir zeigen, dass die Vorstellung von rhythmischen Armbewegungen in einer Ebene nachträglich aus dem EEG dekodiert werden kann. Die nächsten Schritte werden sich mit der Entwicklung von Algorithmen beschäftigen, welche die vorgestellte Armposition in Echtzeit dekodieren können. Diese könnte dann mittels inverser Kinematik auf die Neuroprothese übertragen und somit eine intuitive Kontrolle ermöglichen.
Auf dem Weg dorthin sind aber noch viele Fragen offen, z. B. ist zu klären, ob nicht rhythmische, transiente Bewegungsvorstellungen dekodiert werden können, ob die dekodierte Position auch von anderen Parametern beeinflusst wird (Blickpunkt, Position von externen Zielen), welches Koordinatensystem zur Repräsentation der Armposition am besten geeignet ist (Gelenkswinkel, kartesisches Koordinaten-System in zwei oder drei Dimensionen, lineare oder nicht-linearen Achsen) oder inwiefern fehlerbehaftetes Feedback die Dekodierung beeinflusst. Bei einem idealen Dekoder würde die Steuerung der Neuroprothese mit natürlichen Bewegungsvorstellungen erfolgen. Dies hätte den weiteren Vorteil, dass keine neuen mentalen Strategien erlernt werden müssten, was die Trainingszeit für den Umgang mit der Neuroprothesensteuerung erheblich verkürzen könnte.
Anhand der vorgestellten Studien wird im besonderen Maß deutlich, dass nur durch eine interdisziplinäre Zusammenarbeit von Forschungsinstitutionen wie der TU Graz und des Universitätsklinikums Heidelberg relevante Fortschritte auf dem Gebiet der BCI-gesteuerten Neuroprothesen erreicht werden können. Ein wesentlicher Schritt hierzu sind Studien mit motorisch eingeschränkten Endanwendern (Personen im locked-in state, nach Schlaganfall oder Querschnittlähmung), da an Nichtgelähmten gewonnene Erkenntnisse nicht zwangsläufig auf die Zielgruppe übertragbar sind. Die Grundlagenforschung wird in Zukunft für Alltagsaufgaben geeignetere und natürlichere, intuitiver kontrollierbare Systeme hervorbringen, welche den potentiellen Anwenderkreis für BCI-kontrollierte Neuroprothesen erweitern werden.
Für die Autoren:
Dipl.-Ing. Alex Kreilinger
Institut für Semantische Datenanalyse,
BCI-Labor
Technische Universität Graz
Inffeldgasse 13/IV
A – 8010 Graz
alex.kreilinger@tugraz.at
Begutachteter Beitrag/Reviewed paper
Kreilinger A, Hiebel H, Ofner P, Rohm M, Rupp R, Müller-Putz GR. Brain-Computer Interfaces als assistierende Technologie und in der Rehabilitation nach Schlaganfall. Orthopädie Technik, 2013; 64 (6): 18–25
- Dynamische Hüftabduktions-Lagerungsorthese zur Behandlung pathologisch veränderter Hüften bei neuromuskulären Erkrankungen in der Kinderorthopädie — 5. Juni 2025
- Ein neuronal gesteuertes Exoskelett in der Therapie von Patientinnen und Patienten mit Querschnittlähmung — 5. Juni 2025
- Digitale Wunddokumentation: Warum Papier keine Option mehr ist — 5. Juni 2025
- Wolpaw JR, Birbaumer N, McFarland DJ, Pfurtscheller G, Vaughan TM. Brain-computer interfaces for communication and control. Clin Neurophysiol, 2002; 113: 767–791
- Kaiser V, Kreilinger A, Rupp R, Müller-Putz GR. Einsatz von Brain-Computer Interfaces zur Rehabilitation und Nutzung assistierender Technologien? Orthopädie Technik, 2012; 64 (5): 33–40
- Millán J. del R. , Rupp R, Müller-Putz GR, Murray-Smith R, Giugliemma C, Tangermann M, Vidaurre C, Cincotti F, Kübler A, Leeb R, Neuper C, Müller KR, Mattia D. Combining brain-computer interfaces and assistive technologies: state-of-the-art and challenges. Front Neurosci, 2010; (4): 161
- Müller-Putz GR, Breitwieser C, Cincotti F, Leeb R, Schreuder M, Leotta F, Tavella M, Bianchi L, Kreilinger A, Ramsey A, Rohm M, Sagebaum M, Tonin L, Neuper C, Millán J. del R. Tools for brain-computer interaction: a general concept for a hybrid BCI. Frontiers in Neuroinformatics, 2011; (5): 30
- Pfurtscheller G, Allison BZ, Brunner C, G. Bauernfeind G, Solis-Escalante T, Scherer R, Zander TO, Müller-Putz GR, Neuper C, Birbaumer N. The hybrid BCI. Front in Neurosc, 2010; 4
- Kaiser V, Kreilinger A, Rupp R, Müller-Putz GR. Einsatz von Brain-Computer Interfaces zur Rehabilitation und Nutzung assistierender Technologien? Orthopädie Technik, 2012; 64 (5): 33–40
- Müller-Putz GR, Scherer R, Pfurtscheller G, Rupp R. EEG-based neuroprosthesis control: a step towards clinical practice. Neurosci Lett, 382 (2005), 169–174
- Pfurtscheller G, Müller GR, Pfurtscheller J, Gerner HJ, Rupp R. „Thought“-control of functional electrical stimulation to restore hand grasp in a patient with tetraplegia. Neurosci Lett, 2003; 351 (1): 33–36
- Rupp R, Kreilinger A, Rohm M, Kaiser V, Müller-Putz GR. Development of a non-invasive, multifunctional grasp neuroprosthesis and ist evaluation in an individual with a high spinal cord injury. Proceedings of the 34th Annual International IEEE EMBS Conference, 2012; 1–4
- Kreilinger A, Neuper C, Müller-Putz GR. Error potential detection during continuous movement of an artificial arm controlled by brain-computer interface. Medical & Biological Engineering & Computing, 2012; 50 (3): 223–230
- Müller-Putz GR, Scherer R, Pfurtscheller G, Neuper C. Temporal coding of brain patterns for direct limb control in humans. Front Neurosci, 2010; (4): 34
- Kreilinger A, Rohm M, Kaiser V, Leeb R, Rupp R, Müller-Putz GR. Continuous and discrete control of a hybrid neuroprosthesis via time-coded motor imagery BCI. Proceedings of TOBI Workshop IV, 2013; 43–44
- Rohm M, Müller-Putz GR, von Ascheberg A, Gubler M, Tavella M, Millán J. del R., Rupp R. Modular FES-hybrid orthosis for individualized setup of BCI controlled motor substitution and recovery. Int Journal Bioelectromagnetism, 2011; 13 (3): 127–128
- Calautti C, Baron JC. Functional neuroimaging studies of motor recovery after stroke in adults: a review. Stroke, 2003; 34: 1553–1556
- Kaiser V, Daly I, Pichiorri F, Mattia D, Müller-Putz GR, Neuper C. On the relationship between electrical brain responses to motor imagery and motor impairment in stroke. Stroke, 2012; 43 (10): 2735–2740
- Müller GR, Neuper C, Rupp R, Keinrath C, Gerner HJ, Pfurtscheller G. Event-related beta EEG changes during wrist movements induced by functional electrical stimulation of forearm muscles in man. Neurosci Lett, 2003; 340: 143–147
- Daly JJ, Wolpaw JR. Brain-computer interfaces in neurological rehabilitation. The Lancet Neurology, 2008; (7): 1032–1043
- Hiebel H. Using functional electrical stimulation (FES) as feedback for brain-computer interfaces. Diploma thesis, University of Graz, 2012
- Hiebel H. Using functional electrical stimulation (FES) as feedback for brain-computer interfaces. Diploma thesis, University of Graz, 2012
- Waldert S, Preissl H, Demandt E, Braun C, Birbaumer N, Aertsen A, Mehring C. Hand Movement Direction Decoded from MEG and EEG. The Journal of Neuroscience, 2008; 28 (4): 1000–1008
- Bradberry TJ, Gentili RJ, Contreras-Vidal JL. Reconstructing three-dimensional hand movements from noninvasive electroencephalographic signals, 2010; 30 (9): 3432–3437
- Ofner P, Müller-Putz GR. Decoding of velocities and positions of 3D arm movement from EEG. Proceedings of the 34th Annual International Conference of the IEEE EMBS, 2012; 6406–6409
- Bradberry TJ, Gentili RJ, Contreras-Vidal JL. Reconstructing three-dimensional hand movements from noninvasive electroencephalographic signals, 2010; 30 (9): 3432–3437
- Ofner P, Müller-Putz GR. Decoding of velocities and positions of 3D arm movement from EEG. Proceedings of the 34th Annual International Conference of the IEEE EMBS, 2012; 6406–6409
- Ofner P, Müller-Putz GR. Classifying imaginations of rhythmic arm movements in two planes from EEG, Proceedings of TOBI Workshop IV, 2013; 119–120