Die Auslösung von Anpassungsprozessen ist dabei maßgeblich von der Charakteristik des mechanischen Reizes abhängig. Je nach Größenordnung, Einwirkdauer, Frequenz und Rate des Lasteintrags erhöhen oder reduzieren nicht nur Muskeln, sondern auch Sehnen, Bänder, Knochen und Knorpel ihre Gewebequalität. Die zeitlichen Abläufe von Anpassungsprozessen bei Aktivität und Inaktivität sind dabei besonders zu berücksichtigen.
Einleitung
Das Muskel-Skelett-System des menschlichen Körpers weist ein hohes Potenzial an Belastungsverträglichkeit und Anpassungsfähigkeit auf. Seit sich der Mensch vor ca. drei Millionen Jahren aufrichtete, um die bipedale Lokomotion zu erlernen, veränderte sich durch die Belastungsumverteilung 1 die Morphologie seines Körpers maßgeblich 2 3. Die Belastungen, die der Mensch während der aufrechten Fortbewegung erfährt, sind hinreichend beschrieben z. B.4 5. Während sich stehend das einfache Körpergewicht auf den Körper auswirkt, erhöht sich die Last während des Gehens auf das 1,3‑Fache des Körpergewichts 6, bei zunehmender Geschwindigkeit auf das Zwei- bis Vierfache 7. In sportmotorischen Extremsituationen werden sogar kurzzeitige Belastungen des sieben- bis achtfachen Körpergewichts am Körperschwerpunkt erreicht 8.
Dabei ist zu berücksichtigen, dass die ermittelten Belastungen über Kraftsensoren in Boden oder Equipment zwar abgeschätzt werden können, die interne Beanspruchung der Gewebe aber dadurch unterschätzt wird. Denn die externen Reaktionskräfte weichen von den internen Muskelkräften stark ab, da die externen Hebelarme die internen häufig um ein Vielfaches übersteigen. Bei einbeinigem Zehenstand beispielsweise können zwar Bodenreaktionskräfte von 700 N auftreten, die Plantarflexoren des Sprunggelenks müssen allerdings aufgrund der ungünstigen Hebelverhältnisse Kräfte von ca. 2.000 N erzeugen. Innerhalb des Hüftgelenks können dadurch – bedingt durch Muskelkräfte und Hebelverhältnisse – während des langsamen Laufens Belastungen des fünffachen Körpergewichts entstehen 9. Dies lässt eine präzise Differenzierung zwischen der Mechanik des Körperschwerpunkts und der Mechanik auf Gelenkebene notwendig erscheinen. Betrachtet man die Drehmomente an einem Gelenk als Belastungsindikator, so weisen die externen Flexionsmomente an den Gelenken der unteren Extremität in der schnellen Fortbewegung (6–9 ms‑1) Größenordnungen von 100 bis 600 Nm auf 10 11 12 13 14 15 16. In der Frontalebene des Laufens, Sprintens und bei Richtungswechseln entstehen am Kniegelenk Adduktionsmomente von 75 bis 130 Nm 17 18 19. In extremen Belastungssituationen, wie sie beispielsweise bei Elite-Hochspringern während des Absprungs auftreten, konnten sogar bis zu 800 Nm identifiziert werden. Dabei ist von Kompressionskräften im medialen Kompartiment des Kniegelenks von 18 kN auszugehen. Bei einer Gelenkfläche von ca. 6 cm² entspräche dies einer Druckspannung von ca. 30 MPa 20, wonach der tolerierbare Grenzbereich der Belastung am Knorpel deutlich überschritten wäre (Tab. 1). Allerdings kann in der Absprungphase des Hochsprungs nicht von einer reinen Druckspannung ausgegangen werden, sondern vielmehr von einer Kombination aus Druck‑, Zug- und Scherspannung.
Aus wissenschaftlicher Sicht bestehen keine Zweifel, dass sich nicht nur Muskeln, sondern auch Sehnen, Bänder, Knochen und Knorpel an diese Belastungen anpassen können: Bei Steigerung des Aktivitätsniveaus und der Belastung über Monate bis Jahre werden die Strukturen größer, steifer und dadurch widerstandsfähiger; bei Reduktion des Aktivitätsniveaus und bei Entlastung bilden sie sich innerhalb von wenigen Tagen bis Wochen um bis zu 30 % zurück. Heute ist bekannt, dass der Auslösung biopositiver Anpassungsprozesse ein detaillierter mechanischer Reiz zugrunde liegt, der primär über die Kraft und sekundär über die Spannung und die Dehnung definiert ist. Dabei sind nicht nur die Größenordnung, die Richtung, die Kontaktfläche und die Lokalisation entscheidend, sondern auch die zeitliche Charakteristik, bestimmt durch Dauer, Frequenz und Rate des Lasteintrags.
Muskeln
Der Skelettmuskel ist hochadaptiv: Sowohl Ausdauer- als auch Krafttraining haben umfassende und vollkommen unterschiedliche Effekte auf das Muskelgewebe. An dieser Stelle wird nur in Kürze auf die grundlegende Kraftfähigkeit und die funktionelle Anpassungsfähigkeit an Belastung des Muskels eingegangen.
Die maximale Kraft eines Muskels innerhalb eines Individuums ist abhängig von der Kraft-Längen-Relation 21, der Kraft-Geschwindigkeits-Relation 22 und der Aktivierung des Muskels 23. Da die meisten Muskeln mit ihren Sehnen an einem Gelenkmittelpunkt vorbeiziehen, erzeugen sie Drehmomente an einem Gelenk. Je nach Trainingszustand, Alter, Geschlecht, Muskellänge und unter Vernachlässigung der Kontraktionsgeschwindigkeit (isometrische Kontraktionen) können die Hüftstrecker im Dynamometer maximale Drehmomente von 110 bis 250 Nm, die Kniestrecker von 200 bis 300 Nm und die Fußstrecker von 110 bis 275 Nm produzieren 24 25 26 27. Hochtrainierte Bob-Anschieber sind in der Lage, an Knie- und Sprunggelenken bis zu 450 Nm zu erzeugen. An den Zehengrundgelenken können maximale Drehmomente von 6 bis 24 Nm aufgebracht werden 28 29.
Bereits nach wenigen Trainingseinheiten finden in der neuronalen Ansteuerung von Muskeln erste Anpassungsprozesse statt: Nervenfasern bilden sich aus, Synapsen verändern die Kommunikation untereinander und innervieren nicht nur innerhalb eines Muskels, sondern auch in benachbarten Muskeln die Muskelfasern (inter- und intramuskuläre Koordination), was zu einer Steigerung der Maximalkraft führt. Nach sechs bis acht Wochen können je nach Ausgangsniveau und Gestaltung des Trainingsreizes Zunahmen des Muskelvolumens von 5 bis 8 % beobachtet werden, wodurch der Muskel widerstandsfähiger wird. Bis zur 14. Woche sind bei großen, antigravitatorisch wirkenden Muskelgruppen Zuwächse in der isometrischen Maximalkraft von 16 % bei gleichzeitiger Vergrößerung des Volumens um 10 % möglich 30. Kleine Muskelgruppen wie beispielsweise die Zehenbeuger zeigen sogar eine Zunahme der Maximalkraft durch systematisches Training von bis zu 70 % 31. Für das Training der Zehenbeuger können spezielle Geräte eingesetzt werden, die durch Austausch der Gummiseile eine Regulierung des Trainingswiderstands ermöglichen (Abb. 1). Dabei sollten über acht Wochen in drei Trainingseinheiten pro Woche sechs bis zehn ermüdende Kontraktionen in fünf Serien durchgeführt werden (90 Sekunden Pause zwischen den Serien).
Aber nicht nur in Krafttrainingsgeräten, sondern auch durch minimalistisches Schuhmaterial kann die Kraftfähigkeit der Muskeln um bis zu 20 % – bei Vergrößerung der anatomischen Querschnittsfläche von 4 bis 6 % – gesteigert werden 32 33. Dabei führen unterschiedliche Trainingsintensitäten zu ähnlichen Reizreaktionen (Tab. 2). Wichtig dabei sind insbesondere Lasteinträge über den Vorfuß (z. B. Lauf-ABC, Sprünge und Landungen, Richtungswechsel, Treppenläufe, Bergaufläufe) bei gleichzeitiger Dorsalflexion der Zehengrundgelenke auf verschiedenen Untergründen (Tartan, Gras, Sand).
Sehnen
In der Fortbewegung können Sehnen, insbesondere die Achillessehne, das Achtfache des Körpergewichts tolerieren; in sportmotorischen Extremsituationen kann sogar vom Zehn- bis Zwölffachen ausgegangen werden. Das entspricht Kräften in der Sehne von 8 bis 10 kN 34 35. Diesen Lasteinträgen passen sich Sehnen an, benötigen dafür allerdings deutlich mehr Zeit als Muskeln. In wissenschaftlichen Studien konnten über hohe Lasteinträge (90 % Maximalkraft, vier Wiederholungen, fünf Serien und drei bis vier Trainingseinheiten pro Woche) und eine damit provozierte repetitive Dehnung der Sehne um 4,5 %, eine Vergrößerung der Querschnittsfläche und eine Erhöhung der Steifigkeit der Sehnenaponeurose nach 14-wöchigem Training beobachtet werden 36 37. Auch die freie Sehne zeigte bei Langstreckenläufern eine um 22 % vergrößerte Querschnittsfläche verglichen mit einer nichtlaufenden Kontrollgruppe 38. Die Sehne kann durch diese Anpassungserscheinungen mehr Energie aufnehmen und schützt sich dadurch vor Verletzung durch Überdehnung (> 9 %). Der Auslöser für die Sehnenanpassung ist dabei von einer präzisen Gestaltung des mechanischen Reizes abhängig. Eine hohe Dehnungsamplitude, eine moderate Dehnungsdauer und ein repetitiver Lasteintrag scheinen essentielle Trigger für Anpassungsprozesse darzustellen 39. Ein Zusammenhang zwischen der Veränderung der Sehneneigenschaften und der Optimierung der sportmotorischen Leistung konnte in einer Interventionsstudie beschrieben werden: Eine systematische Erhöhung der Sehnensteifigkeit um 15 % führte zu einer Verbesserung der Laufökonomie um 3 bis 5 % 40. Für die Anwendung dieser Ergebnisse scheint die Erkenntnis elementar zu sein, dass sich Sehnen deutlich langsamer (8 Wochen vs. 14 Wochen) anpassen als Muskeln. Insbesondere im Nachwuchssport, in dem deutliche Reifungsprozesse der Athletinnen und Athleten stattfinden, die mit einem zügigen Muskelwachstum einhergehen 41, ist diese Verzögerung von besonderer Bedeutung. Mersmann et al. (2014) untersuchten die Kniestrecker und die Patellasehne von Nachwuchsund ehemaligen Elite-Volleyballern auf ihre mechanischen Eigenschaften und stellten fest, dass es zwar keinen signifikanten altersbereinigten Unterschied in den Kraftfähigkeiten der Kniestrecker gab, dass allerdings die Querschnittsflächen der Patellasehnen bei den Nachwuchsspielern deutlich kleiner ausfielen als die der ehemaligen Elite-Spieler. Dadurch war die Beanspruchung der Sehne um 20 % erhöht 42. Dies lässt rückschließen, dass vor allem im Nachwuchssport der Schutz der Sehne vor Überlastung besonderes Augenmerk verdienen sollte.
Knochen
Seit den Beobachtungen des Chirurgen Julius Wolff Ende des 19. Jahrhunderts beschäftigten sich zahlreiche Studien mit der Anpassungsfähigkeit des Knochens an mechanische Reize s. Review 43. Deutlich wird dabei der Effekt extern wirkender Kräfte auf den Körper durch Aktivität auf die Morphologie und die interne Struktur des Knochens. So zeigen häufig belastete Oberarme in Schlagdisziplinen (z. B. Baseball, Tennis) signifikant hypertrophierte Knochen im Vergleich zu ihren gering belasteten Gegenarmen 44 45. Ebenso wurde durch repetitive unilaterale Sprünge (Hoch- und Weitsprung) eine um 3,7 % vergrößerte Querschnittsfläche des kortikalen Knochens der Tibia auf der Sprungbeinseite verglichen mit der Schwungbeinseite beobachtet 46. Weitere Anpassungen konnten in der Knochenmineraldichte des Femurs und der Wirbelsäule verzeichnet werden. So wurde beispielsweise bei Gewichthebern eine deutlich höhere Knochenmineraldichte der Lendenwirbelsäule (11 %) und des Oberschenkels (15 %) identifiziert als bei einer gleichaltrigen Vergleichsgruppe 47. Auch bei ambitionierten Läufern (10 km unter 32 min) war die Knochenmineraldichte der Beine und des Beckens im Vergleich zu Nichtaktiven auffällig erhöht 48. Ein Training auf einer Vibrationsplattform (Frequenz 12,6 Hz; Amplitude 3 cm) dreimal pro Woche bei einer Dauer des Lasteintrags von sechsmal einer Minute pro Einheit (eine Minute Pause) über acht Monate führte zu einer Zunahme der Knochenmineraldichte um 4,3 % 49.
Das limitierte Verständnis für die Knochenanpassung an ein Training spiegelt sich in den Ergebnissen von Längsschnittstudien wider. Dabei konnten die Ergebnisse der Querschnittstudien, die die deutlichen Unterschiede in der Knochenmineraldichte zwischen Trainierten und Untrainierten offenlegten, nicht ansatzweise bestätigt werden. Dies scheint jedoch weniger mit der Anpassungsfähigkeit des Knochens als vielmehr mit der präzisen Gestaltung des mechanischen Reizes innerhalb der Studienprotokolle zusammenzuhängen.
Interessanterweise ist die für die Knochenbildung benötigte Anzahl an Belastungszyklen relativ niedrig: Um Knochenabbau durch Inaktivität entgegenzuwirken, waren vier Belastungszyklen pro Tag ausreichend. Konträr dazu zeigte ein Anstieg der Belastungszyklen zwischen 36 und 1.800 pro Tag keine zusätzlichen anabolen Prozesse 50. Diskutiert werden die durch Muskelkontraktion implizierten Stimuli von geringer Spannung (< 100 µɛ) und hoher Frequenz (10–90 Hz) zur Aufrechterhaltung der Knochenhomöostase und zur Knochenhypertrophie 51. Ist allerdings ein Belastungsparameter deutlich zu hoch gewählt, beispielsweise durch zu hohe oder zu lang andauernde Trainingsreize, daraus resultierende Muskelermüdung oder falsche Ausrüstung, kann dies zu einem Missverhältnis in Modeling- und Remodeling-Prozessen des Knochens führen. In der Folge können ein Abbau von Knochenmasse, Ermüdungserscheinungen des Knochenmaterials, Mikroverletzungen und Brüche auftreten 52 53. Stressfrakturen sind häufig im Bereich der Mittelfußknochen vorzufinden. Ein aktives Training der Fußmuskulatur (s. Abb. 1) kann dabei eine höhere Ermüdungswiderstandsfähigkeit und dadurch eine Entlastung des Knochens im Mittelfußbereich bewirken. Ein präzises Training der kurzen Fußmuskulatur und deren funktioneller Anpassungsfähigkeit wurde bereits mehrfach beschrieben 54 55.
Bänder
Ebenso wie die anderen kollagenen Strukturen des muskuloskelettalen Systems weisen Bänder ein deutliches Anpassungspotenzial auf. Durch Training können dabei Optimierungen in der Gewebequalität (z. B. Querschnittsfläche, Steifigkeit) von 10 bis 20 % erreicht werden 56 57 58. Dies wird insbesondere durch die Veränderung der biochemischen Zusammensetzung (u. a. Kollagenkonzentration) eines Bandes erklärt 59. Dabei benötigen Bänder ähnlich wie Sehnen über vier Monate für Struktur- und Morphologieveränderungen. Die Studien müssen allerdings mit Vorsicht betrachtet werden, da ein Trainingsprotokoll nicht zwingend die Spannung an einem untersuchten Band beeinflusst. Zudem ist es eher unwahrscheinlich, dass Bänder in sportmotorischen Situationen in ähnlichem Maße gedehnt werden wie Sehnen, da die Kraft des kontraktilen Elements als Dehnungsursache fehlt. Studien an Tiermodellen verdeutlichten, dass das vordere Kreuzband nach Ruptur über zwölf Monate benötigt, um seine funktionelle Leistungsfähigkeit wiederherzustellen 60. Dies sollte vor allem für Return-to-Sport nach Verletzung berücksichtigt werden. Auch wenn die Maximalkraft der gelenkumspannenden Muskeln ihr Ausgangsniveau wieder erreicht hat, so kann die muskuläre Ansteuerung in der sportmotorischen Wettkampfsituation reduziert sein. Die Folge wären hohe Beanspruchungen der Gelenkstrukturen und damit des betroffenen Bandes. Hier scheint eine gezielte biomechanische Funktionsdiagnostik auf Gelenkebene (mechanische Leistung, Arbeit und Energie in disziplinnahen Bewegungen) unabdingbar, um den Zeitpunkt des Return-to-Sport im Sinne der Verletzungsprävention und der Leistungsoptimierung präziser zu definieren.
Knorpel
Der Knorpel gewährleistet eine exzellente Lastverteilung innerhalb eines Gelenks und sorgt dafür, dass zwei Knochenenden nicht aufeinander reiben. Die Widerstandsfähigkeit des Knorpels ergibt sich aus seiner fibrösen Zusammensetzung. Insbesondere Kollagen II (> 90%) und die Proteoglykane in Kombination mit einem hohen Anteil an Wasser bilden die Basis für eine hohe Druckfestigkeit. Seine biopositive Anpassungsfähigkeit an chronische Belastung ist noch nicht gänzlich erklärt. Einerseits beobachteten verschiedene Studien am Menschen geringe bis moderate Veränderungen von Knorpeldicke, ‑fläche und ‑volumen an chronische Belastung 61 62, andererseits waren die Knorpeldicken und ‑flächen der Kniegelenke hochbelasteter Gewichtheber und Bob-Anschieber im Vergleich zu einer inaktiven Kontrollgruppe nicht vergrößert 63. Unsicherheit hinsichtlich der Ergebnisinterpretation besteht hauptsächlich durch eine hohe interindividuelle Variabilität der Morphologie des Knorpels. Die Modellierung von Muskelkräften und die Analyse der Spannungsverteilung über den gesamten Knorpel werden benötigt, um Reizreaktionen und Adaptation besser verstehen zu können.
Durch Experimente auf zellulärer Ebene erhofft man sich, der Definition einer tolerierbaren mechanischen Belastung für den Knorpel näherzukommen. Jüngste Studien zu präzisen Dehnungsreizen (3 Tage, 30 min pro Tag, 6 % Dehnung, 0,5 Hz) isolierter Knorpelzellen zeigten, dass nicht nur die Zunahme der Proteinmenge (COMP), sondern auch die Umorganisation und damit die Anordnung des extrazellulären Kollagennetzwerks von Bedeutung bei der Anpassung von Knorpel an mechanische Belastung sind 64. Für die Zerstörung von Knorpelmaterial scheinen insbesondere exzessive mechanische Reize eine Rolle zu spielen 65 66. Anhand von Studien an Tiermodellen kann davon ausgegangen werden, dass eine Überlastung des Knorpels (z. B. durch extreme Laufbelastung) zu einer Zerstörung der Kollagenstruktur und ‑organisation führt 67.
Fazit
Der menschliche Körper kann in sportmotorischen Extremsituationen kurzzeitig über das Achtfache seines Körpergewichts tolerieren. Unter Berücksichtigung von Muskelkräften und Hebelverhältnissen entspräche dies gelenkinternen Kräften des achtzehnfachen Körpergewichts. Dies gelingt nur durch eine gezielte Vorbereitung der muskuloskelettalen Strukturen auf Belastung durch intelligentes Training. Diagnostische Maßnahmen zur Identifizierung von Gewebequalität wären eine Möglichkeit, frühzeitig in eine präzise und individuelle Reizsteuerung durch Training einzugreifen.
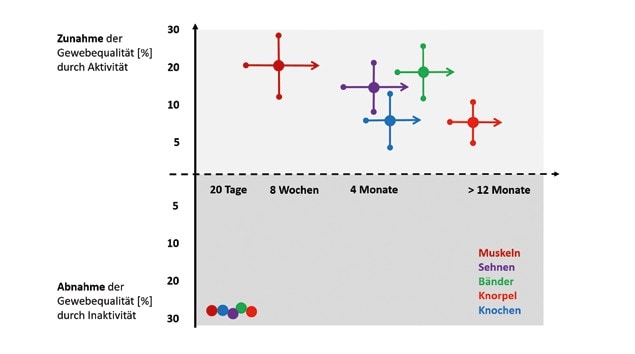
Die Ergebnisse wissenschaftlicher Studien zeigen sehr deutlich, dass sich nicht nur Muskeln, sondern auch Sehnen, Bänder, Knochen und Knorpel an Belastung anpassen können. Dabei ist die Anpassungsausprägung abhängig von der Charakteristik des mechanischen Reizes respektive der Trainingsgestaltung: Erhöhte mechanische Reize resultieren in größeren, steiferen und widerstandsfähigeren Materialien. Funktionelle Kapazitätsverbesserungen um 5 bis 20 %, teilweise 30 %, können durch regelmäßige Aktivität über Jahre hinweg erreicht werden. Sensible Übersteuerungen der Reizcharakteristika können Risse, Entzündungen oder Brüche an den Strukturen provozieren. Wie wichtig regelmäßige Aktivität und mechanische Belastung zum Erhalt der Funktionalität der Strukturen sind, zeigen die katabolen Prozesse, die bei Inaktivität angestoßen werden und die funktionelle Kapazität der Bindegewebe innerhalb weniger Wochen um 30 bis 40 % dramatisch reduzieren (Abb. 2).
Für die Autoren:
Dr. Jan-Peter Goldmann
Deutsche Sporthochschule Köln
Institut für Biomechanik und Orthopädie
Deutsches Forschungszentrum für Leistungssport Köln
Am Sportpark Müngersdorf 6
50933 Köln,
goldmann@dshs-koeln.de
Begutachteter Beitrag/reviewed paper
Goldmann J.-P., Kersting U. Biomechanik von Belastung und Anpassung im Sport. Orthopädie Technik, 2019; 70 (8): 50–56
| Sehne | Band | Kortikaler Knochen | Knorpel | |
|---|---|---|---|---|
| Grenzspannung [MPa] | 100 (Zug) | 60–100 (Zug) | 30 (Zug) bis 200 (Druck) | 5–15 (Druck) |
| Verformung [%] | 8–10 | 12–14 | 3–5 | 25–30 |
| Studien | Goldmann et al. 2013 68 | Brüggemann et al. 2005 69 |
|---|---|---|
| Reizcharakteristik | intensiv und kurz | moderat und lang |
| Intensität | 5000–6000 Push-offs | Aufwärmphase |
| Trainingsdauer | 3 Wochen | 5 Monate |
| Trainingseinheiten pro Woche | 5 | 2–3 |
| Dauer pro Einheit | 30 min | 15–30 min |
| Anzahl Einheiten gesamt | 15 | 45 |
| Kraftzuwachs Zehenbeuger | 13–20 % | 18–20 % |
- Compliance in der Skoliose-Korsettversorgung – Einflussfaktoren und Herausforderungen einer erfolgreichen Therapie — 5. Juli 2025
- Elektrische Anregung eines Teleskop-Phantoms – Fallstudie an einer beinamputierten Patientin — 4. Juli 2025
- Dynamische Hüftabduktions-Lagerungsorthese zur Behandlung pathologisch veränderter Hüften bei neuromuskulären Erkrankungen in der Kinderorthopädie — 5. Juni 2025
- Sockol MD, Raichlen DA, Pontzer H. Chimpanzee locomotor energetics and the origin of human bipedalism. Proc Natl Acad Sci USA, 2007; 104 (30): 12265–12269
- Lovejoy CO. The natural history of human gait and posture. Part 2. Hip and thigh. Gait Posture, 2005; 21 (1): 113–124
- Lovejoy CO. The natural history of human gait and posture. Part 3. The knee. Gait Posture, 2007; 25 (3): 325–341
- Elftman H. The measurement of the external force in walking. Science, 1938; 88 (2276): 152–153
- Cavanagh PR, Lafortune MA. Ground reaction forces in distance running. J Biomech, 1980; 13 (5): 397–406
- Elftman H. The measurement of the external force in walking. Science, 1938; 88 (2276): 152–153
- Cavanagh PR, Lafortune MA. Ground reaction forces in distance running. J Biomech, 1980; 13 (5): 397–406
- Goldmann J‑P, Braunstein B, Heinrich K, Sanno M, Stäudle B, Ritzdorf W, Brüggemann G‑P, Albracht K. Joint work of the take-off leg during elite high jump. Proceedings of the International Society of Biomechanics in Sports, Poitiers, 2015
- Bergmann G, Graichen F, Rohlmann A. Hip joint loading during walking and running, measured in two patients. J Biomech, 1993; 26 (8): 969–990
- Mann RV. A kinetic analysis of sprinting. Med Sci Sports Exerc, 1981; 13 (5): 325–328
- Arampatzis A, Brüggemann GP, Metzler V. The effect of speed on leg stiffness and joint kinetics in human running. J Biomech, 1999; 32 (12): 1349–1353
- Johnson MD, Buckley JG. Muscle power patterns in the mid-acceleration phase of sprinting. J Sports Sci, 2001; 19 (4): 263–272
- Belli A, Kyröläinen H, Komi PV. Moment and power of lower limb joints in running. Int J Sports Med, 2002; 23 (2): 136–141
- Hunter JP, Marshall RN, McNair PJ. Segment-interaction analysis of the stance limb in sprint running. J Biomech, 2004; 37 (9): 1439–1446
- Bezodis IN, Kerwin DG, Salo AIT. Lower-limb mechanics during the support phase of maximum-velocity sprint running. Med Sci Sports Exerc, 2008; 40 (4): 707–715
- Schache AG, Blanch PD, Dorn TW, Brown NAT, Rosemond D, Pandy MG. Effect of running speed on lower limb joint kinetics. Med Sci Sports Exerc, 2011; 43 (7): 1260–1271
- Dupré T, Dietzsch M, Komnik I, Potthast W, David S. Agreement of measured and calculated muscle activity during highly dynamic movements modelled with a spherical knee joint. J Biomech, 2019; 84: 73–80
- Stefanyshyn DJ, Stergiou P, Lun VMY, Meeuwisse WH, Worobets JT. Knee angular impulse as a predictor of patellofemoral pain in runners. Am J Sports Med, 2006; 34 (11): 1844–1851
- Sigward SM, Powers CM. The influence of gender on knee kinematics, kinetics and muscle activation patterns during side-step cutting. Clin Biomech (Bristol, Avon), 2006; 21 (1): 41–48
- Goldmann J, Braunstein B, Heinrich K, Sanno M, Stäudle B, Ritzdorf W, Brüggemann G, Albracht K. Knee joint moments in elite high jumpers. Proceedings of the 24th Annual Congress of the European College of Sports Science, Prague, 2019
- Blix M. Die Länge und die Spannung des Muskels 1. Skandinavisches Archiv Für Physiologie, 1894; 5 (1): 173–206
- Fenn WO, Marsh BS. Muscular force at different speeds of shortening. J Physiol (Lond ), 1935; 85 (3): 277– 297
- Henneman E, Olson CB. Relations between structure and function in the design of skeletal muscles. J Neurophysiol, 1965; 28: 581–598
- Anderson DE, Madigan ML, Nussbaum MA. Maximum voluntary joint torque as a function of joint angle and angular velocity: model development and application to the lower limb. J Biomech, 2007; 40 (14): 3105– 3113
- Arampatzis A, Monte G de, Morey-Klapsing G. Effect of contraction form and contraction velocity on the differences between resultant and measured ankle joint moments. J Biomech, 2007; 40 (7): 1622–1628
- Dean JC, Kuo AD, Alexander NB. Age-related changes in maximal hip strength and movement speed. J Gerontol A Biol Sci Med Sci, 2004; 59 (3): 286–292
- Narici MV, Roi GS, Landoni L. Force of knee extensor and flexor muscles and cross-sectional area determined by nuclear magnetic resonance imaging. Eur J Appl Physiol Occup Physiol, 1988; 57 (1): 39–44
- Goldmann J‑P, Brüggemann G‑P. The potential of human toe flexor muscles to produce force. J Anat, 2012; 221 (2): 187–194
- Goldmann J‑P, Sanno M, Willwacher S, Heinrich K, Brüggemann G‑P. The potential of toe flexor muscles to enhance performance. J Sports Sci, 2013; 31 (4): 424–433
- Aagaard P, Andersen JL, Dyhre-Poulsen P, Leffers AM, Wagner A, Magnusson SP, Halkjaer-Kristensen J, Simonsen EB. A mechanism for increased contractile strength of human pennate muscle in response to strength training: changes in muscle architecture. J Physiol (Lond ), 2001; 534 (Pt. 2): 613–623
- Goldmann J‑P, Sanno M, Willwacher S, Heinrich K, Brüggemann G‑P. The potential of toe flexor muscles to enhance performance. J Sports Sci, 2013; 31 (4): 424–433
- Goldmann J‑P, Potthast W, Brüggemann G‑P. Athletic training with minimal footwear strengthens toe flexor muscles. Footwear Science, 2013; 5 (1): 19–25
- Brüggemann G, Potthast W, Braunstein B, Niehoff A. Effect of increased mechanical stimuli on foot muscles functional capacity. Proceedings of the 20th Congress of the International Society of Biomechanics, Ohio, 2005
- Finni T, Komi PV, Lepola V. In vivo human triceps surae and quadriceps femoris muscle function in a squat jump and counter movement jump. Eur J Appl Physiol, 2000; 83 (4–5): 416–426
- Komi PV, Fukashiro S, Järvinen M. Biomechanical loading of Achilles tendon during normal locomotion. Clin Sports Med, 1992; 11 (3): 521–531
- Arampatzis A, Karamanidis K, Albracht K. Adaptational responses of the human Achilles tendon by modulation of the applied cyclic strain magnitude. J Exp Biol, 2007; 210 (Pt 15): 2743–2753
- Arampatzis A, Peper A, Bierbaum S, Albracht K. Plasticity of human Achilles tendon mechanical and morphological properties in response to cyclic strain. J Biomech, 2010; 43 (16): 3073–3079
- Rosager S, Aagaard P, Dyhre-Poulsen P, Neergaard K, Kjaer M, Magnusson SP. Load-displacement properties of the human triceps surae aponeurosis and tendon in runners and non-runners. Scand J Med Sci Sports, 2002; 12 (2): 90–98
- Bohm S, Mersmann F, Tettke M, Kraft M, Arampatzis A. Human Achilles tendon plasticity in response to cyclic strain: effect of rate and duration. J Exp Biol, 2014; 217 (Pt 22): 4010–4017
- Arampatzis A, Monte G de, Karamanidis K, MoreyKlapsing G, Stafilidis S, Brüggemann G‑P. Influence of the muscle-tendon unit’s mechanical and morphological properties on running economy. J Exp Biol, 2006; 209 (Pt 17): 3345–3357
- O’Brien TD, Reeves ND, Baltzopoulos V, Jones DA, Maganaris CN. Muscle-tendon structure and dimensions in adults and children. J Anat, 2010; 216 (5): 631–642
- Mersmann F, Bohm S, Schroll A, Boeth H, Duda G, Arampatzis A. Evidence of imbalanced adaptation between muscle and tendon in adolescent athletes. Scand J Med Sci Sports, 2014; 24 (4): e283‑9
- Tan VPS, Macdonald HM, Kim S, Nettlefold L, Gabel L, Ashe MC, McKay HA. Influence of physical activity on bone strength in children and adolescents: a systematic review and narrative synthesis. J Bone Miner Res, 2014; 29 (10): 2161–2181
- Jones HH, Priest JD, Hayes WC, Tichenor CC, Nagel DA. Humeral hypertrophy in response to exercise. J Bone Joint Surg Am, 1977; 59 (2): 204–208
- King JW, Brelsford HJ, Tullos HS. Analysis of the pitching arm of the professional baseball pitcher. Clin Orthop Relat Res, 1969; 67: 116–123
- Weatherholt AM, Warden SJ. Tibial Bone Strength is Enhanced in the Jump Leg of Collegiate-Level Jumping Athletes: A Within-Subject Controlled Cross-Sectional Study. Calcif Tissue Int, 2016; 98 (2): 129–139
- Colletti LA, Edwards J, Gordon L, Shary J, Bell NH. The effects of muscle-building exercise on bone mineral density of the radius, spine, and hip in young men. Calcif Tissue Int, 1989; (45): 12–14
- Kemmler W, Engelke K, Baumann H, Beeskow C, Stengel S von, Weineck J, Kalender WA. Bone status in elite male runners. Eur J Appl Physiol, 2006; 96 (1): 78–85
- Gusi N, Raimundo A, Leal A. Low-frequency vibratory exercise reduces the risk of bone fracture more than walking: a randomized controlled trial. BMC Musculoskelet Disord, 2006; 7: 92
- Rubin CT, Lanyon LE. Regulation of bone formation by applied dynamic loads. J Bone Joint Surg Am, 1984; 66 (3): 397–402
- Avin KG, Bloomfield SA, Gross TS, Warden SJ. Biomechanical aspects of the muscle-bone interaction. Curr Osteoporos Rep, 2015; 13 (1): 1–8
- Orava S, Puranen J, Ala-Ketola L. Stress Fractures Caused by Physical Exercise. Acta Orthopaedica Scandinavica, 1978; 49 (1): 19–27
- Pouilles JM, Bernard J, Tremollières F, Louvet JP, Ribot C. Femoral bone density in young male adults with stress fractures. Bone, 1989; 10 (2): 105–108
- Goldmann J‑P, Sanno M, Willwacher S, Heinrich K, Brüggemann G‑P. The potential of toe flexor muscles to enhance performance. J Sports Sci, 2013; 31 (4): 424–433
- Goldmann J‑P, Potthast W, Brüggemann G‑P. Athletic training with minimal footwear strengthens toe flexor muscles. Footwear Science, 2013; 5 (1): 19–25
- Frank CB. Ligament Healing: Current Knowledge and Clinical Applications. J Am Acad Orthop Surg, 1996; 4 (1): 74–83
- Cabaud HE, Chatty A, Gildengorin V, Feltman RJ. Exercise effects on the strength of the rat anterior cruciate ligament. Am J Sports Med, 1980; 8 (2): 79–86
- Tipton CM, James SL, Mergner W, Tcheng TK. Influence of exercise on strength of medial collateral knee ligaments of dogs. Am J Physiol, 1970; 218 (3): 894–902
- Tipton CM, James SL, Mergner W, Tcheng TK. Influence of exercise on strength of medial collateral knee ligaments of dogs. Am J Physiol, 1970; 218 (3): 894–902
- Noyes FR. Functional properties of knee ligaments and alterations induced by immobilization: a correlative biomechanical and histological study in primates. Clin Orthop Relat Res, 1977; (123): 210–242
- Eckstein F, Faber S, Mühlbauer R, Hohe J, Englmeier K‑H, Reiser M, Putz R. Functional adaptation of human joints to mechanical stimuli. Osteoarthr Cartil, 2002; 10 (1): 44–50
- Jones G, Glisson M, Hynes K, Cicuttini F. Sex and site differences in cartilage development: a possible explanation for variations in knee osteoarthritis in later life. Arthritis Rheum, 2000; 43 (11): 2543–2549
- Gratzke C, Hudelmaier M, Hitzl W, Glaser C, Eckstein F. Knee cartilage morphologic characteristics and muscle status of professional weight lifters and sprinters: a magnetic resonance imaging study. Am J Sports Med, 2007; 35 (8): 1346–1353
- Bleuel J, Zaucke F, Brüggemann G‑P, Heilig J, Wolter M‑L, Hamann N, Firner S, Niehoff A. Moderate cyclic tensile strain alters the assembly of cartilage extracellular matrix proteins in vitro. J Biomech Eng, 2015; 137 (6): 61009
- Vasan N. Effects of physical stress on the synthesis and degradation of cartilage matrix. Connect Tissue Res, 1983; 12 (1): 49–58
- Little CB, Ghosh P. Variation in proteoglycan metabolism by articular chondrocytes in different joint regions is determined by post-natal mechanical loading. Osteoarthr Cartil, 1997; 5 (1): 49–62
- Arokoski JP, Jurvelin JS, Väätäinen U, Helminen HJ. Normal and pathological adaptations of articular cartilage to joint loading. Scand J Med Sci Sports, 2000; 10 (4): 186–198