Epidemiologie und Entstehung der Arthrose
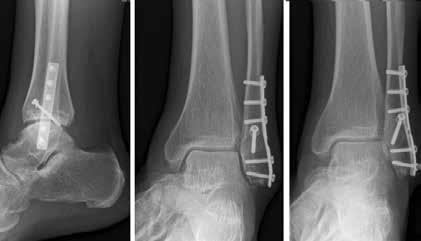
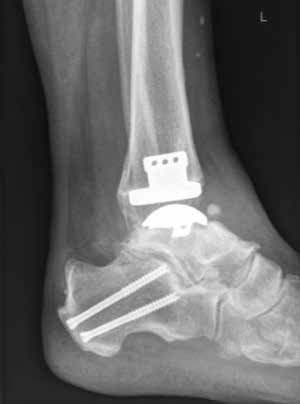
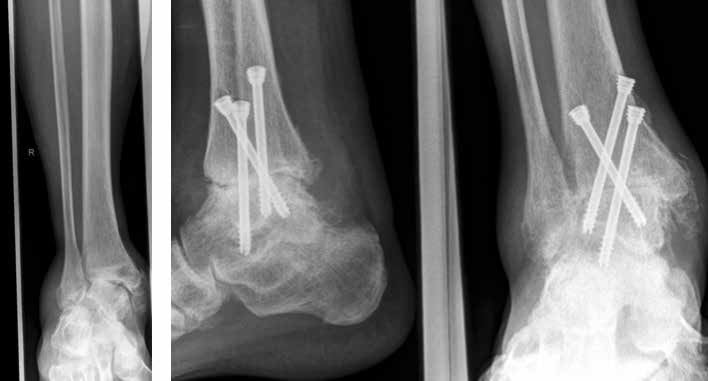
Arthrose stellt weltweit die häufigste Gelenkerkrankung dar und hat damit einen wesentlichen sozioökomischen Einfluss 1. Während 15 % der weltweiten erwachsenen Bevölkerung von Arthrose betroffen sind 2, leiden lediglich 1 % der Bevölkerung 3 bzw. 4,4 % der Arthrosepatienten 4 an einer Arthrose des oberen Sprunggelenks (OSG). Circa 80 % der Arthrosen des OSG sind ursächlich als posttraumatisch einzustufen, nur 9 % gelten als primäre Arthrosen. Dies unterscheidet die Arthrose des OSG von Coxarthrose (58 % primär) und Gonarthrose (67 % primär). 13 % treten im Rahmen systemischer Erkrankungen wie rheumatoider Arthritis, Hämochromatose, Hämophilie oder Osteonekrose auf 5 6. Die posttraumatische Arthrose des OSG wird besonders nach in Achsabweichung verheilten Frakturen (Pilon-tibiale-Frakturen, Weber-A‑, ‑B- und ‑C-Frakturen; Abb. 1a), Bandinstabilitäten des lateralen und medialen Bandapparates des OSG (Lig. fibulotalare anterius, Lig. fibulocalcaneare, Lig. fibulotibiale posterius etc.), nach rezidivierenden ligamentären Verletzungen sowie nach Gelenkverletzungen mit Knorpelschaden, „flake fractures“ oder „bone bruise“ beobachtet 7. Daher ist bei den vergleichsweise häufigen Weber-B- und ‑C-Frakturen die osteosynthetische Versorgung mittels Drittelrohrplatte und Zugschraube (Abb. 1b) sowie ggf. Syndesmosennaht mit Implantation einer Stellschraube mit millimetergenauer Reposition essentiell, um langfristig die Funktionsfähigkeit des OSG aufrechtzuerhalten und eine frühzeitige posttraumatische Arthrose zu verhindern 8.
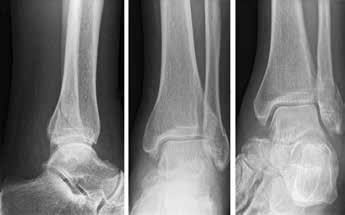
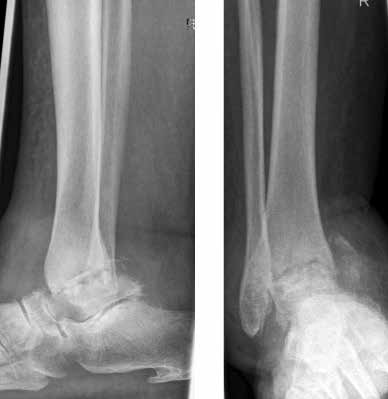
Das besondere Merkmal der Arthrose des OSG ist das relativ junge Alter der Patienten im Vergleich zur Arthrose anderer Gelenke der unteren Extremität, da die meistens zugrunde liegenden Traumata Sportunfälle sind. Zusätzlich werden ein schnellerer Funktionsverlust des Gelenks und eine beschleunigte Progression der Erkrankung bis zum Erreichen des Endstadiums (innerhalb von 10 bis 20 Jahren) beobachtet 9 (Abb. 2a). Negativ beeinflussende Faktoren für die Entwicklung einer Arthrose des OSG sind: Achsfehlstellungen oder angeborene Deformitäten der unteren Extremität, Muskeldysbalance 10, angeborene oder erworbene ligamentäre Fehlentwicklungen, Alter, Geschlecht und genetische Prädisposition 11.
Der Knorpel des OSG weist einige Besonderheiten auf: Die Fläche am OSG umfasst mit 350 mm² ca. ein Drittel der Gelenkfläche am Kniegelenk (1120 mm²) oder Hüftgelenk (1100 mm²), wird jedoch ebenso einer Kraft von 500 N ausgesetzt wie die beiden anderen Gelenke 12 13. Im Gegensatz zum Knorpelgewebe des Knie- und Hüftgelenks konnte in molekularbiologischen Studien gezeigt werden, dass im Knorpel des OSG eine höhere Dichte an Glycosaminglycansulfat, eine höhere Elastizität und eine höhere hydraulische Permeabilität und damit eine höhere Verformungsfähigkeit unter Krafteinfluss besteht 14. Die Organisation der Chondrozyten in den unterschiedlichen Gelenkknorpeln der unteren Extremität belegt die Theorie, dass er im OSG dünner sein kann (OSG: 1–1,62 mm; Hüfte: 1,35–2 mm; Knie: 1,69–2,55 mm), weil (1) die Gelenkfläche deutlich kleiner und (2) der Knorpel des OSG metabolisch aktiver ist 15 16.
Prinzipiell entsteht eine Arthrose durch das Einwirken unphysiologischer Kräfte auf den hyalinen Knorpel am Gelenk. Hierdurch kommt es zu Knorpeleinrissen und vermehrtem Knorpelabrieb sowie zur Freisetzung lysosomaler Enzyme und zu Knorpeldetritus (breiige und krümelige Knorpelreste). Dieser Prozess führt zur Entzündung der Gelenkinnenhaut (Synovialitis) und führt zu einer Reizergussbildung. Der chronische Gelenkerguss, der auch bei Systemerkrankungen wie der rheumatoiden Arthritis auftritt, führt wie nach einer infektiösen Entzündung ebenfalls zur Knorpelschädigung. Das meist erhebliche Trauma sowie die Tatsache, dass der Knorpel vergleichsweise dünn ist, führen zu einer beschleunigten Progression der Arthrose des OSG, während die nichttraumatischen Arthroseformen einen eher langsameren Verlauf aufweisen 17.
Klinik und Diagnostik der Arthrose
Die generellen Symptome bestehen aus Schmerzen in der Gelenkregion, Bewegungseinschränkung und meist auch Umfangsvermehrung der Gelenkregion aufgrund rezidivierender Gelenkergüsse. Damit werden die Funktionalität des Sprunggelenks und die Belastbarkeit der unteren Extremität derart reduziert, dass neben der verminderten Lebensqualität auch die Risiken durch Immobilisation steigen 18.
Die Arthrose des OSG kann klinisch in ein Frühstadium, ein mittleres Stadium und ein Endstadium eingeteilt werden:
- Im Frühstadium gibt der Patient einen Anlaufschmerz sowie meist morgendliche Steifigkeit an. Des Weiteren besteht eine Minderelastizität des Sprunggelenkes.
- Im mittleren Stadium bestehen beginnende Veränderungen der periartikulären Weichteile mit verstrichenen Gelenkkonturen sowie Druckschmerzhaftigkeit. Die Patienten zeigen eine schmerzhafte endgradige Beuge- und Streckhemmung mit beginnender Bildung von Kontrakturen.
- Im Endstadium sind die Sprunggelenkkonturen aufgrund der Kapselschwellung und der Ergussbildung aufgehoben und gehen meist mit einer Überwärmung des Gelenkes im Sinne einer aktivierten und nichtbakteriell entzündlichen Arthrose einher. Es besteht eine Instabilität sowie eine ausgeprägte schmerzhafte Bewegungseinschränkung. In diesem Stadium bestehen die Schmerzen meist bei jeder Bewegung und treten auch in Ruhe auf. Insbesondere der nächtliche Schmerz wird als sehr unangenehm beschrieben.
Primäres radiologisches Verfahren ist die konventionelle Röntgendiagnostik des oberen Sprunggelenkes unter Belastung mit dem eigenen Körpergewicht. Hierbei können bereits unterschiedlich stark ausgeprägte Gelenkdestruktionen diagnostiziert werden. Neben der Gelenkspaltverschmälerung können Osteophytenbildung und subchondrale Sklerosierung sowie Zystenbildung erhoben werden. Die Klassifikation nach Morrey/Wiedemann basiert auf diesen radiologischen Befunden 19:
- Osteophyten, Sklerose
- Gelenkspaltverschmälerung
- subchondraler Knochenkontakt
- Ankylose
Das sensitivste und spezifischste bildgebende nichtinvasive Verfahren ist die Magnetresonanztomographie (MRT). Diese wird meist nur bei unsicheren Diagnosestellungen angewandt, ermöglicht aber zusätzlich die Beurteilung der Weichgewebe und des Knorpels; bei spezifischen Protokollen können Informationen über Morphologie und biochemische Prozesse erhoben werden. Dies kann insbesondere bei der gezielten Therapie lokalisierter osteochondraler Läsionen von Nutzen sein 20 21.
Zur genaueren Untersuchung der Knochenstruktur kann eine Computertomographie durchgeführt werden. In ausgewählten Fällen kann auch eine SPECT-Computertomographie sinnvoll sein, mit deren Hilfe die Morphologie mit biochemischen Informationen korreliert werden kann und aktive degenerative Prozesse in komplexen Gelenkregionen des OSG dargestellt werden können.
Therapie
Bei der OSG-Arthrose sollte sich die Therapieentscheidung primär an den klinischen Symptomen orientieren. Hierbei sind Schmerzintensität, Funktionseinschränkungen, degenerative Gelenkdestruktion, Achsfehlstellungen der unteren Extremität, ligamentärer Status und die Knochenqualität neben dem Alter und systemischen Vorerkrankungen entscheidend.
Konservative Therapie
Der primäre therapeutische Ansatz bei Arthrosen ist immer ein nichtoperativer Behandlungsversuch. Die Indikation für einen konservativen Ansatz besteht bei Patienten mit noch milderen Arthroseausprägungen. Sie weisen meist beginnende Schmerzen und geringe Funktionseinschränkungen auf. Voraussetzung insbesondere für physiotherapeutische Ansätze sowie Einlagen- und Orthesenversorgung sind eine adäquate Achsstellung der unteren Extremität und eine gute Knochenqualität. Ziel dabei ist es, die Symptome zu lindern und die aktuelle Funktionsfähigkeit möglichst lange aufrechtzuerhalten.
Physiotherapie
Physiotherapeutische Verfahren dienen der Beweglichkeitsverbesserung durch z. B. manuelle Therapie und „deep frictions“, Normalisierung des Muskeltonus durch z. B. Massagen, Verbesserung der Koordination und des Bewegungsmusters durch z. B. neurophysiologische krankengymnastische Techniken sowie Muskelkräftigung durch z. B. Krankengymnastik an Geräten. Diese Maßnahmen dienen der Optimierung des aktuellen Status des Patienten und der Vorbereitung auf eine zukünftig ggf. folgende operative Maßnahme.
Die supportive physikalische Therapie kann durch Hemmung der Entzündungsreaktion (Kälte), Senkung des Muskeltonus (Wärme), Verbesserung der Gewebeernährung, Abbau von Schlackenprodukten und Erhöhung der Schmerzschwelle langfristig die Symptome lindern und die Gelenkfunktion zunächst im Status quo halten.
Bei der Elektrotherapie werden verschiedene Ströme appliziert. Folgende Wirkungen sollen erzielt werden: Durchblutungsförderung, Schmerzlinderung, Entzündungshemmung und Muskelstärkung. Dies geschieht mittels Anwendung von Iontophorese, diadynamischen Strömen, transkutaner elektrischer Stimulation (TENS), Interferenzstromapplikation, Hochfrequenzströmen und Ultraschall.
Medikamentöse Therapie
Mit der Stoffgruppe der sog. Antiphlogistika wird eine Entzündungshemmung und dadurch Schmerzhemmung erreicht. Dies geschieht durch COX1-Hemmer (z. B. Diclofenac oder Ibuprofen) oder COX-2-Hemmer (z. B. Celecoxib). Enzymatische Entzündungshemmung kann z. B. durch Bromelaine, Vitamin E oder Brennnesselextrakt erreicht werden. Kortisonpräparate kommen nur bei aktivierten entzündlichen Arthrosen kurzfristig zum Einsatz. Diese werden meist als Gelenkinfiltration angewandt, können dort direkt entzündungshemmend an der Synovia wirken, werden aber aufgrund der hohen Potenz an schwerwiegenden Nebenwirkungen am Gelenkknorpel selten und dann kurzfristig appliziert. Es besteht Evidenz für eine Funktionsverbesserung und Schmerzlinderung als kurzfristige Symptombesserung von ca. einer Woche 22.
Myotonolytika werden bei der mechanisch dekompensierten Arthrose zur Muskelentspannung verabreicht. Dies geschieht aufgrund schmerzhaft verkürzter und verkrampfter Muskulatur.
Bei sehr starken arthrosebedingten Schmerzzuständen erfolgt zusätzlich die Gabe reiner Analgetika. Gemäß dem WHO-Stufenschema 23 erfolgt die Gabe bedarfsgerecht in folgenden Stufen:
- nichtopioides Analgetikum, z. B. nichtsteroidale Antiphlogistika und/ oder Metamizol;
- schwaches Opioid, z. B. Tramadol, Tilidin;
- starkes Opioid, z. B. Morphin, Hydromorphon oder Oxycodon.
Zur Verbesserung des dekompensierten Knorpelstoffwechsels können Nahrungsergänzungsmittel, die mit der Grundsubstanz des Knorpels biochemisch eng verwandt sind, z. B. Glucosaminsulfat und Chondroitinsulfat, substituiert werden. Unter der Anwendung derartiger sog. Chondroprotektiva kommt es oft zu einer Symptomlinderung, obwohl darüber keine gesicherte Evidenz vorliegt. Intraartikuläre Injektionen mit z. B. Hyaluronsäure (Gelenkflüssigkeitsersatz und Knorpelbausteine) oder „platelet-rich plasma“ (PRP) zeigen eine signifikante Verbesserung der Gelenkmobilisation und Schmerzreduktion 24 25. Da es erst zu einem verspäteten schmerzlindernden Effekt kommt, werden Kombinationen von Hyaluronsäure mit Kortisonpräparaten wie Triamzinolon vorgeschlagen 26,- um eine unmittelbar eintretende Schmerzreduktion und Entzündungshemmung zu erreichen. Eine signifikante Verbesserung konnte in der Kombination jedoch nicht erreicht werden 27. Langfristig kann die Injektion von Hyaluronsäure in das OSG bei bestehender OSG-Arthrose die Schmerzen signifikant über den 6‑Wochen-Zeitraum reduzieren 28 29 und die Mobilisation um ca. 20 % verbessern 30 31. Es besteht jedoch aktuell noch kein Konsens über Menge, Anzahl und Dauer der intraartikulären Injektionen von Hyaluronsäure.
Technische Orthopädie
Der Vorteil orthopädietechnischer Therapiemaßnahmen ist die vollständige Reversibilität ohne Nebenwirkungen. Sie können durch folgende Wirkweisen die Arthrosebeschwerden verbessern:
- Stoßdämpfung (Abb. 3);
- Achsenkorrektur, z. B. Schuhranderhöhung oder achskorrigierende Knieorthese;
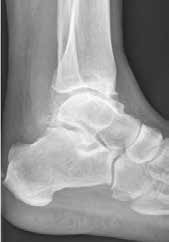
- lokale Entlastung, z. B. gezielt entlastende Orthesen mit oder ohne Abrollhilfe (Abb. 4) oder Einsatz des Handstocks;
- Ruhigstellung, z. B. durch Orthesen und Bandagen mit Ruhigstellung des Gelenkes im schmerzfreien Bewegungsintervall;
- Kälteschutz-Bandagen, z. B. aus einem Thermomaterial wie Neopren zum Kälteschutz je nach Wetterfühligkeit.
Insgesamt sollte durch Orthesen eine Neutralposition des Gelenks unter Mobilisation wieder erreicht oder erhalten werden. Auch Gelenkinstabilitäten des OSG können bei bestehender OSG-Arthrose durch Orthesen gezielt behandelt werden 32.
Operative Therapie
Kann durch konservative Therapiemaßnahmen kein suffizienter Erfolg erreicht werden, stehen mehrere operative Maßnahmen zur Verfügung, die indikationsgerecht einzusetzen sind. Entscheidend für die Auswahl des geeigneten Verfahrens sind auch hier die Symptome des Patienten.
Bei moderater Arthroseausprägung mit täglichem Schmerz von relevanter Intensität und messbaren Funktionseinschränkungen bei gleichzeitig guter Knochenqualität, ggf. Gelenkinstabilität und Achsfehlstellung kann bei Patienten jünger als 65 Jahre ohne systemische Vorerkrankungen ein gelenkerhaltender, sanierender operativer Eingriff durchgeführt werden 33. Das Ziel ist dabei die biomechanische Wiederherstellung der Gelenkkongruenz, die Stabilisierung des Gelenks und die Reduktion des progredient degenerativen Prozesses. Hierzu stehen Gelenkdebridement, Arthroskopie mit Entfernung freier Gelenkkörper und osteophytärer Anbauten sowie Mikrofrakturierung, Osteotomien zur Achskorrektur, autologer osteochondraler Transfer und Chondrozytentransplantation zur Verfügung.
Arthroskopie und Gelenkdebridement
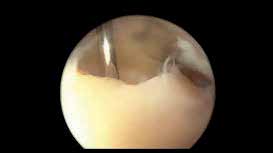
Das Sprunggelenk ist mittels Arthroskopie gut zu erreichen. Durch die oft posttraumatisch bedingten lokalen Knorpelschäden oder Osteonekrosen kann primär eine alleinige arthroskopische Therapie erfolgreich sein. Das reine Gelenkdebridement wird jedoch kontrovers diskutiert und zeigt analog zu den wissenschaftlichen Untersuchungen am Kniegelenk zur Gelenklavage bei Gonarthrose keine langfristige Schmerzlinderung 34. Dagegen kann beim Vorliegen ätiologisch bedingter degenerativer Gelenkveränderungen wie osteophytären Anbauten, freien Gelenkkörpern, vernarbter und hypertroph-entzündlicher Synovia oder fokalen osteochondralen Defekten (Abb. 5) durch das gezielte operative Gelenkdebridement eine signifikante und langfristige Schmerzreduktion erreicht werden 35.
Auch bei Osteophyten an der vorderen Tibiakante ist die arthroskopische Abtragung die Methode der Wahl. Bei dieser Form des Impingements werden neben dem Zelldetritus störende mechanische Knochenanbauten oder Weichgewebe wie eine traumatische mediale Plica entfernt und weisen postoperativ signifikant verbesserte Ergebnisse bzgl. Schmerzreduktion und Funktion auf 36. Beim Abtragen von vorderen Tibiakantenosteophyten darf nur so viel abgetragen werden, dass daraus keine Instabilität des Sprunggelenks resultiert.
Bandplastische Operation
Die OSG-Arthrose geht häufig mit rezidivierenden Bandverletzungen und einer daraus folgenden Bandinstabilität des lateralen OSG (Lig. fibulotalare anterius und fibulocalcaneare sowie Lig. fibulotalare posterius) nach Supinationstrauma einher. Die Instabilität ist entweder ein Resultat aus rezidivierenden Traumata, einer Incompliance bzgl. einer Orthesenversorgung oder einer Instabilität folgend aus vollständigen Bandrupturen. Bei 10 % der Patienten entstehen Instabilitäten nach Außenbandrupturen mit Instabilitätsgefühl und Schmerzen. Sind konservative Therapiemaßnahmen ausgereizt, bietet sich die Stabilisierung des OSG mittels Broström-Technik bzw. Second-Stage-Naht an. Weitere bandplastische Verfahren sind z. B. die Periostlappenplastik und die Sehnentransposition der Sehne des M. peroneus tertius oder des M. semitendinosus.
Mikrofrakturierung
Bei lokalen Läsionen, die nicht größer als 1,5 cm² sind 37, kann nach Debridement des kalzifizierten defektknorpeligen Überzugs der Läsion durch das Einbringen von Bohrlöchern gezielt Kontakt zum subchondralen Knochenmark hergestellt werden, damit mesenchymale Stammzellen in die Läsion einwandern können 38. Da bei diesem Verfahren die Gefahr einer subchondralen Zystenbildung, eines unvollständigen Defektverschlusses und der Entstehung von Osteophyten in der Läsion besteht 39, gibt es erste Bestrebungen, direkt Knochenmark mit mesenchymalen Stammzellen aus einer Knochenmarksbiopsie anderer Lokalisation zu entnehmen und auf die Defektstelle aufzubringen 40. Bei Osteonekrose am Talus ist die Implantation einer AMIC-Membran (AMIC = Autologe Matrixinduzierte Chondrogenese) eine weitere Alternative zur Mikrofrakturierung.
Osteochondraler Transfer
Bei Läsionen bis 2 cm² Größe, die entweder rein kartilaginös sind oder eine subchondrale Komponente aufweisen (z. B. Osteochondrosis dissecans), können osteochondrale Zylinder aus der nichttragenden Zone des Kniegelenks entnommen und in die Läsion transferiert werden 41 42. Hierfür wird meist die interkondyläre Region, lateral der Trochlea, unmittelbar proximal der Belastungszone des lateralen Kondylus verwendet.
Chondrozytentransplantation
Die Chondrozytentransplantation scheint in Zukunft die Methode der Wahl zu werden. Hierfür werden zunächst Chondrozyten über 6 Wochen in vitro aus einem Knorpelbiopsat angezüchtet und anschließend auf die Läsion transplantiert. Dabei ist jedoch entscheidend, dass sich die Knorpelstruktur des Sprunggelenks deutlich von der anderer Gelenke unterscheidet. Bei größeren Defekten als 2,3 cm² 43 ist die Chondrozytentransplantation die Therapie der Wahl. Sie stellt einen sicheren und effektiven Behandlungspfad bei Knorpeldefekten des Talus dar 44 45. Dabei muss zuvor genauestens der Defekt charakterisiert werden – inklusive der Tiefe und der Lokalisation. Die derzeit verhältnismäßig hohen Kosten begründen sich durch den hohen logistischen und molekularbiochemischen Aufwand. Bei entsprechend positivem Ergebnis für den Funktionserhalt des oberen Sprunggelenks sollte der Aufwand jedoch bei dem vergleichsweise jungen Patientenkollektiv vor dem Hintergrund des hohen erfolgversprechenden Potenzials aufgewendet werden.
Achskorrektur
Bei Achsfehlstellung (Valgus- oder Varusabweichung) der unteren Extremität in Verbindung mit OSG-Arthrose kann eine achskorrigierende Osteotomie die Arthrodese oder Endoprothetik verhindern 46. Hierzu ist die sorgfältige Auswahl der Patienten, die für diesen Eingriff in Frage kommen, für das Ergebnis essentiell. Um das „center of rotation and axis“ zu ermitteln, ist stets eine Ganzbeinstand-Röntgenaufnahme notwendig.
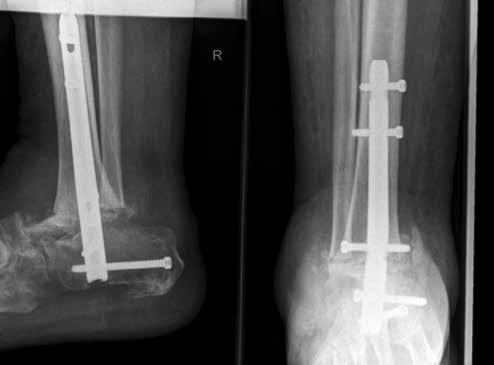
Weiterhin führen Fehlstellungen im Rückfuß zu statischen und dynamischen Überlastungen, da sich bei Varusfehlstellung (Abb. 2a) das Zentrum der Kraftübertragung nach medial und bei Valgusfehlstellungen nach lateral verlagert 47. Die Achillessehne wirkt durch ihren Zug zusätzlich invertierend bei Varusfehlstellung und evertierend bei Valgusfehlstellung auf den Rückfuß ein 48. Möglichkeiten der operativen Therapie sind entweder die einfache Umstellungsosteotomie der distalen Tibia und Fibula als rein supramalleoläre Osteotomie mit dem Ziel einer Überkorrektur des distalen Tibiagelenkflächenwinkels von 3 bis 5° 49 oder die kombinierte Osteotomie an Bein und Rückfuß (Abb. 2b) mit oder ohne Weichteileingriff je nach Topographie der Achsfehlstellung 50. Weitere Möglichkeiten sind die Calcaneusosteotomie, meist als ergänzende Osteotomie nach Wiederherstellung der korrekten Achse (Abb. 2b) im Sinne einer Verschiebeosteotomie, um die Zugrichtung der Achillessehne zu zentrieren, und die Osteotomie der medialen Säule, die bei durch Valgusfehlstellung induzierter Abflachung des medialen Längsgewölbes indiziert sind. Hierbei werden zusätzlich korrigierende Arthrodesen des I. Strahls (Naviculo-cuneiforme-Gelenk, Tarsometatarsalgelenk) oder plantarflektierende Osteotomien (Cuneiforme I oder Metatarsale I) durchgeführt 51.
Voraussetzung für eine tatsächliche Verbesserung der Symptomatik ist eine präzise Achskorrektur und Wiederherstellung der Gelenkkongruenz. Erfolgreiche Schmerzlinderung, Verbesserung der Gelenkfunktion und Dezeleration des degenerativen Prozesses können erreicht werden, wenn es gelingt, die krafttragende Zone des Gelenks vom Defektareal in Richtung gesunder Knorpel zu verschieben bzw. eine biomechanisch korrekte Achse wiederherzustellen 52 53. Die postoperative physiotherapeutische Mitbehandlung beeinflusst das Gesamtergebnis ebenso wie rehabilitative sportliche Belastungen und gezielte Mobilisation nach erfolgter operativer Achskorrektur 54.
Bei der durch eine Rückfußfehlstellung induzierten OSG-Arthrose sind folgende Ziele zu erreichen:
- korrektes Rückfußalignment wiederherstellen;
- Kraftübertragungsachse im OSG zentrieren;
- Richtung des Kraftvektors des M. triceps surae normalisieren 55.
Endoprothetik des OSG
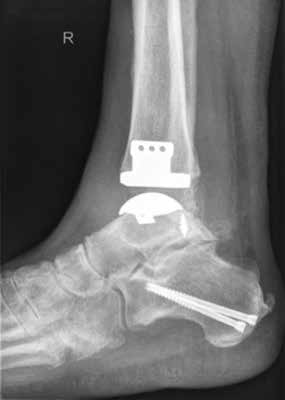
Die Indikation zur endoprothetischen Versorgung einer OSG-Arthrose ist gründlich zu stellen. Darunter fällt die schwere Arthrose jeglicher Ätiologie mit täglich intensiven Schmerzen, hochgradigem Gelenkfunktionsverlust und Gelenkdestruktion. Voraussetzungen sind eine gute Knochenqualität sowie mittleres Alter ohne schwere systemische Vorerkrankungen. Auch bei der Implantation von Endoprothesen des oberen Sprunggelenkes ist es wichtig, bestehende Achsfehlstellungen entweder in gleicher Sitzung oder zuvor zu korrigieren. Sofern nach Achskorrektur die Versorgung mittels einer Endoprothese noch notwendig ist, soll damit die Funktionsfähigkeit des Gelenks, eine Schmerzeliminierung und eine Verbesserung der Lebensqualität erreicht werden (Abb. 6). Kontraindikationen sind neben den bereits oben genannten: bestehende Osteonekrosen, periphere arterielle Verschlusskrankheit, periphere Neuropathie, bestehende oder stattgehabte Gelenkinfektion und schwere Bandinstabilität 56.
Im Vergleich zur Endoprothetik des Hüft- und Kniegelenks bestehen höhere Komplikationsraten bei der Endoprothese des Sprunggelenks. Intraoperativ sind dies meist operationstechnische Komplikationen bei der Osteotomie der Malleoli, beim Sägen oder beim Positionieren der Prothesenkomponenten 57. Postoperativ sind dies vornehmlich Wunddehiszenzen und Infektionen 58, während im Langzeitergebnis aseptische Prothesenlockerung, periprothetische Stressfrakturen und Retraktion der Gelenkkapsel sowie der periartikulären Weichteile auftreten 59.
Arthrodese
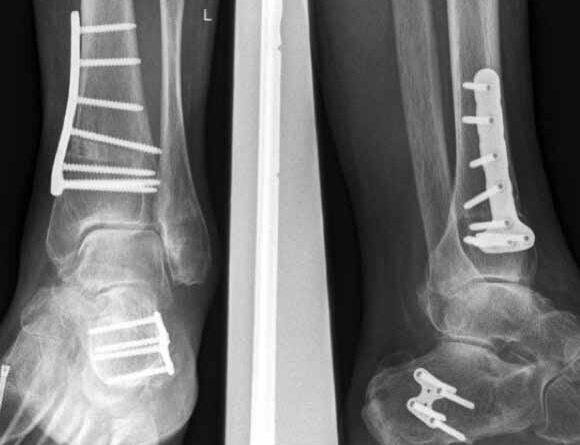
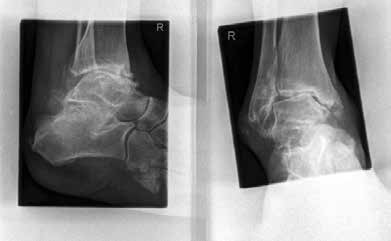
In ausgeprägten Fällen von Arthrose, oft mit Instabilität im oberen Sprunggelenk (Abb. 7), schwerwiegendem Funktionsverlust und starker Schmerzausprägung, ist nach wie vor die Arthrodese die Therapieoption der Wahl. Dadurch sollen die Achskongruenz wiederhergestellt und die Schmerzen eliminiert werden. Gleichzeitig bedeutet dieser Schritt jedoch, dass keine weitere operative Eskalation mehr möglich ist. Meist kommen die tibiotarsale oder tibiatalar-calcaneare Arthrodese zum Einsatz. Entscheidend für die Wahl des Arthrodeseverfahrens sind der Schweregrad der degenerativen Gelenkveränderungen, der Schmerz und die Stellungsverhältnisse im Subtalargelenk.
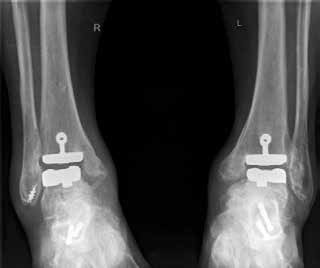
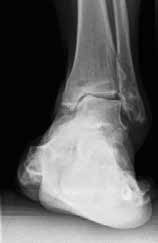
Eine Sonderform stellt die Talusnekrose dar, die ebenfalls zu schwerwiegenden Destruktionen und Achsfehlstellungen im OSG führt. Das Mittel der Wahl im fortgeschrittenen Stadium (Abb. 8a) ist hier die Arthrodese des OSG und des unteren Sprunggelenks (USG) mittels Arthrodesennagel (Abb. 8b).
Während der Eingriff meist in einer guten Funktion und einer Schmerzeliminierung resultiert, muss jedoch im Laufe der Zeit mit Anschlussarthrosen gerechnet werden. Aufgrund dessen sollten alle Patienten nach Arthrodese des oberen Sprunggelenkes mit Einlagen und Abrollhilfen am Konfektionsschuh (Abb. 4) versorgt werden. Ziel ist es, dadurch ein harmonisches Gangbild zu erreichen und die einwirkenden Kräfte auf die Anschlussgelenke zu minimieren.
Zusammenfassung
Die Besonderheit der Arthrose des oberen Sprunggelenks (OSG) ist das vergleichsweise junge Patientengut und der hohe Anteil traumaassoziierter Ätiologie. Langfristige und frühzeitige sozioökonomische Schäden sowie frühzeitige Reduktion der Lebensqualität sind die Folge. Daher ist eine differenzierte Therapie vom Arthrosestadium, der Ätiologie, Achsstellung der unteren Extremität, Bandstabilität, Knochenqualität, dem Alter und von der Symptomatik abhängig. Das initiale Therapiekonzept ist zunächst auf ein möglichst hohes Aktivitätslevel der Patienten fokussiert. Durch konservative Therapiemaßnahmen wie Krankengymnastik, orthopädietechnische Maßnahmen und medikamentöse Therapie kann die Arthrose des OSG in ihrer Progredienz verlangsamt und führende Symptome wie der Schmerz lange suffizient behandelt werden. Die durch eine meist zugrunde liegende traumatische Ätiologie bestehenden Bandinstabilitäten und Achsfehlstellungen indizieren jedoch oft das frühe operative Vorgehen. Als einfache operative Maßnahme können durch ein arthroskopisches Gelenkdebridement des OSG störendes und schmerzhaftes Gewebe entfernt und die Funktionalität des OSG deutlich verbessert werden. Die Evidenz von Knorpeleingriffen zeigt die Tendenz, dass AMIC-Implantation oder Chondrozytentransplantation die Methoden der Zukunft sein werden. Wichtig ist jedoch das Ausbalancieren des Sprunggelenkes, sodass die Achsen korrekt stehen und die Vektorkräfte optimal auf das Sprunggelenk einwirken können. Bei höhergradigen Arthroseformen ist eine endoprothetische Versorgung indiziert. Hierzu müssen jedoch korrekte Achsverhältnisse und stabile Bandstrukturen vorliegen. Als Ultima Ratio steht die Arthrodese bei schweren Arthrosen und Instabilitäten mit guten Langzeitergebnissen zur Verfügung.
Für die Autoren:
Dr. med. Christopher Spering
Klinik für Orthopädie und Unfallchirurgie Abteilung für Unfallchirurgie, Plastische und Wiederherstellungschirurgie der Universitätsmedizin Göttingen
Robert-Koch-Straße 40
37075 Göttingen
christopher.spering@med.uni-goettingen.de
Begutachteter Beitrag/reviewed paper
Spering C, Stinus H. Arthrose des oberen Sprunggelenks. Orthopädie Technik, 2016; 67 (4): 70–76
- Vergleichende Prüfung konventioneller und additiv gefertigter Prothesenschäfte in Anlehnung an DIN EN ISO 10328:2016 — 10. März 2026
- Easypreg – ein Faserverbundwerkstoff zum Tiefziehen — 9. März 2026
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- Buckwalter JA, Saltzman C, Brown T. The impact of osteoarthritis: implications for research. Clin Orthop Relat Res, 2004; 427 Suppl.: S6-S15
- De Campos GC, Rezende MU, Pailo AF, Frucchi R, Camargo OP. Adding triamcinolone improves viscosupplementation: a randomized clinical trial. Clin Orthop Relat Res, 2013; 471 (2): 613–620
- Ogilvie-Harris D, Sekyi-Otu A. Arthroscopic debridement for the osteoarthritic ankle. Arthroscopy, 1995; 11 (4): 433–436
- Buckwalter JA, Saltzman C, Brown T. The impact of osteoarthritis: implications for research. Clin Orthop Relat Res, 2004; 427 Suppl.: S6-S15
- Brown TD, Johnston RC, Saltzman CL, Marsh JL, Buckwalter JA. Posttraumatic osteoarthritis: a first estimate of incidence, prevalence, and burden of disease. J Orthop Trauma, 2006; 20 (10): 739–744.
- Valderrabano V, Horisberger M, Russell I, Dougall H, Hintermann B. Etiology of ankle osteoarthritis. Clin Orthop Relat Res, 2009; 467 (7): 1800–1806
- Hendren L, Beeson P. A review of the differences between normal and osteoarthritis articular cartilage in human knee and ankle joints. Foot (Edinb), 2009; 19 (3): 171–176
- Spering C, Lesche V, Dresing K. Osteosynthese von Sprunggelenksfrakturen Typ Weber‑B mit der Drittelrohrplatte und Syndesmosenrekonstruktion. Oper Orthop Traumatol, 2015; 27 (4): 317–333
- Valderrabano V, Horisberger M, Russell I, Dougall H, Hintermann B. Etiology of ankle osteoarthritis. Clin Orthop Relat Res, 2009; 467 (7): 1800–1806
- Peyron JG. The epidemiology of osteoarthritis. In: Moskowitz RW, Howell DS, Goldberg VM, Mankin HJ (eds). Osteoarthritis. Diagnosis and Treatment. Philadelphia, PA: WB Saunders, 1984: 9–27
- Saltzman CL, Salamon ML, Blanchard GM, Huff T, Hayes A, Buckwalter JA, Amendola A. Epidemiology of ankle arthritis: report of a consecutive series of 639 patients from a tertiary orthopaedic center. Iowa Orthop J, 2005; 25: 44–46
- Chang KV, Hsiao MY, Chen WS, Wang TG, Chien KL. Effectiveness of intra-articular hyaluronic acid for ankle osteoarthritis treatment: a systematic review and meta-analysis. Arch Phys Med Rehabil, 2013; 94 (5): 951–960
- Karantana A, Hobson S, Dhar S. The Scandinavian total ankle replacement: survivorship at 5 and 8 years comparable to other series. Clin Orthop Relat Res, 2010; (468): 951–957
- Treppo S, Koepp H, Quan EC, Cole AA, Kuettner KE, Grodzinsky AJ. Comparison of biomechanical and biochemical properties of cartilage from human knee and ankle pairs. J Orthop Res, 2000; 18 (5): 739–748
- Aurich M, Squires GR, Reiner A, Mollenhauer JA, Kuettner KE, Poole AR. Differential matrix degradation and turnover in early cartilage lesions of human knee and ankle joints. Arthritis Rheum, 2005; 52 (1): 112–119
- Hassouna H, Kumar S, Bendall S. Arthroscopic ankle debridement: 5‑year survival analysis. Acta Orthop Belg, 2007; 73 (6): 737–740
- Treppo S, Koepp H, Quan EC, Cole AA, Kuettner KE, Grodzinsky AJ. Comparison of biomechanical and biochemical properties of cartilage from human knee and ankle pairs. J Orthop Res, 2000; 18 (5): 739–748
- Cole AA, Kuettner KE. Molecular basis for differences between human joints. Cell Mol Life Sci, 2002; 59 (1): 19–26
- Lee K, Cho S, Hur C, Yoon T. Perioperative complications of Hintegra total ankle replacement: our initial 50 cases. Foot Ankle Int, 2008; 29 (10): 978–984
- Morrey BF, Wiedeman GP. Complications and long-term results of ankle arthrodeses following trauma. J Bone Joint Surg Am, 1980; 62 (5): 777–784
- Strickland CD, Kijowski R. Morphologic imaging of articular cartilage. Magn Reson Imaging Clin N Am, 2011; 19 (2): 229–248
- Cuttica DJ, Smith WB, Hyer CF, Philbin TM, Berlet GC. Osteochondral lesions of the talus: predictors of clinical outcome. Foot Ankle Int, 2011; 32 (11): 1045–1051
- World Health Organization. Cancer pain relief. With a guide to opioid availability (2nd ed.). Geneva: WHO. 1996.
- Mei-Dan O, Kish B, Shabat S, Masarawa S, Shteren A, Mann G. Treatment of osteoarthritis of the ankle by intra-articular injections of hyaluronic acid: a prospective study. J Am Podiatr Med Assoc, 2010; 100 (2): 93–100
- Witteveen A, Giannini S, Guido G, Jerosch J, Lohrer H, Vannini F. A prospective multi-centre, open study of the safety and efficacy of hylan G‑F 20 (Synvisc) in patients with symptomatic ankle (talo-crural) osteoarthritis. Foot Ankle Surg, 2008; 14 (3): 145–152
- Mei-Dan O, Kish B, Shabat S, Masarawa S, Shteren A, Mann G. Treatment of osteoarthritis of the ankle by intra-articular injections of hyaluronic acid: a prospective study. J Am Podiatr Med Assoc, 2010; 100 (2): 93–100
- Cuttica DJ, Smith WB, Hyer CF, Philbin TM, Berlet GC. Osteochondral lesions of the talus: predictors of clinical outcome. Foot Ankle Int, 2011; 32 (11): 1045–1051
- Strickland CD, Kijowski R. Morphologic imaging of articular cartilage. Magn Reson Imaging Clin N Am, 2011; 19 (2): 229–248
- Witteveen A, Giannini S, Guido G, Jerosch J, Lohrer H, Vannini F. A prospective multi-centre, open study of the safety and efficacy of hylan G‑F 20 (Synvisc) in patients with symptomatic ankle (talo-crural) osteoarthritis. Foot Ankle Surg, 2008; 14 (3): 145–152
- Mei-Dan O, Kish B, Shabat S, Masarawa S, Shteren A, Mann G. Treatment of osteoarthritis of the ankle by intra-articular injections of hyaluronic acid: a prospective study. J Am Podiatr Med Assoc, 2010; 100 (2): 93–100
- Muehleman C, Fogarty D, Reinhart B, Tzvetkov T, Li J, Nesch I. In-laboratory diffraction-enhanced X‑ray imaging for articular cartilage. Clin Anat, 2010; 23 (5): 530–538
- Kimizuka M, Kurosawa H, Fukubayashi T. Load-bearing pattern of the ankle joint: contact area and pressure distribution. Arch Orthop Trauma Surg, 1980; 96 (1): 45–49
- Saltzman CL, Salamon ML, Blanchard GM, Huff T, Hayes A, Buckwalter JA, Amendola A. Epidemiology of ankle arthritis: report of a consecutive series of 639 patients from a tertiary orthopaedic center. Iowa Orthop J, 2005; 25: 44–46
- Morrey BF, Wiedeman GP. Complications and long-term results of ankle arthrodeses following trauma. J Bone Joint Surg Am, 1980; 62 (5): 777–784
- Gougoulias N, Khanna A, Maffulli N. How successful are current ankle replacements?: a systematic review of the literature. Clin Orthop Relat Res, 2010; (468): 199–208
- Gougoulias N, Khanna A, Maffulli N. How successful are current ankle replacements?: a systematic review of the literature. Clin Orthop Relat Res, 2010; (468): 199–208
- Baums MH, Schultz W, Kostuj T, Klinger HM. Cartilage repair techniques of the talus: An update. World J Orthop, 2014; 5 (3): 171–179. doi: 10.5312/wjo.v5.i3.171. eCollection 2014.
- Santos AL, Demange MK, Prado MP, Fernandes TD, Giglio PN, Hintermann B. Cartilage lesions and ankle osteoarthrosis: review of the literature and treatment algorithm. Rev Bras Ortop, 2014; 11; 49 (6): 565–572
- Cole AA, Kuettner KE. Molecular basis for differences between human joints. Cell Mol Life Sci, 2002; 59 (1): 19–26
- Felson DT. The epidemiology of osteoarthritis: prevalence and risk factors. In: Kuettner KE, Goldberg VM (eds). Osteoarthritis disorders. Rosemont, IL: American Academy of Orthopaedic Surgeons, 1995: 13–24
- Santos AL, Demange MK, Prado MP, Fernandes TD, Giglio PN, Hintermann B. Cartilage lesions and ankle osteoarthrosis: review of the literature and treatment algorithm. Rev Bras Ortop, 2014; 11; 49 (6): 565–572
- Correia SI, Silva-Correia J, Pereira H, Canadas RF, da Silva Morais A, Frias AM, Sousa RA, van Dijk CN, Espregueira-Mendes J, Reis RL, Oliveira JM. Posterior talar process as a suitable cell source for treatment of cartilage and osteochondral defects of the talus. J Tissue Eng Regen Med, 2015 Oct 29. doi: 10.1002/item.2092 [Epub ahead of print]
- Baums MH, Schultz W, Kostuj T, Klinger HM. Cartilage repair techniques of the talus: An update. World J Orthop, 2014; 5 (3): 171–179. doi: 10.5312/wjo.v5.i3.171. eCollection 2014.
- Baums MH, Schultz W, Kostuj T, Klinger HM. Cartilage repair techniques of the talus: An update. World J Orthop, 2014; 5 (3): 171–179. doi: 10.5312/wjo.v5.i3.171. eCollection 2014.
- Correia SI, Silva-Correia J, Pereira H, Canadas RF, da Silva Morais A, Frias AM, Sousa RA, van Dijk CN, Espregueira-Mendes J, Reis RL, Oliveira JM. Posterior talar process as a suitable cell source for treatment of cartilage and osteochondral defects of the talus. J Tissue Eng Regen Med, 2015 Oct 29. doi: 10.1002/item.2092 [Epub ahead of print]
- Pagenstert G, Hintermann B, Barg A, Leumann A, Valderrabano V. Realignment surgery as alternative treatment of varus and valgus ankle osteoarthritis. Clin Orthop Relat Res, 2007; (462): 156–168
- Fortier LA, Potter HG, Rickey EJ, Schnabel LV, Foo LF, Chong LR. Concentrated bone marrow aspirate improves fullthickness cartilage repair compared with microfracture in the equine model. J Bone Joint Surg Am, 2010; 92 (10): 1927–1937
- Kitaoka HB, Crevoisier XM, Harbst K, Hansen D, Kotajarvi B, Kaufman K. The effect of custom-made braces for the ankle and hindfoot on ankle and foot kinematics and ground reaction forces. Arch Phys Med Rehabil, 2006; 87 (1): 130–135
- Fortier LA, Potter HG, Rickey EJ, Schnabel LV, Foo LF, Chong LR. Concentrated bone marrow aspirate improves fullthickness cartilage repair compared with microfracture in the equine model. J Bone Joint Surg Am, 2010; 92 (10): 1927–1937
- Ogilvie-Harris D, Sekyi-Otu A. Arthroscopic debridement for the osteoarthritic ankle. Arthroscopy, 1995; 11 (4): 433–436
- Aurich M, Squires GR, Reiner A, Mollenhauer JA, Kuettner KE, Poole AR. Differential matrix degradation and turnover in early cartilage lesions of human knee and ankle joints. Arthritis Rheum, 2005; 52 (1): 112–119
- Pagenstert G, Hintermann B, Barg A, Leumann A, Valderrabano V. Realignment surgery as alternative treatment of varus and valgus ankle osteoarthritis. Clin Orthop Relat Res, 2007; (462): 156–168
- Pagenstert G, Leumann A, Hintermann B, Valderrabano V. Sports and recreation activity of varus and valgus ankle osteoarthritis before and after realignment surgery. Foot Ankle Int, 2008; 29 (10): 985–993
- Pagenstert G, Leumann A, Hintermann B, Valderrabano V. Sports and recreation activity of varus and valgus ankle osteoarthritis before and after realignment surgery. Foot Ankle Int, 2008; 29 (10): 985–993
- Fortier LA, Potter HG, Rickey EJ, Schnabel LV, Foo LF, Chong LR. Concentrated bone marrow aspirate improves fullthickness cartilage repair compared with microfracture in the equine model. J Bone Joint Surg Am, 2010; 92 (10): 1927–1937
- Hendren L, Beeson P. A review of the differences between normal and osteoarthritis articular cartilage in human knee and ankle joints. Foot (Edinb), 2009; 19 (3): 171–176
- Knupp M, Bolliger L, Hintermann B. Treatment of posttraumatic varus ankle deformity with supramalleolar osteotomy. Foot Ankle Clin, 2012; 17 (1): 95–102
- Fröhlich S, Zwicky L, Knupp M. Korrigierende Osteotomie zur Therapie der Arthrose am oberen Sprunggelenk. Orth und Rheum, 2014; 1 (14)
- Horisberger M, Valderrabano V, Hintermann B. Posttraumatic ankle osteoarthritis after ankle-related fractures. J Orthop Trauma, 2009; 23 (1): 60–67