Einleitung
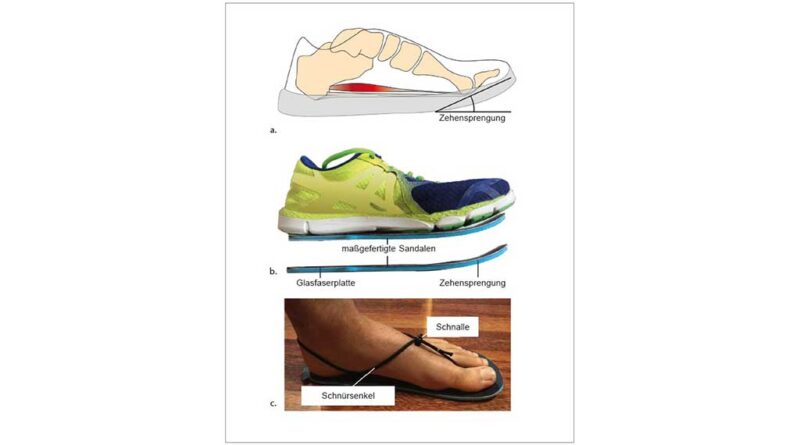
Die meisten Menschen tragen heutzutage Schuhe mit verschiedenen konstruktiven Merkmalen, die die Fußsohle schützen und einen besseren Komfort bieten. Während viele dieser Merkmale bereits intensiv untersucht wurden 1, ist die Wirkung der an fast allen Schuhen vorhandenen Zehensprengung nahezu völlig unerforscht geblieben. Diese Aufwärtswölbung der Schuhsohle, beginnend unterhalb der Metatarsalköpfchen, richtet die Zehenbox im Verhältnis zum restlichen Schuh nach dorsal aus (Abb. 1). Im Allgemeinen geht man davon aus, dass die Zehensprengung das Abrollen über den Vorfuß während der Abstoßphase des Gehens, d. h. zwischen der Fersenablösung und der Zehenablösung, unterstützt. Die Vorteile dieser Abrollbewegung in Bezug auf die mechanische Arbeit wurden bereits bei Schuhen mit gewölbten Abrollsohlen nachgewiesen 2 3 4. Insbesondere scheint diese Unterstützung der Abrollbewegung die mechanische Schwerpunktarbeit, also die bei der Schrittabwicklung auftretende Höhenveränderung des Körperschwerpunktes, zu verringern. Dabei bleibt jedoch unklar, inwieweit die in den Studien verwendeten Zurichtungen der in herkömmlichen Schuhen vorhandenen Zehensprengung entsprechen. In keiner experimentellen Studie wurde bisher untersucht, wie sich die Zehensprengung auf die Funktion des menschlichen Fußes beim Gehen auswirkt und wie sie die Verletzungsanfälligkeit des Fußes beeinflussen kann.
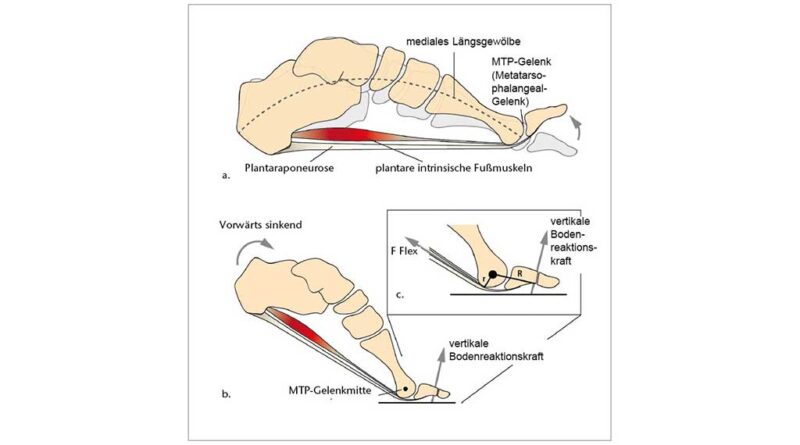
Es ist gut untersucht, dass die Fähigkeit zur Dorsalextension in den Zehengrundgelenken (MTP) einer der wichtigsten Evolutionsschritte ist, die es dem Menschen ermöglichen, effektiv und effizient zweibeinig zu gehen und zu laufen. Im Vergleich zu unseren nächsten Verwandten, den afrikanischen Menschenaffen, zeichnet sich der menschliche Fuß neben den kürzeren, geraderen Phalangen auch durch stärker dorsal orientierte und mediolateral breitere Gelenkflächen an den Metatarsalköpfchen aus 5. Es wird angenommen, dass diese stärker nach dorsal verlängerten Gelenkflächen den proximalen Phalangealbasen einen längeren Gleitweg bieten und sich so die Dorsalextensionsmöglichkeit an den MTP-Gelenken vergrößert 6 7 8 9 10. Obwohl neuere Forschungen zeigen, dass auch die Spreizung der Metatarsalköpfchen über das Quergewölbe die Versteifung der vorderen Fußwurzel unterstützt 11, wird seit Langem argumentiert, dass die Dorsalextension in den Grundgelenken über den Windlass-Mechanismus ebenfalls zur Versteifung des Fußes beiträgt 12. Bei diesem Vorgang führt die Dorsalextension der Zehen zu einer Straffung der Plantaraponeurose, einer breiten, stark faserigen Gewebelage, deren Kollagenfasern die plantare Seite des Fußes von der Ferse bis zu den Zehen verspannen (weiterführende Informationen in 13). Die erhöhte Spannung der Plantaraponeurose zieht den Calcaneus und die Metatarsalköpfchen zueinander, wodurch eine nach oben gerichtete Kraft entsteht, die das Längsgewölbe anhebt, Druckkräften von oben entgegenwirkt und den Fuß insgesamt versteift (Abb. 2a). Neuere Forschungen stellen diese traditionelle Sichtweise des Windlass-Mechanismus jedoch in Frage. In einem statischen In-vivo-Belastungsexperiment stellten Welte et al. 14 fest, dass das durch Dorsalextension der Zehen bewirkte Anheben des Längsgewölbes die Steifigkeit des Längsgewölbes verringert. In einem weiteren statischen In-vivo-Experiment stellten Farris et al. 15 fest, dass der Windlass-Mechanismus während der hohen Belastung des Längsgewölbes beim Abstoß nur geringe Auswirkungen auf die Bewegung des Längsgewölbes hat. Diese Ergebnisse sind zwar für die Statik überzeugend, doch ist eine weitere Bestätigung in der dynamischen In-vivo-Bewegung erforderlich, und der Windlass-Mechanismus ist nach wie vor ein weit verbreitetes Modell zum Verständnis der funktionellen Bedeutung des Längsgewölbes (z. B. 16 17 18). Unabhängig davon, inwieweit der Windlass-Mechanismus passiv stabilisierend ist, haben Untersuchungen zunehmend gezeigt, dass die intrinsische Fußmuskulatur ebenfalls eine wichtige Rolle bei der Unterstützung des Längsgewölbes und der Stabilisierung der MTP-Gelenke spielt 19 20 21. In der Abstoßphase sind die Metatarsalköpfchen und die distalen Phalangen die einzigen Berührungspunkte mit dem Boden am hinteren Bein und werden daher stark belastet. Infolgedessen erzeugen die auf die distalen Phalangen einwirkenden Bodenreaktionskräfte ein Moment, das eine Dorsalextension der MTP-Gelenke bewirkt (Abb. 2b). Elektromyographische Untersuchungen zeigen, dass die intrinsischen Muskeln des Fußes, insbesondere der Flexor digitorum brevis und der Abductor hallucis, am Ende der Standphase aktiv sind und die externen Dorsalextensionsmomente an den MTP-Gelenken intern kompensieren (Abb. 2c) 22 23. Gemäß diesen Erkenntnissen wirkt eine angemessene intrinsische Fußmuskelaktivität daher mit passiven Mechanismen wie dem Windlass-Mechanismus zusammen, um die Fußstabilität während der Abstoßphase aufrechtzuerhalten.
Wegen der Rolle, die die intrinsischen Fußmuskeln bei der Stabilisierung des Vorfußes spielen, kann eine Schwäche oder Funktionsstörung dieser Muskeln mit einer Vielzahl von Überlastungsbeschwerden einschließlich der Plantarfasziitis 24 25 in Verbindung gebracht werden. Diese pathologische Entzündung verursacht jedes Jahr bei mehr als 2 Millionen Patienten in den Vereinigten Staaten Schmerzen und Bewegungseinschränkungen und ist damit die häufigste Erkrankung, mit der die amerikanischen „podiatrists“ (Fußspezialisten) zu tun haben 26. Ätiologisch gesehen ist die Plantarfasziitis eine Verletzung, die durch übermäßige und wiederholte Belastung des Längsgewölbes verursacht wird 27. Neuere Erkenntnisse deuten auf einen Zusammenhang zwischen Plantarfasziitis und schwacher Fußmuskulatur hin, die nicht stark genug ist, um die aktive Stabilität des Fußes zu gewährleisten, wodurch die passive Belastung der Plantaraponeurose, die die MTP-Gelenke überspannt, zunimmt und vermutlich deren Stabilität beeinträchtigt 28. Mehrere Studien deuten darauf hin, dass eine schwache Fußmuskulatur zum Teil Folge der konstruktiven Merkmale moderner Schuhe sein kann, die das Längsgewölbe stützen und den Fuß passiv versteifen 29 30 31. Diese Studien zeigen, dass Personen, die überwiegend Minimalschuhe tragen, intrinsische Fußmuskeln mit größeren Querschnittsflächen und damit verbunden auch dynamisch stabilere Längsgewölbe haben als Personen, die überwiegend Standardschuhe tragen. Eine schwache intrinsische Fußmuskulatur könnte also eine evolutionäre Fehlanpassung sein, die darauf zurückzuführen ist, dass der menschliche Fuß noch nicht vollständig an die zeitgenössischen Schuhe angepasst ist 32. Bis vor geraumer Zeit liefen die Menschen entweder barfuß, oder sie trugen Minimalschuhe. Obwohl die ersten Belege für Minimalschuhe bereits aus der Zeit vor 10.000 Jahren stammen 33 34, waren die meisten Schuhe noch bis in die jüngere Zeit minimalistisch und verfügten nicht über Gewölbestützen, Dämpfung und andere unterstützende Eigenschaften, die den Komfort erhöhen und die erforderliche Arbeit der Fußmuskeln verringern 35.
Die vorliegende Studie untersucht, wie die Zehensprengung die Fähigkeit des Fußes, insbesondere während der Abstoßphase als steifer Hebel zu fungieren, beeinflusst. Es ist allgemein anerkannt, dass die Zehensprengung das Abrollen des Fußes aus der Standposition erleichtert, doch kann die Zehensprengung mit der damit verbundenen Dorsalextension in den Grundgelenken über den Windlass-Mechanismus auch einen Einfluss auf die Steifigkeit des Fußgewölbes haben. Es ist zu vermuten, dass die Zehensprengung kontinuierlich in den Windlass-Mechanismus eingreift, indem sie die Zehen permanent in eine dorsalflektierte Position bringt – auch in den Schrittphasen, in denen sie sich sonst in einer neutralen, horizontalen Position befinden würden – und dadurch permanent das Fußgewölbe anhebt. Ohne eine Zehensprengung verursacht die Belastung des Fußgewölbes einen „umgekehrten Windlass-Effekt“, bei dem die Abflachung des Längsgewölbes den Winkel in den Grundgelenken in Richtung Plantarflexion verändert 36. Eine permanente Anhebung der Zehen durch die Zehensprengung könnte diese Abflachung jedoch verhindern und das Fußgewölbe permanent versteifen. Dieser Versteifungseffekt tritt mit einer Zehensprengung bereits in der mittleren Standphase auf, wenn der Fuß maximal durch die Körpermasse belastet wird, und nicht erst bei der Vorfußbelastung in der Abstoßphase. Gemäß dieser traditionellen Betrachtungsweise des Windlass-Mechanismus könnte die passiv wirksame Zehensprengung also die Notwendigkeit, die Abflachung des Fußgewölbes durch Aktivierung der intrinsischen Fußmuskulatur zu verhindern, überflüssig machen. Eine damit verbundene Auswirkung, die die Zehensprengung auf den Fuß haben könnte, betrifft den Energieverlust an den MTP-Gelenken während der Abstoßphase. Es gilt als gesichert, dass die Beugemuskeln der Zehen bei der Dorsalextension der MTP-Gelenke einen erheblichen Teil der Arbeit leisten. Die intrinsischen Beugemuskeln sind am Ende der Standphase aktiv und gleichen die Dorsalextensionsmomente an den MTP-Gelenken während dieser Phase aus 37. Frühere Studien kamen zu dem Ergebnis, dass die von den Beugemuskeln der Zehen geleistete Arbeit proportional zum Ausmaß der MTP-Gelenkbewegung während des Abstoßens ist 38. Durch die passive Dorsalextension der Zehen bereits vor dem Abstoßen könnte eine Zehensprengung den Gesamtwinkel, um den sich die Zehen drehen, verringern, sodass auch die Muskeln weniger aktiv sind. Diese Auswirkungen auf die Biomechanik des Fußes würden die von den intrinsischen Fußmuskeln geforderte Gesamtarbeit verringern, was möglicherweise deren beobachtete Atrophie bei Personen erklärt, die es gewohnt sind, konventionelle Schuhe zu tragen.
Obwohl die Zehensprengung die Fußbiomechanik sowohl beim Gehen als auch beim Laufen beeinflusst, wird in dieser Studie nur untersucht, wie die Zehensprengung die intrinsische Fußbiomechanik beim Gehen beeinflusst, da dies die häufigere Fortbewegungsart ist. Während die Zehensprengung allgemeine Auswirkungen auf das gesamte Gangbild haben kann, wie in Studien zur Vorfußgestaltung von Prothesenfüßen und zur Steifigkeit der Zwischensohle von Schuhen gezeigt wurde 39 40, konzentrieren wir uns hier auf die unmittelbare Auswirkung der Zehensprengung auf die intrinsische Fußbiomechanik, um verschiedene Hypothesen zur Beeinflussung der Fußfunktion zu überprüfen. Wir konzentrieren uns dabei auf das mediale Längsgewölbe und die MTP-Gelenke während der mittleren Stand- und der Abstoßphase und verwenden kinematische Daten und Kraftdaten, um die allgemeine Hypothese zu bestätigen, dass Schuhe mit einer Zehensprengung die Steifigkeit des Fuß-Schuh-Komplexes und die an den MTP-Gelenken geleistete Gesamtarbeit beeinflussen. Des Weiteren prüfen wir auch zwei spezifische Hypothesen. Hypothese 1 besagt, dass die Steifigkeit des medialen Längsgewölbes während der mittleren Standphase mit größerer Zehensprengung zunimmt, da die dorsalflektierte Stellung der Zehen den Windlass-Mechanismus aktiviert. Hypothese 2 besagt, dass während der Abstoßphase eine größere Zehensprengung den Gesamtwinkel, um den sich die Zehen bewegen, verringert und dass somit die Gesamtarbeit am MTP-Gelenk abnimmt.
Methodik
Teilnehmende
Es wurden Daten von 13 Teilnehmenden (9 Männer, 4 Frauen) im Alter von 19 bis 33 Jahren (Mittelwert ± SD: 22 ± 3,1 Jahre) erhoben. Das Durchschnittsgewicht lag bei 74 ± 7,5 kg und die Durchschnittsgröße bei 182 ± 6 cm. Alle Teilnehmenden waren augenscheinlich gesund und hatten keine aktuellen Verletzungen oder Erkrankungen, die Gangstörungen verursachen könnten. Von jedem Probanden wurde eine schriftliche Einverständniserklärung eingeholt. Das Studienprotokoll wurde vom Harvard Committee on the Use of Human Subjects genehmigt und in Übereinstimmung mit der Deklaration von Helsinki durchgeführt.
Schuhkonstruktion
Auf dem Laufband liefen die Teilnehmenden barfuß und in vier Paar speziell angefertigten Sandalen mit unterschiedlich starker Zehensprengung. Die Sandalen bestanden aus einer Brandsohle, einer Außensohle aus Gummi, einer Zwischensohle aus Schaumstoff (Dicke 2 mm) und einer gewölbten Glasfaserplatte, die über die gesamte Länge der Sandale verlief und sich vom Fußballen bis zur Spitze der Sandale nach oben wölbte (Abb. 1b). Die Aufwärtswölbung unter den Zehen betrug entweder 10°, 20°, 30° oder 40°. Als niedrigstes Profil wurde die 10°-Wölbung gewählt, um ein Minimum an natürlichem Abrollen der Füße während der Abstoßphase zu gewährleisten. Die Sandalen wurden mit dünnen runden Schnürsenkeln befestigt, die mit einer Kordelklemme verstellt werden konnten und keine Einschränkung bei der Platzierung von reflektierenden Markern verursachten. Abhängig von der Fußgröße der Teilnehmenden wurden zwei Sandalengrößen verwendet (24 cm und 28 cm Länge). In dieser Studie entschieden wir uns für Sandalen und nicht für Schuhe, weil sie einfacher zu konstruieren sind und es uns ermöglichten, ein detailliertes Markerset am Fuß anzubringen.
Die Sandalen wurden so konstruiert, dass sie die Steifigkeit und Form von Zehensprengungen nachahmen, die in handelsüblichen Schuhen zu finden sind 41. Vor dem Versuch wurde die Biegesteifigkeit der Sandale mit einer einachsigen Zug- und Druckprüfmaschine (Modell HC 10, Zwick GmbH & Co. KG, Ulm, Deutschland) gemessen. Der Versuchsaufbau zur Messung der Biegesteifigkeit des Schuhs ist an anderer Stelle ausführlich beschrieben worden 42. Kurz gesagt wurde der Rückfußteil der Sandale auf einer festen Plattform so eingespannt, dass die Bewegungsachse der Maschine mit der anatomischen Biegeachse des MTP-Gelenks übereinstimmte. Der Abstand zwischen der Mitte der Metatarsalachse und der Krafteinleitung betrug 50 mm. Gebogen wurde die Sandale, indem der Vorfußstempel um 40 mm angehoben und abgesenkt wurde. Durch die Zuordnung der Kraft zur Verformungskurve konnten das Drehmoment und der Biegewinkel berechnet werden. Die mittlere Biegesteifigkeit wurde auf der Grundlage der Drehmoment-Winkel-Kurve von 10 Belastungszyklen bei 2 Hz berechnet. Die gemessene mittlere Biegesteifigkeit der Sandale betrug 6,38 ± 1,58 Nm/rad und ist damit ähnlich hoch wie die Biegesteifigkeit moderner Schuhe (Adidas „adizero“: 7,00 Nm/rad, Nike „Zoom Streak 6“: 9,4 Nm/rad) 43.
Versuchsablauf
Die Teilnehmenden liefen auf einem geteilten Laufband (Bertec Corporation, Columbus, OH, USA), das unter jedem Laufband mit separaten Kraftmessplatten zur Messung der Bodenreaktionskräfte (GRF) ausgestattet war. Dadurch konnten die Daten für beide Beine separat für alle Schritte erfasst werden. Die Reihenfolge, in der die verschiedenen Sandalen getragen bzw. barfuß gegangen wurde, wurde randomisiert. Vor dem Barfußlaufversuch wurden die Teilnehmenden außerdem 10 Sekunden lang im Stehen gemessen. Das diente dazu, eine neutrale Darstellung des Fußes jedes Teilnehmenden zu erhalten, sodass wir die während des Gehens berechneten Gelenkwinkel auf die neutrale Fußhaltung jedes Teilnehmenden normalisieren konnten. Hierzu wurden die Gelenkwinkel im Stand gleich 0 Grad gesetzt. Die Teilnehmenden liefen in jeder Bedingung einige Minuten lang, bis sie sich wohlfühlten. Die jeweilige Laufgeschwindigkeit wurde proportional zur individuellen Beinlänge festgelegt, sodass sich für jeden Teilnehmenden ein angenehmes, moderates Gehtempo ergab 44. Kinetische und kinematische Daten wurden gleichzeitig über einen Zeitraum von 30 Sekunden für jeden Gehversuch erfasst (barfuß, 10°-, 20°-, 30°- und 40°-Sandale). Zur weiteren Analyse wurden zehn Schritte exportiert.
Erfassung kinematischer und kinetischer Daten
Erfasst wurden die Bewegungsdaten bei 200 Hz mit einem optoelektronischen 3D-Bewegungserfassungssystem mit acht Kameras („Oqus“, Qualysis, Göteborg, Schweden). Die Bodenreaktionskräfte wurden synchron mit den Bewegungsdaten bei 2000 Hz mit Hilfe der Software „Qualisys Track Management“ (Qualisys, Göteborg, Schweden) erfasst. Um die dreidimensionalen Bewegungen des Fußes und des Unterschenkels zu quantifizieren, wurden insgesamt fünfzehn reflektierende Marker (12,0 mm Durchmesser) am rechten Knie, Knöchel und Fuß jedes Probanden angebracht. Die Marker wurden auf den von Leardini et al. 45 definierten knöchernen Orientierungspunkten platziert, die das Bein und den Fuß als fünf separate Segmente definieren: Zehen, Metatarsalen, vorderer (Cuneiformia, Cuboid, Naviculare) und hinterer (Calcaneus) Anteil der Fußwurzel und Unterschenkel.
Datenanalyse
Die Bahnkurven der Marker und die Bodenreaktionskraft-Daten wurden zur Nachbearbeitung und Analyse in „Visual3D“ (C‑motion Inc., Germantown, MD, USA) exportiert. Ein rekursiver Butterworth-Tiefpassfilter vierter Ordnung (Grenzfrequenz 10 Hz) wurde zur Verarbeitung der kinematischen und Bodenreaktionskraft-Daten verwendet. Für beide wurde dieselbe Grenzfrequenz verwendet, um Artefakte bei Berechnungen der inversen Dynamik zu vermeiden, die bei der Verwendung unterschiedlicher Filtergrenzfrequenzen auftreten 46. Die Kontaktzeit (vom Fersenkontakt bis zum Abheben der Zehen) wurde mit einer vertikalen Bodenreaktionskraft-Schwelle von 50 N berechnet. Alle Datenkurven wurden für die Darstellung und visuelle Kontrolle auf die Dauer der Standphase normiert.
Gelenkkinematik
Die geometrischen Definitionen des medialen Längsgewölbes (Medial Longitudinal Arch, MLA) und des MTP-Gelenkwinkels basierten auf Hautmarkierungen am Calcaneus (Cal), am Sustentaculum tali (ST), an der Basis des ersten Mittelfußknochens (First Metatarsal Base, FMB), am Kopf des ersten Mittelfußknochens (First Metatarsal Head, FMH) und am distalen Ende der ersten proximalen Phalanx (PM) 47 48. Die MLA- und MTP-Gelenkmaße wurden als Winkel zwischen den Projektionen zweier Vektoren auf die Sagittalebene des gesamten Fußes bzw. des Vorfußsegments berechnet, gemäß der Definition in Leardini et al. 49. Für den MLA-Winkel wird der Vektor auf dem proximalen Segment durch die Marker Cal_proj und ST begrenzt, wobei Cal_proj die Projektion von Cal auf die x‑y-Ebene des Fußes ist. Der Vektor auf dem distalen Segment wird durch die Marker ST und FMH begrenzt 50. Für das MTP-Gelenk wird der Vektor auf dem proximalen Segment durch die Marker FMB und FMH begrenzt, und der Vektor auf dem distalen Segment wird durch die Marker FMH und PM begrenzt. Um die Auswirkung der Zehensprengung auf die Kinematik des Fußgewölbes zu bewerten, wurden die MLA- und MTP-Gelenkwinkel bei 50 % der Standphase analysiert, obwohl die auf das Fußgewölbe wirkenden Spitzenkräfte erst später in der Standphase beim Gehen auftreten. Auf diese Weise konnten wir die Wirkung der Zehensprengung auf die MLA-Verformung isolieren, da dies vor dem Beginn der normalen MTP-Dorsalextension durch die Fersenanhebung beim Gehen geschieht. Um die Wirkung der Zehensprengung auf die Kinematik des MTP-Gelenks während der Abstoßphase zu bewerten, wurden der maximale Dorsalextensionswinkel des MTP-Gelenks und der entsprechende MLA-Winkel sowie die maximale Winkelgeschwindigkeit des MTP-Gelenks quantifiziert. Darüber hinaus wurde der Gesamtbereich des Dorsalextensionswinkels des MTP-Gelenks als der Bereich definiert, in dem sich die Zehen von dem Zeitpunkt aus, in dem der Kraftangriffspunkt (COP) mit dem MTP-Gelenk übereinstimmt, bis zum maximalen Dorsalextensionswinkel bewegen.
Gelenkkinetik
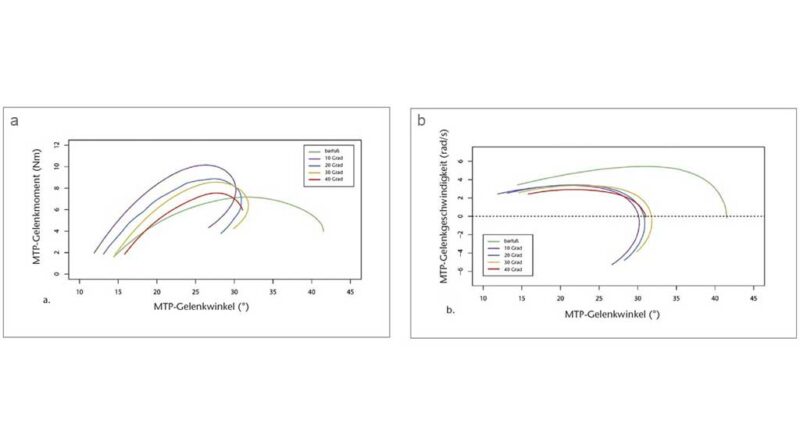
Die Quasi-Steifigkeit des Chopart-Gelenks in der mittleren Standphase (definiert als die Steigung des Verhältnisses zwischen Moment und Winkel des Gelenks) wurde anhand der MLA-Gelenkwinkel und des entsprechenden Gelenkmoments berechnet 51. Die Quasi-Steifigkeit wurde nur berechnet, wenn sich der Kraftangriffspunkt vor dem Zentrum des Chopart-Gelenks befand (definiert durch den Marker auf dem Sustentaculum tali), bis die Ferse vom Boden abhob. Das MTP-Gelenkmoment und die Leistung wurden solange als Null definiert, bis sich der resultierende Belastungsvektor anterior zum MTP-Gelenkzentrum bewegte 52 53. Die Leistung wurde mittels der folgenden Gleichung berechnet: P = M × ω. Dabei ist M das Moment und ω die Winkelgeschwindigkeit am MTP-Gelenk, abgeleitet aus den kinematischen Daten (Abb. 3b). Danach wurden die negative und die positive Arbeit quantifiziert, indem das Integral der Leistung über die Zeit des Abstoßes gebildet wurde (d. h. von dem Zeitpunkt an, an dem der resultierende Bodenreaktionskraftvektor vor dem MTP-Gelenkzentrum entspringt, bis zu dem Zeitpunkt, in dem sich die Zehen vom Boden abheben). Die Wegstrecke des Kraftangriffspunktes, nachdem er sich vor das Zehengrundgelenk bewegt hatte, wurde ebenfalls quantifiziert. Alle Berechnungen wurden mit „Visual3D“ und benutzerdefinierten MATLAB- (The MathWorks, Natick, MA, USA) und R‑Skripten (R Core Team 2019, Wien, Österreich) durchgeführt.
Statistische Auswertung
Für alle Variablen wurden Mittelwerte und Standardabweichungen (Mittelwert ± SD) berechnet und ein Shapiro-Wilk-Test auf Normalität durchgeführt. Ein weiterer Vergleich der kinematischen und kinetischen Messungen zwischen den Barfuß- und den vier Sandalen-Bedingungen wurde mit einer einfachen ANOVA mit wiederholten Messungen für normalverteilte Ergebnisparameter oder einem Friedman-Test für die nicht normalverteilten Messungen durchgeführt. Wenn ein signifikanter Haupteffekt zwischen den Zuständen festgestellt wurde, wurde eine Bonferroni-korrigierte Post-hoc-Analyse durchgeführt. Für die nicht normalverteilten Messwerte wurde ein Wilcoxon-Vorzeichen-Rang-Test durchgeführt. Unter Verwendung von „IBM SPSS Statistics“, Version 25 (IBM, Armonk, New York, USA) wurde für alle Tests eine Signifikanz von α = 0,05 festgelegt.
Ergebnisse
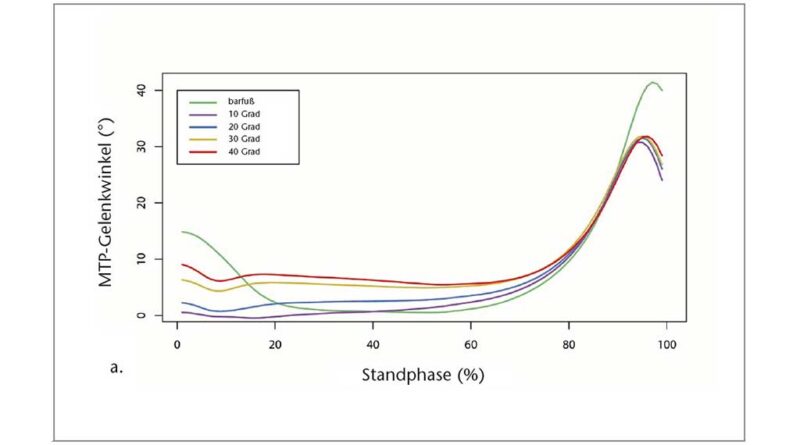
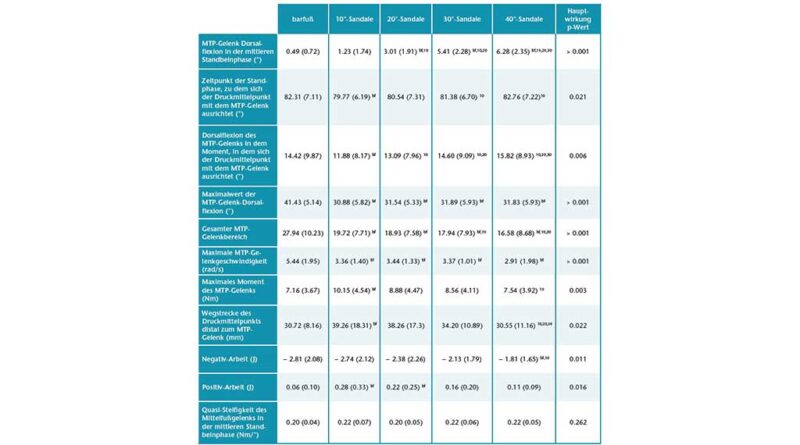
Mit größerer Zehensprengung wurden die Zehen in der mittleren Standphase in leicht, aber signifikant zunehmenden Dorsalextensionsgraden (p < 0,05; ANOVA mit wiederholten Messungen) gehalten. Die Bonferroni-korrigierte Post-hoc-Analyse ergab signifikante Unterschiede in der Dorsalextension des MTP-Gelenks zwischen den verschiedenen Zehensprengungsbedingungen (Tab. 1). Der Absolutwert der Dorsalextension in den Grundgelenken war jedoch relativ gering und erreichte ein Maximum von 6,28° (± 2,35°) bei der 40°-Sandale (Abb. 3). Variationen der Zehensprengung hatten keinen signifikanten Einfluss auf die Quasi-Steifigkeit des Chopart-Gelenkes (p > 0,05; Friedman-ANOVA). Beim Abstoßen wurde ein bemerkenswerter Unterschied von 10,55° für den maximalen MTP-Gelenkwinkel zwischen der Barfuß- und der 10°-Sandalenbedingung festgestellt. Entgegen den Erwartungen wurden für den maximalen MTP-Gelenkwinkel keine Unterschiede zwischen allen Sandalenbedingungen gefunden (p > 0,05; ANOVA mit wiederholten Messungen) (Abb. 3, Tab. 1). Der Gesamtbereich des Dorsalextensionswinkels im MTP-Gelenk änderte sich jedoch zwischen dem Barfußlaufen und allen Sandalenbedingungen. Zwischen barfuß und 10°-Sandalenbedingung verringerte sich der gesamte MTP-Bewegungsumfang signifikant um 29,42 % (p < 0,05; Friedman-ANOVA). Mit zunehmender Zehensprengung verringerte sich der gesamte MTP-Bewegungsumfang um bis zu 15,92 % zwischen den 10°- (19,72° ± 7,71°) und den 40°-Sandalen (16,58° ± 8,68°) (p < 0,05; Friedman-ANOVA). Die Veränderung des gesamten MTP-Bewegungsumfangs stimmt gut mit dem Dorsalextensionswinkel des MTP-Gelenks zu dem Zeitpunkt überein, in dem der Kraftangriffspunkt das MTP-Gelenkzentrum passiert. Der MTP-Gelenkwinkel zu diesem Zeitpunkt nahm mit zunehmender Zehensprengung zu, von 11,88° ± 8,17° bei der 10°-Sandale auf 15,82° ± 8,93° bei der 40°-Sandale (p < 0,05; Friedman-ANOVA). Zusammen mit den Veränderungen im Gesamtbereich des MTP-Gelenk-Dorsalextensionswinkels wurden signifikante Unterschiede zu dem Zeitpunkt festgestellt, in dem der Kraftmittelpunkt das MTP-Gelenkzentrum während der Standphase passierte (p < 0,05; Friedman-ANOVA). Bei der 10°-Sandale (79,77 ± 6,19 % Standphase) passierte der Kraftangriffspunkt das MTP-Gelenkzentrum signifikant früher als beim Barfußlaufen (82,31 ± 7,11 % Standphase) und bei der 40°-Sandale (82,76 ± 7,22 % Standphase). Während die maximale Winkelgeschwindigkeit der MTP-Gelenke in der Barfußbedingung signifikant höher war, gab es keine Unterschiede in der maximalen Winkelgeschwindigkeit zwischen den Sandalenbedingungen (p > 0,05; Friedman-ANOVA) (Abb. 4a, Tab. 1).
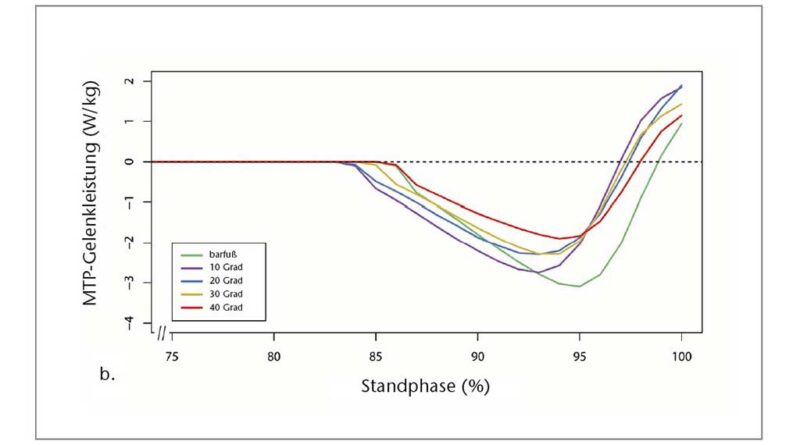
Die interessanteste Erkenntnis aus den Daten der Abstoßphase ist, dass das maximale Moment bei den 10°-Sandalen im Vergleich zur Barfußbedingung anstieg, aber mit zunehmender Zehensprengung allmählich um bis zu 31,63 % zwischen den 10°- und 40°-Sandalen wieder abnahm (Abb. 4b, Tab. 1). Dieses Verhalten des maximalen Moments hängt wahrscheinlich mit der Tatsache zusammen, dass die Wegstrecke des Kraftangriffspunktes distal des MTP-Gelenks zwischen barfuß und 10°-Sandale zunahm, aber mit zunehmender Zehensprengung signifikant um bis zu 22,26 % zwischen den 10°- (39,26 ± 18,31 mm) und den 40°-Sandalen (30,55 ± 11,16 mm) wieder abnahm (p < 0,05; Friedman-ANOVA) (Tab. 1).
Die negative MTP-Gelenkarbeit war am größten beim Barfußlaufen und bei der 10°-Sandale (− 2,81 ± 2,08 bzw. − 2,76 ± 2,12 J) und am geringsten bei der 40°-Sandale (− 1,81 ± 1,65 J). Ein Vergleich zwischen den Sandalen zeigte für die 20°-, 30°- und 40°-Sandalen eine allmähliche Abnahme um 2,5 %, 15,3 %, 24,2 % bzw. 35,6 % im Verhältnis zur 10°-Sandale (p < 0,05; Friedman-ANOVA) (Tab. 1). Eine Bonferroni-korrigierte Post-hoc-Analyse ergab einen signifikanten Unterschied zwischen den 10°- und den 40°-Sandalen. Die positive MTP-Gelenkarbeit war signifikant unterschiedlich zwischen barfuß und 10°- sowie 20°-Sandalen (p < 0,05; Friedman-ANOVA). Zwischen den Sandalenbedingungen wurde kein signifikanter Unterschied festgestellt, aber die Daten zeigen eine allmähliche, leichte Abnahme von der 10°-Sandale (0,28 ± 0,33 J) zur 40°-Sandale (0,11 ± 0,09 J) (Tab. 1).
Diskussion
Ziel der vorliegenden Studie war es, die Auswirkungen von Zehensprengungen in Schuhen auf die Biomechanik des Fußes beim Gehen theoretisch zu erarbeiten und anschließend in der Praxis zu überprüfen. Wir stellten die Hypothese auf, dass die Zehensprengung durch die Aktivierung des Windlass-Mechanismus die Steifigkeit des medialen Längsgewölbes während der mittleren Standphase erhöhen würde. Des Weiteren stellten wir die Hypothese auf, dass die Negativ-Arbeit an den MTP-Gelenken während der Abstoßphase abnehmen würde, da die Zehensprengung den Gesamtwinkel, um den sich die Zehen drehen, verringern würde. Während wir keine Veränderung der Gewölbesteifigkeit durch die Zehensprengung feststellen konnten, deuten unsere Ergebnisse darauf hin, dass die Zehensprengung die Negativ-Arbeit an den MTP-Gelenken während des Abstoßens verringert. Wie erwartet verringerte eine größere Zehensprengung den Gesamtbereich der MTP-Gelenkbewegung. Damit verbunden stellten wir fest, dass stärkere Zehensprengungen den Zeitpunkt verzögerten, zu dem der Kraftangriffspunkt das Zentrum des MTP-Gelenks passierte, und die vom Kraftangriffspunkt zurückgelegte Wegstrecke anterior vom MTP-Gelenk verringerten. Infolge dieser kinematischen Veränderungen nahmen das entsprechende Gelenkmoment und die daraus resultierende Negativ-Arbeit ab. Ein Vergleich der Ergebnisse der verschiedenen Zehensprengungen mit denen des Barfußlaufens ergab, dass die Zehensprengung offenbar die negativen Auswirkungen steifer Schuhe auf die erforderliche Arbeit an den MTP-Gelenken kompensiert.
Der Windlass-Mechanismus prognostiziert, dass die Dorsalextension der Zehen die Spannung in der Plantaraponeurose erhöht, wodurch das Längsgewölbe als Ganzes versteift wird 54. Die leichte Vergrößerung der Dorsalextensionswinkel der MTP-Gelenke, die in dieser Studie durch die Zehensprengung verursacht wurden, hatten jedoch keinen Einfluss auf die gemessene Gewölbesteifigkeit. Dieses Ergebnis deckt sich mit den Erkenntnissen von Welte et al. 55, welche die Fußgewölbe sitzender Probanden unter statischer Belastung bei unterschiedlichen Dorsalextensionswinkeln der Zehen zusammendrückten und feststellten, dass die Steifigkeit des Fußgewölbes nicht durch das Aktivieren des Windlass-Mechanismus erhöht wurde. Eine mögliche Erklärung könnte die Flexibilität der Plantaraponeurose sein, die sich bei Belastung des Bogens dehnt 56 57 58. Unsere Ergebnisse können daher als weiterer Beweis dafür gewertet werden, dass der Windlass-Mechanismus nicht wesentlich zur Versteifung des Längsgewölbes in der mittleren Standphase beiträgt. Eine weitere mögliche Erklärung für den in unserer Studie fehlenden Effekt der Zehensprengung auf die Steifigkeit des Längsgewölbes in der mittleren Standphase könnten die relativ kleinen Dorsalextensionswinkel des MTP-Gelenks sein, die unter den Bedingungen der Zehensprengung erreicht wurden. Obwohl wir Sandalen mit Zehensprengungen von bis zu 40° und einer Biegesteifigkeit ähnlich wie bei herkömmlichen Schuhen konstruierten, betrug der maximale Dorsalextensionswinkel des MTP-Gelenks, der durch die Zehensprengung verursacht wurde, weniger als 10°. Auch wenn wir nicht wissen, warum diese Winkel so gering waren, kann es sein, dass sich der Windlass-Mechanismus während der mittleren Standphase, wenn das Gewölbe durch die Kraft von oben zusammengedrückt wird und sich die Plantaraponeurose anspannt, entgegen der bislang beschriebenen Richtung abwickelt. Dieses Abwickeln des Windlass-Mechanismus, das als „umgekehrter Windlass“ 59 60 bezeichnet wird, könnte die Zehen am MTP-Gelenk plantarflektieren und damit der Wölbung der Zehensprengung entgegenwirken. Dieser Mechanismus muss jedoch weiter geprüft werden.
Im Gegensatz zu dem, was wir in der mittleren Standphase gefunden haben, deuten unsere Ergebnisse während der Abstoßphase darauf hin, dass die Zehensprengung die Dynamik der MTP-Gelenke durch den signifikanten Rückgang der Negativ-Arbeit bei zunehmender Zehensprengung beeinflusst. Paradoxerweise war die Negativ-Arbeit beim Barfußlaufen und mit 10°-Sandalen am höchsten. Es gab jedoch unterschiedliche Gründe, warum diese Werte unter diesen Bedingungen am höchsten waren. Beim Barfußlaufen erreichten die Teilnehmenden hohe maximale MTP-Dorsalextensionswinkel, was eine hohe Winkelgeschwindigkeit und damit eine hohe Negativ-Arbeit erforderte. Im Gegensatz dazu wies die 10°-Sandale einen geringeren MTP-Dorsalextensionswinkel auf, führte aber dazu, dass sich der Kraftangriffspunkt beim Abheben der Zehen weiter nach distal bewegte, was das einwirkende Moment und damit die Negativ-Arbeit effektiv erhöhte. Die distale Verschiebung des Kraftangriffspunktes in den Sandalen ist wahrscheinlich eine Folge des Abstoßens gegen eine relativ steife Plattform in der Sohle, was sich auch in einer früheren Verlagerung des Kraftangriffspunktes relativ zum MTP-Gelenkzentrum widerspiegelt. Diese Ergebnisse stimmen weitgehend mit anderen Studien überein, die Unterschiede in der MTP-Gelenkdynamik mit der Schuhsteifigkeit in Verbindung bringen 61 62 63 64. Während es keine Unterschiede in den maximalen MTP-Dorsalextensionswinkeln zwischen Sandalen mit verschiedenen Zehensprengungen gab, gab es signifikante Unterschiede in dem Zeitpunkt, zu dem der Kraftangriffspunkt das MTP-Gelenkzentrum passierte. Mit zunehmenden Zehensprengungen passierte der Kraftangriffspunkt das MTP-Gelenkzentrum zu einem späteren Zeitpunkt in der Standphase. Diese Verzögerung des Timings könnte den reduzierten Bewegungsumfang des MTP-Gelenks und das Ausmaß der distalen Bewegung des Kraftangriffspunkts erklären. Zusammen mit diesen Ergebnissen zeigen unsere Resultate einen signifikanten Rückgang der Negativ-Arbeit, der mit der Verringerung des MTP-Bewegungsumfangs und der Wegstrecke des Kraftangriffspunkts aufgrund zunehmender Zehensprengungen einhergeht. Darüber hinaus deuten die Daten auf einen allmählichen Rückgang der maximalen Winkelgeschwindigkeit mit zunehmender Zehensprengung hin, doch ist dieser Unterschied zwischen den Zuständen nicht signifikant. Die Zehensprengung scheint also den negativen Auswirkungen steifer Schuhe auf den Arbeitsaufwand der MTP entgegenzuwirken. Während steife Schuhe die MTP-Gelenke versteifen, könnte die Zehensprengung die Auswirkungen der erhöhten Wegstrecke des Kraftangriffspunkts distal der MTP-Gelenke kompensieren und den Gesamtbereich der MTP-Gelenke und möglicherweise die maximale Winkelgeschwindigkeit weiter reduzieren, wodurch die Negativ-Arbeit reduziert wird.
Der Rückgang der Negativ-Arbeit an den MTP-Gelenken deutet darauf hin, dass die intrinsischen Fußmuskeln weniger exzentrische Muskelarbeit leisten müssen, um die Dorsalextension der MTP-Gelenke während der Abstoßphase zu kontrollieren 65. Farris et al. 66 67 stellten fest, dass die intrinsische Fußmuskulatur eine wichtige Rolle bei der Versteifung der MTP-Gelenke spielt, wenn diese am Ende eines Schrittes beim Gehen und Laufen dorsalflektiert werden. Indem sie die Momente an den MTP-Gelenken reduziert, entlastet die Zehensprengung wahrscheinlich die intrinsische Fußmuskulatur von einem Teil der Arbeit, die zur Kontrolle dieser Gelenke erforderlich ist. Wie bereits dargestellt sind die Unterschiede in der Gelenkarbeit zwischen den in der Studie gemessenen Bedingungen relativ klein. Ebenfalls klein sind die intrinsischen Fußmuskeln selbst, was bedeutet, dass ein höherer Anteil der verfügbaren Faszikel (Faserbündel) kontrahiert werden muss, um eine bestimmte Energiemenge zu erzeugen, als bei größeren Muskeln. Ferner summieren sich wahrscheinlich im Laufe der Zeit diese kleinen Unterschiede in der Muskelarbeit zu erheblichen Unterschieden, wenn man bedenkt, dass der durchschnittliche Mensch in den Industrieländern 4.000 bis 6.000 Schritte pro Tag macht 68. So könnte das gewohnheitsmäßige Tragen von Schuhen mit Zehensprengung die Fähigkeit der intrinsischen Fußmuskeln zur Krafterzeugung hemmen oder entkonditionieren. Auch wenn die direkten Folgen einer schwachen Fußmuskulatur nicht vollständig bekannt sind, ist es wahrscheinlich, dass sie die Anfälligkeit für Plattfüße und damit verbundene Probleme wie die Plantarfasziitis erhöhen könnte 69 70. Dieser schmerzhafte Reizzustand der Plantarfaszie, dessen Ursache eine wiederholte übermäßige Belastung des Fußlängsgewölbes ist 71, ist das am häufigsten behandelte Fußproblem bei Menschen, die gewöhnlich beschuht unterwegs sind 72. Farris et al. 73 weisen darauf hin, dass die Kontraktion der intrinsischen Fußmuskeln die Überlastung der Plantaraponeurose bei hohen Belastungen verhindert. Eine Schwächung der intrinsischen Fußmuskeln durch die Zehensprengung könnte somit eine Plantarfasziitis begünstigen.
Zu berücksichtigen ist, dass dieser mögliche Zusammenhang zwischen Zehensprengung und Plantarfasziitis noch weiter untersucht werden muss. Leider wurden in die Studie nur gewohnheitsmäßige Schuhträger einbezogen, deren Füße möglicherweise bereits an Schuhe mit Zehensprengung gewöhnt waren. Weitere Studien sind erforderlich, um die Auswirkungen einer Zehensprengung auf Personen zu untersuchen, die gewöhnlich barfuß laufen. Zusätzliche Einschränkungen, die weiter getestet werden müssen, sind die Gehgeschwindigkeit und die Gangart. Während in dieser Studie nur eine einzige Gehgeschwindigkeit getestet und die Laufbewegung nicht berücksichtigt wurde, sollten in künftigen Untersuchungen auch höhere Geschwindigkeiten getestet werden, die höhere Anforderungen an die Stabilität des Fußgewölbes und an die Muskelaktivität haben. In dieser Studie wurde auch die intrinsische Fußmuskelaktivität nicht gemessen; daher bleibt ungewiss, ob sich die Veränderungen der MTP-Gelenkarbeit in Veränderungen der Muskelaktivität widerspiegeln. Es kann sein, dass sich die intrinsische Fußmuskulatur isometrisch anspannt, wenn die Zehen beim Gehen dorsalflektiert werden, und dass die Veränderungen in der Kraft an den MTP-Gelenken zwischen den verschiedenen Zehensprengungen Unterschiede in der elastischen Energiespeicherung und ‑abgabe widerspiegeln und nicht Veränderungen in der intrinsischen Fußmuskelarbeit selbst. Jüngste statische Belastungsexperimente von Kelly et al. 74 deuten darauf hin, dass die intrinsischen Fußmuskelfaszikel bei hohen Belastungen tatsächlich konzentrisch kontrahieren, aber es sind weitere Untersuchungen erforderlich, um festzustellen, ob dies auch beim Gehen und Laufen zutrifft. Bei der Interpretation der Kinetik des MTP-Gelenks ist zusätzliche Vorsicht geboten. Das MTP-Moment, die Kraft und die Arbeit wurden ab dem Zeitpunkt berechnet, an dem der Kraftangriffspunkt das MTP-Gelenk passierte. Dieser Ansatz wurde bereits in früheren Studien verwendet (Rolian et al., 2009; Farris et al., 2019), könnte jedoch die Moment- und Leistungsberechnungen an den Zehengelenken im Vergleich zu komplexeren Methoden, die unabhängige Kraftmessungen von mehreren Kraftmessplatten erfordern, leicht überschätzen 75. Dennoch gehen wir davon aus, dass dieser Effekt unter allen in dieser Studie verwendeten Zuständen gleich ist und daher unsere allgemeinen Schlussfolgerungen nicht beeinträchtigen sollte.
Ungeachtet dieser Einschränkungen kommen wir zu dem Schluss, dass die Zehensprengung wichtige, bisher unerkannte biomechanische Auswirkungen auf die Fußfunktion hat, die Beachtung verdienen, insbesondere da die Zehensprengung in modernen Sportschuhen zunehmend übertrieben wird 76. Wie hier gezeigt wurde, kann eine Zehensprengung die natürliche Biomechanik des Fußes beim Gehen verändern, indem sie vor allem die Gesamtarbeit am MTP-Gelenk verändert und damit potenziell die von den intrinsischen Fußmuskeln geforderte Arbeit verringert. Folglich kann eine Zehensprengung zwar den Komfort erhöhen, indem sie die erforderliche Arbeit der Fußmuskulatur verringert, aber gleichzeitig auch die Anfälligkeit für Plantarfasziitis und andere fußbezogene Probleme vergrößern. Es muss jedoch noch viel mehr geforscht werden, um die Auswirkungen der Zehensprengung auf die Fußfunktion und das gesamte Gangbild besser zu verstehen. Künftige Studien könnten die Auswirkungen der Zehensprengung in Kombination mit anderen Schuhmerkmalen, einschließlich Einlagen, Schuhsteifigkeit und Dämpfung, untersuchen. Künftige Forschungsarbeiten sollten auch untersuchen, wie sich die Zehensprengung auf allgemeinere Aspekte des Gangs auswirken könnte, z. B. auf die Mechanik des Schwerpunkts, die nachweislich von der Steifigkeit des MTP-Gelenks und der Krümmung der Schuhsohle beeinflusst wird 77 78. Studien könnten auch weitere Gehgeschwindigkeiten und Laufbewegungen untersuchen, um ein umfassenderes Verständnis der Auswirkungen der Zehensprengung auf den Gang zu erlangen, was zur Verbesserung der Konstruktion und der Verwendung von Schuhen beitragen könnte. Schließlich sollten künftige Forschungen Techniken wie Elektromyographie einbeziehen, um zu untersuchen, wie die hier beobachteten mechanischen Effekte der Zehensprengung mit der tatsächlichen neuromuskulären Leistung und Kontrolle während des Gehens zusammenhängen.
Hinweis
Der hier abgedruckte Fachartikel ist eine Übersetzung der folgenden Originalarbeit: Sichting F, Holowka NB, Hansen OB, Lieberman DE. Effect of the upward curvature of toe springs on walking biomechanics in humans. Sci Rep, 2020; (10): 14643. https://doi.org/10.1038/s41598-020–71247‑9.
Für die Autoren:
Dr. Freddy Sichting
Technische Universität Chemnitz
Professur Bewegungswissenschaft
Reichenhainer Str. 31/33
09126 Chemnitz
freddy.sichting@hsw.tu-chemnitz.de
Begutachteter Beitrag/reviewed paper
Sichting F, Holowka NB, Hansen OB, Lieberman DE. Wirkung der Zehensprengung im Schuh auf die Biomechanik des menschlichen Gangs. Orthopädie Technik, 2022; 73 (2): 48–59
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- iOrt – Entwicklung einer überwachenden Orthese mit neuartigem optischen Sensorsystem — 11. Februar 2026
- Nigg B M. Biomechanics of Sport Shoes. 1st edition. Calgary: University of Calgary, 2010
- Honert EC, Bastas G Zelik KE. Effect of toe joint stiffness and toe shape on walking biomechanics. Bioinspir Biomim, 2018; 13: 66007. https://doi.org/10.1088/1748–3190/aadf46
- Adamczyk PG, Collins SH. Kuo AD. The advantages of a rolling foot in human walking. J Exp Biol, 2006; 209: 3953–3963. https://doi.org/10.1242/jeb.02455
- Schaff PS, Cavanagh PR. Shoes for the insensitive foot: the effect of a “rocker bottom” shoe modification on plantar pressure distribution. Foot Ankle, 1990; 11: 129–140. https ://doi.org/10.1177/107110079001100303
- Fernández PJ et al. Evolution and function of the hominin forefoot. Proc Natl Acad Sci USA, 2018; 115: 8746–8751. https://doi. org/10.1073/pnas.1800818115
- Fernández PJ, Holowka NB, Demes B, Jungers WL. Form and function of the human and chimpanzee forefoot: implications for early hominin bipedalism. Sci Rep, 2016; 6: 30532. https://doi.org/10.1038/srep30532
- Harcourt-Smith WEH, Aiello LC. Fossils, feet and the evolution of human bipedal locomotion. J Anat, 2004; 204: 403–416. https://doi.org/10.1111/j.0021–8782.2004.00296.x
- Latimer B, Lovejoy CO. Metatarsophalangeal joints of Australopithecus afarensis. Am J Phys Anthropol, 1990; 83: 13–23. https:// doi.org/10.1002/ajpa.1330830103
- Lewis OJ. Functional morphology of the evolving hand and foot. Oxford and New York: Clarendon Press and Oxford University Press, 1989
- Susman RL, Stern JT, Jungers WL. Arboreality and bipedality in the Hadar hominids. Folia Primatol, 1984; 43: 113–156. https://doi.org/10.1159/000156176
- Venkadesan M et al. Stiffness of the human foot and evolution of the transverse arch. Nature, 2020;579: 97–100. https://doi.org/10.1038/s41586-020‑2053‑y
- Hicks JH. The mechanics of the foot. II. The plantar aponeurosis and the arch. J Anat, 1954; 88: 25–30
- Sichting F, Holowka NB, Ebrecht F, Lieberman DE. Evolutionary anatomy of the plantar aponeurosis inprimates, including humans. J Anat, 2020. https://doi.org/10.1111/joa.13173
- Welte L, Kelly LA, Lichtwark GA, Rainbow MJ. Influence of the windlass mechanism on arch-spring mechanics during dynamic foot arch deformation. JR Soc Interface, 2018; 1: 4. https://doi.org/10.1098/rsif.2018.0270
- Farris DJ, Birch J, Kelly L. Foot stiffening during the push-off phase of human walking is linked to active muscle contraction, and not the windlass mechanism. J R Soc Interface, 2020; 17: 20200208. https://doi.org/10.1098/rsif.2020.0208
- Bruening DA, Pohl MB, Takahashi KZ, Barrios JA. Midtarsal locking, the windlass mechanism, and running strike pattern: a kinematic and kinetic assessment. J Biomech, 2018; 73: 185–191. https://doi.org/10.1016/j.jbiomech.2018.04.010
- Caravaggi P, Sforza C, Leardini A, Portinaro N, Panou A. Effect of plano-valgus foot posture on midfoot kinematics during barefoot walking in an adolescent population. J Foot Ankle Res, 2018; 11: 55. https://doi.org/10.1186/s1304 7–018-0297–7
- Cigoja S et al. The effects of increased midsole bending stiffness of sport shoes on muscle-tendon unit shortening and shortening velocity: a randomized crossover trial in recreational male runners. Sports Med, 2020; 6: 9. https://doi.org/10.1186/s40798-020‑0241‑9
- Farris DJ, Kelly LA, Cresswell AG, Lichtwark GA. The functional importance of human foot muscles for bipedal locomotion. Proc Natl Acad Sci USA, 2019;116: 1645–1650. https://doi.org/10.1073/pnas.18128
- Kelly, L. A., Cresswell, A. G., Racinais, S., Whiteley, R. & Lichtwark, G. Intrinsic foot muscles have the capacity to control deformation of the longitudinal arch. J. R. Soc. Interface 11, 20131188. https ://doi.org/10.1098/rsif.2013.1188 (2014)
- Holowka NB, Wallace IJ, Lieberman DE. Foot strength and stiffness are related to footwear use in a comparison of minimally- vs. conventionallyshod populations. Sci Rep, 2018; 8: 3679. https://doi.org/10.1038/s41598-018–21916‑7
- Farris DJ, Kelly LA, Cresswell AG, Lichtwark GA.The functional importance of human foot muscles for bipedal locomotion. Proc Natl Acad Sci USA, 2019; 116: 1645–1650. https://doi.org/10.1073/pnas.18128
- Mann R, Inman VT. Phasic Activity of Intrinsic Muscles of the Foot. J Bone Joint Surg Am, 1964; 46:469–481
- McKeon PO, Hertel J, Bramble D, Davis I. The foot core system: a new paradigm for understanding intrinsic foot muscle function. Br J Sports Med, 2015; 49:290. https://doi.org/10.1136/bjspo rts-2013–092690
- Zipfel B, Berger LR. Shod versus unshod: The emergence of forefoot pathology in modern humans? The Foot, 2007; 17: 205–213. https://doi.org/10.1016/j.foot.2007.06.002
- Tong KB, Furia J. Economic burden of plantar fasciitis treatment in the United States. Am J Orthop,2010; 39: 227–231
- Wearing SC, Smeathers JE, Urry SR, Hennig EM, Hills AP. The pathomechanics of plantar fasciitis. Sports Med, 2006; 36: 585–611. https://doi.org/10.2165/00007256–200636070-00004
- Cheung RTH, Sze LKY, Mok NW, Ng GYF. Intrinsic foot muscle volume in experienced runners with and without chronic plantar fasciitis. J Sci Med Sport, 2016; 19: 713–715. https://doi.org/10.1016/j.jsams.2015.11.004
- Holowka NB, Wallace IJ, Lieberman DE. Foot strength and stiffness are related to footwear use in a comparison of minimally- vs. conventionallyshod populations. Sci Rep, 2018; 8: 3679. https://doi.org/10.1038/s41598-018–21916‑7
- Chen TL‑W, Sze LKY, Davis IS, Cheung RTH. Effects of training in minimalist shoes on the intrinsic and extrinsic foot muscle volume. Clin Biomech (Bristol, Avon), 2016; 36: 8–13. https //doi.org/10.1016/j.clinbiomech.2016.05.010
- Ridge ST et al. Walking in minimalist shoes is effective for strengthening foot muscles. Med Sci Sports Exercise, 2019; 51: 104–113. https://doi.org/10.1249/MSS.0000000000001751
- Lieberman DE. What we can learn about running from barefoot running: an evolutionary medical perspective.Exercise Sport Sci Rev, 2012; 40: 63–72. https://doi.org/10.1097/JES.0b013 e31824ab210
- Connolly TJ et al. Getting beyond the point: textiles of the terminal pleistocene/early holocene in theNorthwestern Great Basin. Am Antiq, 2016; 81: 490–514. https://doi.org/10.1017/S0002731600003966
- Trinkaus E. Anatomical evidence for the antiquity of human footwear use. J Archaeol Sci, 2005; 32: 1515–1526. https://doi.org/10.1016/j.jas.2005.04.006
- Tenner E. Our Own Devices. The Past and Future of Body Technology. New York: Alfred A. Knopf, 2003
- Hicks JH. The mechanics of the foot. II. The plantaraponeurosis and the arch. J Anat, 1954; 88: 25–30
- Stefanyshyn DJ, Nigg BM. Mechanical energy contribution of the metatarsophalangeal joint to running and sprinting. J Biomech, 1997; 30: 1081–1085. https://doi.org/10.1016/S0021-9290(97)00081‑X
- Rolian C, Lieberman DE, Hamill J, Scott JW, Werbel W. Walking, running and the evolution of short toes in humans. J Exp Biol, 2009; 212: 713–721. https://doi.org/10.1242/jeb.019885
- Honert EC, Bastas G Zelik KE. Effect of toe joint stiffness and toe shape on walking biomechanics. Bioinspir Biomim, 2018; 13: 66007. https://doi.org/10.1088/1748–3190/aadf46
- Cigoja S et al. The effects of increased midsole bending stiffness of sport shoes on muscle-tendon unit shortening and shortening velocity: a randomized crossover trial in recreational male runners. Sports Med, 2020; 6: 9. https://doi.org/10.1186/s40798-020‑0241‑9
- Toon DT. [Titel fehlt] Dissertation, Loughborough University, 2008
- Krumm D, Schwanitz S, Odenwald S. Development and reliability quantification of a novel test setup for measuring footwear bending stiffness. Sports Eng, 2013; 16: 13–19. https://doi.org/10.1007/s12283-012‑0106‑7
- Hoogkamer W, Kipp S, Kram R. The biomechanics of competitive male runners in three marathon racing shoes: a randomized crossover study. Sports Med, 2019; 49: 133–143. https://doi.org/10.1007/s40279-018‑1024‑z
- Alexander RM, Jayes AS. A dynamic similarity hypothesis for the gaits of quadrupedal mammals. J Zool, 1983; 201: 135–152. https://doi.org/10.1111/j.1469–7998.1983.tb04266.x
- Leardini, A. et al. Rear-foot, mid-foot and forefoot motion during the stance phase of gait. Gait Posture 25, 453–462. https ://doi. org/10.1016/j.gaitpost.2006.05.017 (2007).
- Kristianslund, E., Krosshaug, T. & van den Bogert, A. J. Effect of low pass filtering on joint moments from inverse dynamics: implications for injury prevention. J. Biomech. 45, 666–671. https://doi.org/10.1016/j.jbiom ech.2011.12.011 (2012).
- Leardini, A. et al. Rear-foot, mid-foot and forefoot motion during the stance phase of gait. Gait Posture 25, 453–462. https ://doi. org/10.1016/j.gaitpost.2006.05.017 (2007).
- Caravaggi P et al. Reliability of medial-longitudinal-arch measures for skin-markers based kinematic analysis. J Biomech, 2019; 88: 180–185. https://doi.org/10.1016/j.jbiomech.2019.03.017
- Leardini, A. et al. Rear-foot, mid-foot and forefoot motion during the stance phase of gait. Gait Posture 25, 453–462. https ://doi. org/10.1016/j.gaitpost.2006.05.017 (2007).
- Caravaggi P et al. Reliability of medial-longitudinal-arch measures for skin-markers based kinematic analysis. J Biomech, 2019; 88: 180–185. https://doi.org/10.1016/j.jbiomech.2019.03.017
- Kern AM, Papachatzis N, Patterson JM, Bruening DA, Takahashi KZ. Ankle and midtarsal joint quasistiffness during walking with added mass. PeerJ, 2019;7: e7487. https://doi.org/10.7717/peerj.7487
- Farris DJ, Kelly LA, Cresswell AG, Lichtwark GA. The functional importance of human foot muscles for bipedal locomotion. Proc Natl Acad Sci USA, 2019; 116: 1645–1650. https://doi.org/10.1073/pnas.18128
- Rolian C, Lieberman DE, Hamill J, Scott JW, Werbel W. Walking, running and the evolution of short toes in humans. J Exp Biol, 2009; 212: 713–721. https://doi.org/10.1242/jeb.019885
- Hicks JH. The mechanics of the foot. II. The plantar aponeurosis and the arch. J Anat, 1954; 88: 25–30
- Welte L, Kelly LA, Lichtwark GA, Rainbow MJ. Influence of the windlass mechanism on arch-spring mechanics during dynamic foot arch deformation. JR Soc Interface, 2018; 1: 4. https://doi.org/10.1098/rsif.2018.0270
- Caravaggi P, Pataky T, Goulermas JY, Savage R, Crompton R. A dynamic model of the windlass mechanism of the foot: evidence for early stance phase preloading of the plantar aponeurosis. J Exp Biol, 2009; 212: 2491–2499. https://doi.org/10.1242/ jeb.025767
- Fessel G et al. Changes in length of the plantar aponeurosis during the stance phase of gait: an in vivo dynamic fluoroscopic study. Ann Anat = Anatomischer Anzeiger, 2014; 196: 471–478. https://doi.org/10.1016/j.aanat.2014.07.003
- Gefen A. The in vivo elastic properties of the plantar fascia during the contact phase of walking. Foot Ankle Int, 24, 2003; 238–244. https://doi.org/10.1177/107110070302400307
- Hicks JH. The mechanics of the foot. II. The plantar aponeurosis and the arch. J Anat, 1954; 88: 25–30
- Farris DJ, Birch J, Kelly L. Foot stiffening during the push-off phase of human walking is linked to active muscle contraction, and not the windlass mechanism. J R Soc Interface, 2020; 17: 20200208. https://doi.org/10.1098/rsif.2020.0208
- Willwacher S, König M, Potthast W, Brüggemann G‑P. Does specific footwear facilitate energy storage and return at the metatarsophalangeal joint in running? J Appl Biomech, 2013; 29: 583–592. https://doi.org/10.1123/jab.29.5.583
- Stefanyshyn DJ, Nigg BM. Influence of midsole bending stiffness on joint energy and jump height performance.Med Sci Sports Exerc, 2000; 32: 471–476
- Oleson M, Adler D, Goldsmith P. A comparison of forefoot stiffness in running and running shoe bending stiffness. J Biomech, 2005; 38: 1886–1894. https://doi.org/10.1016/j.jbiomech.2004.08.014
- Oh K, Park S. The bending stiffness of shoes is beneficial to running energetics if it does not disturb the natural MTP joint flexion. J Biomech, 2017; 53: 127–135. https://doi.org/10.1016/j.jbiomech.2017.01.014
- Farris DJ, Kelly LA, Cresswell AG, Lichtwark GA. The functional importance of human foot muscles for bipedal locomotion. Proc Natl Acad Sci USA, 2019; 116: 1645–1650. https://doi.org/10.1073/pnas.18128
- Farris DJ, Birch J, Kelly L. Foot stiffening during the push-off phase of human walking is linked to active muscle contraction, and not the windlass mechanism. J R Soc Interface, 2020; 17: 20200208. https://doi.org/10.1098/rsif.2020.0208
- Farris DJ, Kelly LA, Cresswell AG, Lichtwark GA. The functional importance of human foot muscles for bipedal locomotion. Proc Natl Acad Sci USA, 2019; 116: 1645–1650. https://doi.org/10.1073/pnas.18128
- Althoff T et al. Large-scale physical activity data reveal worldwide activity inequality. Nature, 2017; 547: 336–339. https://doi.org/10.1038/nature23018
- Holowka NB, Wallace IJ, Lieberman DE. Foot strength and stiffness are related to footwear use in a comparison of minimally- vs. conventionallyshod populations. Sci Rep, 2018; 8: 3679. https://doi.org/10.1038/s41598-018–21916‑7
- McKeon PO, Hertel J, Bramble D, Davis I. The foot core system: a new paradigm for understanding intrinsic foot muscle function. Br J Sports Med, 2015; 49: 290. https://doi.org/10.1136/bjspo rts-2013–092690
- Wearing SC, Smeathers JE, Urry SR, Hennig EM, Hills AP. The pathomechanics of plantar fasciitis. Sports Med, 2006; 36: 585–611. https://doi.org/10.2165/00007256–200636070-00004
- Cole C, Seto C, Gazewood J. Plantar fasciitis: evidence-based review of diagnosis and therapy. Am Fam Physician, 2005; 72: 2237–2242
- Farris DJ, Birch J, Kelly L. Foot stiffening during the push-off phase of human walking is linked to active muscle contraction, and not the windlass mechanism. J R Soc Interface, 2020; 17: 20200208. https://doi.org/10.1098/rsif.2020.0208
- Kelly LA, Farris DJ, Cresswell AG, Lichtwark GA. Intrinsic foot muscles contribute to elastic energy storage and return in the human foot. J Appl Physiol, 2019; 126: 231–238. https://doi.org/10.1152/japplphysiol.00736.2018
- Bruening DA, Takahashi KZ. Partitioning ground reaction forces for multi-segment foot joint kinetics. Gait Posture, 2018; 62: 111–116. https://doi.org/10.1016/j.gaitpost.2018.03.001
- Cavanagh PR. The Running Shoe book. [The Complete Story of the Running Shoe; Its History and Evolution, How It Is Manufactured and Tested, How It Can Help Prevent Injuries, and a Ten-Point Plan to Help You Choose the Shoe That’s Right for You]. Mountain View, CA: Anderson World, 1980
- Honert EC, Bastas G Zelik KE. Effect of toe joint stiffness and toe shape on walking biomechanics. Bioinspir Biomim, 2018; 13: 66007. https://doi.org/10.1088/1748–3190/aadf46
- Adamczyk PG, Collins SH. Kuo AD. The advantages of a rolling foot in human walking. J Exp Biol, 2006; 209: 3953–3963. https://doi.org/10.1242/jeb.02455