Einführung
Der Grad der Nutzbarkeit einer Prothese für einen Prothesenanwender hängt außer von deren mechanischen Komponenten von drei weiteren Faktoren ab: I) der Güte und Passform des Schafts, II), der „Intelligenz“ der Steuerung und III) dem mentalen und physiologischen Zustand des Amputierten. Die tägliche Praxis zeigt leider, dass speziell dem dritten Punkt zu wenig Augenmerk geschenkt wird. So bleibt im Allgemeinen schon während des Rehabilitationstrainings, das ja nach der Amputation die bestmögliche physiologische Wiederherstellung unterstützen soll, zu wenig Zeit für ein eingehendes Training mit dem späteren Prothesenanwender. Jüngst Amputierte berichten, dass für sie pro Tag maximal eine Stunde Training eingeplant wurde, und dass für den Rest des Tages zwar eigenes Training vorgesehen war, dieses jedoch mangels Führung und Feedback nur rudimentär erfolgreich durchgeführt werden konnte. Noch weiter unterrepräsentiert ist Training in mentaler Hinsicht. Die Motivation zu selbstständigem Training steigt mit dem Grad der Autonomie. Hat der Anwender die Möglichkeit, sein Training selbst zu gestalten und vor allem den Zielerfüllungsgrad auch selbst zu kontrollieren, so steigt auch die Selbstmotivation.
Die Erreichung eines möglichst hohen Wiederherstellungs- und Rehabilitationsgrades nach einer Amputation muss also ein Ziel aller Beteiligten sein. Dafür wird es auch langsam Zeit, datiert doch der Fund einer künstlichen Hand an einer Mumie bis etwa auf das Jahr 300 vor Christus zurück und bestätigt, dass dies schon Thema im antiken Ägypten war. Experten schätzen die Verwendung von mechanischen Handprothesen mit nur einem Freiheitsgrad bis ins späte Mittelalter hinein 1. Anfang des 16. Jahrhunderts erhielt Ritter Götz von Berlichingen (1480–1562) eine mechanisch betriebene Hand (die 1. Jagsthäuser Hand) mit einzeln beweglichen Fingern, die aber recht reparaturanfällig gewesen sein soll 2. Heutige Handprothesen werden durch Elektromotoren betrieben und bevorzugt Elektro-Myogramm-gesteuert (EMG) ausgeführt 3.
Nach Statistiken sind gesamt gesehen etwa 87 % der Amputationen auf Gefäßerkrankungen, 4 % auf Traumata, 2 % auf Tumore, 2 % auf Infektionen, 0,2 % auf angeborene Fehlbildungen und schließlich 5 % auf andere Ursachen zurückzuführen 4. Obwohl hier die unteren Extremitäten den Großteil einnehmen, stieg und steigt in jüngster Zeit auch die Bedeutung der Wiederherstellung der oberen Extremitäten an, zumal die technischen Möglichkeiten in den letzten Jahren eine rasante Entwicklung machten. Bedingt durch die höheren funktionalen Anforderungen (ein kompletter Arm hat 28 Freiheitsgrade), stellen Amputationen an den oberen Extremitäten nach wie vor eine Menge Herausforderungen an Mediziner und Chirurgen (z. B. TMR, Muskel- und Nerventransfer), Physio- und Ergotherapeuten, Orthopädie-Techniker und natürlich auch an die Hersteller von Prothesen und deren Ingenieure. Dabei erlangt der Einsatz von umfangreichen Softwarelösungen immer mehr an Bedeutung. Die dabei angewandten, immer komplexeren Methoden zum Wohle des Prothesenanwenders dürfen jedoch die Bedienung einer Prothese selbst nicht komplizieren – im Gegenteil – die Bedienung sollte immer mehr in intuitiver Art möglich sein.
Anwender werden in der Regel nach erfolgter Amputation, Wundheilung und Rehabilitations-Training mit Prothesen versorgt. Dabei sind die Fertigkeiten, die ein Anwender mitbringt, von Fall zu Fall sehr unterschiedlich. Es spielen hier sowohl die Ausgangssituation des Amputierten vor der Amputation, die Art und Schwere der Verletzung als auch die Güte und Dauer der Physiotherapie eine entscheidende Rolle. Es kommt auch vor, dass alle Wiederherstellungsversuche einer betroffenen Gliedmaße misslingen, und diese dann doch noch abgenommen werden muss, da sie letztlich gelähmt geblieben ist. Das Spektrum der verbleibenden Defizite ist leider immer noch groß. Neben solchen physiologisch bedingten Ursachen können auch mentale und psychische Probleme dazu führen, dass ein Amputierter eine Prothese nicht oder nur unzureichend ansteuern kann.
Zur Steuerung der Prothese lernt der Anwender gezielt Muskelkontraktionen auszuführen, deren EMG-Signal durch Elektroden über den betreffenden Muskeln abgeleitet wird. Mit den steigenden Anforderungen an multifunktionale Prothesen werden nun verstärkt Phantombewegungen eingesetzt, da diese einer natürlich-intuitiven Bedienung am nächsten kommen. Eine Phantombewegung ist die Bewegung eines bereits abgenommenen Gliedes, das durch seine verbliebene Repräsentation im neuronalen Netzwerk des Gehirns nach wie vor bedient werden kann. Der Amputierte besitzt also noch einen Rest mentaler Vorstellung über die Funktionalität des abgenommenen Gliedes, z. B. „wie kann ich das Handgelenk nach oben schwenken“.
Es kann sein, dass ein Amputierter bereits Bewegungen einfach vergessen hat, wenn er für eine längere Zeit eine betreffende Muskelgruppe nicht mehr angesteuert hat. Aber selbst da kann durch gezieltes Training eine Verbesserung der Situation erfolgen, wie eine Studie an Paraplegie-Patienten unter Zuhilfenahme funktioneller Magnetresonanztomographie (fMRI) gezeigt hat 5. Laut einer anderen Studie der US-Armee führt „aggressives und frühes“ Training, das innerhalb von 30 Tagen ab Amputation gestartet wird, zu einer Rehabilitationserfolgsrate von 93 % und einer Wiedereinsatzrate von 100 % innerhalb von vier Monaten. Diese Zeitspanne wird „Golden-Window“ genannt; vergleichsweise führt Training, das erst nach dem Golden-Window beginnt, also nach 30 Tagen und mehr zu einer Rehabilitationserfolgsrate von 42 % und einer Wiedereinsatzrate von nur mehr 15 %, bezogen auf die Zeitspanne von sechs Monaten bis zwei Jahren 6.
Es liegt klar auf der Hand, dass die eingesetzten Rehabilitationstechnologien sich immer mehr an anwenderzentrierte Sichtweisen anpassen müssen, also die Technologie auf die Bedürfnisse von Menschen zuzuschneiden ist und neue Steuerungskonzepte zu entwickeln sind. Im Kern dieses Artikels wird ein neues Konzept vorgestellt, das patientenorientiertes Training mit maximaler Effizienz ermöglicht. So wird im Folgenden gezeigt, wie die versuchsweise klinische Anwendung einer in Entwicklung befindlichen Trainingssoftware von Otto Bock die Physiotherapie nicht nur unterstützen kann, sondern auch eine bedeutende Entlastung für die Therapeuten bringt, wodurch ein längeres und intensiveres Training bei gleichem Stundeneinsatz ermöglicht wird. Diese Trainingssoftware wird im Zuge eines EU-Projektes in Zusammenarbeit der Medizinischen Universität Göttingen, TU-Berlin und der TU-Wien von Otto Bock Healthcare Products GmbH entwickelt. Die Erprobung erfolgt derzeit in einer klinischen Studie in Zusammenarbeit des Christian Doppler Labors für die Wiederherstellung von Extremitätenfunktionen der Medizinischen Universität Wien, unter der Leitung von Prof. Dr. Oskar Aszmann, und Otto Bock Wien.
Weiterentwicklung des State-of-the-Art bei Prothesen der oberen Extremität
Um beim Signal zu beginnen – ein EMG-Signal entsteht während einer Muskelkontraktion im Muskel und wird an der Hautoberfläche entweder von Ag-AgCl (Silber/SilberChlorid) oder aber Titan-Elektroden abgegriffen und an die Prothesensteuerung weitergeleitet. Im Allgemeinen werden zwei Elektroden verwendet, eine wird dazu auf der Hautoberfläche oberhalb der Flexor-Muskelgruppe, die andere über der Extensions-Muskelgruppe angebracht. Damit sind die Bewegungen „Schließen“ und „Öffnen“ eines einzelnen Freiheitsgrades (Engl. Degree of Freedom, DOF) vom Amputierten individuell steuerbar 7.
In den letzten Jahren konnten weitere Prothesenkomponenten entwickelt werden (z. B. Handgelenksrotation, Handgelenksflexion bzw. ‑extension, Ellbogenbeuger), die dem Anwender weitere Freiheitsgrade zur Verfügung stellen können. Durch speziell vereinbarte und willentlich vom Anwender erzeugte kurze Umschaltsignale (z. B. Ko-Kontraktion beider Muskelgruppen, impulsartige Kontraktion oder das längere „Öffnen“ eines Signals) ist es möglich, die Kontrolle zwischen den Prothesenkomponenten umzuschalten und damit die Steuerung jeder Komponente durch die beiden Elektrodensignale zu gewährleisten. Diese Umschaltungen zwischen den Prothesenkomponenten funktionieren zwar ganz gut, besitzen jedoch einige gravierende Nachteile. Ein Nachteil ist, dass der Anwender sich merken muss, welche Komponente er zuletzt bedient hatte, sofern er nicht eine automatische Zwangsrückschaltung in eine bestimmte Komponente ausgewählt hat. Ein weiterer Nachteil ist, dass die Umschaltung sequentiell erfolgt, so dass im Extremfall alle Komponenten durchlaufen werden müssen, um die „letzte“ Komponente in Folge zu erreichen.
Der gravierendste Nachteil ist aber die mangelnde Neurointegration der Prothesensteuerung in den Motorkortex und das Kleinhirn des Anwenders durch dieses sequentielle Umschalten. Dadurch wird die Bedienung der Prothese in hohem Maße nichtlinear. Die inhärente Plastizität des Gehirns würde eine direkte und intuitive Ansteuerung durch parallel vorhandene Steuersignale derart unterstützen, dass sie die Steuerbefehle von der explizit kognitiven Ebene über die Zeit in die prozedurale Ebene verlagern könnte. Dies würde bedeuten, dass der Anwender schließlich nicht mehr darüber nachdenken müsste, wie er konkret die Prothese bedienen soll, um eine Folge von Manipulationen der Reihe nach zu realisieren. Die Prothesenfunktion würde in den Motorkortex und die dort ablaufenden Motorprogramme integriert werden, was einer maximal möglichen intuitiven Bedienung nahe käme.
Herausforderungen durch neue Prothesenkomponenten
Es sind also durch den Fortschritt der technischen Entwicklung und Miniaturisierung einerseits Vorteile in Form von vielfältigeren Bewegungsmöglichkeiten entstanden, andererseits stoßen konventionelle Vorgangsweisen und Steuerungen rasch an ihre Grenzen. So wurden eben in den letzten Jahren Prothesenkomponenten entwickelt, die dem Amputierten höhere Freiheitsgrade zur Verfügung zu stellen. Das Problem dabei ist, dass es nicht einfach ist, mehr als zwei bis maximal vier unabhängige EMG-Signale von einem Unterarmamputierten der Mustererkennung zur Verfügung zu stellen (Ausnahme: Targeted Muscle Reinnervation TMR). Bei kurzem Amputationsniveau stehen im besten Falle vierzehn einzelne Muskeln zur Verfügung, deren Aktivierung jedoch in synergistischer Weise erfolgt. Ein Synergismus bedeutet allgemein das Zusammenwirken von Substanzen oder Faktoren, die sich gegenseitig fördern. Bei den aus Prothesensicht interessanten sieben Muskelkontraktionen (also den vier Handgelenksbewegungen: Extension/Flexion/Supination/Pronation und den drei Handfunktionen der Michelangelo® Hand: Öffnen/Schlüsselgriff/Oppositionsgriff) wirken leider nicht sieben, passend durch Elektroden ermittelbare Signale, sondern es werden je nach Bewegungsvorgang Muskeln synergistisch (Synergismus) zu Muskelgruppen zusammengeschaltet 8. Damit überlagern sich die Signale jedes einzelnen Muskels an jeder Elektrode zu je einer Mixtur, die mit konventionellen Methoden nicht trennbar ist.
Um diese komplexen physiologischen Zusammenhänge besser zu veranschaulichen, bedient man sich am besten eines Modells. Abbildung 1 zeigt so ein generisches, physiologisches Modell 9, das im Prinzip aus drei Funktionsgruppen besteht: I) eine rechteckige Synergie-Matrix S, II) den Muskeln des Unterarms (als parallel liegende Rechtecke gezeichnet) und III) einer Mix-Matrix G. Man muss sich vorstellen, dass an einer Stelle im Gehirn, genauer gesagt dem Präfrontalen Kortex (= Zentren Willkürlicher Entscheidungsfindung), eine Bewegungsentscheidung getroffen wird, diese im Modell von links als Funktionskomponente des Muskelfunktionsvektors F(t) über die Synergie-Matrix S derart an die gezeichneten Muskeln geleitet wird, dass deren Rekrutierung der Bewegungsentscheidung entsprechend durchgeführt wird. Die Synergie-Matrix ist also für die Auswahl der Muskeln zu einer „gedachten“ Bewegungsentscheidung verantwortlich. Vom Motorkortex aus werden nun die efferenten Steuersignale an die Motorneuronen im Rückenmark geleitet, im Modell mit D(t) bezeichnet; die Motorneuronen innervieren Muskelfasern, und die ausgewählten Muskeln kontrahieren. Dieses Kontrahieren erzeugt in den Muskeln die „inneren“ EMG-Signale, im Modell als Y(t) bezeichnet, welche durch die Mix-Matrix G(t) an die Hautoberfläche gelangen und schließlich als Z(t)-Signale von Elektroden abgeleitet werden.
Definition der Steuerungsmuster aus Phantombewegungen
Werden also z. B. acht Elektroden um einen Unterarm herum angeordnet, so erzeugt jede Muskelkontraktion einer (Phantom-)Bewegung ein charakteristisches Potenzialfeld auf der Hautoberfläche, das von den Elektroden äquidistant aufgenommen wird (siehe Abb. 2). Abbildung 2 zeigt eine Trainingsanordnung, die bereits sehr früh dem Anwender angelegt werden kann, da kein expliziter Schaft benötigt wird. Später werden die Elektroden im tatsächlichen Schaft angebracht, was das Trainingsparadigma selbst nicht ändert. Die acht Elektroden liefern also ein bestimmtes Muster, das die Prothesensteuerung interpretieren muss, um die entsprechenden Komponenten zu bewegen. Die richtige Interpretation muss die Prothesensteuerung aber erst lernen, wozu ein Lernparadigma die benötigten Signale liefert. Man kann hierbei praktisch beliebige Muster erzeugen, um diese zu lernen und sie dann Prothesenbewegungen zuzuordnen.
Bei Otto Bock Healthcare Products GmbH wurde aber ein Schritt weiter gegangen und analysiert, welche (Phantom-)Bewegungen am Erfolg versprechendsten sind und das Potenzial haben, eine hohe Wiederholungssicherheit zu besitzen. Die Performanz-Zahlen aus diversen wissenschaftlichen Publikationen spannen ein weites Feld auf, das zwischen 50 % und 98 % oder mehr beziffert wird. Freilich erscheint eine Performanz von 50 % als mit Sicherheit unbrauchbar, entspricht sie ja einer Wahrscheinlichkeit, die beim simplen Würfeln erreicht wird. Nun welcher Anwender würde sich mit solch einer Steuerung zufrieden geben? Eher wohl keiner. Das Gros der Berichte pendelt dann um den Wert von 80 % herum 10. Was aber bedeutet nun eine Performanz von 80 %? Umgerechnet in Prothesenbewegungen würde das bedeuten, dass jede fünfte (!) Bewegung, statistisch gesehen, schief gehen könnte. Auch das erscheint für einen praktischen Betrieb einer Prothese unbrauchbar. Eine 100 %ige Performanz lässt sich wohl kaum erreichen, aber eine Annäherung an z. B. 98 % würde bedeuten, dass nur mehr jede 50. Bewegung, statistisch gesehen, schief gehen könnte.
Damit liegt man im Bereich, wo auch konventionell gesteuerte Prothesen Aussetzer haben können. Wichtig ist hierbei, dass die Prothese, bei Unklarheit, welche Bewegung ausgeführt werden soll, eben keine falsche Bewegung ausführt, sondern sich einfach nicht bewegt und damit den zuvor aktivierten Zustand beibehält (z. B. ein Glas halten). Eine Wiederholung der Bewegungsausführung durch den Anwender löst dann das Problem auf. Die Arbeiten der Forschung und Produktentwicklung bei Otto Bock Healthcare Products GmbH zielen laufend in Richtung der steten Erhöhung der Wiedererkennungsperformanz in Richtung 100 % ab, wobei Fehlbedienungen, die eindeutig dem Anwender zuzuschreiben sind, davon natürlich ausgenommen sind.
Das Lernparadigma mit optischem Feedback
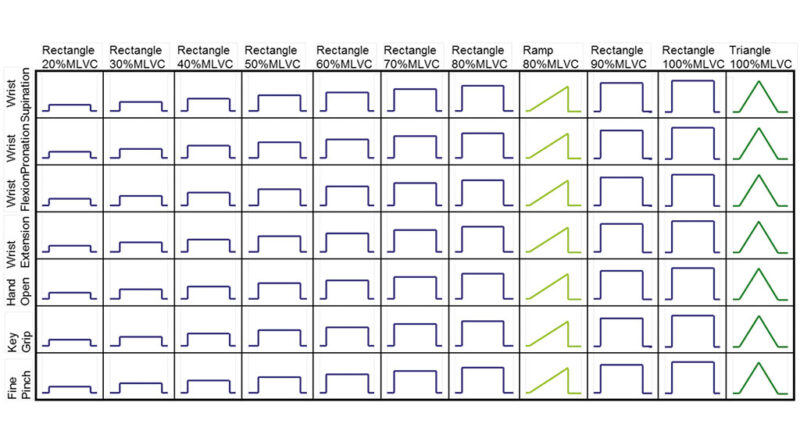
Wie schon im Absatz zuvor beschrieben, erfolgt gezieltes Training durch ein genau definiertes Lernparadigma, das auch eine exakte Wiederholung von Lernschritten ermöglicht. Gelernt wird mit Unterstützung einer Trainingssoftware, die auch Physiotherapeuten und Orthopädie-Techniker entscheidend bei deren Zielerreichung – Anwender kann eine Prothese sicher steuern – unterstützt. Das Lernen von sieben Phantombewegungen benötigt natürlich auch etwas mehr Zeit, als man dies für Zweielektrodensysteme gewohnt ist. Der Vorteil liegt aber, wie eingangs schon erwähnt, im Entfallen der Umschaltung zwischen den Prothesengelenken und vor allem in der besseren Integration der Prothesensteuerung im Motorkortex und Kleinhirn des Anwenders. Darauf wurde das Lernparadigma abgestimmt – es werden dem Anwender Bewegungsvorgaben, wie in Abbildung 3 gezeigt, für jede zu trainierende (Phantom)-Bewegung mit wechselnden Kontraktionsstärken vorgegeben, wie in Abbildung 4 gezeigt.
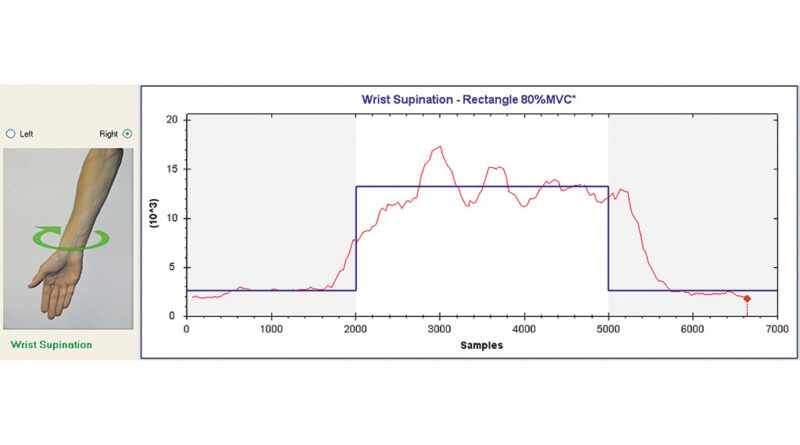
Zunächst wird eine Kalibrierung durchgeführt, bei der alle möglichen Phantombewegungen mit für den Anwender maximal angenehmer Kontraktionsstärke durchgeführt werden. Dies ist dazu notwendig, um die unterschiedlichen EMG-Stärken zu vereinheitlichen. Abbildung 3 zeigt ein Beispiel für die Vorgabe für das Training der Handgelenks-Supination mit 80 % der maximalen Kontraktionsstärke (MVC). Im linken Teil der Abbildung wird die aktuelle Bewegung als Bild seitenrichtig angezeigt, während der rechte Teil einen Kontraktions-/Zeitgraphen zeigt, der in Blau die Profilvorgabe für 80 % MVC als Rechteckfunktion anzeigt, dem überlagert ist in Rot die vom Anwender erzeugte Kontraktionsstärke, wobei der rote Punkt mit der Zeit über den Graphen läuft. Die Abweichungen zwischen der blauen Vorgabe und dem roten Kontraktionsverlauf des Anwenders ergeben einen Score, der der Fertigkeit oder Englisch „Ability“ des Anwenders entspricht, das so präsentierte „Item“ zu meistern.
Entsprechend der Abbildung 4 wird mit jedem der darin gezeigten Items so verfahren, was einer Datenaufnahme für das Training des Klassifikators gleichkommt, der die erzeugten und abgeleiteten EMG-Signalmuster letztlich Prothesenbewegungen zuordnet. Die Trainingssoftware führt also den Anwender durch das gesamte Trainingsset; eine Sprachausgabe kündigt automatisch den Beginn einer neuen Bewegungs-/Kontraktionsgruppe akustisch an. Einstellbare Pausen- und Kontraktionszeiten gestatten es, das Training an die jeweiligen Bedürfnisse des Anwenders abzustimmen.
Durch mehrmalige Wiederholung dieses Trainings entsteht ein Datenpool mit immer mehr Daten, die eine immer bessere Repräsentation der Phantombewegungen ermöglichen. Abbildung 5 zeigt, wie die Repräsentation des Datenpools graphisch aufbereitet dem Anwender Feedback seiner Bewegungen geben kann. Links in der Abbildung ist eine mehrfarbige, sternförmige Punktwolke zu sehen, wo jede Farbe einer (Phantom)-Bewegung entspricht (blau = Entspannt, rot = Handgelenkssupination, lila = Handgelenkspronation, gelb = Handgelenksflexion, grün = Handgelenksextension, rosa = Hand auf, grau = Schlüsselgriff und braun = Oppositions-Griff). Das blaue Rechteck im Zentrum des Sternes zeigt den Zustand der Ruhe an, der mit „No-Move“ tituliert ist. Von dieser Ruhelage, also dem entspannten Zustand der Muskeln, können die jeweiligen Prothesenbewegungen direkt durch Aktivierung der (Phantom)-Bewegungen ohne Umschaltung initiiert werden. Das bedeutet, dass das blaue Rechteck lila wird und sich in die lila Punktwolke bewegt, sobald der Anwender die Muskeln einer Handgelenkspronation kontrahiert.
Dabei gilt, je größer der Abstand des Rechtecks zur Ruheposition wird, desto stärker ist die Kontraktion des Anwenders. Dieser erhält also ein direktes Feedback über die erkannte Bewegungsart und deren Intensität. Dem Anwender werden also einerseits die unter Beisein eines Therapeuten trainierten Bewegungen durch die farbigen Punktwolken vor Augen geführt und andererseits seine aktuellen Bewegungen mit den früher trainierten in Beziehung gesetzt. Dies ermöglicht dem Anwender ein sicheres Training, da er sich an die farblichen Vorgaben der Punktwolken halten kann und ihm eine falsche Bewegung sofort auffallen würde, bewegte er sich ja dann außerhalb der farbigen Punktwolken.
In Abbildung 5 ist auch rechts eine virtuelle Michelangelo® Prothese zu sehen, die während des Trainings durch die Muskelkontraktionen des Anwenders bedient werden kann. Der Anwender bekommt also von dieser Trainingssoftware optimale Unterstützung für sein autonomes Training. Für den Physiotherapeuten könnte diese Software eine wertvolle Unterstützung sein, und durch diese inhärente Entlastung könnten auch mehrere fortgeschrittene Anwender (aus unserer Sicht drei bis vier) parallel von einem Physiotherapeuten betreut werden, da die Anleitung im Training durch die Software gegeben ist und der Therapeut entkoppelt von der reinen Trainingsdurchführung sich der individuellen Betreuung der Gruppe widmen könnte.
Resultate
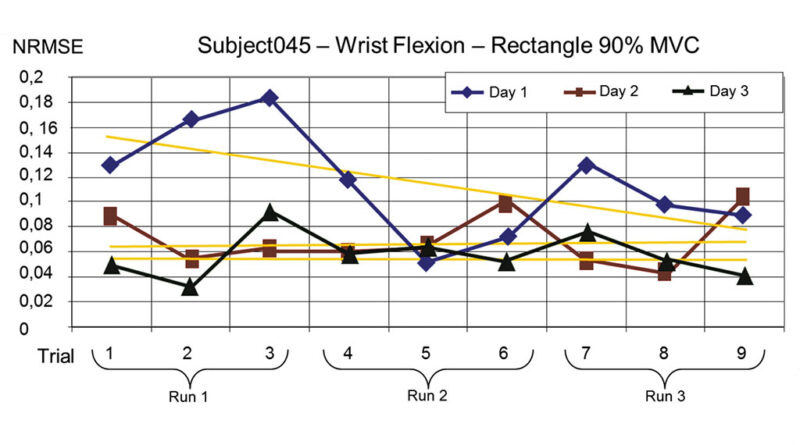
Abbildung 6 zeigt den exemplarischen Verlauf (aus einer derzeit laufenden klinischen Studie) eines dreitägigen Trainings für Handgelenksflexionsbewegungen – bei 90 % der Maximal-Kontraktion MVC. Die Abszisse zeigt den zeitlichen Verlauf mehrerer Trainingsläufe (Run #); farblich kodiert sind die Trainingstage. Die Ordinate zeigt den Fehler zwischen dem Vorgabeprofil und der Leistung des Anwenders. Der Wert ist normiert auf den Bereich zwischen 0 und 1 und zeigt damit die mittlere prozentuale Abweichung, die der Anwender vom Vorgabeprofil erreicht hat. Man kann deutlich eine Abnahme des Fehlers, sowohl während eines Tages (gelbe Regressionsgerade) als auch zwischen den Tagen erkennen. Die Ergebnisse der kompletten Studie werden nach deren Abschluss publiziert und diskutiert werden.
Konklusion und Ausblick
Das zuvor beschriebene Trainingsparadigma und die Trainingssoftware werden derzeit in Zusammenarbeit mit dem Christian Doppler Labor für die Wiederherstellung von Extremitäten-Funktionen klinisch erprobt. Dabei werden TMR-Anwender und klassisch amputierte Anwender in der Studie aufgenommen. Ziel ist es, diese neue Methode mit der konventionellen Vorgangsweise zu vergleichen und die Vorteile bzw. etwaige Nachteile klar herauszuarbeiten.
Der Autor:
Peter Göbel
Otto Bock Healthcare Products GmbH
Kaiserstr. 39
A – 1070 Wien
peter.goebel@ottobock.com
Begutachteter Beitrag/Reviewed paper
Göbel P, Honeder JL, Erber St, van Vliet H‑W. Visuelles Biofeedback für anwenderorientiertes Training und Steuerung von multifunktionalen Oberflächen-EMG Prothesen. Orthopädie Technik, 2013; 64 (2): 38–44
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Ein engagierter Leistungssportler mit Hemiparese und der Einsatz sensomotorischer Fußorthesen (SMFO) — 12. Februar 2026
- Löffler L. Der Ersatz für die obere Extremität – Die Entwicklung von den ersten Zeugnissen bis heute, Stuttgart, Ferdinand und Enke Verlag, 1984
- Löffler L. Der Ersatz für die obere Extremität – Die Entwicklung von den ersten Zeugnissen bis heute, Stuttgart, Ferdinand und Enke Verlag, 1984
- Merletti R, Parker PJ. Electromyography: Physiology, Engineering, and Non-Invasive Applications, Wiley IEEE-Press Verlag, 2004
- Amputierten-Initiative e. V. Gefäßkranke, Amputationsursachen, Online: http://www.amputierten-initiative.de/amputationsursachen.html
- Hotz-Boendermaker S, Funk M, Summers P, Brugger P, Hepp-Reymond MC, Curt A, Kollias SS. Preservation of Motor Programs in Paraplegics as Demonstrated by Attempted and Imagined Foot Movements, Neuroimage, Elsevier 2008; 39: 383–394
- Smurr LM, Gulick K, Yanosek K, Ganz O. Managing the Upper Extremity Amputee: A Protocol for Success, Journal of Hand Therapy, 2008; 21: 160–175
- Merletti R, Parker PJ. Electromyography: Physiology, Engineering, and Non-Invasive Applications, Wiley IEEE-Press Verlag, 2004
- Loeb GE. Learning from the Spinal Cord, Journal of Physiology 2001; 533.1: 111–117
- Jiang N, Englehart KB, Parker PA. Extracting simultaneous and proportional neural control information for multiple-DOF prostheses from the surface electro-myographic signal. IEEE Transactions on Biomedical Engineering 2009; 56 (4): 1070–1080
- Bai O, Lin P, Vorbach S, Li J., Furlani S, Hallet M. Exploration of computational methods for classification of movement intention during human voluntary movement from single trial EEG, Clinical Neurophysiology 2007; 118, (12): 2637–2655


![Das generative, physiologische EMG Modell [Jiang N, Englehart KB, Parker PA. Extracting simultaneous and proportional neural control information for multiple-DOF prostheses from the surface electro-myographic signal. IEEE Transactions on Biomedical Engineering 2009; 56 (4): 1070-1080].](https://360-ot.de/wp-content/uploads/2013/02/training-oberflaechen-emgprothesen-goebel-abb-1-web-800x445.jpg)