Einführung/Definition
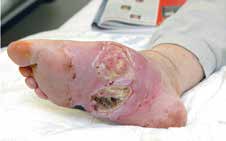
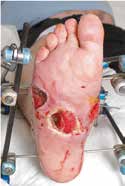
Die Charcot-Arthropathie bzw. neuropathische Osteoarthropathie (NOAP) des Fußes und Sprunggelenkes ist eine schwerwiegende Form des Diabetischen Fußsyndroms. Es ist ein deformierender und zerstörerischer Prozess auf dem Boden einer Polyneuropathie, der zu gravierenden Instabilitäten, rezidivierenden Ulzera und bakteriellen Superinfektionen führen kann (Abb. 1). Schlussendlich kann dieses Erkrankungsbild bis zur Amputation führen. Ziel der Behandlung des Charcot-Fußes ist es daher, eine Amputation zu verhindern. Dies gilt vor allem für die Majoramputation, da dieser Eingriff insbesondere beim diabetischen Patienten statistisch signifikant mit erhöhter Morbidität und Mortalität einhergeht 123.
Die Charcot-Arthropathie des Fußes wurde bei vielen Ätiologien wie Syphilis, Lepra, Syringomyelie, Analgesiesyndrom, hereditären Neuropathien, Morbus Bureau-Barrière, traumatischer Querschnittssymptomatik und zahlreichen weiteren angeborenen und erworbenen Erkrankungen des peripheren oder zentralen Nervensystems beschrieben 4. Unter den vielen Ätiologien stellt der Diabetes mellitus in unserer modernen Zeit die Hauptursache für den Charcot-Fuß dar, weil er in ca. 75 % der Fälle als Hauptursache für eine distale symmetrische Polyneuropathie kausal verantwortlich ist 5. Eine diabetische Neuroosteoarthropathie (DNOAP) entwickelt sich bei ca. 9 bis 32 % aller Patienten mit diabetischer Neuropathie – mit hoher Dunkelziffer 6789. Die Charcot-Arthropathie stellt eine hohe Gefahr einer Ulzeration im Fußbereich mit konsekutiver Superinfektion und drohender (Teil-)Amputation dar, insbesondere wenn sie spät oder gar nicht diagnostiziert wurde. Bei manifester Charcot-Arthropathie ist mit einer jährlichen Amputationsrate von 2,7 % zu rechnen 10.
Der genaue Pathomechanismus der diabetischen neuropathischen Osteoarthropathie bleibt in vielen Punkten unklar und ist seit mehr als 100 Jahren umstritten. Für die Entstehung der Osteoarthropathie ist stets eine Polyneuropathie verantwortlich, zuerst der sensiblen, später auch der motorischen und sympathischen Nervenfasern. Eine Hypothese in diesem Zusammenhang basiert auf der neurovaskulären Theorie: Mit Schädigung des Nervensystems kommt es demnach zu einer gesteigerten peripheren Zirkulation infolge einer Gefäßweitstellung und damit zu einem Auswaschphänomen des Knochens mit Verlust der Belastbarkeit.
Eine zweite Hypothese basiert auf dem neurotraumatischen/inflammatorischen Modell: Durch den weitgehenden Verlust der Sensomotorik kommt es zu repetitiven Mikrotraumata. Dies führt zur Freisetzung inflammatorischer Botenstoffe, die eine Entzündungskette aktivieren. Diese entspricht klinisch dem typischen Bild einer akuten Osteoarthropathie mit hochrotem, geschwollenem und überwärmtem Fuß.
Klinik
Klinisch imponiert die aktivierte DNOAP typischerweise mit einem einseitig geschwollenen, geröteten und überwärmten Fuß ohne oder mit geringen Schmerzen bei meist erhaltenen Fußpulsen. Auffällig ist eine Polyneuropathie, die durch Testung der Sensibilität, der Reflexe und des Vibrationsempfindens schnell und sicher identifiziert werden kann. Die Beweglichkeit kann eingeschränkt sein, oder es können auch pathologische Bewegungen bei Instabilitäten – oft schmerzlos – provoziert werden. Äußerst selten ist die Symptomatik gleichzeitig beidseits. Dagegen ist die Wahrscheinlichkeit für die bilaterale Entwicklung eines Charcot-Fußes, die nicht zeitgleich erfolgt, höchstwahrscheinlich groß 11. Sie schwankt aber stark in den untersuchten Patientenkollektiven – zwischen 9 % und 75 % 12.
Diese imposante Symptomatik kann zur Fehldiagnose der Infektion führen. Als Konsequenz daraus droht in diesen Fällen die Amputation des Fußes zur Verhinderung der vitalen Gefährdung des Patienten 13. Das Labor hilft ebenfalls nicht sicher, eine klinisch nicht auszuschließende Osteomyelitis von der DNOAP laborchemisch zu unterscheiden, da bei beiden erhöhte Leukozyten- und CRP-Werte vorliegen können. Aktuell bleibt daher die Kenntnis der Klinik Grundlage der Diagnostik. Bleibt die Diagnose weiter unklar, können intraoperativ gewonnene Gewebeproben zur histologischen und mikrobiologischen Untersuchung weiterhelfen 141516. Häufig jedoch findet sich simultan zur DNOAP eine Superinfektion – insbesondere beim Vorliegen tiefgehender Ulzera bis zum Knochen. Das kausale Krankheitsgeschehen stellt jedoch die DNOAP dar, die einer konservativen oder im Falle der Ulzeration operativen Therapie bedarf.
Die DNOAP wird klassisch nach Eichenholtz (klinisch und radiologisch) in 3 Stadien eingeteilt:
- Stadium I (Auflösung): Klinisch zeigt sich ein geschwollener und überwärmter Fuß. Die Haut ist angespannt und manchmal blutig unterlaufen. Radiologisch sind ein deutliches Weichteilödem sowie eine Knochendichteminderung teilweise bis zur kompletten Auflösung von Gelenken und Knochen sichtbar.
- Stadium II (Reparation, Aufräumen): Schwellung und Überwärmung sind rückläufig. Radiologisch liegt eine Remineralisierung und Sklerosierung des Knochens bei rückläufigem Ödem vor.
- Stadium III (Restitution, Wiederaufbau): Die klinischen Symptome sind verschwunden. Der Fuß kann teilweise groteske Fußfehlstellungen aufweisen. Radiologisch kommt eine Kondensation mit Remodellierung des Knochens unter Aufhebung der anatomischen Gelenkgrenzen mit knöcherner oder fibröser Ankylose zur Darstellung.
Durch die Einführung der MRT-Technologie wurde die Einteilung von Shibata, Tada und Hashizume modifiziert durch die Einführung eines „inflammatory or 0 stage“ 1718. Klinisch zeigt sich dabei die Symptomatik aus Stadium 1. In der konventionell radiologischen Untersuchung zeigen sich aber keine oder nur minimale Veränderungen. Im MRT zeigen sich dagegen Ödeme des Knochenmarks bzw. kleine nichtdislozierte pathologische Frakturen. In jüngster Zeit wird aber empfohlen, in aktive (Stadium 0–2 nach Eichenholtz) oder inaktive (Stadium 3 nach Eichenholtz) Stadien zu differenzieren, um den inflammatorischen bzw. ausgebrannten Zustand der Charcot-Arthropathie zu beschreiben 19.
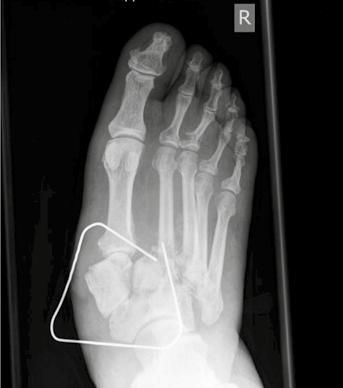
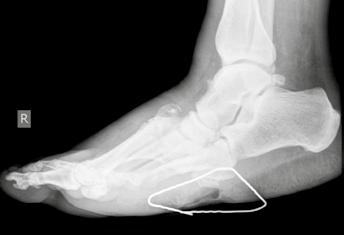
Zur topographischen, rein radiologischen Einteilung nach Befallsmuster wird meist die Klassifikation nach Sanders u. Frykberg verwendet. In Anlehnung an die Unterteilung von Sanders wird die diabetisch-neuropathische Osteoarthropathie in fünf Haupttypen klassifiziert, die den Hauptprädilektionsstellen der Erkrankung am Fuße entsprechen. Dabei wird die Häufigkeit für den Befall von Sanders & Frykberg wie folgt angegeben: Typ I = 15 % ‚Typ II = 40 % , Typ III = 30 % , Typ IV = 10 % und Typ V = 5 %. Koller ermittelte ähnliche Ergebnisse in seiner Studie 20. Die häufigsten Veränderungen am Fuß der diabetisch-neuropathischen Osteoarthropathie entfallen somit auf die Typen I, II und III (ca. 80 %). Nicht selten zeigt sich ein kombiniertes Befallsmuster (Abb. 2) 21.
- Typ I: Beim Typ I findet man Knochennekrosen im Bereich der Metatarsophalangealgelenke. Diese Nekrosen können zur sogenannten „candy stick deformity“ („Zuckerstängel-Deformität“) des Knochens führen, mit der Gefahr der knöchernen Durchspießung der Fußsohlenhaut.
- Typ II: Typ II betrifft die Tarsometatarsalgelenke, also den Bereich des Lisfranc-Gelenks, und hat als wesentliche Konsequenz – wie beim Typ III – den Verlust der Rückfußstatik zur Folge. Es kommt häufig zur Ausbildung eines Knick-Plattfußes mit deutlicher Vorfußabduktion.
- Typ III: Beim Typ III der DNOAP ist die Nekrose hauptsächlich auf den Bereich des Chopart-Gelenks, den Bereich zwischen Talus und Os naviculare, begrenzt. Hier entwickelt sich der klassische Tintenlöscherfuß mit völligem Einbrechen des Längsgewölbes und Drucküberlastung in der Mitte der Fußsohle.
- Typ IV: Bei diesem Typ, der zu den selteneren Verlaufsformen zählt, zeigt sich die Veränderung im Bereich des oberen Sprunggelenks (OSG). Es kommt dabei häufig zu massiven Instabilitäten.
- Typ V: Diese seltene Verlaufsform der DNOAP betrifft den Calcaneus und das dazugehörige talocalcaneare Gelenk. Es führt zum Zusammenbrechen dieses Gelenkabschnittes mit der zwangsläufigen Verplumpung des gesamten Rückfußes oder zu Schnabelfrakturen des Calcaneus, bedingt durch den Zug der Achillessehne.
Es existieren noch weitere Einteilungen, die das klinische Bild aber nicht wesentlich präziser klassifizieren. CT, MRT und Szintigraphie können weitergehende Informationen z. B. zur Knochenstellung beitragen, gehören aber nicht zur Standarddiagnostik. Sensitivität und Spezifität dieser Untersuchungen erlauben aber ebenfalls keine sichere Abgrenzung einer akuten DNOAP von einer Knocheninfektion oder DNOAP mit Knocheninfektion. Lediglich im frühen Stadium 0 der DNOAP ohne vorherige Ulzera erlauben Veränderungen im MRT mit typischer Klinik eine nahezu sichere Diagnostik der DNOAP 22.
Therapiekonzept
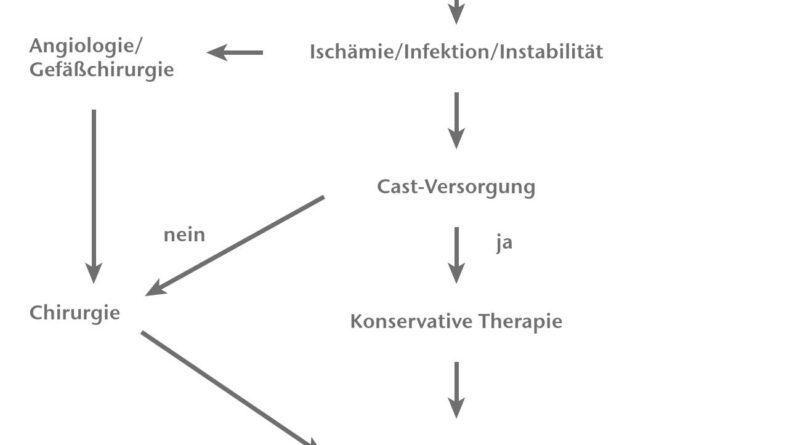
Das Management der DNOAP (Abb. 3) ist komplex und häufig mit Komplikationen behaftet. Die Einteilung in aktive und inaktive Stadien ist von größter Bedeutung für das therapeutische Vorgehen. Im klinisch aktiven Stadium hat die konservative Behandlung mittels Total-Contact-Cast Vorrang; etwa 75 % der Patienten können konservativ behandelt werden 23. Der Total-Contact-Cast gilt als Goldstandard in der Behandlung des aktivierten Charcot-Fußes, wobei der Walker eine Alternative darstellt, insbesondere wenn keine TCC-Behandlung möglich oder nicht gewünscht ist. Die Therapie im Total-Contact-Cast wird für 6 bis 12 Wochen durchgeführt. Erfolgt sie frühzeitig und effizient, kann ein Zusammenbrechen der knöchernen Strukturen verhindert werden 24.
Anschließend hat sich eine Versorgung in einer Unterschenkelorthese für weitere 3 bis 12 Monate bewährt 25. Hierbei muss allerdings die deutlich verzögerte Knochenheilung bei DNOAP berücksichtigt werden. Ist es zu einer knöchernen Konsolidierung gekommen bzw. ist der Charcot-Fuß inaktiv, kann der Patient mit orthopädischen Maßschuhen versorgt und mobilisiert werden.
Bei konservativ nicht beherrschbarer komplexer Fehlstellung/Instabilität, chronischen Ulzera oder aufgesetzter Osteomyelitis besteht eine Operationsindikation. Tritt ein massiver, tiefer Infekt mit septischen Zeichen ein, muss schnellstmöglich gehandelt werden, um fatale Folgen wie Amputationen oder sogar das Versterben an einer Sepsis zu verhindern.
Therapieziel ist stets die Verhinderung einer Amputation. Eine Ausnahme bildet die Charcot-Arthropathie nach Sanders/Frykberg Typ 1. In diesem Fall wird bei einer notwendigen operativen Versorgung in der Klinik der Verfasser eine „innere Amputation“ nach Baumgartner durchgeführt. Weitere Ziele sind eine schmerzfreie Gehfähigkeit in orthopädischem Schuhwerk sowie dieErhöhung der Aktivitätsklasse der Patienten.
Die Art und Weise einer adäquaten operativen Therapie wird stark kontrovers diskutiert. Nach Auffassung der Verfasser ist die externe Fixation ein geeignetes, effektives und äußerst variables Verfahren mit relativ geringer Komplikationsrate. Es können sowohl aktive als auch inaktive Osteoarthropathien mit einem Fixateur externe behandelt werden. In der Regel wird eine Arthrodese oder zumindest eine straffe und belastbare Pseudarthrose hergestellt, die eine schmerzfreie Mobilisation unter Vollbelastung ermöglicht.
Das Versorgungskonzept bei der operativen Schiene ähnelt dem konservativen Konzept. Die Fixateur-externe-Therapie wird für 6 bis 12 Wochen durchgeführt. Die Verfasser ziehen 8 bis 12 Wochen vor, die Therapiedauer ist aber abhängig von der Compliance und der Mitarbeit des Patienten und kann sich auf ein Minimum von 6 Wochen reduzieren. Anschließend hat sich eine Versorgung in einer Unterschenkelorthese für weitere 3 bis 9 (12) Monate bewährt. Ist es zu einer knöchernen Konsolidierung bzw. straffen Pseudarthrose gekommen, kann der Patient mit orthopädischen Maßschuhen versorgt und mobilisiert werden.
Das operative Verfahren im Einzelnen
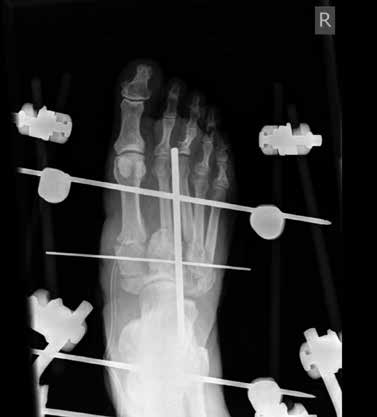
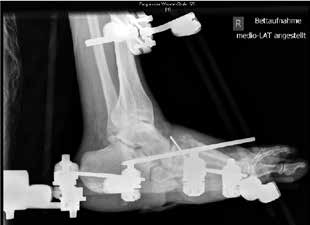
Der operative Zugang erfolgt abhängig von der Lokalisation der Charcot-Arthropathie. Bei ausgeprägten Deformitäten ziehen die Verfasser einen bilateralen Zugang vor. Neben einer sorgfältigen Entfernung avitalen Knochengewebes erfolgt gegebenenfalls eine Resektion infizierten Gewebes sowie eine Abtragung von Pseudoexostosen. Die alleinige Abtragung von Pseudoexostosen kann in einigen Fällen als alleinige operative Behandlungsmethode ausreichend sein. Bei vorhandenen Ulzera bzw. Infektionen werden gentamicinhaltige Antibiotikaträger appliziert. Autologe Spongiosa bzw. Knochenersatzstoffe können in die restlichen Defekte nach Reposition und Anfrischung der Gelenkpartner interponiert werden. Fixateur-Pins mit zentralem Gwinde werden in die Metatarsaliaköpfchenreihe, den Calcaneus und die Tibia eingebracht. Nach Reposition des Fußes wird der Fixateur externe montiert, in der Klinik der Verfasser der Hoffmann-II-Fixateur als bilaterale Rahmenkonstruktion (Abb. 4). Zielvorgabe für die dreidimensionale Stellungskorrektur ist hierbei die lotgerechte Einstellung des Fußes in der frontalen Ebene mit plantigrader Belastbarkeit (Abb. 5a u. b). Während der Tragedauer des Fixateurs erfolgt eine vollständige Entlastung der betroffenen Extremität. Der Patient ist für diese Zeit im Rollstuhl oder bestenfalls an Unterarmgehstützen mobilisiert. Sechs bis zwölf Wochen postoperativ wird das Material entfernt. Die vollständige Materialentfernung kann ohne Narkose unter Analgesie durchgeführt werden. Bis zur Versorgung mit einer Orthese wird der Fuß vor der Überbelastung des reponierten Fußes mit einem Cast geschützt.
Nachbehandlung
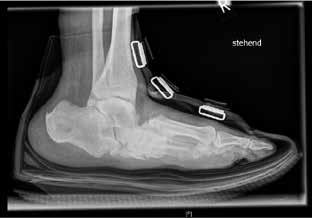
Die Verfasser versorgen den Patienten postoperativ mit einer individuell nach Gipsabdruck angefertigten Unterschenkelorthese. Diese hat ventral eine geschlossene Tibiaanlage, die eine rotationsstabile Ruhigstellung des Fußes ermöglicht. Mit passgerechter Orthese ist eine Vollbelastung des Fußes möglich. Eine solche wird zum frühestmöglichen Zeitpunkt angestrebt, um eine weitere knöcherne Demineralisierung der betroffenen Seite sowie eine Überlastung der kontralateralen Extremität zu vermeiden. Die Belastungsdauer sollte sukzessiv gesteigert werden. Die Verfasser empfehlen, dass die Abnahme der Orthese stets durch den Verordner bzw. in diesem Fall durch den Operateur erfolgen sollte. Erst die Kombination aus adäquater Operation und geeignetem Hilfsmittel macht das Behandlungskonzept aus Sicht der Verfasser erfolgreich. Bei guter Stellung und ausreichender Stabilität des Fußes ist nach ca. 3- bis 12-monatiger Tragedauer der Unterschenkelorthese die Versorgung mit orthopädischen Maßschuhen möglich. Auch hier empfehlen die Verfasser, dass die Abnahme der orthopädischen Maßschuhe durch den Operateur erfolgen sollte. Dabei erfolgt die radiologische Kontrolle im Schuh und im Stehen (Abb. 6). Die Verfasser führen regelmäßige klinische und radiologische Kontrollen in den ersten 2 Jahren durch. Die Kontrollintervalle erfolgen, abhängig vom klinischen Bild, alle 6 bis 12 Wochen. Die Kontrollen in diesem Behandlungszeitraum ermöglichen das frühzeitige Erkennen von Problemen (z. B. neue Ulzerationen oder Druckstellen, neu aufgetretene Schmerzen). Ab dem 3. Jahr können die klinischen Kontrollen halbjährlich erfolgen. Radiologische Kontrollen erfolgen fakultativ.
Fazit
Viele Amputationen lassen sich durch den hier vorgestellten Behandlungsalgorithmus vermeiden; die Wahrscheinlichkeit des Auftretens weiterer Komplikationen oder Rezidive wird vermindert sowie eine deutliche Verbesserung der Aktivitätsklasse der Patienten erzielt. In der Klinik der Verfasser wurden zwischen 1996 bis 2012 ca. 300 Patienten mit einem nicht konservativ beherrschbaren Charcot-Fuß operiert. Im späteren Verlauf mussten ca. 3 bis 4 % der Patienten aufgrund nicht beherrschbarer Infektionen der Knochen amputiert werden. Die meisten der Patienten konnten schlussendlich mit einem orthopädischen Maßschuh versorgt werden, die restlichen Patienten wurden mit einer dauerhaften Orthese versorgt. Zusammenfassend ist festzustellen, dass die Behandlung des Charcot-Fußes nur in einer interdisziplinären Zusammenarbeit aus orthopädischen Chirurgen, Orthopädie-Technikern und Orthopädie-Schuhmachern die sinnvollste und optimale Option ist, um auch bei Hochrisikopatienten erhaltende Erfolge zu erzielen (Abb. 7).
Für die Autoren:
Dr. med. Tymoteusz Budny
Klinik für Allgemeine Orthopädie und Tumororthopädie
Universität Münster
Albert-Schweitzer-Campus 1
Gebäude A1
48149 Münster
budny@uni-muenster.de
Begutachteter Beitrag/reviewed paper
Budny T B, Hardes J, Gosheger G. Versorgungskonzept beim diabetischen Charcot-Fuß mit Fokus auf Typ Sanders 2–4. Orthopädie Technik, 2017; 68 (9): 52–57
- Vergleichende Prüfung konventioneller und additiv gefertigter Prothesenschäfte in Anlehnung an DIN EN ISO 10328:2016 — 10. März 2026
- Easypreg – ein Faserverbundwerkstoff zum Tiefziehen — 9. März 2026
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- American Diabetes Association. Consensus Development Conference on Diabetic Foot Wound Care: 7–8 April 1999, Boston, Massachusetts. Diabetes Care, 1999; 22 (8): 1354–1360
- Lavery LA, Hunt NA, Ndip A, Lavery DC, Van Houtum W, Boulton AJ. Impact of chronic kidney disease on survival after amputation in individuals with diabetes. Diabetes Care, 2010; 33 (11): 2365–2369
- Ikonen TS, Sund R, Venermo M, Winell K. Fewer major amputations among individuals with diabetes in Finland in 1997–2007: a population-based study. Diabetes Care, 2010; 33 (12): 2598–2603
- Illgner U, Podella M, Rummler M, Wuhr J, Busch HG, Wetz HH. Rekonstruktive Chirurgie beim Charcot-Fuß. 5‑Jahres-Langzeitoutcome. Orthopäde, 2009; 38 (12): 1180–1186
- Hyer CF, Lee TH, Philbin TM, Berlet GC. Diabetic neuropathy: the painful foot. Foot Ankle Clin, 2004; 9 (2): 221–237
- Armstrong DG, Todd WF, Lavery LA, Harkless LB, Bushman TR. The natural history of acute Charcot’s arthropathy in a dia- betic foot specialty clinic. J Am Podiatr Med Assoc, 1997; 87 (6): 272–278
- Armstrong DG, Lavery LA, Harkless LB. Who is at risk for diabetic foot ulceration? Clin Podiatr Med Surg, 1998; 15 (1): 11–19
- Pinzur MS. Charcot’s foot. Foot Ankle Clin, 2000; 5 (4): 897–912
- Pinzur MS. Current concepts review: Charcot arthropathy of the foot and ankle. Foot Ankle Int, 2007; 28 (8): 952–959
- Mittlmeier T, Klaue K, Haar P, Beck M. Charcot-Fuß. Eine Standortbestimmung und Perspektiven. Unfallchirurg, 2008; 111 (4): 218–231
- Koller A, Fühner J, Wetz HH. Radiologische und klinische Aspekte der diabetisch-neuropathischen Osteoarthropathie. Orthopäde, 2004; 33: 972–982
- Mittlmeier T, Klaue K, Haar P, Beck M. Charcot-Fuß. Eine Standortbestimmung und Perspektiven. Unfallchirurg, 2008; 111 (4): 218–231
- Young MJ. The management of neurogenic arthropathy: a tale of two charcots. Diabetes Metab Res Rev, 1999; 15 (1): 59–64
- Sequeira W. The neuropathic joint. Clin Exp Rheumatol, 1994; 12 (3): 325–337
- Lavery LA, Armstrong DG, Peters EJ, Lipsky BA. Probe-to-bone test for diagnosing diabetic foot osteomyelitis: reliable or relic? Diabetes Care, 2007; 30 (2): 270–274
- Shone A, Burnside J, Chipchase S, Game F, Jeffcoate W. Probing the validity of the probe-to-bone test in the diagnosis of osteomyelitis of the foot in diabetes. Diabetes Care, 2006; 29 (4): 945
- Sanders LJ, Frykberg RG. Diabetic neuropathic osteoarthropathy: The Charcot foot. In: Frykberg RG, editor. The high risk foot in diabetes mellitus. New York: Churchill Livingstone, 1991; 297–338
- Wukich DK, Sung W. Charcot arthropathy of the foot and ankle: modern concepts and management review. J Diabetes Complications, 2009; 23 (6): 409–426
- Sequeira W. The neuropathic joint. Clin Exp Rheumatol, 1994; 12 (3): 325–337
- Koller A, Fühner J, Wetz HH. Radiologische und klinische Aspekte der diabetisch-neuropathischen Osteoarthropathie. Orthopäde, 2004; 33: 972–982
- Koller A, Fühner J, Wetz HH. Radiologische und klinische Aspekte der diabetisch-neuropathischen Osteoarthropathie. Orthopäde, 2004; 33: 972–982
- Wukich DK, Sung W. Charcot arthropathy of the foot and ankle: modern concepts and management review. J Diabetes Complications, 2009; 23 (6): 409–426
- Illgner U, Podella M, Rummler M, Wuhr J, Busch HG, Wetz HH. Rekonstruktive Chirurgie beim Charcot-Fuß. 5‑Jahres-Langzeitoutcome. Orthopäde, 2009; 38 (12): 1180–1186
- Wukich DK, Sung W. Charcot arthropathy of the foot and ankle: modern concepts and management review. J Diabetes Complications, 2009; 23 (6): 409–426
- Illgner U, Podella M, Rummler M, Wuhr J, Busch HG, Wetz HH. Rekonstruktive Chirurgie beim Charcot-Fuß. 5‑Jahres-Langzeitoutcome. Orthopäde, 2009; 38 (12): 1180–1186