Einleitung
Die erste medizinische Beschreibung von Schmerzen nach Amputation stammt von Ambroise Paré (1510–1590), einem französischen Militärchirurgen 1 2 3. Der Begriff „Phantomglied“ wurde 1871 vom Neurologen Silas Weir Mitchell (1829–1914) eingeführt 4. 50 bis 90 % aller Patienten mit Amputationen leiden an Phantommodalitäten. Es wird dabei im deutschen Sprachraum zwischen Phantomschmerzen, Phantomgefühlen und Phantomsensationen unterschieden 5. Der Leidensdruck und die daraus resultierende Einschränkung an Mobilität und Lebensqualität werden von den Betroffenen als großes Handicap beschrieben. Die genaue Ursache dieser Phantomphänomene ist unklar. Oft werden mit dem Tragen der Prothese und vor allem durch deren täglichen Gebrauch die Phantommodalitäten geringer. Wichtig dabei ist aber, dass der Betroffene seine neue Gliedmaße in seinen Alltag wirklich integriert, die Prothese auch emotional „einverleibt“ und sie nicht als Fremdkörper wahrnimmt. Es gibt auch Fälle, bei denen das Tragen der Prothese die Phantomphänomene verstärkt, wodurch an einen Mobilitätsgewinn mit der Prothese kaum zu denken ist. Oftmals sind aber auch Stumpfschmerzen (Belastungsschmerzen) ein auslösender und unterhaltender Faktor für die Phantommodalitäten. In solchen Fällen ist die Ursache zusätzlich in der Peripherie zu suchen. Ausschlaggebend dafür können zum Beispiel Druckneuropathien, Neurome und Minderdurchblutung des Stumpfes sein.
Definition, Inzidenz, Prävalenz
Phantomschmerzen sind als länger anhaltende Schmerzen im nicht mehr oder nur teilweise vorhandenen Körperteil definiert. Das Phantomgefühl hingegen beschreibt lediglich eine Stellung oder Position oder eine nicht schmerzhafte Empfindung (z. B. Wärmegefühl, Kribbeln etc.) im nicht mehr vorhandenen Körperteil. Phantomsensationen werden als einschießende, schmerzhafte, nur Sekundenbruchteile dauernde, ausstrahlende Blitze im nicht mehr vorhandenen Körperteil definiert. Klassifiziert wird Phantomschmerz als neuropathischer Schmerz. Ähnliche Gefühlsqualitäten können aber auch in der Nähe der Amputationslinie, also noch im vorhandenen Körperteil, auftreten. Diese werden als Stumpfschmerzen definiert 6.
Die Inzidenz von Phantomschmerzen variiert zwischen 60 und 80 %, die von Phantomgefühlen zwischen 80 und 100 % 7 8 9 10 11. Die Prävalenz wird in der Literatur bei Phantomschmerzen mit 45 bis 50 %, beim Phantomgefühl mit 55 bis 75 % angegeben 12 13. Über die Häufigkeitsverteilung von Amputationen der oberen und unteren Extremität findet man kaum Zahlen. Kern et al. 14 befragten 537 Patienten mit Amputationen; 4,5 % davon waren an der oberen Extremität amputiert, 95,5 % an der unteren.
Ätiologie
Die Ursachen für Phantomschmerzen sind noch nicht eindeutig geklärt. Faktoren wie Schmerzen vor der Amputation, Schmerzintensität, Geschlecht, Dominanz der betroffenen Extremität und Zeit seit der Amputation scheinen beitragende Faktoren zu sein 15 16. Aktuelle Forschungsergebnisse zeigen, dass sowohl periphere als auch zentrale Faktoren eine wichtige Rolle bei der Initialisierung und der Aufrechterhaltung von Phantomschmerzen spielen 17 18 19. Psychologische Faktoren haben keinen direkten Einfluss auf die Phantomschmerzen, wohl aber über die Modulation der Schmerzverarbeitung 20 21.
Durch den Verlust einer Gliedmaße nach Amputation kommt es zu einer Unterbrechung des normal vorhandenen afferenten Einstroms zum Rückenmark und zum Gehirn, was als „Deafferenzierung“ bezeichnet wird. Dies bewirkt eine Reihe von Veränderungen im schmerzleitenden und im schmerzverarbeitenden System, mit Auswirkungen auf allen Ebenen des nozizeptiven Systems, vom peripheren Nerv über das Rückenmark bis zur Großhirnrinde.
Periphere Faktoren
Als periphere Ursache für Phantomschmerzen kommen eine reduzierte Oberflächendurchblutung und ein erhöhter Muskeltonus im Stumpf genauso in Betracht wie Veränderungen an den peripheren Nervenendigungen. Diese sind vermehrt empfindlich gegenüber mechanischen, chemischen und thermischen Reizen, wodurch sich ihre ektopische Entladungsrate erhöhen kann. Sie aktivieren das zentrale Nervensystem, was zur Wahrnehmung der Phantomschmerzen führen kann.
Am dorsalen Hinterhornganglion können die ektopen Entladungen sowohl zu einer verstärkten zentralen Antwort auf afferente neurale Impulse führen, die vom Stumpf her kommen, als auch Depolarisationen in den benachbarten Neuronen bewirken. Die peripheren Faktoren können nicht die primären Auslöser von Phantomschmerzen sein, sind aber sicher mitverantwortlich.
Zentrale Faktoren
Die anhaltend erhöhte Nozizeption aus der Peripherie, die durch die Nervendurchtrennung bei einer Amputation entsteht, kann zu anhaltenden Veränderungen in den synaptischen Strukturen des dorsalen Hinterhorns und der supraspinalen Strukturen führen. Dies wird als „zentrale Sensibilisierung“ bezeichnet 22. Diese geht einher mit einer erhöhten Erregbarkeit der Mechanorezeptoren im Hinterhorn und reduzierten inhibitorischen Prozessen sowie strukturellen Veränderungen an den primären sensorischen Neuronen, den Interneuronen oder den Übertragungsneuronen 23 24.
Die periphere Nervenverletzung kann auch zu einer Zerstörung der C‑Fasern führen, die zusammen mit den Aδ-Fasern im Hinterhorn im Bereich der II. Lamina terminieren. Durch den Verlust der synaptischen Verbindungen wandern Aβ-Fasern (mechanosensible Fasern), die normalerweise in der III. und IV. Lamina enden, in die II. Lamina ein (wo sie normalerweise nicht vorhanden sind). Dadurch wird der Input der Aβ-Fasern als nozizeptiver Stimulus wahrgenommen, was die Ursache für eine Allodynie sein könnte 25 26.
Neuere Studien aus der Neurowissenschaft im Zusammenhang mit Phantomschmerzen, die sich mit funktionellen und strukturellen Veränderungen im primären sensorischen und motorischen Kortex befasst haben, konnten aufzeigen, dass die kortikale Reorganisation stark mit dem Ausmaß der Phantomschmerzen korreliert.
Kortikale Repräsentation
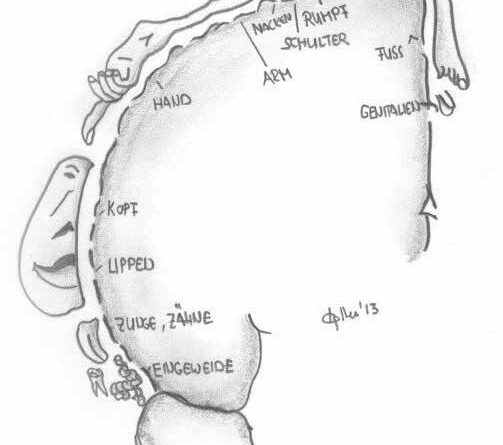
Die kortikale Repräsentation ist das Abbild des Körpers über ein neuronales Netzwerk im primären somatosensorischen Kortex (S1). Die Körperregionen werden dabei nicht aufgrund ihrer Größe, sondern entsprechend der Dichte der sensiblen Rezeptoren abgebildet (Abb. 1).
Kommt es zu funktionellen und strukturellen Veränderungen in der kortikalen Repräsentation, spricht man von kortikaler Reorganisation 27 28. Die Reorganisation des somatosensorischen Kortex ist ein Prozess neuronaler Plastizität und bedeutet eine Neukartierung („Remapping“) des Gehirns; also eine Verschiebung der somatotopen Repräsentation 29 30. Die Signifikanz der Verschiebung der kortikalen Repräsentationszone und des Ausmaßes von Phantomschmerzen konnten Flor et al. 31 mit einer Studie, in der sie die neuromagnetische Quellenanalyse anwendeten, nachweisen. Sie verglichen traumatisch amputierte Patienten mit und ohne Phantomschmerzen mit einer Gruppe von Personen mit einer kongenitalen Aplasie der oberen Extremität. Nur die Gruppe mit Phantomschmerzen wies eine signifikante Verschiebung der Repräsentationszone der Lippen in die Amputationszone kontralateral zur Amputationsseite auf. Die Gruppe mit kongenitaler Aplasie und die Amputierten ohne Phantomschmerzen zeigten keine signifikanten Veränderungen der kortikalen Repräsentation. Die Personen mit kongenitalem Verlust der oberen Extremität berichteten über keinerlei Phantommodalitäten. Es liegt daher nahe, aufgrund dieser Befunde die Hypothese zu bilden, dass die Phantomschmerzen eine Konsequenz der kortikalen Reorganisationsprozesse sein könnten 32.
Das Ausmaß der pathologischen Veränderungen der kortikalen Repräsentation korreliert bei all diesen Dysfunktionen mit der Schmerzintensität oder der motorischen Funktion 33 34 35. Basierend auf der Erkenntnis, dass Phantomschmerzen mit kortikaler Reorganisation einhergehen, untersuchten Flor et al. 36 bei armamputierten Patienten den Effekt eines sensorischen Diskriminationstrainings auf die kortikale Reorganisation und auf Phantomschmerzen. In den Resultaten zeigte sich, dass die Patienten der Interventionsgruppe eine deutliche Verbesserung in der Diskriminationsfähigkeit aufwiesen und die Phantomschmerzen signifikant zurückgingen, ebenso die kortikale Reorganisation, die mit neuroelektrischer Bildgebung untersucht wurde.
Weiss, Miltner, Adler, Brückner und Taub 37 verglichen den Einfluss auf die Phantomschmerzen beim Tragen einer kosmetischen Prothese gegenüber dem Tragen einer Sauerbruch-Prothese (myoelektrisch), die funktionelle und extensive Bewegungen der betroffenen Extremität zulässt. Die Träger einer Sauerbruch-Prothese erlebten einen signifikanten Rückgang der Phantomschmerzen gegenüber den Trägern kosmetischer Prothesen, die keinen Rückgang der Phantomschmerzen erfuhren.
Behandlungsansätze und deren Evidenz
Die meisten bisherigen Behandlungen von Phantomschmerzen waren ineffektiv. Dies wurde durch verschiedene Studien inklusive großer Umfragen bei Amputierten aufgezeigt. Meist wurde nicht der Mechanismus behandelt, der die Phantomschmerzen verursacht, sondern es wurde nur versucht, die Symptome zu bekämpfen. Über einen großen, eher kurzfristigen Nutzen gegen Phantomschmerzen wurde von verschiedenen Behandlungen berichtet, darunter Lokalanästhesie, Sympathektomie (operative Durchtrennung einzelner Ganglien des sympathischen Nervensystems), Chordotomie (operative Durchtrennung der Vorderseitenstrangbahn des Rückenmarks), Rhizotomie (beidseitige intradurale Resektion der hinteren Spinalnervenwurzeln), Neurostimulationsmethoden oder pharmakologische Interventionen 38 39 40. Innerhalb der heutigen Behandlungsoptionen von Phantomschmerzen stehen folgende Behandlungsmethoden im Vordergrund: Pharmakologie, Chirurgie, Schmerzintervention/Anästhesie, Psychologie sowie Physiotherapie mit all ihren verschiedenen Angeboten.
Pharmakologie
Die medikamentöse Behandlung spielt eine wichtige Rolle, vor allem dann, wenn die Phantomschmerzen durch zentrale Faktoren verursacht oder unterhalten werden 41. In diesem Fall kommen Medikamente wie Antikonvulsiva, Barbiturate, Antidepressiva, Neuroleptika, Muskelrelaxantien und Opioide zum Einsatz. Zur Behandlung neuropathischer Schmerzen werden vor allem trizyklische Antidepressiva und Sodium-Kanal-Blocker empfohlen 42 43. Huse, Larbig, Flor und Birbaumer 44 untersuchten den Effekt von Opioiden auf Phantomschmerzen und kortikale Reorganisation. In einer doppelt verblindeten Crossover-Studie mit Patienten, die nach einseitiger Amputation der oberen oder unteren Extremität an Phantomschmerzen litten, erreichten sie eine signifikante Schmerzreduktion durch orale Abgabe von Morphinsulfat-Retardtabletten (MST®). Durch weitere kontrollierte Studien bezüglich der Wirksamkeit von Opioiden konnte deren positiver Effekt auf Phantomschmerzen nachgewiesen werden 45. Die Wirksamkeit von NMDA-(N‑Methyl-D-Asparat-)Rezeptoren-Agonisten wie Ketamin untersuchten Nikolajsen et al. 46. In der doppelt verblindeten placebokontrollierten Studie konnte durch Ketamin bei Phantomschmerzen eine Schmerzreduktion erreicht werden. Nebst der Reduktion von Phantomschmerzen können NMDA-Agonisten wie auch GABA-(„gamma-aminobutyric-acid“-)Rezeptoren-Agonisten und anticholinerge Medikamente möglicherweise hilfreich sein, um einer kortikalen Reorganisation vorzubeugen 47 48. Ermöglicht wird dies durch Verstärkung der kortikalen Hemmung durch die GABA-Agonisten oder durch Verhinderung der kortikalen Reorganisation durch NMDA-Antagonisten 49. Mit ihrer placebokontrollierten randomisierten Crossover-Studie wollten Wiech et al. 50 diesen Zusammenhang untersuchen. Sie konnten durch die Behandlung mit Memantin jedoch keinen Effekt nachweisen, weder in Bezug auf die Phantomschmerzen noch auf die kortikale Reorganisation. Es scheint angesichts der unterschiedlichen Resultate so zu sein, dass der NMDA-Antagonist Ketamin einen positiven Effekt auf die kortikale Reorganisation und auf Phantomschmerzen hat, der NMDA-Antagonist Memantin hingegen nicht 51. NSAR und Paracetamol gelten in der Behandlung von Phantomschmerzen als ineffektiv 52.
Chirurgie
Diese ist effektiv bei lokalen, spezifischen Pathologien wie Wundheilungsstörungen am Stumpf, bei denen eine Stumpfrevision oder eine Neurektomie (chirurgische Durchtrennung eines peripheren Nervs) sinnvoll sein können. Neurochirurgische Eingriffe wie Chordotomie, Thalamotomie (Koagulation von Kerngebieten des Thalamus) oder Sympathektomie können zwar möglicherweise zu einer kurzzeitigen Schmerzbefreiung führen, sind in der heutigen Medizin aber nicht mehr üblich 53.
Physiotherapie
Transkutane Nervenstimulation (TENS) scheint einen kleinen Effekt auf Phantomschmerz zu haben 54. Bei Patienten, bei denen die Phantomschmerzen primär durch periphere Faktoren generiert werden, können Therapien mit Biofeedback, die zu einer Vasodilatation oder einer reduzierten Muskelspannung im Stumpf führen, als Ergänzung zu anderen Behandlungen sinnvoll sein 55.
In der heutigen physiotherapeutischen (neuropsychologischen) Nachbehandlung steht aber klar die Behandlung basierend auf den Mechanismen der maladaptiven Gehirnplastizität im Vordergrund. Wie im Abschnitt „Kortikale Repräsentation“ beschrieben, wurde mit bildgebenden Verfahren der Zusammenhang zwischen Phantomschmerzen und kortikaler Reorganisation dargelegt, zumindest bei Amputierten der oberen Extremität. Es konnte aufgezeigt werden, dass sich die kortikale Repräsentation nicht nur durch Verletzung, sondern auch durch verhaltensrelevante Stimulation und Training verändern kann 56. Dies ist ein klarer Hinweis auf die Wichtigkeit einer konsequenten Integration der Aktivitäten und Funktionen in den Alltag.
Ein weiterer Behandlungsansatz ist das sensorische und motorische Training: Bei Patienten mit Phantomschmerzen konnte aufgezeigt werden, dass verschiedene Stimulationsverfahren effektiv waren, sei es das Tragen einer Prothese oder taktile Stimulation. Den Effekt, den das Tragen einer Prothese auf Phantomschmerzen und die kortikale Reorganisation hat, untersuchten Lotze et al. 57. Bei 14 einseitig amputierten Patienten der oberen Extremität (Zeit seit Amputation 3 bis 53 Jahre) führten sie eine funktionelle Kernspintomografie (fMRT) durch, während die Patienten ihre Lippen bewegten. Die kortikale Reorganisation wurde untersucht, indem Lokalisation und Ausweitung der kortikalen Reorganisation der Lippenbewegung im prä(M1) und im postzentralen (S1) Kortex dargestellt wurden. Es zeigte sich dabei, dass bei den 7 Patienten, die keine Phantomschmerzen hatten, die Lippenlokalisation symmetrisch war. Bei den anderen 7 Patienten mit Phantomschmerzen war die Aktivierungszone in der Hemisphäre kontralateral zum amputierten Glied zum Handareal hin verschoben. Die Phantomschmerzen und die Verschiebung der Aktivierungsareale korrelierten im motorischen wie auch im somatosensorischen Kortex.
Die Patienten wurden sodann in zwei Gruppen unterteilt: eine Gruppe, in der die Patienten täglich (≥ 8 Stunden) eine myoelektrische Prothese benutzten, und eine zweite Gruppe, bei der die Patienten keine, eine kosmetische Prothese oder ihre myoelektrische Prothese kaum benutzten (< 8 h pro Tag). Bei der Gruppe der Patienten, welche die Prothesen regelmäßig über einen längeren Zeitraum trugen, zeigte sich, dass dies signifikant negativ sowohl mit der kortikalen Reorganisation als auch mit den Phantomschmerzen korrelierte. Die Patienten, die ihre myoelektrische Prothese regelmäßig trugen, litten signifikant weniger an Phantomschmerzen und hatten eine weniger ausgeprägte kortikale Reorganisation.
Zu ähnlichen Ergebnissen kamen Weiss und Miltner 58. Sie befragten 11 Träger (Amputierte der oberen Extremität) einer Sauerbruch-Prothese (myoelektrisch) und verglichen sie mit 17 Trägern kosmetischer Prothesen. Zwischen den beiden Gruppen gab es keine Unterschiede bezüglich Alter, Zeitpunkt der Amputation, Dauer des Tragens der Prothese oder der Schmerzen vor und nach der Amputation. Ein hochsignifikanter Unterschied zeigte sich aber bei der Befragung der Patienten in Bezug auf die Ausprägung der Phantomschmerzen: Die Träger einer Sauerbruch-Prothese wiesen über die Jahre, seit sie die Prothese trugen, eine signifikante Abnahme der Phantomschmerzen auf, während sich bei den Trägern einer kosmetischen Prothese kein signifikanter Unterschied ergab.
Bei Patienten, die keine Prothesen trugen, zeigten Flor et al. 59, dass durch ein sensorisches Diskriminationstraining mittels synchroner Elektrostimulation ein signifikanter Rückgang der Phantomschmerzen und der kortikalen Reorganisation erreicht werden konnte. Huse und Preissl 60 bestätigten die Ergebnisse von Flor et al. Sie führten bei 6 Amputierten der oberen Extremität ein sensorisches Diskriminationstraining durch und verwendeten dazu asynchrone taktile Stimulation von 1 bis 10 Hz am Stumpf und an den Lippen. Das Stimulationsprogramm wurde über 2 Wochen 3‑mal täglich jeweils 60 Minuten lang durchgeführt. Die kortikale Reorganisation wurde mit einem Magnetenzephalogramm überprüft. Mit der Anwendung einer asynchronen, taktilen Stimulation konnte eine signifikante Reduktion der Phantomschmerzen erreicht werden. Die reduzierte Expansion der Lippenrepräsentation korrelierte signifikant positiv mit der Reduktion von Schmerzintensität, Schmerzhäufigkeit und Dauer der Schmerzattacken.
Moseley et al. 61 konnten nachweisen, dass eine aktive Unterscheidung von taktilen Stimuli (Diskrimination) bei Patienten mit CRPS einen größeren Effekt hat als nur einfache taktile Stimulation. Nebst einer Schmerzreduktion durch taktiles Diskriminationstraining konnten sie auch eine Zunahme der Tastschärfe nachweisen.
Weitere Ansätze sind die Spiegeltherapie und das motorische Vorstellungstraining. Ramachandran und Rogers-Ramachandran 62 untersuchten erstmals den Effekt eines visuellen Inputs auf Phantomphänomene. Dazu ließen sie Amputierte der oberen Extremität Bewegungen mit der intakten Extremität vor einem Spiegel durchführen, was bei den Patienten den Eindruck hervorrief, sie würden ihr amputiertes Glied bewegen, das im Spiegel intakt erschien. Dies führte bei den Patienten zu einer Reduktion der Phantomschmerzen und einer besseren Beweglichkeit im Stumpf. Brodie, Whyte und Waller 63 testeten ein ähnliches Verfahren an 21 Amputierten der unteren Extremität. Die Patienten wurden aufgefordert, beide Beine zu bewegen. In der einen Gruppe konnten die Patienten nur die Bewegung ihres intakten Beines sehen, in der anderen konnten sie zusätzlich die Bewegung ihres „virtuellen“ Beines sehen. Diese Gruppe berichtete über eine signifikant größere Anzahl von Bewegungen in ihrem Phantombein als diejenigen, die nur das intakte Bein betrachteten.
In einer weiteren Studie mit 80 beinamputierten Patienten untersuchten Brodie, Whyte und Nieven 64 den Effekt von 100 klar definierten Bewegungen, welche die Patienten vor einem Spiegel ausführten, wobei sie das Bein im Spiegelbild betrachteten. Die Kontrollgruppe führte die gleichen Bewegungen bei abgedecktem Spiegel durch. Beide Gruppen berichteten über eine signifikante Abnahme der Phantomschmerzen; es wurde aber kein Unterschied zwischen der Interventions- und der Kontrollgruppe ermittelt.
Im Gegensatz dazu lässt die Arbeit von Chan et al. 65 die Hypothese zu, dass das visuelle Bild Einfluss auf die Phantomschmerzen hat. Sie untersuchten in ihrer Arbeit die Spiegeltherapie im Vergleich mit der vorgestellten Bewegungstherapie. 18 Patienten mit Amputation des Fußes oder des Beines wurden in 3 Gruppen randomisiert. Die Probanden der „Spiegelgruppe“ führten Bewegungen mit ihrem amputierten Glied aus, während sie das Spiegelbild ihres intakten Beines betrachteten. Die Mitglieder der zweiten Gruppe führten die gleichen Bewegungen mit dem Phantomglied und dem intakten Bein bei abgedecktem Spiegel aus. Die Angehörigen der dritten Gruppe führten eine mentale Visualisierung durch. Sie führten die Bewegungen mit ihrem Phantomglied nicht aus, sondern stellten sich diese nur vor und hielten die Augen geschlossen. Unter direkter Beobachtung eines Therapeuten wurden die Therapien 15 Minuten täglich über 4 Wochen durchgeführt. Dabei wurden Anzahl und Dauer der Schmerzepisoden wie auch die Schmerzintensität gemessen. 100 % der Patienten aus der Spiegelgruppe berichteten über eine Reduktion ihrer Phantomschmerzen, 17 % aus der „abgedeckten“ Spiegelgruppe. In der Gruppe mit der mentalen Visualisierung berichteten 33 % über eine Schmerzabnahme, 67 % über eine Schmerzzunahme. Die Patienten aus der Spiegelgruppe hoben sich bezüglich Reduktion der Phantomschmerzen signifikant von den anderen beiden Gruppen ab.
Dass die vorgestellte Bewegung doch Einfluss auf Phantomschmerzen haben kann, belegten MacIver, Lloyd, Kelly, Roberts und Nurmikko 66. Bei 13 unilateral Amputierten der oberen Extremität mit Phantomschmerzen untersuchten sie mit einem fMRT die kortikale Aktivierung während Hand- und Lippenbewegungen, und zwar vor und nach der Durchführung eines 6‑wöchigen Trainings von vorgestellten Bewegungen. Vor dem Training zeigte sich bei der Aktivierung der Gehirnareale, die durch die Lippen- oder Handbewegungen hervorgerufen wurde, dass sowohl im somatosensorischen als auch im motorischen Kortex eine Reorganisation mit Ausdehnung der Lippen in die Handzone stattgefunden hatte. Diese Reorganisation korrelierte auch mit dem Ausmaß der Phantomschmerzen. Zudem zeigte sich auf den Bildern, dass es bei der vorgestellten Bewegung der Phantomhand und bei der ausgeführten Bewegung der intakten Hand nebst der bilateralen Aktivierung der M1- und S1-Areale der Hand auch zu einer Aktivierung der Lippen-Areale kam. Bei den nichtamputierten Kontrollprobanden wurden bei den Lippenbewegungen, den vorgestellten und durchgeführten Bewegungen der nichtdominanten Hand nur die zugehörigen Areale der kortikalen Repräsentation aktiviert. Nach dem Training berichteten die Patienten über eine signifikante Reduktion der Phantomschmerzen, was mit der Reduktion der kortikalen Reorganisation übereinstimmte.
Seidel et al. 67 untersuchten kortikale Reorganisationsphänomene vor und nach Spiegeltherapie bei Beinamputierten mit Phantomschmerzen. Acht Beinamputierte, die im Durchschnitt seit 162 Monaten amputiert waren, absolvierten 12 Spiegeltherapiesitzungen über 21 Tage mit jeweils 2 Sitzungen pro Tag (eine Sitzung dauerte jeweils zwischen 26 und 31 Minuten). In den Therapiesitzungen wurden die Patienten aufgefordert, mit der gesunden unteren Extremität ein vorgegebenes Übungsprogramm mit Bewegungen im Hüft‑, Knie- und Fußgelenk zu absolvieren und dabei das intakte Bein im Spiegel zu betrachten. Die funktionelle Organisation der repetitiven Bewegungen des gesunden und des amputierten Sprunggelenkes wurde vor der ersten und nach der letzten Therapiesitzung mit einer fMRT-Messung getestet. Anhand der Ergebnisse konnte zwar eine signifikante Reduktion der Phantomschmerzen aufgezeigt werden, jedoch keine konsistente Aktivierung des primären sensomotorischen Kortex während der Bewegung des Phantomsprunggelenkes im Vergleich zur Ruhebedingung.
Inzwischen gibt es mehrere Studien über kombinierte Therapieverfahren. G. L. Moseley 68 69 zeigte bei Patienten mit CRPS 1 auf, dass ein dreiteiliges Therapieverfahren, welches Hand-Seiten-Erkennung, vorgestellte Bewegungen und Spiegeltherapie kombinierte, größeren Einfluss auf die Reduktion von Schmerzen und Behinderung hatte, als wenn die Therapien einzeln angewendet wurden. Diese signifikant positiven Resultate konnte Moseley 70 bei einer Studie mit gleichem Verfahren bei 51 Patienten mit CRPS 1, Amputation der oberen Extremität mit Phantomschmerzen und nach Armplexus-Läsion replizieren.
Fazit
„Der Gebrauch bestimmt die Funktion.“ Durch Generierung eines alltäglichen Inputs wird die kortikale Repräsentation aufrechterhalten. Entsteht durch eine Amputation oder evtl. auch durch „Nichtgebrauch“ mehr oder weniger Input, kann es zu einer maladaptiven kortikalen Reorganisation kommen. Die Folge dessen ist das Entstehen von Phantommodalitäten. Durch geeignete und wohldosierte kortikale Inputanwendungen, die im besten Fall auch in Diskriminierung und topografischer Zuordnung taktiler Reize bestehen, kann die kortikale Reorganisation wieder positiv beeinflusst werden.
Für die Autoren:
Thomas Koller
Dipl. Physiotherapeut FH
(MAS msk ZFH, OMT svomp®)
Fachexperte OHR-Therapien (orthopädische und handchirurgische Rehabilitation)
Rehaklinik Bellikon, CH-5454 Bellikon
thomas.koller@rehabellikon.ch
Begutachteter Beitrag/reviewed paper
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 11. Februar 2026
- Keil G. Sogenannte Erstbeschreibung des Phantomschmerzes von Ambroise Paré. „Chose digne d’admiration et quasi incredible“: die „douleurs és parties mortes et amputées“ [So-called initial description of phantom pain by Ambroise Paré. „Chose digne d’admiration et quasi incredible“: the „douleur és parties mortes et amputées“]. Fortschr Med, 1990; 108 (4): 62–66
- Nikolajsen L, Jensen TS. Phantom limb pain. Br J Anaesth, 2001; 87 (1): 107–116
- Schley MT, Wilms P, Toepfner S, Schaller HP, Schmelz M, Konrad CJ, Birbaumer N. Painful and nonpainful phantom and stump sensations in acute traumatic amputees. J Trauma, 2008; 65 (4): 858–864. doi: 00005373–200810000-00020 [pii] 10.1097/TA.0b013e31812eed9e
- Steffen P. Phantomschmerz: Diagnostik und Therapie [Phantom limb pain]. Anästhesiol Intensivmed Notfallmed Schmerzther, 2006; 41 (6): 378–386; quiz 387–378. doi: 10.1055/s‑2006–947304
- Grüsser SM, Diers M, Flor H. Phantomschmerz: Aspekte der Neuroplastizität und Intervention [Phantom limb pain: aspects of neuroplasticity and intervention]. Anästhesiol Intensivmed Notfallmed Schmerzther, 2003; 38 (12): 762–766. doi: 10.1055/s‑2003–45403
- Grüsser SM, Diers M, Flor H. Phantomschmerz: Aspekte der Neuroplastizität und Intervention [Phantom limb pain: aspects of neuroplasticity and intervention]. Anästhesiol Intensivmed Notfallmed Schmerzther, 2003; 38 (12): 762–766. doi: 10.1055/s‑2003–45403
- Flor H, Birbaumer N. Phantom limb pain: cortical plasticity and novel therapeutic approaches. Curr Opin Anaesthesiol, 2000; 13 (5): 561–564. doi: 00001503–200010000-00013 [pii]
- Flor H, Nikolajsen L, Staehelin Jensen T. Phantom limb pain: a case of maladaptive CNS plasticity? [10.1038/nrn1991]. Nat Rev Neurosci, 2006; 7 (11): 873–881
- Jensen TS, Krebs B, Nielsen J, Rasmussen P. Phantom limb, phantom pain and stump pain in amputees during the first 6 months following limb amputation. Pain, 1983; 17 (3): 243–256
- Jensen TS, Krebs B, Nielsen J, Rasmussen P. Immediate and long-term phantom limb pain in amputees: incidence, clinical characteristics and relationship to pre-amputation limb pain. Pain, 1985; 21 (3): 267–278. doi: 10.1016/0304–3959(85)90090–9
- Woodhouse A. Phantom limb sensation. Clin Exp Pharmacol Physiol, 2005; 32 (1–2): 132–134. doi: CEP4142 [pii] 10.1111/j.1440–1681.2005.04142.x
- Schley MT, Wilms P, Toepfner S, Schaller HP, Schmelz M, Konrad CJ, Birbaumer N. Painful and nonpainful phantom and stump sensations in acute traumatic amputees. J Trauma, 2008; 65 (4): 858–864. doi: 00005373–200810000-00020 [pii] 10.1097/TA.0b013e31812eed9e
- Kooijman CM, Dijkstra PU, Geertzen JHB, Elzinga A, van der Schans CP. Phantom pain and phantom sensations in upper limb amputees: an epidemiological study. Pain, 2000; 87 (1): 33–41. doi: 10.1016/s0304-3959(00)00264–5
- Kern U, Busch V, Rockland M, Kohl M, Birklein F. Prävalenz und Risikofaktoren von Phantomschmerzen und Phantomwahrnehmung in Deutschland. Schmerz, 2009; 23: 479–488. doi: DOI 10.1007/s00482-009‑0786‑5
- Grüsser SM, Diers M, Flor H. Phantomschmerz: Aspekte der Neuroplastizität und Intervention [Phantom limb pain: aspects of neuroplasticity and intervention]. Anästhesiol Intensivmed Notfallmed Schmerzther, 2003; 38 (12): 762–766. doi: 10.1055/s‑2003–45403
- Woodhouse A. Phantom limb sensation. Clin Exp Pharmacol Physiol, 2005; 32 (1–2): 132–134. doi: CEP4142 [pii] 10.1111/j.1440–1681.2005.04142.x
- Nikolajsen L, Jensen TS. Phantom limb pain. Br J Anaesth, 2001; 87 (1): 107–116
- Flor H, Nikolajsen L, Staehelin Jensen T. Phantom limb pain: a case of maladaptive CNS plasticity? [10.1038/nrn1991]. Nat Rev Neurosci, 2006; 7 (11): 873–881
- Flor H. Maladaptive plasticity, memory for pain and phantom limb pain: review and suggestions for new therapies. Expert Rev Neurother, 2008; 8 (5): 809–818. doi: 10.1586/14737175.8.5.809
- Flor H. Phantom Limb Pain. Encyclopedia of the Human Brain, 2002; 3: 831–841
- Pezzin LE, Dillingham TR, MacKenzie EJ. Rehabilitation and the long-term outcomes of persons with trauma-related amputations. Arch Phys Med Rehabil, 2000; 81 (3): 292–300. doi: S0003-9993(00)90074–1 [pii]
- Woolf CJ, Mannion RJ. Neuropathic pain: aetiology, symptoms, mechanisms, and management. The Lancet, 1999; 353 (9168): 1959–1964. doi: 10.1016/s0140-6736(99)01307–0
- Grüsser SM, Diers M, Flor H. Phantomschmerz: Aspekte der Neuroplastizität und Intervention [Phantom limb pain: aspects of neuroplasticity and intervention]. Anästhesiol Intensivmed Notfallmed Schmerzther, 2003; 38 (12): 762–766. doi: 10.1055/s‑2003–45403
- Flor H. Phantom-limb pain: characteristics, causes, and treatment. The Lancet Neurology, 2002; 1(3): 182–189. doi: 10.1016/s1474-4422(02)00074–1
- Nikolajsen L, Jensen TS. Phantom limb pain. Br J Anaesth, 2001; 87 (1): 107–116
- Flor H. Phantom-limb pain: characteristics, causes, and treatment. The Lancet Neurology, 2002; 1(3): 182–189. doi: 10.1016/s1474-4422(02)00074–1
- Flor H, Birbaumer N. Phantom limb pain: cortical plasticity and novel therapeutic approaches. Curr Opin Anaesthesiol, 2000; 13 (5): 561–564. doi: 00001503–200010000-00013 [pii]
- Moseley GL, Zalucki NM, Wiech K. Tactile discrimination, but not tactile stimulation alone, reduces chronic limb pain. Pain, 2008; 137 (3): 600–608. doi: 10.1016/j.pain.2007.10.021
- Flor H, Diers M. Sensorimotor training and cortical reorganization. NeuroRehabilitation, 2009; 25 (1): 19–27. doi: B70P08T137N56M57 [pii]
- Flor H, Elbert T, Mühlnickel W, Pantev C, Wienbruch C, Taub E. Cortical reorganization and phantom phenomena in congenital and traumatic upper-extremity amputees. Exp Brain Res, 1998; 119 (2): 205–212
- Flor H, Elbert T, Mühlnickel W, Pantev C, Wienbruch C, Taub E. Cortical reorganization and phantom phenomena in congenital and traumatic upper-extremity amputees. Exp Brain Res, 1998; 119 (2): 205–212
- Flor H. Visualisierung von Phantom- und Rückenschmerzen durch bildgebende Verfahren: Implikationen für die Behandlung [Visualisation of phantom- and backpain using imaging techniques. Implication for treatment]. Orthopäde, 2004; 33 (5): 553–557. doi: 10.1007/s00132-003‑0614‑z
- Flor H, Diers M. Sensorimotor training and cortical reorganization. NeuroRehabilitation, 2009; 25 (1): 19–27. doi: B70P08T137N56M57 [pii]
- Maihöfner C, Baron R, DeCol R, Binder A, Birklein F, Deuschl G, Handwerker HO, Schattschneider J. The motor system shows adaptive changes in complex regional pain syndrome. Brain, 2007; 130 (10): 2671–2687. doi: awm131 [pii] 10.1093/brain/awm131
- Maihöfner C, Handwerker HO, Neundörfer B, Birklein F. Cortical reorganization during recovery from complex regional pain syndrome. Neurology, 2004; 63 (4): 693–701. doi: 63/4/693 [pii]
- Flor H, Denke C, Schaefer M, Grüsser S. Effect of sensory discrimination training on cortical reorganisation and phantom limb pain. The Lancet, 2001; 357 (9270): 1763–1764. doi: 10.1016/s0140-6736(00)04890‑x
- Weiss T, Miltner WHR, Adler T, Brückner L, Taub E. Decrease in phantom limb pain associated with prosthesis-induced increased use of an amputation stump in humans. Neuroscience Letters, 1999; 272 (2): 131–134. doi: 10.1016/s0304-3940(99)00595–9
- Flor H, Nikolajsen L, Staehelin Jensen T. Phantom limb pain: a case of maladaptive CNS plasticity? [10.1038/nrn1991]. Nat Rev Neurosci, 2006; 7 (11): 873–881
- Flor H. Maladaptive plasticity, memory for pain and phantom limb pain: review and suggestions for new therapies. Expert Rev Neurother, 2008; 8 (5): 809–818. doi: 10.1586/14737175.8.5.809
- Flor H. Phantom Limb Pain. Encyclopedia of the Human Brain, 2002; 3: 831–841
- Flor H. Phantom Limb Pain. Encyclopedia of the Human Brain, 2002; 3: 831–841
- Moulin DE, Clark AJ, Gilron I, Ware MA, Watson CP, SessleBJ, Canadian Pain Society et al. Pharmacological management of chronic neuropathic pain – consensus statement and guidelines from the Canadian Pain Society. Pain Res Manag, 2007; 12 (1): 13–21
- Sindrup SH, Jensen TS Efficacy of pharmacological treatments of neuropathic pain: an update and effect related to mechanism of drug action. Pain, 1999; 83 (3): 389–400. doi: 10.1016/s0304-3959(99)00154–2
- Huse E, Larbig W, Flor H, Birbaumer N. The effect of opioids on phantom limb pain and cortical reorganization. Pain, 2001; 90 (1–2): 47–55. doi: 10.1016/s0304-3959(00)00385–7
- Flor H. Maladaptive plasticity, memory for pain and phantom limb pain: review and suggestions for new therapies. Expert Rev Neurother, 2008; 8 (5): 809–818. doi: 10.1586/14737175.8.5.809
- Nikolajsen L, Hansen CL, Nielsen J, Keller J, Arendt-Nielsen L, Jensen TS. The effect of ketamine on phantom pain: a central neuropathic disorder maintained by peripheral input. Pain, 1996; 67 (1): 69–77. doi: 10.1016/0304–3959(96)03080–1
- Grüsser SM, Diers M, Flor H. Phantomschmerz: Aspekte der Neuroplastizität und Intervention [Phantom limb pain: aspects of neuroplasticity and intervention]. Anästhesiol Intensivmed Notfallmed Schmerzther, 2003; 38 (12): 762–766. doi: 10.1055/s‑2003–45403
- Flor H. Phantom-limb pain: characteristics, causes, and treatment. The Lancet Neurology, 2002; 1(3): 182–189. doi: 10.1016/s1474-4422(02)00074–1
- Flor H. Visualisierung von Phantom- und Rückenschmerzen durch bildgebende Verfahren: Implikationen für die Behandlung [Visualisation of phantom- and backpain using imaging techniques. Implication for treatment]. Orthopäde, 2004; 33 (5): 553–557. doi: 10.1007/s00132-003‑0614‑z
- Wiech K, Kiefer RT, Töpfner S, Preissl H, Braun C, Unertl K, Flor H, Birbaumer N. A placebo-controlled randomized crossover trial of the Nmethyl-D-aspartic acid receptor antagonist, memantine, in patients with chronic phantom limb pain. Anesth Analg, 2004; 98 (2): 408–413, table of contents.
- Grüsser SM, Diers M, Flor H. Phantomschmerz: Aspekte der Neuroplastizität und Intervention [Phantom limb pain: aspects of neuroplasticity and intervention]. Anästhesiol Intensivmed Notfallmed Schmerzther, 2003; 38 (12): 762–766. doi: 10.1055/s‑2003–45403
- Nikolajsen L, Jensen TS. Phantom limb pain. Br J Anaesth, 2001; 87 (1): 107–116
- Nikolajsen L, Jensen TS. Phantom limb pain. Br J Anaesth, 2001; 87 (1): 107–116
- Katz J, Melzack R. Auricular transcutaneous electrical nerve stimulation (TENS) reduces phantom limb pain. J Pain Symptom Manage, 1991; 6 (2): 73–83
- Flor H. Phantom-limb pain: characteristics, causes, and treatment. The Lancet Neurology, 2002; 1(3): 182–189. doi: 10.1016/s1474-4422(02)00074–1
- Flor H. Visualisierung von Phantom- und Rückenschmerzen durch bildgebende Verfahren: Implikationen für die Behandlung [Visualisation of phantom- and backpain using imaging techniques. Implication for treatment]. Orthopäde, 2004; 33 (5): 553–557. doi: 10.1007/s00132-003‑0614‑z
- Lotze M, Flor H, Grodd W, Larbig W, Birbaumer N. Phantom movements and pain. An fMRI study in upper limb amputees. Brain, 2001; 124 (Pt 11): 2268–2277
- Weiss T, Miltner WH, Huonker R, Friedel R, Schmidt I, Taub E. Rapid functional plasticity of the somatosensory cortex after finger amputation. Exp Brain Res, 2000; 134 (2): 199–203
- Flor H, Denke C, Schaefer M, Grüsser S. Effect of sensory discrimination training on cortical reorganisation and phantom limb pain. The Lancet, 2001; 357 (9270): 1763–1764. doi: 10.1016/s0140-6736(00)04890‑x
- Huse E, Larbig W, Flor H, Birbaumer N. The effect of opioids on phantom limb pain and cortical reorganization. Pain, 2001; 90 (1–2): 47–55. doi: 10.1016/s0304-3959(00)00385–7
- Moseley GL, Zalucki NM, Wiech K. Tactile discrimination, but not tactile stimulation alone, reduces chronic limb pain. Pain, 2008; 137 (3): 600–608. doi: 10.1016/j.pain.2007.10.021
- Ramachandran VS, Rogers-Ramachandran D. Synaesthesia in phantom limbs induced with mirrors. Proc Biol Sci, 1996; 263 (1369): 377–386. doi: 10.1098/rspb.1996.0058
- Brodie EE, Whyte A, Waller B. Increased motor control of a phantom leg in humans results from the visual feedback of a virtual leg. Neurosci Lett, 2003; 341 (2): 167–169. doi: S0304394003001605 [pii]
- Brodie EE, Whyte A, Niven CA. Analgesia through the looking-glass? A randomized controlled trial investigating the effect of viewing a ‚virtual‘ limb upon phantom limb pain, sensation and movement. Eur J Pain, 2007; 11 (4): 428–436. doi: S1090-3801(06)00087–5 [pii]
- Chan BL, Witt R, Charrow AP, Magee A, Howard R, Pasquina PF, Heilman KM, Tsao JW. Mirror therapy for phantom limb pain. N Engl J Med, 2007; 357 (21): 2206–2207. doi: 357/21/2206 [pii]
- MacIver K, Lloyd DM, KellyS, Roberts N, Nurmikko T. Phantom limb pain, cortical reorganization and the therapeutic effect of mental imagery. Brain, 2008; 131 (Pt 8): 2181–2191. doi: awn124 [pii] 10.1093/brain/ awn124
- Seidel, S, Kasprian G, Furtner J, Schöpf V, Essmeister M, Sycha T, Auff E, Prayer D. Mirror therapy in lower limb amputees – a look beyond primary motor cortex reorganization. Rofo, 2011; 183 (11): 1051–1057. doi: 10.1055/s‑0031–1281768
- Moseley GL. Graded motor imagery is effective for long-standing complex regional pain syndrome: a randomised controlled trial. Pain, 2004; 108 (1–2): 192–198. doi: 10.1016/j.pain.2004.01.006
- Moseley GL. Is successful rehabilitation of complex regional pain syndrome due to sustained attention to the affected limb? A randomised clinical trial. Pain, 2005; 114 (1–2): 54–61. doi: 10.1016/j.pain.2004.11.024
- Moseley GL. Graded motor imagery for pathologic pain: a randomized controlled trial. Neurology, 2006; 67 (12): 2129–2134. doi: 01.wnl.0000249112.56935.32 [pii] 10.1212/01.wnl.0000249112.56935.32