Die funktionelle Muskel-Knochen-Einheit
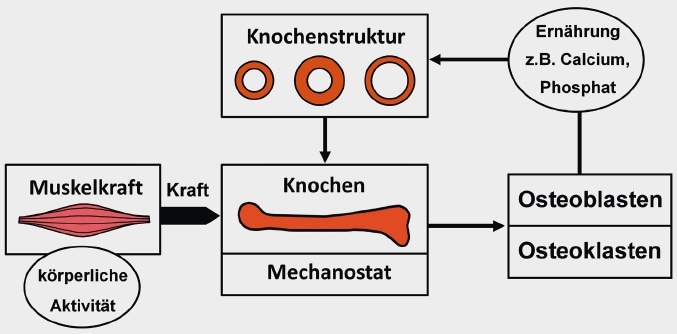
Zur Beurteilung des muskuloskelettalen Systems im Kindes- und Jugendalter hat sich in den vergangenen Jahren das Konzept der funktionellen Muskel-Knochen-Einheit zunehmend etabliert. Der wichtigste Faktor für die Skelettentwicklung im Kindes- und Jugendalter ist die aktive Nutzung des Skelettsystems durch die Muskulatur. Vor mehr als 100 Jahren beschrieb der Anatom Julius Wolff in seinem „Gesetz der Transformation der Knochen” den Zusammenhang zwischen Muskulatur und Skelettentwicklung 1. Dieses Gesetz besagt, dass sich das Knochensystem den äußeren Bedingungen bzw. den auf das Skelettsystem einwirkenden Kräften anpasst. Hieraus entwickelte sich unter Einfluss des Orthopäden Harald Frost die „Mechanostat-Hypothese” 2 3. Im Zentrum dieses Modells zur Knochenentwicklung steht die aktive Muskulatur. Durch die von der Muskulatur ausgelösten Knochenverformungen kommt es zur Aktivierung von Osteoblasten und Osteoklasten und somit zur Anpassung der Knochenfestigkeit. Hohe Kräfte durch starke Muskeln erzeugen einen Knochenaufbau, geringe Kräfte, wie sie z. B. bei Immobilität auftreten, einen Abbau von Knochen und somit eine Reduktion der Knochenfestigkeit. Das Modell des Mechanostaten ist in Abbildung 1 dargestellt und wird durch verschiedene nichtmechanische Einflüsse wie Hormone, Ernährung und Medikamente modifiziert. Die treibende Kraft für die Skelettentwicklung bleibt jedoch die aktive Nutzung der Muskulatur.
Bewegungsstörungen und physiotherapeutische Konzepte
Kinder mit Bewegungsstörungen sind aufgrund ihrer primären Erkrankung nicht in der Lage, adäquate Muskelaktivität durch Bewegung zu erzeugen, und entwickeln aufgrund dessen sekundär Skelett-Erkrankungen. Zur Aktivierung der Muskulatur haben sich verschiedene physiotherapeutische Trainingsprogramme bewährt 4. Insbesondere können für zielorientierte, intensive und gerätegestützte Verfahren nach dem aktuellen Stand der Wissenschaft bestimmte Effekte nachgewiesen werden 5. Physiotherapeutische Konzepte im Allgemeinen zielen auf eine aktive Nutzung der Muskulatur ab. Unter Berücksichtigung der funktionellen Muskel-Knochen-Einheit führt eine aktivere Muskelnutzung zu einem osteoanabolen Effekt und somit zu einer Stabilisierung des Skelettsystems und einer Reduktion der sekundären Osteoporose.
Vibrationsunterstützte Physiotherapie
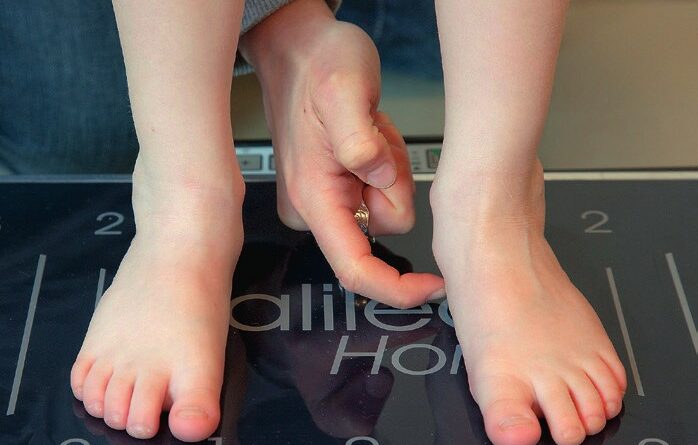
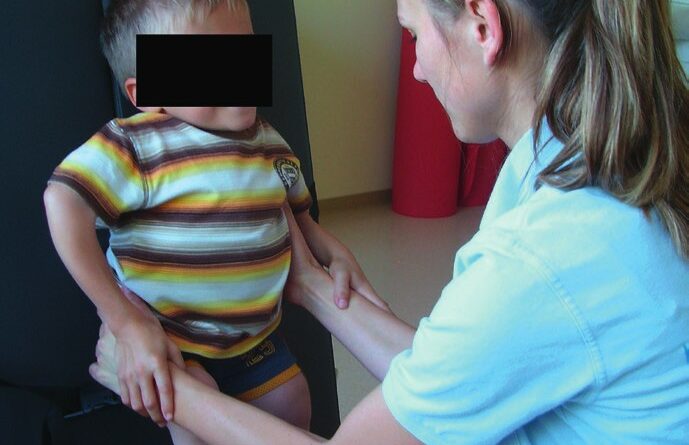
Eine neuere Möglichkeit zur Unterstützung des physiotherapeutischen Trainings ist der Einsatz der seitenalternierenden Ganzkörpervibration mit dem System Galileo® (Novotec Medical, Pforzheim) (Abb. 2). Die Galileo®-Vibrationsplatte erzeugt eine seitenalternierende Bewegung ähnlich einer Wippe, die den Körper in Schwingungen versetzt. Die eingeleiteten Schwingungen lösen in schneller Folge Reflexe aus, die eine Kontraktion der Muskelgruppen zur Folge haben und so zu einem Zuwachs an Muskelkraft und Muskelleistung führen 6 7. Durch die seitenalternierenden Wechsel in hoher Frequenz werden Agonisten und Antagonisten stimuliert, ähnlich dem Bewegungsmuster beim Gehen. Die Schwingungen werden durch die zwei Kenngrößen „Frequenz” und „Amplitude” charakterisiert. Die Frequenz ist beliebig einstellbar (5–30 Hertz) und kann somit an die individuelle körperliche Belastbarkeit und die Bedürfnisse des Patienten angepasst werden. Niedrige Frequenzen (5–12 Hertz) dienen der Mobilisation, der Muskelentspannung und dem Gleichgewicht. Mittlere Frequenzen (12–20 Hertz) trainieren die Koordination der Muskulatur (Kontraktion/Relaxation) und die Dehnung des Muskel- und Sehnenapparats. Hohe Frequenzen (20–30 Hertz) steigern die Muskelleistung und stellen die Muskelkraft wieder her. Die Amplitude kann über die Position des Patienten auf der Vibrationsplatte zwischen 0 und 12 mm eingestellt werden. Die Einleitung der Schwingungen in den Körper und somit in die verschiedenen Muskelgruppen kann durch verschiedene Variationen der Körperhaltung erzielt werden. Durch diese reflexgesteuerte Form des Trainings können bei Patienten mit Bewegungsstörungen Muskelkraft und Koordination unabhängig von der willentlichen Ansteuerung verbessert werden. Stehfähige Kinder trainieren auf einem Standgerät, nicht stehfähige Kinder auf einem Kipptisch, der am Fußende mit einer Vibrationsplatte kombiniert wird (Abb. 3). Der Winkel der Vertikalisierung kann somit stufenlos eingestellt werden.
In Pilotstudien mit Kindern und Jugendlichen mit unterschiedlichen immobilisierenden Erkrankungen konnte ein sicherer Einsatz dieser Methode gezeigt werden. Bei Kindern mit einer Osteogenesis imperfecta konnte eine Zunahme der Muskelkraft nachgewiesen werden 8 9. Auch bei Kindern mit einer muskulären Ursache für ihre Immobilität wurde das Vibrationstraining untersucht, und es zeigte sich ein sicherer Einsatz bei Kindern mit Muskeldystrophie Duchenne und spinaler Muskelatrophie 10. Auch bei anderen chronischen Erkrankungen, die zu einer reduzierten körperlichen Belastbarkeit führen, wurde die Wirksamkeit und Sicherheit der Ganzkörpervibration untersucht 11 12; an jungen Erwachsenen mit einer cystischen Fibrose wurde eine Zunahme der muskulären Leistungsfähigkeit nachgewiesen 13.
Multimodales Rehabilitationsprogramm “Auf die Beine”
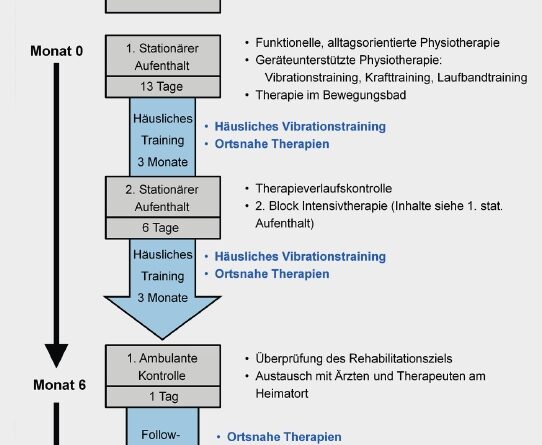
Aus den oben genannten Erkenntnissen entstand das multimodale Rehabilitationskonzept der Regelversorgung „Auf die Beine”. Kurze, intensive stationäre Phasen werden dabei mit 6 Monaten häuslichem Ganzkörpervibrationstraining kombiniert, welches durch die Eltern durchgeführt wird; somit werden die Eltern zu Co-Therapeuten und können die Therapie zu Hause fortführen. Das Rehabilitationsprogramm ist auf die Behandlung von Kindern und Jugendlichen mit Bewegungsstörungen ausgerichtet und besteht aus einem zweiwöchigen stationären Aufenthalt zu Beginn und einem sechstägigen Aufenthalt nach 3 Monaten. Zur Kontrolle und Erfassung der Nachhaltigkeit erfolgen ambulante Untersuchungen 6 Monate nach Beginn und nach 12 Monaten (Abb. 4). Während des ersten stationären Aufenthaltes werden die Eltern und Patienten für ein häusliches sechsmonatiges Ganzkörpervibrationstraining angeleitet. Das Trainingsgerät wird den Familien für 6 Monate zur Verfügung gestellt. Das häusliche Training wird 10 Mal pro Woche für 3 mal 3 Minuten durchgeführt; die häuslichen Übungen werden entsprechend der individuellen Zielsetzung ausgewählt.
Während der stationären Trainingsblöcke erhält der Patient 4 bis 5 Stunden Physiotherapie täglich mit und ohne Unterstützung durch Geräte: Zweimal täglich wird in jeweils einer Stunde funktionellen Trainings an der individuellen Zielsetzung des Patienten gearbeitet. Ebenfalls täglich erhalten die Patienten 3 Einheiten Ganzkörpervibrationstraining. Zur zweimal täglichen funktionellen Physiotherapie und zum dreimal täglichen Vibrationstraining kommen 3 weitere Komponenten wöchentlich zur Steigerung der Intensität hinzu: isoliertes Muskelkrafttraining, Laufbandtherapie oder Gehtraining mit dem Lokomat® und Therapie im Bewegungsbad.
Ergebnisse des Rehabilitationsprogramms
Insgesamt wurden die Ergebnisse des multimodalen Rehabilitationsprogramms bisher für 469 Patienten beschrieben: 356 Kinder und Jugendliche mit Cerebralparese (CP) (durchschnittliches Alter 8.9 ± 4.4 Jahre, GMFCS-Level I–IV; GMFCS = Gross Motor Function Classification System), 60 mit Spina bifida (durchschnittliches Alter 8.71 ± 4.7 Jahre) und 53 mit Osteogenesis imperfecta (OI) (durchschnittliches Alter: 9.1 ± 0.61 Jahre). Bei den 356 Kindern mit einer zerebralen Bewegungsstörung konnte eine positive Entwicklung der Mobilität nach Teilnahme am Konzept „Auf die Beine” gezeigt werden, die auch nach 6 Monaten nach Beendigung der Maßnahme erhalten blieb 14. Diese Ergebnisse konnten auch bei den anderen beiden Gruppen (Spina bifida und OI) beobachtet werden 15 16. Vorangegangene Arbeiten zeigten, dass das Training innerhalb des Konzeptes „Auf die Beine” durch die verbesserte Mobilität auch einen positiven Effekt auf die gesamte Skelettentwicklung hat 17.
Wann ist der optimale Behandlungsbeginn?
Die oben beschriebenen Ergebnisse weisen auf einen Effekt zielgerichteter, intensiver, technologiegestützter physiotherapeutischer Verfahren hin. Wann ist jedoch der optimale Behandlungsbeginn? Die von den Verfassern untersuchten Patientengruppen waren im Durchschnitt 8 bis 9 Jahre alt, mit einer Altersspanne von ca. 2 bis 25 Jahren. In der Gruppe der Kinder mit zerebraler Bewegungsstörung war eine größere Zunahme der motorischen Fähigkeiten im jungen Alter zu beobachten. Dies ist jedoch nicht ungewöhnlich, denn im jungen Lebensalter wird eine größere Entwicklung der motorischen Fähigkeiten erwartet (wie auch bei einem gesunden Kind). Rosenbaum et al. (2002) zeigten, dass Kinder mit zerebraler Bewegungsstörung 90 % des Maximums ihrer motorischen Fähigkeiten im Alter von 4,8 Jahren (GMFCS Level I), 4,4 Jahren (GMFCS Level II), 3,7 Jahren (GMFCS Level III), 3,5 Jahren (GMFCS Level II) und 2,7 Jahren (GMFCS Level I) erreichen 18. Nach dem Erreichen dieser motorischen Entwicklungsgrenzen bleibt das motorische Niveau bis zum Erwachsenenalter relativ stabil, und die Möglichkeiten einer Verbesserung des motorischen Niveaus sind limitiert 19 20, sowohl durch physiotherapeutische Maßnahmen als auch durch Operationen. Jedoch ist dies im jungen Alter vor dem zweiten Lebensjahr nicht der Fall. Vor dem zweiten Lebensjahr ist das GMFCS-Level noch nicht stabil, und es kann mit einem Wechsel in ein nächsthöheres GMFCS-Level gerechnet werden 21. Es ist anzunehmen, dass relativ kleine Verbesserungen der motorischen Fähigkeiten eines Kindes mit zerebraler Bewegungsstörung vor dem zweiten Lebensjahr zu grundsätzlich besseren motorischen Verläufen in der späteren Entwicklung führen. Diese Beobachtungen weisen auf ein „biologisch-genetisches” Zeitfenster hin, in dem die motorische Entwicklung noch variabel ist und eine positive Beeinflussung der zukünftigen motorischen Entwicklung möglich scheint. Wie dies jedoch am besten umzusetzen sei, ist derzeit noch nicht geklärt und Gegenstand wissenschaftlicher Untersuchungen mit unterschiedlichen Ergebnissen, z. B. 22 23.
Neurowissenschaftlicher Hintergrund
Auch aus dem Bereich der Neurowissenschaften gibt es in der aktuellen Literatur Empfehlungen zum frühzeitigen Behandlungsbeginn, wenn das Gehirn noch sehr plastisch ist 24. Muskeln und Nerven passen sich kontinuierlich den wechselnden Anforderungen der motorischen Aktivität an. Es konnte nachgewiesen werden, dass dadurch bei häufiger, zielgerichteter Bewegung positive Effekte im Hinblick auf die Motorik gezeigt werden können, aber auch negative Effekte bei Immobilität und Fehlbelastung entstehen 25. Dies zeigt die Notwendigkeit für optimale, zielgerichtete physiotherapeutische Strategien, aber auch die Dringlichkeit der Vermeidung von falschen, fehlenden oder inadäquaten physiotherapeutischen Interventionen, die zur Verschlechterung führen 26.
Fazit
Das multimodale Rehabilitationsprogramm „Auf die Beine” für Kinder und Jugendliche mit Bewegungsstörungen ist translational aus Modellen zur funktionellen Muskel-Knochen-Einheit entstanden und wird weiterhin kontinuierlich wissenschaftlich begleitet und weiterentwickelt. Es konnte eine positive Entwicklung der Mobilität bei Kindern und Jugendlichen mit Mobilitätsstörungen nach Teilnahme am Konzept „Auf die Beine” gezeigt werden, die auch 6 Monate nach Beendigung der Maßnahme erhalten blieb. Funktionelle Therapien sind wichtig für ein gutes Aktivitätsniveau der Kinder mit Bewegungsstörungen 27 28, und Training hat einen positiven neuronalen Effekt 29; jedoch wissen wir bis heute nicht, welche Arten von Bewegung oder Übungen wann und in welchem Umfang am erfolgreichsten sind. Mit zunehmender Evidenz kristallisieren sich intensive, zielorientierte und gerätegestützte Verfahren als die effektivsten heraus – mit Tendenz zu einem frühestmöglichen Behandlungsbeginn.
Für die Autoren:
Prof. Dr. Christina Stark
Klinik und Poliklinik für Kinder- und Jugendmedizin
Uniklinik Köln
Kerpener Straße 62
50931 Köln
christina.stark@uk-koeln.de
Begutachteter Beitrag/reviewed paper
Stark C, Schönau E. Biologisch-genetische Zeitfenster, Neuroplastizität, Frühtherapie – Neue Konzepte für Kinder mit Bewegungsstörungen. Orthopädie Technik, 2015; 66 (4): 56–60
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Ein engagierter Leistungssportler mit Hemiparese und der Einsatz sensomotorischer Fußorthesen (SMFO) — 12. Februar 2026
- Wolff J. Das Gesetz der Transformation der Knochen. Berlin, Hirschwald: Julius Wolff Institut, 1892
- Frost HM, Schönau E. The „muscle-bone unit” in children and adolescents: a 2000 overview. J Pediatr Endocrinol Metab, 2000;13 (6):571–590
- Schoenau E, Frost HM. The “muscle-bone unit” in children and adolescents. Calcif Tissue Int, 2002; 70 (5): 405–407
- Novak I, McIntyre S, Morgan C, Campbell L, Dark L, Morton N, et al. A systematic review of interventions for children with cerebral palsy: state of the evidence. Dev Med Child Neurol, 2013; 55 (10): 885–910
- Novak I, McIntyre S, Morgan C, Campbell L, Dark L, Morton N, et al. A systematic review of interventions for children with cerebral palsy: state of the evidence. Dev Med Child Neurol, 2013; 55 (10): 885–910
- Rittweger J, Mutschelknauss M, Felsenberg D. Acute changes in neuromuscular excitability after exhaustive whole body vibration exercise as compared to exhaustion by squatting exercise. Clin Physiol Funct Imaging, 2003; 23 (2): 81–86
- Cardinale M, Bosco C. The use of vibration as an exercise intervention. Exerc Sport Sci Rev, 2003; 31 (1): 3–7
- Semler O, Fricke O, Vezyroglou K, Stark C, Schoenau E. Preliminary results on the mobility after whole body vibration in immobilized children and adolescents. J Musculoskelet Neuronal Interact, 2007; 7 (1): 77–81
- Semler O, Fricke O, Vezyroglou K, Stark C, Stabrey A, Schoenau E. Results of a prospective pilot trial on mobility after whole body vibration in children and adolescents with osteogenesis imperfecta. Clin Rehabil, 2008; 22 (5): 387–394
- Vry J, Schubert IJ, Semler O, Haug V, Schönau E, Kirschner J. Whole-body vibration training in children with Duchenne muscular dystrophy and spinal muscular atrophy. Eur J Paediatr Neurol, 2014; 18 (2): 140–149
- Semler O, Fricke O, Vezyroglou K, Stark C, Schoenau E. Preliminary results on the mobility after whole body vibration in immobilized children and adolescents. J Musculoskelet Neuronal Interact, 2007; 7 (1): 77–81
- Semler O, Fricke O, Vezyroglou K, Stark C, Stabrey A, Schoenau E. Results of a prospective pilot trial on mobility after whole body vibration in children and adolescents with osteogenesis imperfecta. Clin Rehabil, 2008; 22 (5): 387–394
- Rietschel E, van Koningsbruggen S, Fricke O, Semler O, Schoenau E. Whole body vibration: a new therapeutic approach to improve muscle function in cystic fibrosis? Int J Rehabil Res, 2008; 31 (3): 253–256
- Stark C, Semler O, Duran I, Stabrey A, Kaul I, Herkenrath P, et al. Intervallrehabilitation mit häuslichem Training bei Kindern mit Zerebralparese. Monatsschr Kinderheilkd, 2013; 161: 625–632
- Stark C, Hoyer-Kuhn HK, Semler O, Hoebing L, Duran I, Cremer R, et al. Neuromuscular training based on whole body vibration in children with spina bifida: a retrospective analysis of a new physiotherapy treatment program. Childs Nerv Syst, 2015; 31 (2): 301–309
- Hoyer-Kuhn H, Semler O, Stark C, Struebing N, Goebel O, Schoenau E. A specialized rehabilitation approach improves mobility in children with osteogenesis imperfecta. J Musculoskelet Neuronal Interact, 2014; 14 (4): 445–453
- Stark C, Nikopoulou-Smyrni P, Stabrey A, Semler O, Schoenau E. Effect of a new physiotherapy concept on bone mineral density, muscle force and gross motor function in children with bilateral cerebral palsy. Journal of Musculoskeletal Neuronal Interactions, 2010; 10 (2): 151–158
- Rosenbaum PL, Walter SD, Hanna SE, Palisano RJ, Russell DJ, Raina P, et al. Prognosis for gross motor function in cerebral palsy: Creation of motor development curves. J Am Med Assoc, 2002; 288 (11): 1357–1363
- Palisano RJ, Cameron D, Rosenbaum PL, Walter SD, Russell D. Stability of the gross motor function classification system. Dev Med Child Neurol, 2006; 48 (6): 424–428
- McCormick A, Brien M, Plourde J, Wood E, Rosenbaum P, McLean J. Stability of the Gross Motor Function Classification System in adults with cerebral palsy. Dev Med Child Neurol, 2007; 49 (4): 265–269
- Gorter JW, Ketelaar M, Rosenbaum P, Helders PJ, Palisano R. Use of the GMFCS in infants with CP: the need for reclassification at age 2 years or older. Dev Med Child Neurol, 2009; 51 (1): 46–52
- Hielkema T, Hamer EG, Reinders-Messelink HA, Maathuis CG, Bos AF, Dirks T, et al. LEARN 2 MOVE 0–2 years: effects of a new intervention program in infants at very high risk for cerebral palsy; a randomized controlled trial. BMC Pediatr, 2010; 10: 76
- Prosser LA, Ohlrich LB, Curatalo LA, Alter KE, Damiano DL. Feasibility and preliminary effectiveness of a novel mobility training intervention in infants and toddlers with cerebral palsy. Dev Neurorehabil, 2012; 15 (4): 259–266
- Kolb B, Brown R, Witt-Lajeunesse A, Gibb R. Neural compensations after lesion of the cerebral cortex. Neural Plast, 2001; 8(1–2): 1–16
- Johnston MV. Clinical disorders of brain plasticity. Brain Dev, 2004; 26 (2): 73–80
- Johnston MV. Plasticity in the developing brain: implications for rehabilitation. Developmental Disabilities Research Reviews 2009; 15 (2): 94–101
- Damiano DL. Activity, activity, activity: rethinking our physical therapy approach to cerebral palsy. Phys Ther, 2006; 86 (11): 1534–1540
- Garvey MA, Giannetti ML, Alter KE, Lum PS. Cerebral palsy: New approaches to therapy. Current Neurology and Neuroscience Reports, 2007; 7 (2): 147–155
- Damiano DL. Rehabilitative therapies in cerebral palsy: the good, the not as good, and the possible. J Child Neurol, 2009; 24 (9): 1200–1204