Einleitung
Moderne Schaft-Stumpf-Anbindungen werden hinsichtlich der Materialauswahl immer innovativer und komplexer, um möglichst optimal formschlüssige und stark haftende Prothesenschäfte herzustellen. Die Passform ist und bleibt aber die Domäne des Orthopädie-Technikers und ist untrennbar mit dessen Erfahrungsschatz gekoppelt. Was kennzeichnet einen gut sitzenden und passenden Prothesenschaft? Es sind lediglich die äußerlichen Kontrollmöglichkeiten seitens des Handwerkers, die bei der Überprüfung in Augenschein genommen werden. Was ist aber zu tun, wenn sich die Haut verändert, es zu Rötungen, Verhärtungen oder gar wunden Stellen kommt? Oft ist es dann zu spät, und es muss – sofern möglich – umgehend reagiert werden. Aber die sichtbaren Veränderungen sind lediglich Symptome. Aufgabe sowohl des Technikers als auch des Arztes ist es, die Ursachen entsprechend zu diagnostizieren. Hilfreich bei diesem Prozess könnte eine Darstellung der Geschehnisse im Stumpf auf der Basis von Bioimpedanzmessungen sein. Könnte dies zukünftig die oben genannten Symptome verhindern oder zumindest die am Prozess beteiligten Berufsgruppen dafür sensibilisieren? Arzt und Techniker könnten dadurch gemeinsam auf dieselben Informationen zurückgreifen, was die Diagnostik beider Berufsgruppen und deren Kommunikation miteinander verbessern würde.
Einführung ins Thema
Alle Körpergewebe setzen sich aus Komponenten wie Fett, Muskeln, Wasser, Knochen usw. zusammen, die je nach ihren spezifischen chemischen Eigenschaften verschiedene Leitfähigkeiten bzw. Widerstände einem Strom gegenüber aufweisen. In Tabelle 1 wird der spezifische Widerstand üblicher Körpergewebe in Ohm-Zentimeter (Ω · cm) angegeben.
Wie man der Tabelle entnehmen kann, zeigen Gewebe mit einem erhöhten Wasser- und Elektrolytgehalt, z. B. Blut oder Blutplasma, einen niedrigen Widerstand einem elektrischen Strom gegenüber. Demgegenüber wirken Fettgewebe als Isolierungsschicht und weisen daher einen deutlich erhöhten spezifischen Widerstand auf. Das bedeutet, dass unterschiedliche Gewebe sich durch ihre entsprechenden elektrischen Eigenschaften und insbesondere mittels ihrer Leitfähigkeit analysieren lassen.
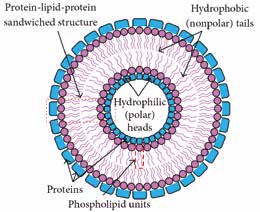
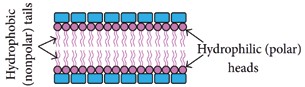
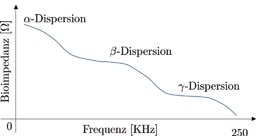
Die elektrischen Eigenschaften biologischer Gewebe werden generell als „Bioimpedanz“ bezeichnet. Dabei ist jedoch zu beachten, dass die Bioimpedanz nicht nur von der biochemischen Zusammensetzung der analysierten Gewebe, sondern auch von der Frequenz des eingehenden Stroms abhängig ist [1–4]. Grund dafür ist die Basiskomposition der Zellen, aus denen die Gewebe zusammengesetzt sind. Wie in Abbildung 1 dargestellt, hat jede Zelle eine phospholipidische Membran (Zellmembran), die eine Abgrenzung der Zelle gegenüber der äußeren Welt schafft. Innerhalb und außerhalb der Zelle gibt es leitfähige, elektrolytische Flüssigkeiten; andererseits kann die Zellmembran elektro physiologisch als Plattenkondensator angesehen werden, dessen spezifische Kapazität bei Membranen verschiedener Zelltypen im Bereich von etwa 1 μF · cm−2 liegt. Deshalb lässt die Zellmembran niedrige Stromfrequenzen nicht hindurch.
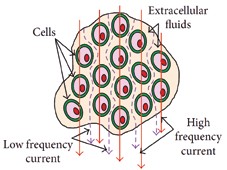
Wie in Abbildung 2 dargestellt, kann man je nach der eingehenden Stromfrequenz drei Hauptfrequenzbereiche unterscheiden:
- Bereich α‑Dispersion: In diesem Frequenzbereich ist der Widerstand lediglich eine Konsequenz der Wassermenge und der Elektrolyten außerhalb der Zellen (extrazelluläre Flüssigkeit).
- Bereich β‑Dispersion: In diesem Fall wirkt die Zellmembran als Kondensator und lässt den Strom mit niedrigen Frequenzen nicht hindurchfließen.
- Bereich γ‑Dispersion: In diesem Frequenzbereich kann der Strom durch die Zellmembran der Gewebe hindurchfließen. Der Widerstand ist in diesem Fall lediglich eine Konsequenz des Ionentransports durch die Zellmembran selbst, während die tatsächliche Leitfähigkeit von den intra- und extrazellulären Flüssigkeiten abhängig ist.
Die Analyse, die durch Anwendung eines Wechselstroms zur Auswertung der Bioimpedanz durchgeführt wird, wird als „Bioimpedanzanalyse“ (abgekürzt BIA) bezeichnet. Diese ist beispielsweise das Basisprinzip aller elektronischen Personenwaagen, die eine Analyse der Körperzusammensetzung erlauben.
Prinzipiell kann eine BIA mit einer oder mehreren Frequenzen durchgeführt werden. Die Anwendung mehrerer Frequenzen hat den großen Vorteil, zusätzliche Informationen bezüglich Gewebezusammensetzung und Stoffwechselfunktionen zu liefern. In der Tat ist die Menge an extra- und intrazellulären Flüssigkeiten durch die sogenannte Kalium-Natrium-Pumpe (oder Kalium-Natrium-ATPase) reguliert, die eine wesentliche Rolle bei der Hindurchführung von Energie (ATP) in die Zellen spielt. Eine unbalancierte Menge an intra- und extrazellulären Flüssigkeiten kann daher eine Stoffwechselstörung signalisieren. Dennoch können lokale Entzündungen, Muskelverletzungen, Blutergüsse, Veränderungen der peripheren Durchblutung und weitere lokale Veränderungen der in den Geweben verfügbaren (extrazellulären) Flüssigkeiten ebenfalls durch BIA erkannt werden. Eine vollständige Übersicht über das allgemeine Verfahren und die praktische Anwendung der Bioimpedanz ist 1 2 3 4 zu entnehmen.
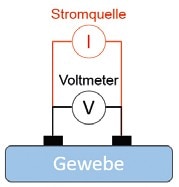
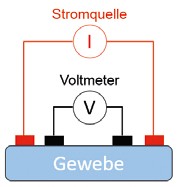
Hauptvorteil der BIA ist ihre Nichtinvasivität: Nur einfache Elektroden, die an der Haut positioniert werden, sind dafür nötig. Die Elektroden können Bandelektroden sein, d. h. Elektroden, die wie ein Gürtel beispielsweise am ganzen Bein befestigt werden. Außerdem ist keine komplexe messtechnische Hardware erforderlich. Typische Elektrodenkonfigurationen für eine einfache BIA sind in Abbildung 3 dargestellt, wobei die zweite Konfiguration (Abb. 3b), bei der Messelektroden (Voltmeter) und Elektroden für den Wechselstrom getrennt sind, in der Regel präzisere Ergebnisse liefert.
Typische klinische Anwendungen sind die Auswertung der Körperzusammensetzung, z. B. bei adipösen Patienten 5 6 sowie bei Dialysepatienten, bei denen das kontinuierliche Monitoring des Wasseranteils eine äußerst wichtige Rolle spielt 7. Neue Studien verwenden Bioimpedanzmessungen auch für die Untersuchung (chronischer) Herzinsuffizienzpatienten, bei denen oft Lungen- oder Beinödeme entstehen 8. Das hämodynamische Monitoring von Traumapatienten lässt sich auch mittels Bioimpedanz durchführen, wie u. a. in 9 10 gezeigt.
Im Folgenden werden diverse Anwendungsmöglichkeiten der BIA vorgestellt, die für die Erkennung bzw. Auswertung von Störungen bei beinamputierten Patienten signifikant sein können. Der Fokus liegt hauptsächlich auf Lösungen, mit deren Hilfe man Störungen am Beinstumpf wie z. B. Schwellungen, eine beschränkte Durchblutung usw. erkennen kann.
Impedanzplethysmographie (IPG)
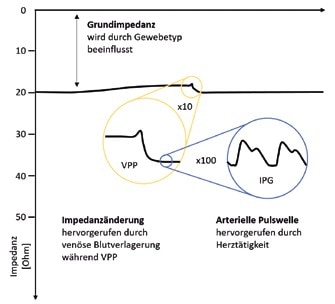
Unter Impedanzplethysmographie (IPG) versteht man die Anwendung von Bioimpedanz zur nichtinvasiven Messung kleiner Blutvolumenveränderungen eines Körperteils mit dem spezifischen Ziel, den Gesundheitszustand der untersuchten Gewebe zu analysieren. Sowohl Standard- als auch Bandelektroden können für die Messung benutzt werden. Das Prinzip der IPG ist schematisch in Abbildung 4 dargestellt. Dabei wird in der Regel ein Wechselstrom mit einer Frequenz von 86 KHz angewendet.
Wie der Abbildung zu entnehmen ist, ist die resultierende Bioimpedanz abhängig von arteriellen und venösen Blutvolumenvariationen und setzt sich aus drei Komponenten zusammen:
- aus der arteriellen Pulswelle,
- aus den venösen Blutvolumenveränderungen,
- aus einer konstanten Komponente, der Grundimpedanz, die von allen anderen Bestandteilen des Messabschnitts bestimmt wird.
Die arteriellen Pulswellen des IPG-Signals werden zur Diagnose der Arterien ausgewertet. Bei der Venenverschlussplethysmographie (VVP) und der Arterienverschlussplethysmographie (AVP) werden venöse Blutvolumenveränderungen provoziert, die mit Hilfe der IPG gemessen werden können, um einen Funktionstest des peripheren venösen bzw. arteriellen Systems durchzuführen.
Dieses Verfahren kann vorteilhaft zur Auswertung der peripheren Durchblutung bei Patienten angewendet werden, die eine Ober- bzw. Unterschenkelamputation erlebt haben. Die Methode ist nichtinvasiv und ermöglicht ein kontinuierliches Monitoring, damit mögliche Durchblutungsprobleme rechtzeitig erkannt werden können. Mit der Anwendung von nur einer Messfrequenz ist außerdem die Hardware technisch einfach zu realisieren. Zu beachten ist dabei jedoch, dass der Abstand zwischen den Messelektroden nicht geringer als 10 cm sein sollte, um eine gute Signalqualität zu erreichen. Dieses Erfordernis könnte ein Problem bei Patienten mit extrem kurzem Beinstumpf darstellen. In diesen Ausnahmefällen ist IPG daher nicht gut geeignet.
Multifrequenz-Bioimpedanzanalyse (MFBIA)
Da die Bioimpedanz von der Wechselstromfrequenz abhängig ist und diese eine indirekte Auswertung der Menge an intra- und extrazellulären Flüssigkeiten liefert, kann man mehrere unterschiedliche Frequenzen statt einer einzelnen Messfrequenz anwenden. Die Anwendung mehrerer Frequenzen vermittelt nicht nur direkte Informationen über den Hydratationsstatus des Patienten, sondern auch in Bezug auf Stoffwechselfunktionalität, Durchblutungsstörungen, Ödeme, lokale Entzündungen, Nekrosen usw.
Wie oben erwähnt, wird die Menge an intra- und extrazellulären Flüssigkeiten durch die sogenannte Natrium-Kalium-ATPase geregelt, d. h., die Menge an Wasser, das sich im Zytoplasma und im Extrazellraum befindet, wird durch eine feine, selbstregulierende Reaktion festgelegt, die das Wasser durch die Zellmembran hindurchfließen lässt, um die Konzentration von Kalium innerhalb und Natrium außerhalb der Zellen automatisch auszugleichen. Zahlreiche Studien zeigen eine starke Korrelation zwischen Na-K-Pumpe und Mortalitätsrisiko sowie Gesundheitsstörungen, die mit systemischen und neurologischen Erkrankungen zu tun haben 11.
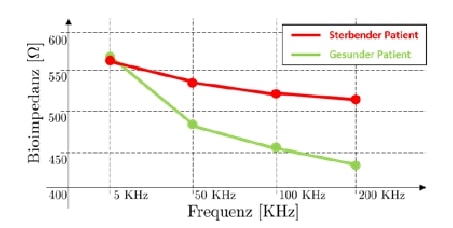
Typische Messfrequenzen für eine MFBIA sind 5, 50, 100 und 200 KHz. Wenn diese Punkte im Frequenz-Bioimpedanz-Raum dargestellt werden, erhält man sogenannte Multifrequenz-Bioimpedanz-Kurven (MFBIA-Kurven). Bei gesunden Patienten sind diese durch eine steile Abnahme mit steigender Frequenz gekennzeichnet, weil die Menge an Wasser im Zytoplasma und im Extrazellraum gut ausbalanciert ist. Dagegen ist die MFBIA-Kurve bei Patienten mit erhöhtem Mortalitätsrisiko wegen der unausgeglichenen Menge an intra- und extrazellulärem Wasser relativ flach. Somit stellen die MFBI-Kurven eine einfache grafische Lösung zur intuitiven, direkten Auswertung der Patienten gesundheit dar (siehe Abb. 5).
Zudem kann man anhand der MFBIA-Kurven einen weiteren Parameter definieren: die Impedanz-Ratio als
![]() .
.
Diese entspricht dem Quotienten aus der Impedanz bei der maximalen und der minimalen Messfrequenz, die eine Approximation der Kurvenabstiegsgeschwindigkeit ergibt.
Der Hauptvorteil der Impedanz-Ratio besteht darin, dass alle multiplikativen Störungen, die Einfluss auf den Endwert der Impedanz nehmen können, sich automatisch annullieren. Das heißt aber auch, dass Ergebnisse unterschiedlicher Patienten voneinander unabhängig und miteinander vergleichbar sind. Eine allgemeine Übersicht über die MFBIA und die Bedeutung der Impedanz-Ratio ist in 12 zu finden.
Obwohl die derzeitige Forschung auf die Auswertung des gesamten Gesundheitsstatus eines Patienten beschränkt ist, können die MFBIA-Kurve und die Impedanz-Ratio in ähnlicher Weise zur Untersuchung und zum Monitoring von Körperteilen bei Patienten mit Amputationen verwendet werden. Veränderungen in den Kurven können in der Tat ein peripherisches Problem signalisieren, wobei die Erkennung der Ursache und der Natur sowie die Isolierung bzw. Lokalisierung per se nicht trivial sind.
Zudem kann die Impedanz-Ratio ein adäquater Parameter für das Monitoring und für die rechtzeitige Erkennung von Störungen an amputierten Gliedmaßen sein, wobei die tatsächliche Bedeutung der gemessenen Werte in der Praxis noch experimentellmittelt werden muss.
Derzeit sind keine Studien bekannt, in denen MFBIA-Kurven oder die Impedanz-Ratio zum Monitoring oder zur Untersuchung peripherer Störungen bei amputierten Gliedmaßen verwendet werden.
Impedanzspektroskopie
Die Impedanzspektroskopie ist ein Sonderfall der MFBIA, bei der nicht nur einige, sondern sehr viele diverse Messfrequenzen verwendet werden. Technisch unterscheidet sie sich von der MFBIA jedoch kaum. Hier sind ebenfalls derzeit keine Forschungsarbeiten bekannt, in denen diese Technik zur Untersuchung peripherer Störungen bei amputierten Gliedmaßen angewendet wird. Auch auf diesem Gebiet gibt es die Möglichkeit, innovative Lösungen zu entwickeln, die die Erkennung minimaler Veränderungen in den peripheren Geweben wegen Durchblutungsstörungen, Schwellungen, Wunden usw. erlauben.
Vergleich der Methoden
In Tabelle 2 sind die hier vorgestellten Methoden mit entsprechenden Vorteilen und Herausforderungen überblicksartig zusammengefasst.
Dabei ist zu beachten, dass die genannten Methoden im Prinzip zwar die Erkennung peripherer Veränderungen in den untersuchten Geweben erlauben – eine genaue Lokalisierung bzw. Isolierung der entsprechenden Störung ist dabei jedoch ausgeschlossen. Mit mehreren Frequenzen können gleichzeitig mehrere Informationen über die genaue Gewebezusammensetzung gesammelt werden, d. h., durch Impedanzspektroskopie könnten prinzipiell Art und Ursache der Beschwerde identifiziert werden, jedoch wächst dadurch die technische Komplexität der dafür erforderlichen Hardware. Außerdem sind derzeit keine Studienbekannt, in denen die spektralen Informationen über die Bioimpedanz mit diversen Beschwerdearten (Schwellungen, Wunden, Entzündungen usw.) korreliert werden. Daher ist ein Erfolg solcher Klassifikationen derzeit nur schwer zu prognostizieren.
Fazit
Die Datenerfassung durch Bioimpedanzmessungen stellt eine Möglichkeit dar, Haut‑, Gewebe- und Gefäßveränderungen des Stumpfes während des Tragens eines Prothesenschaftes frühzeitig zu erkennen und Rückschlüsse auf deren Ursache zu ziehen. Technisch gesehen ist aber der Kontakt der Sensoren zur Haut eine große Herausforderung. Nach eingehender Recherche und entsprechenden Analysen bzw. Versuchen wird sich das Projektteam des Autors weiterhin mit diesem Thema auseinandersetzen. Das hier Beschriebene ist ein erster Ansatz zum Monitoring des Prothesentrageverhaltens; insbesondere bezüglich des Schaftes und auch hinsichtlich telemedizinischer Ansätze kann dies als Schritt nach vorn gelten. Zum Zeitpunkt der Beitragserstellung konnten bereits Versuchsaufbauten in gesicherter Umgebung getestet werden. Für die Publikation von Ergebnissen ist es aber noch zu früh; diese werden zu einem späteren Zeitpunkt veröffentlicht.
Der Autor:
Daniel Merbold (CPO, MBA)
D Med Tech Consulting
Waidmannspromenade 10
14548 Schwielowsee
info@dmedtech.consulting
Begutachteter Beitrag/reviewed paper
Merbold D. Mögliche Anwendungen der Bioimpedanz bei Patienten mit transfemoraler Amputation. Orthopädie Technik, 2019; 70 (8): 36–41
| Gewebe | Spezifischer Widerstand (Ω · cm) |
|---|---|
| Salzlösung 0,9 % | ca. 55 Ω · cm |
| Blutplasma | ca. 65 Ω · cm |
| Blut (für Hämatokrit 47 %) | ca. 150 Ω · cm |
| Herzmuskeln | ca. 700 Ω · cm |
| Fett | ca. 2.000 Ω · cm |
Tab. 1 Beispiele spezifischer Widerstände unterschiedlicher biologischer Gewebe.
| Methode | Prinuip | Ziel | Vorteile | Herausforderung |
|---|---|---|---|---|
| IPG | Messung der bioimpedanz bei 86 KHz mit vier (Band-)Elektrode |
|
|
|
| MFBIA | Messung der Bioimpedanz bei unterschiedlichen Frequenzen, z. B. 5, 50, 100, 200 KHz mit vier (Band-)Elektroden |
|
| Wie oben, zusätzlich:
|
| Impedanzspektroskopie | wie MFBIA mit sehr vielen diversen Messfrequenzen |
| Wie oben, zusätzlich:
| Wie oben, zusätzlich:
|
Tab. 2 Vorgestellte Methoden mit ihren jeweiligen Vorteilen und Herausforderungen im Vergleich.
- Vergleichende Prüfung konventioneller und additiv gefertigter Prothesenschäfte in Anlehnung an DIN EN ISO 10328:2016 — 10. März 2026
- Easypreg – ein Faserverbundwerkstoff zum Tiefziehen — 9. März 2026
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- Lenk J. Methodenvergleich zur Messung der Körperzusammensetzung bei Patienten mit chronischer Herzinsuffizienz. Berlin: Medizinische Fakultät Charité – Universität Berlin, 2015
- Bera TK. Bioelectrical Impedance Methods for Noninvasive Health Monitoring: A Review. J Med Eng, 2014: 1–28
- Kyle U, Bosaeus I, De Lorenzo A, Deurenberg P, Elia M, Gòmez J, Heitmann BL, Kent-Smith L, Melchior J, Pirlich M. Bioelectrical Impedance Analysis – Part I: Review of Principles and Methods. Clinical Nutrition, 2004; 23 (5): 1226–1243
- Kyle U, Bosaeus I, De Lorenzo A, Deurenberg P, Elia M, Gòmez J, Heitmann BL, Kent-Smith L, Melchior J, Pirlich M. Bioelectrical Impedance Analysis – Part II: Utilization in Clinical Practice. Clinical Nutrition, 2004; 23 (6):1430–1453
- Kusche R. Entwurf, Aufbau und messtechnischer Vergleich zweier Messapparaturen zur zeitaufgelösten Bestimmung der Phasenverschiebung der Bioimpedanz. Lübeck: Fachhochschule Lübeck, 2013
- Tammy Ho L, Kushner RF, Schoeller DA, Gudivaka R, Spiegel DM. Bioimpedance Analysis of Total Body Water in Hemodialysis Patients. Kidney International, 1994; 46 (5): 1438–1442
- Voigt K. Die Unterschiede der Körperzusammensetzung bei Übergewicht in Abhängigkeit verschiedener Einflussfaktoren. Berlin: Charité – Universitätsmedizin, 2009
- Lohman TG. Advances in body composition assessment. Champaign, Illinois: Human Kinetics Publishers, 1992
- Kuster M, Exadaktylos A, Schnüringer B. Non-invasive hemodynamic monitoring in trauma patients. World J Emerg Surg, 2015; 10 (1): 11
- Bodystat® Ltd. BIA Impedance Ratio – Prediction Marker. What is the prediction marker and how does it help me? Version 01/14. https://www.bodystat.com/wp-content/uploads/2017/05/Bodystat-Prediction-Marker.pdf (Zugriff am 03.07.2019)
- Kuster M, Exadaktylos A, Schnüringer B. Non-invasive hemodynamic monitoring in trauma patients. World J Emerg Surg, 2015; 10 (1): 11
- Bodystat® Ltd. BIA Impedance Ratio – Prediction Marker. What is the prediction marker and how does it help me? Version 01/14. https://www.bodystat.com/wp-content/uploads/2017/05/Bodystat-Prediction-Marker.pdf (Zugriff am 03.07.2019)