Einleitung
In Deutschland erkranken jedes Jahr etwa 500.000 Patienten neu an Diabetes mellitus. Von diesen entwickeln im Laufe ihrer Erkrankung ca. 6 % ein diabetisches Fußsyndrom. Hauptrisikofaktoren hierfür sind das Vorliegen einer peripheren arteriellen Verschlusskrankheit (pAVK) und/oder einer Polyneuropathie im Rahmen des Diabetes mellitus. Zusätzlich können Fehlstellungen und Fehlbelastungen vorliegen, die eine solche Wunde verursachen und/oder unterhalten 1.
Auch wenn Majoramputationen (oberhalb des Sprunggelenks) in den letzten 15 Jahren um ca. 30 % zurückgegangen sind, werden dafür ca. 25 % mehr Minoramputationen vorgenommen. Im Jahr 2014 wurden insgesamt etwa 13.000 Majoramputationen und ca. 35.000 Minoramputationen in Deutschland durchgeführt. Rund 70 % der betroffenen Patienten wiesen einen Diabetes mellitus auf 2.
Bei der Behandlung eines Patienten mit diabetischem Fußsyndrom überprüft das Behandlungsteam dementsprechend alle der oben genannten Risikofaktoren. Eine relevante pAVK wird mittels Revaskularisation behandelt, der Patient erhält ggf. eine entsprechende Orthese zur Druckentlastung; eine Infektion wird gezielt (nach Abstrich) antibiotisch therapiert. Dennoch finden sich immer wieder hartnäckige Wunden, die unter einem solchen Behandlungsregime nicht abheilen. Dies ist besonders problematisch, wenn Sehnen- oder Knochenanteile freiliegen, da in diesem Fall die Bildung von Granulationsgewebe eingeschränkt ist. Auch Verfahren wie z. B. Spalthauttransplantationen können hier im weiteren Verlauf nicht direkt eingesetzt werden, womit letztlich die Amputation drohen kann. Die Problematik der Wundheilung beim Diabetes mellitus liegt in der Störung der biologischen Prozesse durch die Grunderkrankung selbst. Durch Faktoren wie Hyperglykämie, Neuropathie oder chronische Entzündungen kommt es zu einem Überschuss an proinflammatorischen Zytokinen und Matrixmetalloproteinasen in Kombination mit einer reduzierten Bildung von Wachstumsfaktoren. Angiogenese sowie Endothelfunktion sind dabei ebenso vermindert wie die Proliferation, Ausdifferenzierung und Migration von Keratinozyten und Fibroblasten 3. Entsprechend sucht die Wissenschaft neue Ansätze für genau diese Wunden. Mehrfach ungesättigte Omega-3-Fettsäuren, Eicosapentaensäure sowie Docosahexaensäure reduzieren die überschießende inflammatorische Reaktion, indem sie den Übertritt der proinflammatorischen Zytokine aus dem Blut ins Gewebe hemmen. Darüber hinaus werden sie zu Signalmolekülen weiterprozessiert (Resolvine, Protektine und Maresine), die auf der einen Seite negative chronische Entzündungsprozesse wie z. B. die Fibrosierung von Organen hemmen und auf der anderen Seite die Wundheilung aktiv unterstützen. Diese Lipidmediatoren finden sich in hoher Konzentration in Fischhaut 4.
Das Produkt und seine Anwendung
Die hier vorgestellte Wundmatrix „Kerecis® Omega3 Wound“ (Kerecis, Isafjordur, Island) wird vom Kabeljau gewonnen und entsprechend aufbereitet und dezellularisiert. Sie ist in vakuumgetrockneter Form in unterschiedlichen Größen und auch als „Micrografts“ (Abb. 1a u. b, Abb. 2) für sehr zerklüftete Wunden erhältlich. Das Produkt ist sowohl CE-zertifiziert als auch von der FDA zugelassen. Da es keine direkt vom Fisch auf den Menschen übertragbaren Pathogene (Keime, Viren o. Ä.) gibt, kann die marine Fischhaut-Matrix im Gegensatz zu bovinen (Rind) oder porcinen (Schwein) Produkten in einem sehr gewebeschonenden Verfahren behandelt und konserviert werden. Das führt dazu, dass insbesondere der sehr hohe Gehalt an den wichtigen Omega-3-Fettsäuren in der Matrix erhalten bleibt. Zusätzlich enthält sie Kollagen, Fibrin, Proteoglykane und Glykosaminoglykane und ist der menschlichen Haut auch hinsichtlich der Gewebestruktur sehr ähnlich. Sie dient damit als „Gerüst“, welches das Einwachsen neuer Zellen unterstützt 5. Neben Wunden beim diabetischen Fußsyndrom können die Matrices unter anderem auch bei Druck-Ulzerationen, traumatischen Wunden oder Verbrennungen angewendet werden.
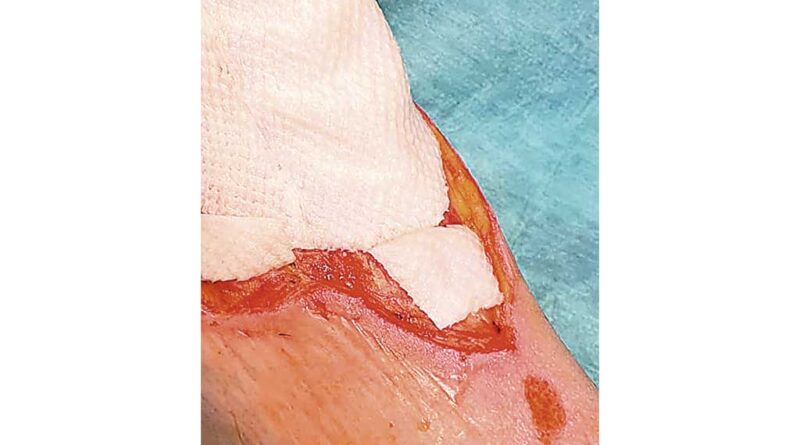
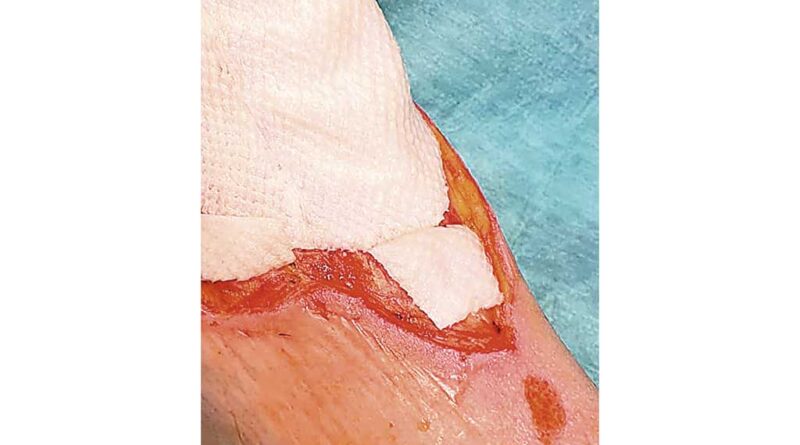
Vor Beginn einer Behandlung mit mariner Matrix muss das Wundbett vorbereitet und Fibrinbeläge sowie abgestorbenes bzw. avitales Gewebe bis in intakte bzw. vitale Gewebeschichten hinein entfernt werden. Dies kann mit Hilfe des klassischen chirurgischen Debridements oder alternativer Verfahren wie ultraschallassistiertem Wunddebridement oder Kaltplasmaapplikation erfolgen 6. Im Idealfall blutet der Wundgrund leicht vor der Applikation der Matrix. Die Matrix sollte dann so zugeschnitten werden, dass sie die Wunde ideal überdeckt, aber nicht über die Wundränder hinausragt. Im Anschluss wird sie in physiologischer Kochsalzlösung (NaCl 0,9%) rehydriert (Abb. 3). Sollte mehr als eine Matrix genutzt werden, um eine Wunde zu überdecken, sollten sich die Ränder der Matrices leicht überlappen (Abb. 4). Im Anschluss wird ein stadiengerechter Deckverband wie zum Beispiel ein Polyurethan-(PU-)Schaumverband aufgebracht. Auch wenn es zum Teil kontraintuitiv erscheint, ist hier ein etwas „überfeuchtes“ Wundmilieu das Ziel. Im Rahmen der weiteren Verbandwechsel (je nach Wundbefund alle 2 bis 7 Tage) werden in gleicher Art und Weise neue Matrices an jenen Stellen auf die Wunde aufgebracht, an denen die vorhergehenden Matrices bereits vollständig absorbiert und somit nicht mehr sichtbar sind. Ein aggressives Debridement sollte hier nicht stattfinden, da sonst möglicherweise auch altes Matrixmaterial unbeabsichtigt mit abgetragen würde.
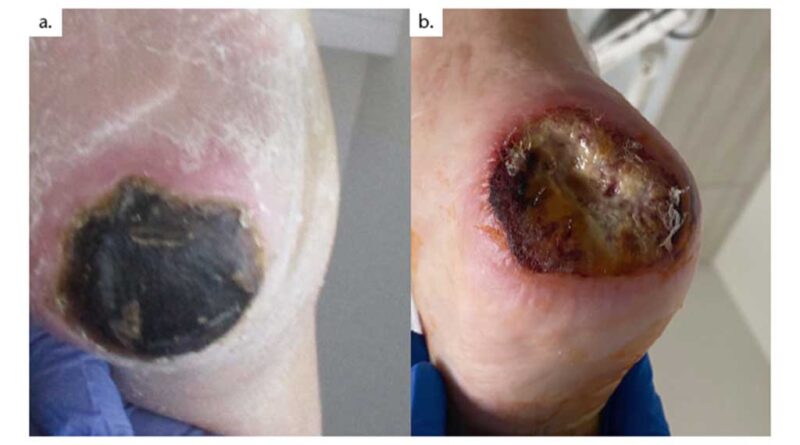
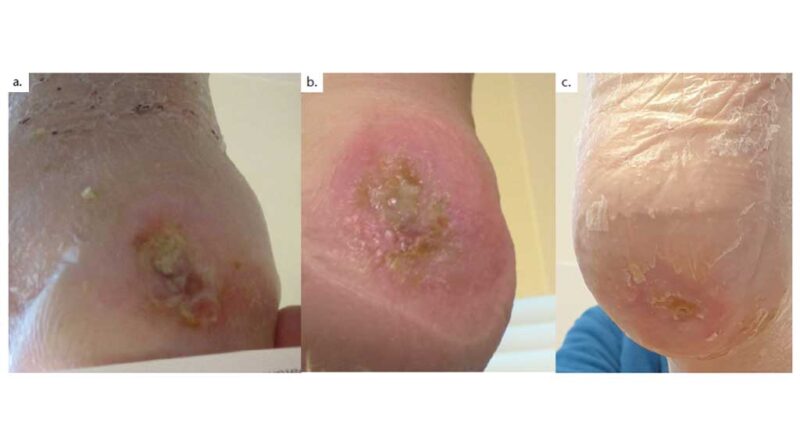
In den Abbildungen 5 und 6 wird der Heilungsverlauf einer Fersennekrose mit freiliegendem Calcaneus bei pAVK IV aufgezeigt. Zunächst erfolgte die Revaskularisation mittels femorocruralem Venenbypass. Im Anschluss erfolgte das initiale (und einzige) chirurgische Debridement. Zu Beginn der Behandlung wurde hier dreimalig im Abstand von ca. 14 Tagen eine „Kerecis®-Omega3-Wound“-Wundmatrix aufgebracht; danach erfolgten rein konservative Verbandwechsel sowie eine konsequente Entlastung mittels Entlastungsorthese. Nach etwa drei Monaten zeigte sich die Wunde vollständig epithelialisiert mit seitdem stabilem Befund.
Diese Therapie kann (nach ggf. notwendigem initialem Debridement) vollständig ambulant erfolgen, was nicht nur aus dem wirtschaftlichen Blickwinkel einen wichtigen Faktor darstellt. Gerade bei älteren Patienten birgt ein Krankenhausaufenthalt die Gefahr der Entwicklung eines Delirs mit häufig doch langfristig bestehenden kognitiven Dysfunktionen und erhöhter Letalität 7. Zudem kann die für die Patienten mitunter durchaus belastende Vakuumtherapie zur Wundkonditionierung in vielen Fällen abgekürzt oder ganz vermieden werden.
Bisherige Ergebnisse/Evidenz
Im Folgenden werden einschlägige Studien, welche die Anwendung von „Kerecis® Omega3 Wound“ (Kerecis, Isafjordur, Island) in der Wundtherapie evaluieren, vorgestellt und die wichtigsten Ergebnisse diskutiert.
Yang et al. konnten im Jahr 2016 in einer kleinen Vergleichsstudie (N = 18) mit im Durchschnitt seit 3 Jahren bestehenden „Hard-to-heal“-Läsionen in der behandelten Gruppe eine signifikante Reduktion der Wundflächen um 40 % sowie der Wundtiefe um 48 % und in 16,67 % der Fälle eine Abheilung der Läsion erreichen. In der Vergleichsgruppe zeigten sich keine Veränderungen der Läsionen 8.
Woodrow et al. (2019) evaluierten die Anwendung von Omega-3-Wundmatrices bei 8 Diabetikern nach operativen Eingriffen im Vorfußbereich. Die Kolleginnen und Kollegen konnten einen prinzipiell positiven Effekt der Wundmatrices auf die Wundheilung aufzeigen und empfehlen entsprechend eine weiterführende Evaluation mittels größer angelegter randomisierter Studien 9.
Michael et al. berichteten ebenfalls im Jahr 2019 in einer retrospektiven Studie, die 58 Wunden einschloss, von einer Reduktion der Wundfläche um 87,57 % innerhalb von 16 Wochen sowie von einer vollständigen Abheilungsrate von 60,34 % 10.
Trinh et al. (2016) zeigten anhand einer kleinen Kohorte von 5 Patienten auf, dass 50 % der Wundflächenreduktion im ersten Drittel der Behandlungsdauer erreicht wurde. Zusätzlich sammelten die Kollegen Hinweise auf eine schmerzreduzierende Wirkung der Wundmatrix 11.
Ein multizentrischer Erfahrungsbericht von Dorweiler et al. aus dem Jahr 2017 (23 Patientinnen und Patienten mit insgesamt 25 Wunden) zeigte eine Reduktion der Wundgröße innerhalb von 12 Wochen um bis zu 79 % sowie Abheilungsraten von 50 % innerhalb von 16 Wochen. Auch hier wurden 50 % der Wundflächenreduktion bereits nach 20 % der Behandlungsdauer erreicht. Eine Limitation ergab sich bei der Behandlung von Wunden, die mit Pseudomonas spec. besiedelt waren: Dabei kam es zu einer vorzeitigen Resorption der Matrix ohne positiven Effekt, sodass hier vor der Applikation einer Matrix die Eradikation der Bakterien empfohlen wird. Erneut zeigte sich auch der analgetische Effekt der Wundmatrix, insbesondere bei initial hohem Schmerzmittelbedarf. Zusammengefasst ergaben sich in dieser multizentrischen Fallsammlung Hinweise darauf, dass gerade bei „Hard-to-heal“-Fußwunden des Diabetikers, die häufig auch freiliegende Knochenanteile oder Sehnen aufweisen, eine Wundheilung erreicht und eine sekundäre Amputation vermieden werden konnte 12.
Die ODIN-Studie
Bei den vorliegenden Berichten zu Behandlungsergebnissen mit mariner Wundmatrix handelt es sich um Einzelberichte, Fallserien und nicht-kontrollierte Studien, die in wissenschaftlicher Hinsicht nur eine begrenzte Aussagekraft aufweisen. Um eine verbesserte Datengrundlage zu schaffen, startete im Jahr 2019 eine große europäische multinationale (Frankreich, Italien, Deutschland, Schweden) und multizentrische randomisierte Studie. Prospektiv, randomisiert und kontrolliert wird darin die Applikation von Omega-3-Wundmatrices („Kerecis® Omega3 Wound“) bei diabetischem Fußsyndrom mit dem aktuellen „standard of care“ in der Wundbehandlung verglichen. Es handelt sich um eine der größte randomisierten Studien zur Behandlung des diabetischen Fußsyndroms überhaupt. Eingeschlossen wurden Patienten mit seit mindestens 4 Wochen bestehenden Wunden am Fuß. Neben nicht-heilenden Amputationswunden im Fußbereich wurden tiefe Wunden eingeschlossen, die mindestens auf Faszien‑, Kapsel- oder Sehnen-Niveau reichen (Wagner-Armstrong-Klassifikation, Wagner-Grad 2–3). Eine Osteomyelitis muss vor dem Studieneinschluss saniert werden, und bei reduzierter Durchblutung muss zunächst eine Revaskularisation durchgeführt werden. Der Studieneinschluss kann dann 4 Wochen später erfolgen. Patientinnen und Patienten, die eine systemische Kortikosteroidgabe erhalten, können ebenso wie Patientinnen und Patienten mit Fischallergie oder Autoimmunerkrankungen (wie Lupus oder rheumatoider Arthritis) nicht in die Studie eingeschlossen werden. Ebenso von der Teilnahme ausgeschlossenen sind schwangere Patientinnen.
In Deutschland ist die Studie multizentrisch organisiert (Köln, Hamburg, Karlsruhe) mit dem Universitätsklinikum der Universität zu Köln (Klinik für Gefäßchirurgie) als führendem Zentrum. Im Juni 2020 wurde mit der Rekrutierung von Probandinnen und Probanden in Frankreich begonnen; im Juli 2021 konnte der erste deutsche Proband eingeschlossen werden. Insgesamt liegt das Rekrutierungsziel bei 320 Probandinnen und Probanden, wovon 40 in den deutschen Zentren vorgesehen sind. Der Patienteneinschluss in die ODIN-Studie wird im Laufe des Jahres 2022 beendet; Auswertung und Veröffentlichung erster Ergebnisse werden Ende desselben Jahres erwartet.
Die Studie wird von der Europäischen Union im Rahmen des Horizon-2020-Programmes (H2020-EU 2.1 #878896) gefördert und ist in der internationalen Studien-Datenbank gelistet (ClinicalTrials.gov identifier: NCT04257370).
Diskussion
In der modernen Wundtherapie stellt das diabetische Fußsyndrom ein spezielles Problem dar, da durch die Fehlregulation insbesondere der Entzündungsprozesse durch die Grunderkrankung selbst eine reguläre Wundheilung meist nicht möglich ist. Auch „Hard-to-heal“-Wunden, die seit Langem bestehen, oder innerhalb der Wunde freiliegende kritische Strukturen wie Sehnen oder Knochen bergen auch heute noch das Risiko einer (Major-)Amputation 13 14. Extrazelluläre Wundmatrices stellen einen innovativen Ansatz in der Wundbehandlung dar. Die bisher verfügbaren Matrices (vom Schwein oder Rind gewonnen) haben jedoch im Gegensatz zur marinen Wundmatrix eine sehr dichte Struktur. Die poröse Mikrostruktur der marinen Matrices unterstützt dagegen wie ein „Klettergerüst“ die Migration von Zellen und das Einwachsen neuer Blutgefäßkapillaren. Zudem bergen marine Wundmatrices nicht die Gefahr einer autoimmunen Reaktion, einer Übertragung von Prionen oder anderer Infektionen und kollidieren nicht mit möglicherweise vorliegenden religiösen oder kulturellen Wertvorstellungen.
In der heutigen Zeit steht auch immer das Potenzial zur Kostenreduktion im Fokus. Winters et al. (USA) untersuchten im Jahr 2020 die Kosteneffektivität einer Therapie mit mariner Wundmatrix bei chronischen Ulzerationen im Zusammenhang mit einem diabetischem Fußsyndrom und konnten dabei nicht nur eine Kostenreduktion, sondern auch deutlich höhere Wundheilungsraten (83,2 % vs. 63,4 %) sowie weniger Amputationen (4,6 % vs. 6,9 %) nachweisen. Auch wenn aufgrund der unterschiedlichen Abrechnungssysteme eine direkte Übertragung einer solchen amerikanischen Studie auf Deutschland nicht möglich ist, so ist hier zumindest mit einem gleichgerichteten Effekt zu rechnen 15.
Darüber darf jedoch nicht vergessen werden, dass am Anfang der Behandlung eines diabetischen Fußsyndroms immer die „klassische“ Evaluation und Behandlung der Risikofaktoren stehen muss, insbesondere bei der in hohem Prozentsatz (ca. 29 % bei allen Diabetikern, ca. 70 % beim DFS) mit einem Diabetes mellitus vergesellschafteten pAVK. Für eine Wundheilung beim diabetischen Fußsyndrom wird idealerweise immer ein multimodaler Ansatz mit Sicherstellung einer suffizienten Perfusion, Druckentlastung (orthetische Versorgung von Fehlbelastungen), Therapie einer etwaigen Osteomyelitis bzw. Infektion sowie der Grunderkrankung, das heißt des Diabetes an sich, umgesetzt.
Fazit
Insbesondere bei „Hard-to-heal“-Läsionen bei Patienten mit diabetischem Fußsyndrom scheint sich ein Nutzen aus einer Behandlung mit mariner Omega3-Wundmatrix zu ergeben 16 17. Die Evaluation und Behandlung der Risikofaktoren der Patienten und die lokale Optimierung des Wundbettes stellen jedoch immer die Basis der Wundbehandlung dar. Die hier vorgestellte Therapie bietet das Potenzial einer langfristigen Kostenreduktion (durch Vermeidung von Major-/Minoramputationen und angesichts der Reduktion der benötigten Schmerztherapie) sowie die Möglichkeit der (früheren) ambulanten Therapie.
Um eine wissenschaftlich untermauerte Evidenz zu schaffen und die Therapie von Patienten mit diabetischem Fußsyndrom zu evaluieren und zu optimieren, sind großangelegte Wundstudien wie z. B. die ODIN-Studie wichtig.
Aktuell ist die marine Wundmatrix „Kerecis® Omega3 Wound“ zur Wundbehandlung in Deutschland zwar zugelassen und erhältlich, die Kosten werden aktuell jedoch nicht von den gesetzlichen Kostenträgern übernommen (bzw. nur auf Antrag und per Sondervereinbarung). Auch in dieser Hinsicht ist eine fundierte wissenschaftliche Evaluation wichtig, um die Evidenz zu erzeugen, die notwendig ist, um diese wichtige Therapieoption auch für Patientinnen und Patienten in Deutschland flächendeckend anbieten zu können.
Für die Autoren:
Dr. med. Ursula Werra
Fachärztin für Gefäßchirurgie, endovaskuläre Chirurgin
Funktionsoberärztin
Klinik und Poliklinik für Gefäßchirurgie, Vaskuläre und endovaskuläre Chirurgie
Gebäude 9 (Hauptgebäude Bettenhaus), Ebene 5
Universitätsklinikum Köln
Kerpener Str. 62
50937 Köln
ursula.werra@uk-koeln.de
Begutachteter Beitrag/reviewed paper
Werra UEM, Trinh TT, Tahtaci E, Dorweiler B. Marine Omega-3-Wundmatrix („Fischhaut“) – neuer Ansatz zur Heilung chronischer Wunden bei diabetischem Fußsyndrom. Orthopädie Technik, 2022; 73 (10): 48–53
- Vergleichende Prüfung konventioneller und additiv gefertigter Prothesenschäfte in Anlehnung an DIN EN ISO 10328:2016 — 10. März 2026
- Easypreg – ein Faserverbundwerkstoff zum Tiefziehen — 9. März 2026
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- Robert Koch-Institut. Diabetes in Deutschland. Bericht der nationalen Diabetes Surveillance 2019. Berlin: Robert Koch-Institut, 2019. https://www.rki.de/DE/Content/Gesundheitsmonitoring/Studien/Diabetes_Surveillance/Diabetesbericht.pdf?__blob=publicationFile (Zugriff am 27.07.2022)
- Knut K, Berg C, Santosa F, Malyar N, Reinecke H. Amputationen der unteren Extremität in Deutschland. Eine Analyse auf der Grundlage von Daten des Statistischen Bundesamtes im Zeitraum 2005 bis 2014. Dtsch Arztebl Int, 2017; 114: 130–136. doi: 10.3238/arztebl.2017.0130
- Baltzis D, Eleftheriadou I, Veves A. Pathogenesis and Treatment of Impaired Wound Healing in Diabetes Mellitus: New Insights. Adv Ther, 2014; 31: 817–836. https://doi.org/10.1007/s12325-014‑0140‑x
- Serhan CN. Pro-resolving lipid mediators are leads for resolution physiology. Nature, 2014; 510 (7503): 92–101. doi:10.1038/nature13479
- Yang CK, Polanco TO, Lantis II JC. A Prospective, Postmarket, Compassionate Clinical Evaluation of a Novel Acellular Fish-skin Graft Which Contains Omega‑3 Fatty Acids for the Closure of Hard-to-heal Lower Extremity Chronic Ulcers. Wounds, 2016; 28 (4): 112–118
- Werra UEM, Zinser M, Dorweiler B. Physikalische Interventionen als Alternative/Ergänzung zum chirurgischen Wunddebridement. Ultraschall, Kaltplasma und LASER/Photobiomodulation. Gefässchirurgie, 2022; 27: 129–134. https://doi.org/10.1007/s00772-021–00854‑1
- Zoremba N, Coburn M. Delir im Krankenhaus. Dtsch Arztebl Int, 2019; 116: 101–106
- Yang CK, Polanco TO, Lantis II JC. A Prospective, Postmarket, Compassionate Clinical Evaluation of a Novel Acellular Fish-skin Graft Which Contains Omega‑3 Fatty Acids for the Closure of Hard-to-heal Lower Extremity Chronic Ulcers. Wounds, 2016; 28 (4): 112–118
- Woodrow T, Chant T, Chant H. Treatment of diabetic foot wounds with acellular fish skin graft rich in omega‑3: a prospective evaluation. J Wound Care, 2019; 28 (2): 76–80. doi: 10.12968/jowc.2019.28.2.76. PMID: 30767649
- Michael S, Winters C, Khan M. Acellular Fish Skin Graft Use for Diabetic Lower Extremity Wound Healing: A Retrospective Study of 58 Ulcerations and a Literature Review. Wounds, 2019; 31 (10): 262–268
- Trinh TT, Dünschede F, Vahl CF, Dorweiler B. Marine Omega3 Wound Matrix for the Treatment of Complicated Wounds. Phlebologie, 2016; 45 (2): 93–98
- Dorweiler B, Trinh TT, Dünschede F, Vahl CF, Debus ES, Storck M, Diener H. The marine Omega3 wound matrix for treatment of complicated wounds: A multicenter experience report. Gefässchirurgie, 2018; 23 (Suppl 2): 46–55. doi: 10.1007/s00772-018‑0428‑2
- Yang CK, Polanco TO, Lantis II JC. A Prospective, Postmarket, Compassionate Clinical Evaluation of a Novel Acellular Fish-skin Graft Which Contains Omega‑3 Fatty Acids for the Closure of Hard-to-heal Lower Extremity Chronic Ulcers. Wounds, 2016; 28 (4): 112–118
- Dorweiler B, Trinh TT, Dünschede F, Vahl CF, Debus ES, Storck M, Diener H. The marine Omega3 wound matrix for treatment of complicated wounds: A multicenter experience report. Gefässchirurgie, 2018; 23 (Suppl 2): 46–55. doi: 10.1007/s00772-018‑0428‑2
- Winters C, Kirsner RS, Margolis DJ, Lantis JC. Cost Effectiveness of Fish Skin Grafts Versus Standard of Care on Wound Healing of Chronic Diabetic Foot Ulcers: A Retrospective Comparative Cohort Study. Wounds, 2020; 32 (10): 283–290. PMID: 33370245
- Yang CK, Polanco TO, Lantis II JC. A Prospective, Postmarket, Compassionate Clinical Evaluation of a Novel Acellular Fish-skin Graft Which Contains Omega‑3 Fatty Acids for the Closure of Hard-to-heal Lower Extremity Chronic Ulcers. Wounds, 2016; 28 (4): 112–118
- Dorweiler B, Trinh TT, Dünschede F, Vahl CF, Debus ES, Storck M, Diener H. The marine Omega3 wound matrix for treatment of complicated wounds: A multicenter experience report. Gefässchirurgie, 2018; 23 (Suppl 2): 46–55. doi: 10.1007/s00772-018‑0428‑2