Methode: Es wurden Daten von 72 Probanden aus regulären Versuchsanproben analysiert. Das Durchschnittsalter betrug 36,6 (19,8) Jahre, 44 Probanden waren weiblich. Die Kohorte umfasste infantile Zerebralparese (ZP) (N = 29), multiple Sklerose (MS) (N = 23) und Schlaganfall (N = 20). Die Daten wurden nach Ätiologie und einem anfänglichen BBS-Score von < 45 stratifiziert.
Ergebnisse: Gemessene Effektstärken (Cohen‘s d) beziehen sich auf die Berg-Balance-Skala (BBS), den Timed-up-and-go-Test (TUG), das Functional Gait Assesssment (FGA), den 10-Meter-Gehtest (10mWT), den Wolf-Motor-Function-Test (WMFT), den Utility-Wert abgeleitet aus dem EuroQoL-Fragebogen EQ-5D-5L und Schmerzen nach der EQ5D5L-Schmerz-Skala.
Schlussfolgerungen: Die multifokale Neuromodulation kann bei Patienten mit SBS, die durch ZP, MS und Schlaganfall begründet ist, die Gehfähigkeit verbessern. Die Ergebnisse zeigen Wirkungen auf das statische und dynamische Gleichgewicht, das Sturzrisiko, die Mobilität, Verbesserungen bei den oberen Extremitäten und eine allgemeine Steigerung des gesundheitlichen Nutzens (utility) sowie eine Verringerung durch Spastik bedingter Schmerzen. Die Wirkungen sind sowohl unmittelbar als auch anhaltend. Diese Ergebnisse können Anregungen für individuelle Testversorgungen liefern und als Grundlage für weitere kontrollierte klinische Studien dienen.
Einleitung
Beeinträchtigungen, Erkrankungen oder Verletzungen des Zentralnervensystems können ein Syndrom des oberen Motoneurons (upper motor neuron syndrome, UMNS) verursachen1. Dieses ist oft mit anderen Phänomenen wie unwillkürlichen Beuge- oder Streckbewegungen, Klonus, Dystonie oder erhöhten Reflexreaktionen verbunden und wird oft als spastisches Syndrom bezeichnet2.
Die Steigerung der Auslösbarkeit des Muskeldehnungsreflexes wird auf eine anomale Aktivität der Muskelspindeln in Kombination mit Innervationen der extrafusalen Muskelfasern auf der Wirbelsäulenebene zurückgeführt. Diese stehen unter dem Einfluss supraspinaler inhibitorischer und unterstützender Bahnen, die in der Regel durch das UMNS verändert werden. Die reflexartige Übererregbarkeit entwickelt sich über einen unterschiedlichen Zeitraum nach der primären Gehirn- oder Rückenmarksläsion und umfasst die Anpassung in spinalen neuronalen Netzen kaudal zur Läsion.
Die motorischen Folgen werden oft als spastische Bewegungsstörung (SBS) bezeichnet3, die unter anderem bei Schlaganfall, multipler Sklerose (MS), Zerebralparese (ZP), Rückenmarksverletzungen und traumatischen Hirnverletzungen beobachtet wird. Bei Unterbehandlung kann es zu einer erheblichen dauerhaften funktionellen Beeinträchtigung, Schmerzen, Sturzgefahr und schweren sozialen Funktionsstörungen kommen4.
Die klinische Behandlung der Symptome des UMNS – und hier insbesondere die Behandlung von Spastik, Spasmen und damit verbundenen Schmerzen – umfasst ein breites Spektrum pharmazeutischer und chirurgischer Behandlungen, die durch Training und Physiotherapie begleitet werden5.
Als zusätzliche Behandlung wird häufig Elektrostimulation angewendet. Verschiedene Stimulationsformen (transkutane elektrische Nervenstimulation, TENS; transkraniale elektrische Stimulation, TES) haben lokale Wirkungen bei der Verringerung der Spastik gezeigt6.
Bei diesen Behandlungen ergeben sich häufig Einschränkungen durch die Präzision, die erforderlich ist, um die Elektroden adäquat zu platzieren, und einen damit verbundenen Rückgang der Therapietreue seitens der Patienten7.
Im Jahr 2012 hat Lundqvist das Elektrodress 100 (heute Exopulse Mollii Suit) vorgestellt, eine aus Jacke, Hose und Steuereinheit bestehende Ganzkörperbekleidung mit 58 integrierten Elektroden8. Diese Anordnung stimuliert Neuronen in Dermatomen und Myotomen von bis zu 40 Muskelgruppen. Neben der Bewältigung der Herausforderungen bei der Elektrodenplatzierung wird angenommen, dass die gleichzeitige Stimulation verschiedener anatomischer Regionen und ihrer afferenten Nerven zu ausgeprägten Wirkungen auf die Verarbeitung sowohl in spinalen als auch supraspinalen Interneuronennetzen führen kann.
Die Platzierung der Elektroden in einem funktionellen Kleidungsstück wie dem Exopulse Mollii Suit (EMS) bietet räumliche Selektivität afferenter neuronaler Eingänge zu spinalen Interneuronennetzen und damit die Möglichkeit, das Interventionsprotokoll zu individualisieren. Stimulationsmuster können spezifischer an Neuronen in Regionen gekoppelt werden, in denen die peripheren Bewegungsstörungen auftreten. Inhibitorische Mechanismen wie reziproke Inhibition9 oder Depression nach Aktivierung10 werden zur Modifikation der Spastik genutzt. Die reziproke Hemmung wird durch Stimulation der propriozeptiven Afferenten des Antagonisten des spastischen Agonisten induziert. Propriozeptive afferente Neuronen weisen eine niedrigere Stimulationsschwelle auf als efferente Motoneuronen und können daher mit einer gewissen Selektivität aktiviert werden. Das afferente Signal aktiviert Hemmschleifen in den segmentalen spinalen Interneuronennetzen und blockiert die Aktivierung von Motoneuronen des agonistischen (spastischen) Muskels. Gleichzeitig kann es die motorische Reststeuerung des Agonisten verstärken, jedoch nicht in jedem Fall in starker Abhängigkeit von der Manifestation der zugrunde liegenden neuronalen Schädigung. Auslösemechanismen und eine Erhöhung des zentralen Erregungszustandes sind die Hauptziele bei der Verstärkung von Bewegungsfunktionen. Techniken zur Modifikation der zentralen interneuronalen Verarbeitung durch künstliche afferente Eingaben sind als Neuromodulation bekannt11 12.
Der EMS wurde in einer Reihe von explorativen klinischen Studien untersucht. Eine kürzlich erschienene zusammenfassende systematische Begutachtung von Perpetuini et al.13 kam zu dem Schluss, dass das Potential des EMS zur Verbesserung der motorischen Fähigkeiten in neurologischen Patienten dargestellt wurde. Die Verringerung der Spastizität steht in Bezug zum Anwendungszeitraum und der verabreichten Dosis der Behandlung.
Die Evidenz wird durch anekdotische oder per Video berichtete Hinweise auf individuelle funktionelle Verbesserungen ergänzt14.
Ziel
Frühere Untersuchungen mit dem Exopulse Mollii Suit lieferten ermutigende Ergebnisse. Ziel dieser Untersuchung ist es, den potentiellen klinischen Nutzen bei gehfähigen Personen zu untersuchen, die an einer spastischen Bewegungsstörung aufgrund einer durch infantile Zerebralparese, multiple Sklerose oder Schlaganfall verursachten Läsion des oberen Motoneurons leiden. Hierbei kommt die aktuelle, gegenüber den Vormodellen verbesserte Version des EMS (9.3) und dem optimierten Stimulationsmuster zum Einsatz. Ein weiteres Ziel dieser Untersuchung ist es, direkte Wirkungen auf spastisch induzierte Schmerzen zu untersuchen. Ziel dieser Untersuchung ist es auch, über sensitive Ergebnisgrößen zu informieren, die in späteren kontrollierten Studien verwendet werden können.
Methode
Die bei routinemäßigen Versuchsanproben erfassten Daten wurden von zertifizierten Orthopädietechnikwerkstätten und Kliniken zur Verfügung gestellt. Die Teilnehmer wurden routinemäßig gebeten, eine Einwilligung nach Aufklärung zu unterzeichnen, um eine spätere wissenschaftliche Analyse zu ermöglichen. War die an der Versuchsanprobe teilnehmende Person minderjährig, wurde der gesetzliche Vertreter des Kindes zusätzlich um seine Einwilligung ersucht. Anonymisierte Daten wurden elektronisch erfasst und pseudonymisiert. Die Analyse wurde von der Ethikkommission der Universitätsmedizin Göttingen genehmigt (17.01.2023).
Für die Analyse geeignete Studienteilnehmer mussten kognitiv in der Lage sein, Anweisungen zu befolgen und verbal über Beschwerden zu informieren. Die Ätiologie der Untersuchungsteilnehmer war auf Schlaganfall, multiple Sklerose oder Zerebralparese beschränkt. Die Teilnehmer mussten mit oder ohne Gehhilfen gehen können. Die Teilnehmer wurden als Kinder eingestuft, wenn sie bei der Ausgangsbeurteilung jünger als 18 Jahre waren.
Ergebnisbezogene Messungen (Outcome Measures)
Um den individuellen klinischen Nutzen zu ermitteln und zu quantifizieren, wurden die Studienteilnehmer mehreren validierten Messungen unterzogen. Der Timed-up-and-go-Test (TUG) dient zur Bewertung von Mobilität, Gleichgewicht, Gehfähigkeit und Sturzrisiko. Der minimale nachweisbare Unterschied (minimally detectable change, MDC) bei chronischem Schlaganfall beträgt 2,9 s, mit einem Cut-off-Wert von 14 s, der bei Überschreitung auf ein erhöhtes Sturzrisiko hindeutet15.
Die Berg-Balance-Skala (BBS) ist eine Bewertungsskala mit 14 Elementen, bei der eine Punktzahl von 0 bis 56 zur Bewertung des statischen Gleichgewichts und des Sturzrisikos bei Erwachsenen vergeben wird. Schwellenwerte ermöglichen die Unterscheidung von Probanden mit erhöhter (< 45) und sehr hoher (< 40) Sturzgefahr. Eine Ableitung, die Pediatric Balance Scale, verkürzt die Evaluationsdauer, um reduzierte Aufmerksamkeitsperioden bei einer pädiatrischen Population zu berücksichtigen (MDC 1,59 Punkte) 16.
Der 10-Meter-Gehtest (10mWT) 17 bewertet die Gehgeschwindigkeit über eine kurze Strecke. Der minimale klinisch bedeutsame Unterschied liegt zwischen 0,05 m/s (gering) und > 0,13 m/s. Die abgeleiteten Geschwindigkeiten erlauben Rückschlüsse auf die funktionale Mobilität, z. B. auf der Grundlage von Community-Walking-Kategorisierungen nach der Klassifizierung nach Perry (< 0,4 m/s: Gehfähigkeit im Haus; 0,4 m/s bis 0,8 m/s: eingeschränkte Gehfähigkeit außerhalb des Hauses; > 0,8 m/s: uneingeschränkte Gehfähigkeit außerhalb des Hauses) 18.
Das Functional Gait Assessment (FGA) ist ein 10-teiliger funktionaler Score, der die Bewältigung mehrerer motorischer Aufgaben während des Gehens auf einer 4‑stufigen Skala bewertet. Der Test umfasst eine Verbesserung des dynamischen Gangindex mit verbesserter Zuverlässigkeit und einer Reduzierung von Höchstwerteffekten. Die minimale nachweisbare Veränderung wird mit 4,2 Punkten bei Schlaganfall angegeben. Die Punktzahl hat eine Vorhersagefähigkeit in Bezug auf das Risiko des Sturzes mit Punktzahlen von < 23 Hinweis auf ein erhöhtes Sturzrisiko bei älteren Menschen, die sich außerhalb des häuslichen Umfelds bewegen19.
Der Wolf-Motor-Function-Test (WMFT) ist ein Test der motorischen Funktionen der oberen Extremitäten. In der bei dieser Beurteilung verwendeten Version wurden auf Kraft beruhende Positionen weggelassen. Der minimale klinisch bedeutsame Unterschied wird als indiziert angegeben, wenn die Veränderung auf der dominanten Seite um 17 % und auf der nichtdominanten Seite um 20 % zunimmt20. Die Ratings wurden anhand eines quantitativen 6‑Punkte-Index umgesetzt.
Der EuroQol-Fragebogen EQ-5D-5L ist ein standardisiertes, auf Patientenberichten basierendes Maß für die Gesundheit, welches die klinische und gesundheitsökonomische Beurteilung unterstützt21. Die Selbsteinstufungen der Studienteilnehmer in 5 Dimensionen (Mobilität, Selbstversorgung, normale Aktivitäten, Schmerzen/Beschwerden und Angst/Depression) auf einer Likert-Skala mit 5 Punkten werden auf einer gesellschaftsspezifischen Nutzeneinstufung abgebildet. Das Instrument vermittelt eine subjektive wie auch gesellschaftliche Perspektive auf die Gesundheitseinstufungen der einzelnen Personen. Die abgeleiteten gesundheitlichen Nutzen unterstützen die Berechnung von qualitätskorrigierten Lebensjahren (quality adjusted life years, QALYs), einer häufig verwendeten gesundheitsökonomischen Messgröße.
Der Ganzkörper-Elektrostimulationsanzug
In diesen Untersuchungen wurde der Exopulse Mollii Suit (Exoneural Network, ENN, Schweden) in seiner Version 9.3 verwendet22. Die 58 Polymer-Gummielektroden im Anzug sind mit einer Steuereinheit verbunden und arbeiten paarweise. Jedes Paar einer Anode und einer Kathode befindet sich an einem Dermatom einer Zielmuskelgruppe.
Die individuelle Stimulation wird von einem zertifizierten Behandler programmiert. Der Behandler identifiziert die Muskelregionen (Agonisten), die die beabsichtigten funktionellen Bewegungen am deutlichsten einschränken. Stimulationsmuster können aus 30 vordefinierten Standardeinstellungen ausgewählt und individuell angepasst werden. Wenn die Bewegungsstörung von Schmerzen begleitet wird, wird zusätzlich die Stimulation aller Elektroden an mehreren Stellen aktiviert. Das Stimulationsmuster aktiviert die Elektrodenpaare sequenziell. Die Stimulationsintensität wird anhand des Gewichts, der Größe und des Schweregrads der Symptome der Probanden ausgewählt und angepasst, wenn das Stimulationsgefühl (sofern vorhanden) als unangenehm empfunden wird. Der Behandler muss sicherstellen, dass die Stimulationsintensität unter der motorischen Schwelle bleibt. Die Stimulation erfolgt kontinuierlich mit 20 Hz für die eingestellte Zeitdauer. Die Stimulation bleibt während der gesamten Anwendungssitzung unverändert, eine Anpassung durch den Patienten ist nicht möglich.
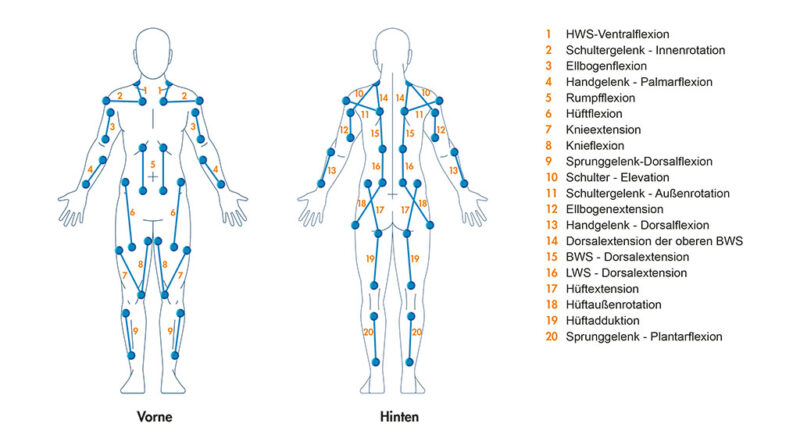
Reize werden mit einer konstanten Amplitude von 20 V spannungsgesteuert abgegeben, die Stimulationsintensität wird über die Impulsbreite bis maximal 170 µs eingestellt, die Stromstärke ist auf 46 mA begrenzt. Die maximale Impulsenergie ist auf 300 mJ begrenzt. Die Positionen der Elektroden und die entsprechenden motorischen Funktionen sind in Abbildung 1 dargestellt.
Die Stromversorgung erfolgt über 4 AAA-Batterien. Alle Sicherheitsstandards, die für Nerven- und Muskelstimulatoren nach IEC 60601–2‑10 vorgegeben sind, werden eingehalten. Im Rahmen dieser Studie wurden keine unerwünschten Ereignisse beobachtet.
Die Beurteilungen wurden nach Bewertung des körperlichen Zustands des Probanden durchgeführt, wobei Ermüdung durch Testverfahren oder andere Belastungen des Probanden so weit wie möglich berücksichtigt und vermieden wurden. Die Bewerter waren zertifizierte Behandler für Exopulse und verfügten über Erfahrung mit der Durchführung der hier beschriebenen Beurteilungen. Die erste Beurteilung (T0) wurde vor der ersten Stimulation mit dem Exopulse Mollii Suit eingeplant. Die Probanden wurden gebeten, den Anzug bereits bei allen Beurteilungen sowie alle Hilfsmittel (vor allem Orthesen), die sie im täglichen Leben verwenden, zu tragen. Die zweite Beurteilung (T1) folgte unmittelbar nach 60 min Stimulation. Die dritte Beurteilung (T2) folgte auf eine 4‑wöchige Testphase, in der die Teilnehmer gebeten wurden, eine letzte Stimulationssitzung am Tag vor der Rückgabe des Testanzugs einzuplanen. Den Teilnehmern wurde empfohlen, den Anzug während des gesamten Versuchszeitraums jeden zweiten Tag 60 min lang oder bei Bedarf täglich zu verwenden. Die Probanden wurden darüber informiert, dass während ihrer Teilnahme an der Probeversorgung keine Änderung des Lebensstils, der Routine oder anderer angewandter medizinischer Interventionen, z. B. Physiotherapie, erfolgen sollte.
Statistische Analysen
Der Kolmogorow-Smirnow-Test und der Shapiro-Wilk-Test wurden zum Test auf Normalität angewendet. Da die Daten nicht normalverteilt waren, wurden die Veränderungen im zeitlichen Verlauf mit einem Friedman-Test beurteilt. Paarweise Veränderungen wurden durch einen Durbin-Conover-Test mit angewendeter Bonferroni-Korrektur beurteilt. Cohen‘s d wurde angewendet, um die gesamte Effektstärke zwischen T0 und T2 zu schätzen. Cohen‘s d wird so interpretiert, dass es unter 0,3 einen kleinen oder keinen Effekt, bei 0,3 ≤ d ≤ 0,8 einen mittleren Effekt und einen großen Effekt beschreibt, wenn d größer als 0,8 ist. Die Datenerhebung erfolgte in einer Version von Lime Survey (Limesurvey GmbH, Hamburg, Deutschland, www.limesurvey.org), die den Anforderungen der klinischen Datenerhebung entsprach. Die Analyse wurde mit R Version 4.1.3 durchgeführt23.
Die Daten wurden zur Analyse nach Ätiologie stratifiziert. Darüber hinaus wurden die Daten für Studienteilnehmer mit einem anfänglichen BBS-Score von < 45 stratifiziert, was für ein erhöhtes Sturzrisiko steht. Wir haben auch die Daten bezüglich ZP stratifiziert, um die Leistung in der erwachsenen und pädiatrischen Population zu verdeutlichen.
Ergebnisse
Daten von 72 Probanden wurden von insgesamt 7 zertifizierten Orthopädietechnikwerkstätten und einer Klinik zur Verfügung gestellt. Die Stichprobe umfasste infantile Zerebralparese (N = 29), multiple Sklerose (N = 23) und Schlaganfall (N = 20) als Hauptätiologien. Alle Probanden schlossen T2 ab, jedoch wurden nicht alle Messungen von allen Probanden durchgeführt. Es wurde berichtet, dass die Nichtvervollständigung möglicherweise auf die Erschöpfung der Probanden, Konzentrationsverlust und/oder zeitliche Beschränkungen zurückzuführen war. Es liegen keine Informationen vor, anhand derer beurteilt werden könnte, ob die Probanden die Empfehlungen des Herstellers einhielten.
Die demographischen Informationen der Kohorte sind in Tabelle 1 dargestellt.
Erläuterung der Struktur der Ergebnistabellen
In den Tabellen und Abbildungen werden die Signifikanzniveaus der gepaarten Tests durch * gekennzeichnet: *: p < 0,05, **: p < 0,01, ***: p < 0,001, (t): p < 0,1. Differenzen ohne Anmerkungen weisen keine statistische Signifikanz auf. Die Ergebnisse von BBS, FGA und WMFT werden als Scores dargestellt. Die Ergebnisse des TUG werden in Sekunden (s), die Ergebnisse des 10-Meter-Gehtests als Geschwindigkeit (m/s) dargestellt. Für EQ-5D-5L wird der Nutzwert (utility) dargestellt. Alle Werte beziehen sich auf den Mittelwert. Die Standardabweichung (STD) wird in den jeweiligen Einheiten dargestellt. Die Spalte „Friedman“ gibt die Signifikanz des Friedman-Tests an. Die Effektstärke (Cohen‘s d) wird in Bezug auf T0 angegeben. Die Anzahl der Studienteilnehmer ist mit N gekennzeichnet.
Nummerische Ergebnisse
Tabelle 3 zeigt die mittleren Unterschiede und Effektstärken aller Probanden, d. h. es wurde keine Stratifizierung in Bezug auf den BBS-Score vorgenommen.
Im realen Umfeld zeigte sich die Verbesserung der individuellen Studienteilnehmer am deutlichsten in der Berg-Balance-Skala. Dies wird in der gesamten Kohorte sowohl unabhängig von der Ätiologie als auch von der Stratifikation des erhöhten Sturzrisikos beobachtet. Die Effektstärken liegen in allen untersuchten Szenarien über 0,8 und können daher als hoch eingestuft werden.
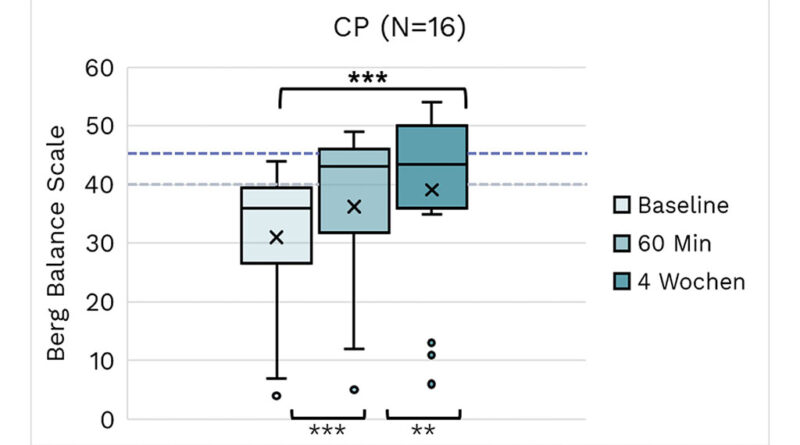
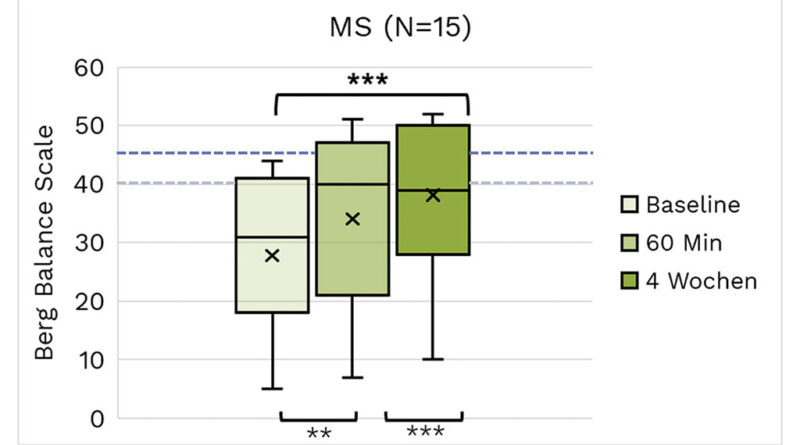
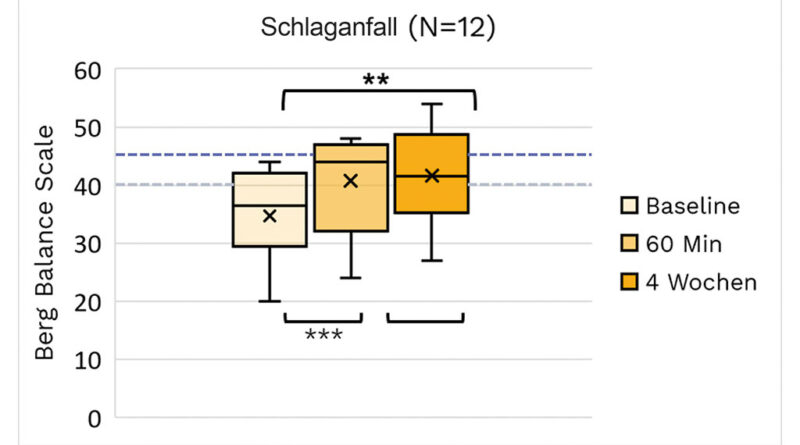
Die BBS-Beurteilungen werden für die Untergruppen ZP, MS und Schlaganfall in den Abbildungen 2a, b bzw. c visualisiert.
Die Verbesserung beim FGA ist bei Probanden mit ZP und MS von vergleichbarem Ausmaß. Das FGA erwies sich bei vielen Probanden, die einen Schlaganfall als führende Ätiologie aufwiesen, als anstrengend und wurde daher nur bei 6 Teilnehmern durchgeführt. Der TUG erfasste die Verbesserungen der Studienteilnehmer in der Schlaganfall-Untergruppe und bei den Probanden mit MS. In der ZP-Kohorte waren die Effektstärken gering, wobei die Signifikanz nur in der Gesamtgruppe erreicht wurde. Der 10mWT erfasste die Verbesserungen der Probanden in der Untergruppe mit MS mit hohen Effektstärken. Die Ergebnisse in der ZP- und der Schlaganfall-Untergruppe zeigen eine Signifikanz bei moderaten bzw. hohen Effektstärken.
In Tabelle 4 wird zwischen erwachsenen und pädiatrischen ZP-Patienten unterschieden.
Während statistisch signifikante Unterschiede in der Kinder-Untergruppe mit dem BBS festgestellt werden können, zeigt kein anderes Ergebnis in dieser kleinen Gruppe eine Signifikanz. Es kann eine Ähnlichkeit der Effektstärken im Vergleich zur Gruppe der Erwachsenen festgestellt werden.
Verbesserungen der motorischen Funktion der oberen Extremitäten, die mit dem Wolf-Motor-Funktionstest gemessen wurden, können in der ZP- und MS-Kohorte nachgewiesen werden. Der Test zeigt in der Schlaganfallkohorte keine sensitive Wirkung. Die Wirkung ist bei erwachsenen ZP-Patienten stärker ausgeprägt und eine Tendenz könnte bei der Kinderpopulation indiziert sein.
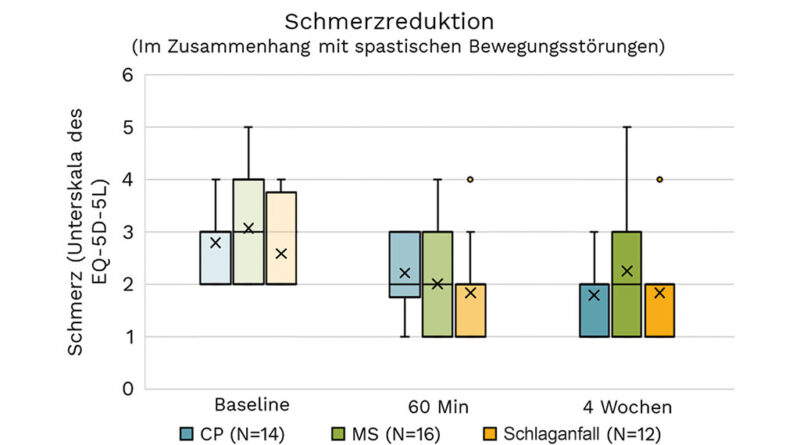
Tabelle 5 zeigt die Auswirkungen der Intervention auf durch Spastik bedingte Schmerzen. Die Studienteilnehmer wurden dahingehend stratifiziert, ob sie einen minimalen Schmerzgrad auf der jeweiligen EQ-5D-5L-Schmerz-Subskala zeigten.
Die Ergebnisse sind in Abbildung 3 visuell dargestellt.
Diskussion
Die Ergebnisse zeigen signifikante Verbesserungen beim statischen und dynamischen Gleichgewicht sowie bei der Gehleistung. Erstmals ist es auch möglich, die Wirkung bei einer Kohorte von Patienten mit multipler Sklerose nachzuweisen.
Am stärksten ausgeprägt sind die Wirkungen beim BBS. Große Wirkungen von hoher statistischer Signifikanz wurden bei allen hier aufgeführten Ätiologien beobachtet. Wir nahmen eine Stratifizierung für Einzelpersonen mit BBS/PBS < 45 zur Untersuchung von Patienten mit einem erhöhten Sturzrisiko (Tab. 2a–c) vor. Die absoluten BBS-Werte steigen mit dem Mittelwert, der sich dem Schwellenwert von 40 nähert oder ihn überschreitet (Schlaganfall). Vergleicht man diese Ergebnisse mit denen der gesamten Kohorte (Tab. 3), so zeigt sich, dass die Effektstärken bei allen 3 Ätiologien ausgeprägter sind. Innerhalb der ZP-Gruppe scheinen die Effektstärken bei Kindern und Erwachsenen ähnlich zu sein.
Vergleich zu anderen Arbeiten
Palmcrantz et al. 24 berichteten über eine nicht signifikante (p = 0,063) Veränderung des BBS-Medianwerts um 3,5 Punkte und über keine Veränderungen bei Gehtests mit Zeitmessung. Im Vergleich dazu berichten Ng et al. 25 von einem Anstieg der BBS-Scores aufgrund einer TENS-Stimulation in Kombination mit einem intensiven aufgabenorientierten Gleichgewichtstraining bei einer subakuten Schlaganfallpopulation von d = 1,4 (berechnet nach Ng et al., p < 0,01).
Die auf der BBS/PBS festgestellten Verbesserungen scheinen die Ergebnisse der Standardrehabilitationsprogramme für ZP mit intensivem Training der oberen und unteren Extremitäten, mit Laufbandtraining26 oder Verfahren einschließlich Gaming-Balance-Boards27 zu erreichen oder zu übertreffen. Hier wurden durchschnittliche Verbesserungen zwischen 2 und 6 Punkten berichtet. Ein weiteres Standardverfahren bei solchen Patienten umfasst Einlagen zur Haltungsunterstützung, bei denen nach 3 Monaten eine mediane Verbesserung um 2 berichtet wird, ohne dass eine unmittelbare Wirkung sichtbar ist28.
Zusätzlich zu den Ergebnissen bezüglich des statischen Gleichgewichts (BBS/PBS) können ähnliche Effektstärken im das dynamische Gleichgewicht beschreibenden FGA beobachtet werden. Da das FGA jedoch ein höheres Maß an unabhängigem Gehen erfordert und für den Probanden anstrengender sein kann, wurden nicht alle Probanden dieser Beurteilung unterzogen. Raffalt et al. berichten über eine Veränderung der nichtlinearen Dynamik beim Gehen bei Kindern mit einseitiger ZP nach 24 Wochen Behandlung mit dem Exopulse Mollii Suit29. Sie schließen daraus, dass sich die zeitliche Struktur der Rumpfbeschleunigung in anterior-posteriorer Richtung denen von gesunden Personen annähert.
TUG und 10mWT sind Instrumente, die in der klinischen Alltagspraxis häufiger eingesetzt werden. Im TUG lassen sich nur geringe Effektstärken in der ZP-Population beobachten. Wir berechneten die Effektstärke aus den von Bakaniene et al. 30 berichteten Daten bei Kindern mit ZP und erhielten d = 0,42 ohne Möglichkeit, die statistische Signifikanz zu beurteilen. Unsere Ergebnisse scheinen mit ihren Ergebnissen in Einklang zu stehen, wobei wir auch statistische Signifikanz in unserer Kohorte beobachten. Ertzgaard et al. 31 beobachteten in ihrer gemischten Population in der PP-Analyse keine solche Veränderung. Arkkukangas et al. 32 beobachteten keine Veränderungen beim TUG in 7 Einzelfällen von Kindern mit ZP einschließlich GMFCS-Stufen 1 bis 4. Die Effektstärken, die in unserer Untersuchung in der MS- und Schlaganfallkohorte beobachtet wurden, sind wesentlich größer.
Der 10mWT zeigt mittlere Effektstärken von 0,76 bis 1,07 in dieser Studie. Ertzgaard et al. 33 hatten berichtet, dass die PP-Analyse eine Verringerung der komfortablen Gehzeit um ‑1,5 s (p = 0,026) während der Stimulation in einem 10mWT bei ihrer gemischten Population zeigte. Unsere Ergebnisse stehen nicht im Widerspruch hierzu.
Ertzgaard et al. 34 untersuchten funktionelle Wirkungen auf die obere Extremität sowohl mit dem ARAT als auch mit dem WMFT. Beide Instrumente zeigten in der ITT-Analyse keine Unterschiede. Dieses Ergebnis wird von Palmcrantz et al. 35 kontrastiert, die einen deutlichen Anstieg des Medianwerts des ARAT Scores berichteten, der jedoch statistisch nicht signifikant wurde. Die Ergebnisse bzgl. des WMFT sind in unserer Untersuchung deutlich prägnanter.
Die vom Instrument EQ-5D-5L abgeleiteten Nutzwerte (utility) überschreiten in allen Kohorten einen absoluten Wert von 0,1. Die Wirkung ist in der Schlaganfallkohorte am ausgeprägtesten. In der ZP-Kohorte ist der Effekt bei der pädiatrischen Population stärker ausgeprägt. In der Kohorte der erwachsenen Patienten mit ZP ist die Wirkung statistisch nicht signifikant. Insgesamt sind diese Ergebnisse besonders ermutigend. Nutzwerte sind die Grundlage für Informationen über mögliche Kostenwirksamkeitseffekte. Jüngste Modellierungen von Kuhlmann et al. 36, bei denen speziell auf die Wirkungen der Verringerung des Sturzrisikos und damit verbundene Nutzwertveränderungen geachtet wurde, deuten auf eine Kostenwirksamkeit bei mikroprozessorgesteuerten exoprothetischen Kniegelenken hin. Solche Untersuchungen gibt es zu Ganzkörper-Elektrostimulationsanzügen nicht. Die Größe der Nutzwertänderungen und die Gesamtkostenbasis lassen jedoch eine günstige Bewertung möglich erscheinen.
Spastik in der untersuchten Kohorte ist bei den meisten Studienteilnehmern mit Schmerzen verbunden. In allen 3 beschriebenen Untergruppen wurde eine signifikante Abnahme beobachtet. Es ist zu berücksichtigen, dass die Ableitung von der EQ-5D-5L-Schmerz-Subskala ein vergleichsweise ungenaues Instrument ist und darauf hindeuten kann, dass diese Befunde untere Grenzwerte für den Effekt der Schmerzreduktion darstellen (d. h., die tatsächlichen Effekte sind wahrscheinlich höher). Unsere Ergebnisse stehen im Gegensatz zu den Ergebnissen von Ertzgaard et al. 37, bei denen Änderungen in der Schmerzbeurteilung unberücksichtigt blieben, und zu den Ergebnissen von Palmcrantz et al. 38, bei denen Schmerzen anhand der jeweiligen Fugl-Meyer-Subscores für die oberen und unteren Extremitäten beurteilt wurden. Unsere Ergebnisse stützen hier frühere Beobachtungen von Riachi et al. 39.
Die hier dargestellten Ergebnisse waren sowohl unmittelbar als auch nachhaltig über den Beurteilungszeitraum. Statistisch signifikante Veränderungen erheblichen Ausmaßes wurden bei T1 beobachtet und bis T2 aufrechterhalten. In gewissem Maße könnte dies im Gegensatz zu den Erkenntnissen von Pennati et al. 40 stehen, bei denen sofortige Messungen der Handgelenkspastik, die vom Instrument Neuroflexor (Aggero MedTech AB, Älta, Schweden) 41 beurteilt wurden, sowie Beurteilungen mit der modifizierten Ashworth-Skala keine Unterschiede zeigten.
Die hier berichteten Effektstärken sowie das Gesamtansprechen auf die therapeutische Intervention sind ermutigend, stehen aber teilweise im Gegensatz zu einigen früheren Befunden. Das liegt möglicherweise an unserer strengeren Auswahl der Probanden. Wir wählten ausschließlich gehfähige Personen aus und beschränkten die Untersuchung auf Probanden, die kognitiv in der Lage sind, Anweisungen zu befolgen und sich bei Unbehagen äußern zu können. Es scheint plausibel, dass Ersteres die Sensitivität für mit der Gehfähigkeit zusammenhängende Ergebnisse erhöht haben könnte, während Letzteres dazu beigetragen haben könnte, die Therapietreue zu erhöhen. Technische Fortschritte sowie eine Anpassung von Stimulationsmustern könnten das individuelle Ansprechen auf die Stimulation erhöht haben.
Einschränkungen
Diese Arbeit präsentiert vorläufige Daten, die in einer realen Umgebung gesammelt wurden und Versuchsanproben für kommerzielle Zwecke unterstützen. Somit können weder Verzerrungen ausgeschlossen werden, noch wurden Gruppeneffekte verglichen. Auch wurden keine vergleichenden Untersuchungen, beispielsweise mit einer Placebo-Gruppe, durchgeführt. Die Stichproben sind klein, weshalb sich die Ergebnisse nur begrenzt verallgemeinern lassen.
Die in diesem Projekt verwendeten Methoden sind in der Rehabilitation gut etabliert. Die psychometrischen Eigenschaften wurden jedoch nicht für alle Ätiologien und Altersgruppen, über die in der Studie berichtet wurde, vollständig untersucht. Die Interpretation solcher Ergebnisse erfordert eine individuelle klinische Beurteilung.
Die hier vorgestellten Ergebnisse konzentrieren sich auf die Beurteilung funktioneller klinischer Wirkungen. Frühere Arbeiten konzentrierten sich auf die direkte Messung einer Reduktion der Spastik sowie auf Wirkungen auf Gelenkbewegungen. Während einige Effekte durch die Neuroflexor-Instrumente gezeigt wurden, konnten klinische Instrumente wie die Ashworth- oder die Tardieu-Skala möglicherweise aufgrund ihrer inhärenten Ungenauigkeit nicht immer Wirkungen nachweisen. Die berichteten Ergebnisse zu Gelenkbewegungen waren positiv, wie von Flodström et al. 42 und Hedin et al. 43 berichtet. Obwohl die zuvor berichteten Wirkungen auf Gruppenebene gering blieben, wurde insgesamt häufig auf die große interindividuelle Variabilität und auf beeindruckende individuelle Verbesserungen hingewiesen.
Fazit
Die individualisierte transkutane multifokale Neuromodulation scheint die Geh- und Bewegungsfähigkeit bei Teilnehmern einer Versuchsanprobe mit einem Syndrom des oberen Motoneurons, das auf infantile Zerebralparese, multiple Sklerose oder Schlaganfall zurückzuführen ist, zu erhöhen. Diese mit einem verbesserten Ganzkörper-Elektrostimulationsanzug erzielten Ergebnisse zeigen ermutigende Wirkungen auf das statische und dynamische Gleichgewicht, das Sturzrisiko und die Mobilität. Eine Verbesserung der oberen Extremitäten kann ebenso beobachtet werden wie eine allgemeine Zunahme des gesundheitlichen Nutzens und eine Verringerung durch Spastik bedingter Schmerzen. Die Wirkungen treten sofort (nach 1 Stunde Stimulation) und anhaltend (1 Monat ab Anwendung) auf, wenn die Stimulation täglich oder jeden zweiten Tag 60 Minuten lang angewendet wird. Instrumente, die diese Verbesserungen quantifizieren, konnten identifiziert werden. Die Ergebnisse können die Qualität einzelner Versuchsanproben verbessern und als Grundlage für weiterführende kontrollierte klinische Studien dienen, die zur weiteren Beurteilung erforderlich sind.
Erstveröffentlichung
Dieser Artikel erschien bereits in ähnlicher Form auf Englisch in der Zeitschrift Biomedical Engineering – Biomedizinische Technik:
https://doi.org/10.1515/bmt-2023–0271.
Interessenkonflikt
Der Autor ist bei der Firma Otto Bock Healthcare Products tätig, die den Ganzkörperanzug vertreibt.
Der Autor:
Dr. Andreas Hahn
Corporate Vice President
Clinical Research & Services
Otto Bock Healthcare Products GmbH
Brehmstraße 16
1110 Wien
andreas.hahn@ottobock.com
Begutachteter Beitrag/reviewed paper
A. Hahn. Wirkungen eines Ganzkörper-Elektrostimulationsanzugs in einer Kohorte von Probanden mit Zerebralparese, multipler Sklerose und Schlaganfall auf spastische Bewegungsstörung – eine explorative Studie zur Wirkungsweise. Orthopädie Technik, 2024; 75 (1): 44–55
Tab. 0 Die Signifikanzniveaus sind gekennzeichnet mit *: p < 0,05, **: p < 0,01, ***: p < 0,001, (t): p < 0,1.
| Cohen‘s d | BBS | TUG | FGA | 10mWT | WMFT | EQ5D5L | Schmerz |
|---|---|---|---|---|---|---|---|
| ZP | 1,64*** | 0,29* | 1,59*** | 0,76 (t) | 1,00*** | 0,5* | 1,28*** |
| MS | 1,83*** | 0,83*** | 1,28** | 1,07*** | 0,93* | 1,11** | 0,78* |
| Schlaganfall | 1,28** | 0,78** | 0,89 | 0,92** | 0,71 | 1,26* | 0,78* |
Tab. 1 Demographie der in die Analyse einbezogenen Probanden. F: weiblich; M: männlich.
| Alle Teilnehmer | Alle Teilnehmer (BBS <45) | Zentralparese (BBS <45) | Multiple Sklerose (BBS <45) | Schlaganfall (BBS <45) | |
|---|---|---|---|---|---|
| N | 72 | 44 | 16 | 16 | 12 |
| Alter | 36,64 (19,8) | 39,16 (19,9) | 20,38 (10,6) | 50,13 (9,7) | 49,58 (21,3) |
| Geschlecht | F=44, M=28 | F=24, M=20 | F=7, M=9 | F=13, M=3 | F=4, M=8 |
Tab. 2a Beurteilungsergebnisse der ZP-Subpopulation für Probanden mit einem BBS-Score unter 45 bei T0. Begriffserklärungen können der allgemeinen Beschreibung der Tabellenstruktur am Anfang des Ergebnisabschnitts entnommen werden. Die Effektstärken sind statistisch signifikant und hoch für BBS, FGA und WMFT und mittelhoch für 10mWT und EQ-5D-5L. Im TUG zeigt sich eine nur geringe oder gar keine Wirkung.
| Outcome | N | T0 (STD) | T1 (STD) | T2 (STD) | ∆ (T0-T1) | ∆ (T0-T2) | Friedman | Cohen‘s d |
|---|---|---|---|---|---|---|---|---|
| BBS | 16 | 31 (13,2) | 36,3 (14,1) | 39,1 (15,3) | 5,25*** | 8,06*** | *** | 1,64 |
| TUG | 16 | 26,4 (26,0) | 22,0 (19,7) | 23,2 (27,9) | -4,4 | -3,2* | * | 0,29 |
| FGA | 13 | 11 (5,5) | 15,5 (7,6) | 16,6 (7,6) | 4,5*** | 5,6*** | *** | 1,59 |
| 10mWT | 15 | 0,96 (0,46) | 1 (0,33) | 1,1 (0,4) | 0,05 | 0,1 (t) | * | 0,76 |
| WMFT | 9 | 53,1 (19,4) | 56,1 (19,3) | 59,1 (18,9) | 3,0 (t) | 6,0*** | ** | 1,00 |
| EQ 5D 5L | 15 | 0,76 (0,2) | 0,87 (0,1) | 0,87 (0,1) | 0,109 (t) | 0,112* | * | 0,50 |
Tab. 2b Beurteilungsergebnisse der MS-Subpopulation für Probanden mit einem BBS-Score unter 45 bei T0. Begriffserklärungen können der allgemeinen Beschreibung der Tabellenstruktur am Anfang des Ergebnisabschnitts entnommen werden. Alle Ergebnisse zeigen statistisch signifikante hohe Effektstärken.
| Outcome | N | T0 (STD) | T1 (STD) | T2 (STD) | ∆ (T0-T1) | ∆ (T0-T2) | Friedman | Cohen‘s d |
|---|---|---|---|---|---|---|---|---|
| BBS | 15 | 27,8 (13,0) | 34,1 (14,4) | 38,1 (12.3) | 6,28** | 10,33*** | *** | 1,83 |
| TUG | 14 | 29,7 (20,6) | 23,3 (14,8) | 21,3 (11,8) | -6,40*** | -8,36*** | *** | 0,83 |
| FGA | 6 | 11,3 (2,3) | 16,7 (4,4) | 18,3 (7,0) | 5,3* | 7,0** | * | 1,28 |
| 10mWT | 11 | 0,66 (0,34) | 0,76 (0,34) | 0,80 (0,32) | 0,098** | 0,145*** | ** | 1,07 |
| WMFT | 6 | 64,2 (11,7) | 71,7 (4,7) | 71,7 (5,1) | 7,5* | 7,5* | * | 0,93 |
| EQ 5D 5L | 14 | 0,55 (0,27) | 0,77 (0,10) | 0,73 (0,21) | 0,22*** | 0,177** | *** | 1,11 |
Tab. 2c Beurteilungsergebnisse der Schlaganfall-Subpopulation für Probanden mit einem BBS-Score unter 45 bei T0. Begriffserklärungen können der allgemeinen Beschreibung der Tabellenstruktur am Anfang des Ergebnisabschnitts entnommen werden. Die Effektstärken sind statistisch signifikant und hoch für BBS, 10mWT und EQ-5D-5L. Eine statistisch signifikante mittelgradige Wirkung ist beim TUG zu beobachten. Die beim FGA beobachtete Wirkung ist statistisch nicht signifikant, wobei die geringe Anzahl von Probanden, die diesen Test beendet haben, zu berücksichtigen ist. Auch weist der WMFT keine statistische Signifikanz auf.
| Outcome | N | T0 (STD) | T1 (STD) | T2 (STD) | ∆ (T0-T1) | ∆ (T0-T2) | Friedman | Cohen‘s d |
|---|---|---|---|---|---|---|---|---|
| BBS | 12 | 34,7 (8,4) | 40,8 (8,6) | 41,6 (8,3) | 6,08*** | 6,92*** | ** | 1,28 |
| TUG | 12 | 36,0 (27,22) | 25,7 (20,5) | 22,3 (15,7) | -10,32*** | -13,66** | ** | 0,78 |
| FGA | 6 | 14,17 (11,22) | 16,5 (12,0) | 19 (8,9) | 2,33 | 4,83 | (t) | 0,89 |
| 10mWT | 11 | 0,57 (0,32) | 0,67 (0,33) | 0,76 (0,35) | 0,096 | 0,19** | * | 0,92 |
| WMFT | 8 | 28,6 (24,1) | 30,6 (23,8) | 38,3 (28,6) | 2,00 | 9,63 | 0,71 | |
| EQ 5D 5L | 10 | 0,54 (0,30) | 0,66 (0,23) | 0,75 (0,24) | 0,13 | 0,21* | * | 1,26 |
Tab. 3 Mittlere Differenzen und Effektstärken in der nicht stratifizierten Kohorte. Begriffserklärungen können der allgemeinen Beschreibung der Tabellenstruktur am Anfang des Ergebnisabschnitts entnommen werden. Der BBS zeigt statistisch signifikante Effektstärken bei allen 3 Ätiologien, was die spezifische Sensitivität dieses Instruments für die untersuchten Auswirkungen anzeigt. Die Effektstärken sind geringer als die in den stratifizierten Gruppen, was auf eine Beschränkung des Instruments (Deckeneffekt) hinweist. Beim FGA zeigen sich hohe statistisch signifikante Effektstärken für ZP und MS. Abgesehen vom EQ-5D-5L zeigen alle anderen Ergebnisse statistisch signifikante Wirkungen mittlerer Stärke.
| Gesamtkohorte (n=72) | ZP | MS | Schlaganfall | |||
|---|---|---|---|---|---|---|
| Outcome | ∆T0-T2 | Cohen‘s d | ∆T0-T2 | Cohen‘s d | ∆T0-T2 | Cohen‘s d |
| BBS | 5,92*** (n=25) | 1,161 | 8,24*** (n=21) | 1,377 | 5,6*** (n=20) | 1,184 |
| TUG | -3.2*** (n=27) | 0,369 | -5,93*** (n=21) | 0,67 | -8,55** (n=20) | 0,572 |
| FGA | 4,86*** (n=22) | 1,543 | 6,25*** (n=12) | 1,349 | 3,86** (n=14) | 0,783 |
| 10mWT | 0,11* (n=26) | 0,562 | 0,166*** (n=18) | 0,991 | 0,16** (n=19) | 0,721 |
| WMFT | 5,72*** (n=18) | 0,795 | 4,6* (n=10) | 0,647 | 7,19* (n=16) | 0,727 |
| EQ 5D 5L | 0,11** (n=27) | 0,538 | 0,08 (t) (n=21) | 0,337 | 0,13* (n=17) | 0,776 |
Tab. 4 Absolute Differenzen und Effektstärken bei Kindern und Erwachsenen mit ZP bei Studienteilnehmern mit BBS <45. Begriffserklärungen können der
allgemeinen Beschreibung der Tabellenstruktur am Anfang des Ergebnisabschnitts entnommen werden.
| BBS <45 | Kinder | Erwachsene | Schlaganfall | |||
|---|---|---|---|---|---|---|
| Outcome | N | ∆T0-T2 | Cohen‘s d | N | ∆T0-T2 | Cohen‘s d |
| BBS | 7 | 6,86** | 1,49 | 9 | 9*** | 1,72 |
| TUG | 7 | -1,47 | 0,37 | 9 | -4,6** | 0,31 |
| FGA | 4 | 4,00 (t) | 2,83 | 9 | 6,36*** | 1,58 |
| 10mWT | 7 | 0,22 (t) | 0,87 | 8 | 0,121 | 0,63 |
| WMFT | 4 | 6,75 | 0,74 | 5 | 5,4*** | 1,73 |
| EQ 5D 5L | 6 | 0,12 | 0,80 | 9 | 0,11 | 0,40 |
Tab. 5 Absolute Differenzen und Effektstärken bei Probanden, die über Schmerzen bei T0 berichten. Begriffserklärungen können der allgemeinen Beschreibung der Tabellenstruktur am Anfang des Ergebnisabschnitts entnommen werden.
| Ätiologie | N | T0 (STD) | ∆T0-T1 | ∆T0-T2 | Cohen‘s d |
|---|---|---|---|---|---|
| ZP | 14 | 2,79 (0,70) | -0,57** | -1,00*** | 1,28 |
| MS | 16 | 3,06 (1,00) | -1,06*** | -0,81** | 0,78 |
| Schlaganfall | 12 | 2,58 (0,9) | -0,75* | -0,75* | 0,78 |
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- iOrt – Entwicklung einer überwachenden Orthese mit neuartigem optischen Sensorsystem — 11. Februar 2026
- Trompetto C et al. Pathophysiology of Spasticity: Implications for Neurorehabilitation. BioMed Research International, 2014: 354906. doi: 10.1155/2014/354906
- Mukherjee A, Chakravarty A. Spasticity mechanisms – for the clinician. Frontiers in Neurology, 2010; 17 (1): 149. doi: 10.3389/fneur.2010.00149
- Nielsen JB, Christensen MS, Farmer SF, Lorentzen J. Spastic movement disorder: should we forget hyperexcitable stretch reflexes and start talking about inappropriate prediction of sensory consequences of movement? Experimental Brain Research, 2020; 238 (7–8): 1627–1636. doi: 10.1007/s00221-020–05792
- Mukherjee A, Chakravarty A. Spasticity mechanisms – for the clinician. Frontiers in Neurology, 2010; 17 (1): 149. doi: 10.3389/fneur.2010.00149
- Chang E et al. A Review of Spasticity Treatments: Pharmacological and Interventional Approaches. Critical Reviews in Physical and Rehabilitation Medicine, 2013; 25 (1–2): 11–22. doi: 10.1615/CritRevPhysRehabilMed.2013007945
- Mahmood A et al. Effect of Transcutaneous Electrical Nerve Stimulation on Spasticity in Adults with Stroke: A Systematic Review and Meta-analysis. American Journal of Physical Medicine & Rehabilitation, 2018; 97 (11): 793–807. doi: 10.1097/PHM.0000000000000970
- Vance CG, Dailey DL, Rakel BA, Sluka KA. Using TENS for pain control: the state of the evidence. Journal of Pain Management, 2014; 4 (3): 197–209. doi:10.2217/pmt.14.13
- Electrodress 100 user manual. Solna, Sweden: Inerventions AB, o.J.
- McDonough SM. The neurophysiological basis of reciprocal inhibition in man. Physical Therapy Reviews, 1997; 2 (1): 19–28, doi: 10.1179/ptr.1997.2.1.19
- Pierrot-Deseilligny E, Burke D. Monosynaptic Ia excitation and post-activation depression. The Circuitry of the Human Spinal Cord: Its Role in Motor Control and Movement Disorders. Cambridge: Cambridge University Press 2005: 63–112. doi:10.1017/CBO9780511545047.003
- Mayr W, Krenn M, Dimitrijevic MR. Epidural and transcutaneous spinal electrical stimulation for restoration of movement after incomplete and complete spinal cord injury. Current Opinion in Neurology, 2016; 29 (6): 721–726. doi: 10.1097/WCO.0000000000000382
- Minassian K, Hofstoetter U, Tansey K, Mayr W. Neuromodulation of lower limb motor control in restorative neurology. Clinical Neurology and Neurosurgery, 2012; 114 (5): 489–497. doi: 10.1016/j.clineuro.2012.03.013
- Perpetuini D et al. Use and Effectiveness of Electrosuit in Neurological Disorders: A Systematic Review with Clinical Implications. Bioengeneering, 2023; 10 (6): 680. doi: 10.3390/bioengeneering10060680
- Remotion Mollii Stories. https://www.remotion.co.uk. (Zugriff am 22.03.2023)
- Shirley Ryan Ability Lab. Rehabilitation measures database. https://www.sralab.org/rehabilitation-measures/ (Zugriff am 22.03.2023)
- Shirley Ryan Ability Lab. Rehabilitation measures database. https://www.sralab.org/rehabilitation-measures/ (Zugriff am 22.03.2023)
- Shirley Ryan Ability Lab. Rehabilitation measures database. https://www.sralab.org/rehabilitation-measures/ (Zugriff am 22.03.2023)
- Perry J, Garrett M, Gronley JK, Mulroy SJ. Classification of walking handicap in the stroke population. Stroke, 1995; 26 (6): 982–989. doi: 10.1161/01.str.26.6.982
- Shirley Ryan Ability Lab. Rehabilitation measures database. https://www.sralab.org/rehabilitation-measures/ (Zugriff am 22.03.2023)
- Shirley Ryan Ability Lab. Rehabilitation measures database. https://www.sralab.org/rehabilitation-measures/ (Zugriff am 22.03.2023)
- Shirley Ryan Ability Lab. Rehabilitation measures database. https://www.sralab.org/rehabilitation-measures/ (Zugriff am 22.03.2023)
- Exopulse Mollii Suit: user manual, Exoneural Network AB, Svärdvägen 11D, Schweden
- R Core Team. R: A language and environment for statistical computing. Wien: R Foundation for Statistical Computing, 2020. https://www.R‑project.org (Zugriff am 22.03.2023)
- Palmcrantz S et al. Feasibility and potential effects of using the electro-dress Mollii on spasticity and functioning in chronic stroke. Journal of NeuroEngineering and Rehabilitation, 2020; 17 (1): 109. doi: 10.1186/s12984-020–00740‑z
- Ng SSM, Lai CWK, Tang MWS, Woo J. Cutaneous electrical stimulation to improve balance performance in patients with sub-acute stroke: a randomised controlled trial. Hong Kong Medical Journal, 2016; 22 (2): 33–36
- Bleyenheuft Y et al. Intensive upper- and lower-extremity training for children with bilateral cerebral palsy: a quasi-randomized trial. Developmental Medicine and Child Neurology, 2017; 59 (6): 625–633
- Cho C, Hwang W, Hwang S, Chung Y. Treadmill Training with Virtual Reality Improves Gait, Balance, and Mus-cle Strength in Children with Cerebral Palsy. Tohoku Journal of Experimental Medicine, 2016; 238 (3): 213–218
- Hsieh HC. Preliminary Study of the Effect of Training With a Gaming Balance Board on Balance Control in Children With Cerebral Palsy: A Randomized Controlled Trial. American Journal of Physical Medicine & Rehabilitation, 2020; 99 (2): 142–148
- Raffalt PC et al. Electro-suit treatment of children with unilateral cerebral palsy alters nonlinear dynamics of walking. Clinical Biomechanics, 2022; 98: 10571. doi: 10.1016/j.clinbiomech.2022.105714
- Bakaniene I, Urbonaviciene G, Janaviciute K, Prasauskiene A. Effects of the Interventions method on gross motor function in children with spastic cerebral palsy. Polish Neurological Society, 2018; 52 (5): 581–586. doi: 10.1016/j.pjnns.2018.07.003
- Ertzgaard P et al. Evaluation of a self-administered transcutaneous electrical stimulation concept for the treatment of spasticity: a randomized placebo-controlled trial. European Journal of Physical and Rehabilitation Medicine, 2018; 54 (4): 507–517. doi: 10.23736/s1973-9087.17.04791–8
- Arkkukangas M, Hedberg Graff J, Denison E: Evaluation of the electro-dress Mollii® to affect spasticity and motor function in children with cerebral palsy: Seven experimental single-case studies with an ABAB design. Cogent Engineering, 2022; 9 (1). doi: 10.1080/23311916.2022.2064587
- Ertzgaard P et al. Evaluation of a self-administered transcutaneous electrical stimulation concept for the treatment of spasticity: a randomized placebo-controlled trial. European Journal of Physical and Rehabilitation Medicine, 2018; 54 (4): 507–517. doi: 10.23736/s1973-9087.17.04791–8
- Ertzgaard P et al. Evaluation of a self-administered transcutaneous electrical stimulation concept for the treatment of spasticity: a randomized placebo-controlled trial. European Journal of Physical and Rehabilitation Medicine, 2018; 54 (4): 507–517. doi: 10.23736/s1973-9087.17.04791–8
- Palmcrantz S et al. Feasibility and potential effects of using the electro-dress Mollii on spasticity and functioning in chronic stroke. Journal of NeuroEngineering and Rehabilitation, 2020; 17 (1): 109. doi: 10.1186/s12984-020–00740‑z
- Kuhlmann A, Krüger H, Seidinger S; Hahn A: Cost-effectiveness and budget impact of the microprocessor-controlled knee C‑Leg in transfemoral amputees with and without diabetes mellitus. European Journal of Health Economics, 2020; 21 (3): 437–449. doi: 10.1007/s10198-019–01138‑y
- Ertzgaard P et al. Evaluation of a self-administered transcutaneous electrical stimulation concept for the treatment of spasticity: a randomized placebo-controlled trial. European Journal of Physical and Rehabilitation Medicine, 2018; 54 (4): 507–517. doi: 10.23736/s1973-9087.17.04791–8
- Palmcrantz S et al. Feasibility and potential effects of using the electro-dress Mollii on spasticity and functioning in chronic stroke. Journal of NeuroEngineering and Rehabilitation, 2020; 17 (1): 109. doi: 10.1186/s12984-020–00740‑z
- Riachi N et al. Effects of the TENS device, Exopulse Mollii Suit, on pain related to fibromyalgia: An open-label study. Neurophysiology Clinique, 2023; 53 (4): 102863. doi: 10.1016/j.neucli.2023.102863
- Pennati GV et al. Effects of 60 Min Electrostimulation With the EXOPULSE Mollii Suit on Objective Signs of Spasticity. Frontiers in Neurololgy, 2021; 12: 706610. doi: 10.3389/fneur.2021.706610
- Lindberg PG, Gaverth J, Islam M, Fagergren A, Borg J, Forssberg H. Validation of a new biomechanical model to measure muscle tone in spastic muscles. Neurorehabilitation and Neural Repair, 2011; 25 (7): 617–625. doi: 10.1177/1545968311403494
- Flodström C et al. A pilot study of the impact of the electro-suit Mollii® on body functions, activity, and participation in children with cerebral palsy. Assistive Technology, 2021; 34 (4): 411–417. doi:10.1080/10400435.2020.1837288
- Hedin H, Wong C. Sjödén A. The effects of using an electrodress (Mollii®) to reduce spasticity and enhance functioning in children with cerebral palsy: a pilot study. European Journal of Physiotherapy, 2020; 24 (3): 134–143. doi: 10.1080/21679169.2020.1807602