Einleitung
Phantomschmerzen und andere Phantomsensationen stellen noch immer ein Mysterium dar. Viele Amputationspatienten verspüren im Phantomglied Bewegungen und/oder können Bewegungen im Phantomglied mental initiieren; nahezu alle Patienten, die sich im Erwachsenenalter einer Amputation unterziehen müssen, nehmen das nicht mehr vorhandene Glied propriozeptiv und somatosensorisch wahr 1. Phantomsensationen, etwa das Gefühl von Wärme oder Kälte, Gewicht und Lage des Körperteils, treten besonders häufig nach Amputation der oberen oder unteren Extremitäten auf und entsprechen nahezu exakt dem früheren Glied. Bei ca. 60 % der Patienten verkürzt sich im Laufe der Zeit das Phantomglied in Relation zum übrigen Körper, ein Prozess, der „telescoping“ genannt wird. Die Patienten nehmen mit zunehmendem zeitlichem Abstand zur Amputation den Fuß oder die Hand direkt an oder in der Trennstelle des Stumpfes wahr.
Klinisch besonders bedeutsam ist der Phantomschmerz. Unter Phantomschmerzen werden dabei schmerzhafte Empfindungen verstanden, die im nicht mehr vorhandenen, virtuellen Körperteil empfunden werden 2 3. Die Häufigkeit von Phantomschmerzen ist von der Höhe der Amputation abhängig, aber auch von der Art der Befragung. Fragt man präzise und detailliert, stellt man fest, dass nahezu alle Amputationspatienten irgendwann einmal Phantomschmerzen empfunden haben. Phantomschmerzen sind nach Arm‑, Hand‑, Bein- oder Fußamputation besonders häufig. Sie können aber auch nach kleineren Amputationen, etwa von Fingern 4 5, nach Zahnextraktionen, Brustamputationen u. a. auftreten. Neben spontan auftretenden Phantomschmerzen gibt es auch solche, die durch Manipulation z. B. des Stumpfes oder anderer Stellen des Körpers hervorgerufen werden können 6 7 8. Diese übertragenen Sensationen weisen manchmal eine Punkt-zu-Punkt-Korrespondenz auf, d. h., die Stimulation benachbarter Hautareale im Gesicht kann zur Wahrnehmung von Berührungen in benachbarten virtuellen Fingern der Phantomhand führen 9.
Intensität und Dauer der Phantomschmerzen variieren beträchtlich. Sherman 10 ermittelte in einer Befragung von ca. 5.000 Amputierten bei 18 % der Patienten kontinuierliche Schmerzen, bei 33 % tägliche Schmerzepisoden. Aktuelle Daten aus Deutschland zeigen ein ähnliches Bild 11: Rund 50 % der Patienten suchten wegen der Schmerzen den Arzt auf. Phantomschmerzen gehören zur Gruppe der neuropathischen Schmerzen. Diese lassen sich oft nicht zufriedenstellend therapieren, auch wenn in der Literatur mehr als 60 Therapieansätze beschrieben werden 12 13 14.
Aufbauend auf einem Vortrag auf der OTWorld in Leipzig 2014 werden im Folgenden Überlegungen und Befunde zur funktionellen Plastizität des somatosensorischen Kortex vermittelt, die die Bedeutsamkeit funktioneller und anatomischer Plastizität für die Entstehung des Phantomschmerzes nahelegen. Im Anschluss werden die Ergebnisse zweier Projekte vorgestellt, die auf dem postulierten Zusammenhang zwischen kortikaler Plastizität und Phantomschmerz fußen und in denen versucht wurde, Phantomschmerz durch kommerzielle Prothesen mit zusätzlichem somatosensorischem Biofeedback zu therapieren.
Mechanismen der Pathogenese von Phantomschmerz
In der Pathogenese von Phantomschmerzen spielen viele Mechanismen eine Rolle (für Überblicksarbeiten siehe z. B. 15 16). Unterschiedliche Autoren differenzieren diese Mechanismen unterschiedlich. Hinsichtlich der Lokalisation im Organismus lassen sich die Mechanismen grob in periphere und zentralnervöse Mechanismen unterteilen. Für die vorliegende Arbeit spielen die zentralnervösen Mechanismen eine herausragende Rolle. Sie werden nach einer kurzen Darstellung der peripheren Mechanismen ausführlicher behandelt.
Jede Amputation stellt eine Axotomie der peripheren Nerven dar, also eine periphere Nervenverletzung von extremem Ausmaß. Axotomierte Nerven degenerieren teilweise. Davon sind unmyelinisierte C‑Fasern, die Temperatur und Schmerz vermitteln, besonders betroffen. Die Stimulation dieser verletzten Fasern wird mit Berichten der Patienten über Schmerz und Hypersensitivität in Reaktion auf Änderungen der Temperatur oder des Luftdrucks, Vibration, Berührung oder leichtes Klopfen am Stumpf in Verbindung gebracht. Überlebende Fasern weisen zudem oft eine erhöhte Aktivität auf 17, die vom Gehirn als Schmerz im amputierten Körperteil, also Phantomschmerz, interpretiert werden. Die geschädigten Nervenendigungen versuchen zudem, den Schaden zu beheben, indem sie aussprossen. In der Folge können sich oberflächlich oder tief im Gewebe liegende gutartige Verklumpungen neuronalen Gewebes, sogenannte Neurome, bilden. Innerhalb der Neurome kommt es ebenfalls zu Veränderungen, die spontanen und/oder evozierten Phantomschmerz hervorrufen können 18.
Zentralnervöse Veränderungen bei Phantomschmerz finden sich in sehr vielen Regionen des Zentralnervensystems. Sie beginnen im Rückenmark und reichen über alle schmerzverarbeitenden Strukturen bis hin zu Hirnregionen, die eher mit Motivation und Emotion zu tun haben. Sie betreffen also alle Schaltstationen der sogenannten Neuromatrix des Schmerzes 19: Hirnstamm, Thalamus, primären und sekundären somatosensorischen Kortex, die Insula sowie den zingulären Kortex 20. Einige Veränderungen sind eng mit Phantomsensationen und Phantomschmerz assoziiert. Es besteht zudem die Befürchtung, dass die zentralen Veränderungen mit Fortdauer der chronischen Schmerzen immer stärker in den Vordergrund treten 21 22 23 24. Dies würde auch erklären, warum die bisherigen Therapieerfolge so gering ausfallen.
Neben Veränderungen in den Strukturen der Neuromatrix des Schmerzes gibt es Hinweise darauf, dass sich Phantomschmerz aus der Inkongruenz motorischer Intention und daraus resultierendem sensorischem Feedback ergeben könnte. Eine weitere Hypothese zur Pathogenese von Phantomschmerz verknüpft das Ereignis der Amputation mit der Entstehung eines spezifischen Schmerzgedächtnisses 25 26.
Maladaptive Reorganisation und Phantomschmerz
Eine besondere Rolle bei der Entstehung und/oder der Pathogenese von Phantomschmerz scheint die kortikale Reorganisation zu spielen, auf die nun genauer eingegangen werden soll. Nach einer Amputation erfolgt eine funktionelle Reorganisation der Somatotopie im primären somatosensorischen Kortex S1. Infolge der Amputation werden die freiwerdenden Repräsentationen (etwa des Armes und der Hand) durch somatotop benachbart liegende Repräsentationen (etwa das Gesicht und den Rumpf) okkupiert. Spannenderweise korreliert das Ausmaß dieser Reorganisation bei Patienten extrem stark mit dem Phantomschmerz (r = .93 27). Diverse Folgestudien bestätigten diese hohe Korrelation, wenngleich kürzlich eine Arbeitsgruppe eine geringer ausgeprägte Reorganisation ermittelte und eine alternative Theorie (der persistierenden Schmerzrepräsentation) aufstellte 28 29. Studien zeigen zudem, dass es auch in anderen kortikalen Strukturen (etwa im sekundären somatosensorischen Kortex oder im primären motorischen Kortex 30 31) zur funktionellen Reorganisation kommt, deren Ausmaß hoch mit dem empfundenen Phantomschmerz korreliert.
Auf der Grundlage dieser Befunde wurde die Hypothese der maladaptiven Plastizität zur Genese und zur Aufrechterhaltung von Phantomschmerz aufgestellt 32. Sie postuliert, dass vor, während und/oder als Folge der Amputation ein somatosensorisches bzw. ein Schmerzgedächtnis mit neuronalem Substrat auf verschiedenen neuronalen Ebenen etabliert wird, wobei der primäre somatosensorische Kortex S1 eine besondere Rolle spielt. Die dargelegte Okkupation der deafferenzierten Repräsentation durch somatotop benachbart liegende Repräsentationen repräsentiert normalerweise einen adaptiven Prozess, der hier maladaptiv ist (daher der Name).
Verschiedene Befunde lassen sich mit der Hypothese der maladaptiven Plastizität sehr plausibel erklären. So spricht nicht nur die Korrelation der funktionellen Reorganisation mit dem Ausmaß der Phantomschmerzen für diese Hypothese, sondern Patienten berichten überzufällig häufig von Phantomschmerzen, die den Schmerzen direkt vor der Amputation gleichen. Phantomsensationen und Phantomschmerzen lassen sich bei vielen Patienten durch Stimulation somatotop benachbarter Areale auslösen 33 34, wenngleich nicht nur von dort 35 36. Auch zeigen einzelne Falldaten von Teildestruktionen des S1 eine Reduktion von Phantomschmerz bzw. eine Verstärkung des Phantomschmerzes bei selektiver Stimulation von S1.
Zentrale Retro-Reorganisation als Therapieansatz
In der Literatur sind mehr als 60 verschiedene Formen der Therapie von Phantomschmerz beschrieben; allerdings sind placebokontrollierte und randomisierte Studien sehr selten 37 38 39. Noch bedrückender als dieses Fehlen hochwertiger Studien ist jedoch die in großangelegten Untersuchungen nachgewiesene Tatsache, dass nach Bewertung des Erfolgs durch die Patienten die meisten Ansätze wenig effizient sind. So ermittelte Sherman 40 bei einer Befragung von ca. 5.000 Amputationspatienten, dass weniger als 1 % der Patienten eine permanente oder doch wenigstens lang andauernde substanzielle Reduktion ihres Phantomschmerzes bemerkten. Aktuelle Studien bestätigen dieses Bild 41 42. Es bleibt somit zu konstatieren, dass Phantomschmerz auch heute ein medizinisches Problem darstellt 43.
Zweifellos tragen verschiedene Faktoren zu diesem unbefriedigenden Zustand bei, hier seien nur einige erwähnt. Wie oben dargestellt, sind offenbar diverse Mechanismen, die zudem zum Teil nicht komplett verstanden sind, an Genese und Aufrechterhaltung von Phantomschmerz beteiligt. In den meisten Untersuchungen werden nur einzelne Mechanismen behandelt; bestimmte andere Mechanismen können, etwa aufgrund von Nebenwirkungen, nicht gleichzeitig behandelt werden. Weiterhin erschwert die zu geringe Anzahl systematischer, gut kontrollierter Studien zur Therapie von Phantomschmerz wissenschaftlich fundierte Schlussfolgerungen. Bedeutsam scheint zudem, dass die Einflussnahme auf zentrale Mechanismen viel schwieriger ist als auf periphere. Allerdings haben die schlechten Therapieerfolge in den letzten Jahren die Einsicht gefördert, dass die Rolle zentraler Mechanismen bei der Genese und Aufrechterhaltung von Phantomschmerzen möglicherweise unterschätzt wurde. So wenden sich verschiedene Gruppen der Korrektur der zentralen Prozesse zu.
Eine Möglichkeit, auf die zentrale funktionelle Organisation des Gehirns einzuwirken, ist Training. Es ist heute unumstritten, dass wiederholte afferente Stimulation, etwa in Form eines Diskriminationstrainings, zu robusten Veränderungen der funktionellen Organisation in S1 führt. So ist etwa bei professionellen Violinisten die funktionelle kortikale Repräsentation der Finger der linken Greifhand in S1 gegenüber der rechten Hand und auch gegenüber normalen gesunden Kontrollpersonen deutlich vergrößert 44. Personen, die Blindenschrift lesen können, haben deutlich vergrößerte Repräsentationen der entsprechenden Finger, die mit der Leseerfahrung korrelieren 45. Werden Schlaganfallpatienten einem intensiven Training unterzogen, vergrößern sich die kortikalen Repräsentationsareale der beübten Extremität 46 47. Kurzum – eine massive, möglichst (aber nicht zwingend) verhaltensrelevante Stimulation führt zu einer Veränderung der Repräsentation im Sinne einer Ausweitung bzw. Vergrößerung der kortikalen Repräsentation. Training führt also zur Ausdehnung der kortikalen Repräsentationsareale der beübten Funktion. Wenn nun, wie oben ausführlich beschrieben, Amputationen zu einer Einengung der kortikalen Repräsentation und zur Übernahme der Repräsentation durch benachbarte Regionen führen können, intensives Training aber zu einer Ausdehnung der kortikalen Repräsentationen, dann liegt es nahe, Stimulation, Training und Lernprozesse einzusetzen, um die maladaptive funktionelle Plastizität in S1 wieder zurückzudrängen, also zu retro-reorganisieren.
Befunde zur zentralen Retro-Reorganisation
Ausgehend von den Untersuchungen zur kortikalen Reorganisation untersuchte die Arbeitsgruppe um Herta Flor als Erste die Nutzung einer Methode, die auf eine Retro-Reorganisation ausgerichtet war. Dazu wurde eine Gruppe von 5 Phantomschmerzpatienten einem somatosensorischen Diskriminationstraining unterzogen 48. Konkret wurden Stimulationselektroden am Stumpf der amputierten Extremität appliziert. Während eines zweiwöchigen Diskriminationstrainings von täglich 90 Minuten hatten die Patienten zu lernen, Lokalisation und Frequenz der elektrischen Stimulation zu erkennen. Die Patienten zeigten über den Trainingszeitraum einen signifikanten Anstieg der Diskriminationsfähigkeit der Reize am Stumpf; auch die Zweipunktdiskrimination stieg im trainierten Areal an. Bedeutsamer aber war, dass es dabei auch zu einer signifikanten Abnahme der Phantomschmerzen kam. Die Schmerzabnahme korrelierte dabei mit einer gleichzeitigen Reduktion der funktionellen Reorganisation, sprich der zentralen Retro-Reorganisation, in S1. Diese Daten sprechen also dafür, dass der postulierte Zusammenhang zwischen Phantomschmerz und zentraler Reorganisation in S1 nicht nur existiert, sondern dass dieser Zusammenhang für eine mechanismenbasierte Therapie zur funktionellen Retro-Reorganisation in S1 bei gleichzeitiger Schmerzreduktion genutzt werden kann.
In eine ähnliche Richtung lassen sich auch Befunde aus dem Labor des Verfassers bei Trägern funktioneller Prothesen interpretieren. Bei Patienten mit Sauerbruch-Prothese konnte festgestellt werden, dass sie auffällig weniger über Phantomschmerzen klagten als Patienten mit kosmetischen Prothesen 49 50. Dabei korrelierte die Abnahme des Phantomschmerzes mit der Dauer des Tragens der funktionellen Sauerbruch-Prothese 51 52. Eine ähnliche Studie konnte zusätzlich belegen, dass Patienten mit myoelektrischer Prothese seltener unter Phantomschmerz leiden, wobei dann bei den schmerzfreien Patienten keine signifikante Reorganisation in S1 auftrat 53.
Es gibt weitere Therapieansätze, die man in Richtung Retro-Reorganisation interpretieren kann. Hierzu gehören die Spiegeltherapie 54 55, virtuelle Realität 56 und das mentale Üben von Bewegungen 57 58. Die Spiegeltherapie nutzt das Primat des visuellen Inputs, um eine Illusion der Existenz der amputierten Extremität herzustellen 59. Die Spiegeltherapie kann den Phantomschmerz unterschiedlich effizient reduzieren 60 61. Ob diese Therapie effizienter ist als mentales Üben, das ebenfalls erfolgreich zur Reduktion von Phantomschmerz eingesetzt wird, ist jedoch umstritten 62.
Bedeutung der zentralen Retro-Reorganisation für die Orthopädie-Technik
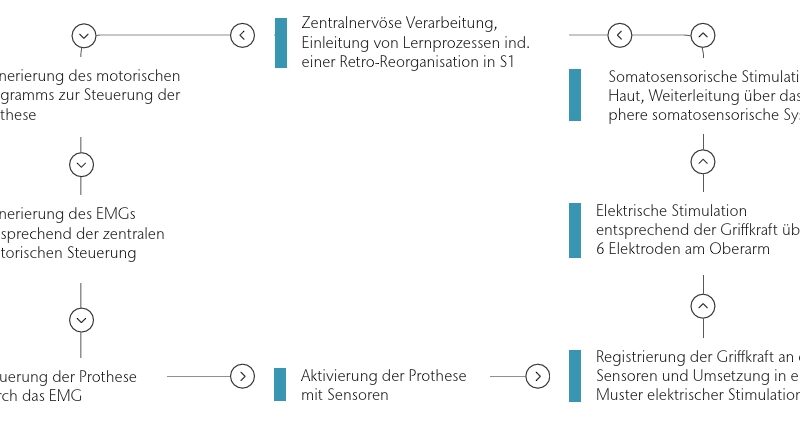
Die oben dargestellten Untersuchungen gaben Anlass zu der Idee, eine Verbindung von somatosensorischem Training und dem Tragen von Prothesen herzustellen, um eine sich aufaddierende Retro-Reorganisation in S1 sowie eine sich aufaddierende Reduktion von Phantomschmerz zu erreichen. Diese Idee wurde realisiert, indem den Patienten Informationen aus den Sensoren der Prothesenhand zur Nutzung als somatosensorisches Feedback zur Verfügung gestellt wurden (Abb. 1). Zunächst wurde eine elektrische Stimulation entwickelt, die auch bei myoelektrischen Prothesen eingesetzt werden kann, ohne diese zu stören, und doch Lernprozesse analog zum somatosensorischen Diskriminationstraining zulässt 63 64. Diese Art von Stimulation wurde anschließend in einer Anordnung als somatosensorisches Feedback genutzt, das mit einer myoelektrischen Handprothese vereinigt wurde. Damit wird einerseits die somatosensorische Diskrimination genutzt, indem unterschiedliche Muster für die diversen Griffkräfte verwendet werden, andererseits wird die Nutzung funktioneller Prothesen als Methode zur Reduktion von Phantomschmerz eingearbeitet. Bedeutsam ist dabei zu erwähnen, dass sich das somatosensorische Feedback in gewisser Weise von dem bei Flor et al. 65 genutzten unterscheidet: Dieses Feedback ist hochgradig verhaltensrelevant, weil der Patient eine Rückmeldung über die Stärke des Griffes der Prothesenhand erhält und somit die Griffkraft bewusst steuern kann.
Im Rahmen eines Projektes wurden Patienten mit myoelektrischen Prothesen unter Nutzung somatosensorischen Feedbacks über 14 Tage trainiert. Die Ergebnisse sind überzeugend: Es wurde eine Reduktion des Phantomschmerzes innerhalb dieses Zeitraums um ca. 50 % ermittelt 66 67. Die Reduktion betrug zwischen 0 und 92 % (!) innerhalb dieses Zeitraumes. Für die Patienten mindestens ähnlich bedeutsam war der Zugewinn an Funktionalität der Prothese. Innerhalb des Trainingszeitraumes konnte eine deutliche und hochsignifikante Verbesserung der Funktionalität erreicht werden. Erwartungsgemäß hatten sich insbesondere Bewegungen verbessert, die eine Abstimmung der erzeugten Kraft durch die Prothesenhand erfordern, etwa das Heben und Tragen fragiler Elemente wie Tennisbälle oder Weintrauben. Mit Blick auf den Phantomschmerz ergaben sich Zusammenhänge mit der Leistung: Die Verminderung der Phantomschmerzen im Trainingszeitraum war umso stärker, je besser es den Patienten gelang, das somatosensorische Feedback zu interpretieren. Im Rahmen einer Nachbefragung teilten die meisten Probanden mit, dass ihnen die Verbesserung der Funktionalität mindestens ebenso wichtig war wie die Reduktion des Phantomschmerzes. Sie berichteten, dass das sensible Halten von Mandarinen, Weintrauben, Tischtennisbällen, Plastikbechern und Ähnlichem im Alltag einen enormen Gewinn an Lebensqualität bringe. Nach Abschluss des Trainings wünschte nahezu jeder Patient ein derartiges System für den Alltag.
Fasst man diese Untersuchung zusammen, so kann man festhalten, dass dieser Ansatz eine weitere Möglichkeit zur Beeinflussung von Phantomschmerz bei gleichzeitiger Verbesserung der Lebensqualität darstellt. Der Nachweis kortikaler Retro-Reorganisation in diesem Zusammenhang steht jedoch noch aus. Um diesen Zusammenhang zu untersuchen, wird derzeit ein Projekt durchgeführt, bei dem eine ähnliche Feedbackanordnung auch für Patienten mit Unterschenkelamputationen realisiert wurde. Als somatosensorisches Feedback wird wiederum eine schmerzfreie elektrische Stimulation – nunmehr am Oberschenkel – genutzt. Dabei wird das Gangmuster zurückgemeldet. Die Patienten trainieren 2 Wochen lang unterschiedliche Aktivitäten, etwa auf einem Parcours, Treppensteigen, schiefe Ebene, Balance mittels der Spielekonsole Wii etc. Hier stehen noch einige wenige Plätze zur Verfügung (Anmeldung per E‑Mail beim Verfasser möglich).
Fazit
Zusammenfassend ist festzustellen, dass in der Pathogenese des Phantomschmerzes unterschiedliche Prozesse eine Rolle spielen. Die vorher wenig beachteten zentralnervösen Mechanismen spielen nunmehr eine wichtigere Rolle, wobei der maladaptiven Reorganisation besonderes Augenmerk geschenkt wird. Inzwischen gibt es erste Versuche, die zentralnervöse maladaptive Reorganisation zu retro-organisieren, d. h. zurückzudrängen. Diese Versuche erbrachten bislang erstaunlich gute Ergebnisse. Diese erfolgversprechenden Ansätze sollten daher weiter verfolgt werden.
Danksagung
Teile der eigenen Ergebnisse wurden maßgeblich mit Hilfe verschiedener Mitarbeiter des Lehrstuhls für Biologische und Klinische Psychologie erbracht, wobei Prof. Dr. Wolfgang H. R. Miltner, Dipl.-Psych. Kathrin Blume, Dr. Caroline Dietrich, Dipl.-Ing. Holger Hecht, Ergotherapeut Hendrik Möbius, Dr. Sandra Preißler und Dr. Katrin Walter-Walsh besonderer Dank gebührt. Für eine ausgezeichnete Kooperation bedanken wir uns bei den Kollegen der Klinik für Unfall‑, Rekonstruktions- und Wiederherstellungschirurgie, insbesondere bei Prof. Dr. Gunther O. Hofmann und Dr. Reinhard Friedel, sowie bei den Kollegen der BG-Klinik Bergmannstrost Halle/Saale, insbesondere bei Frau Heidrun Gube und PD Dr. Lutz Brückner. Besonderer Dank gebührt der Firma Ingenieur- und Medienberatungs-Büro Torma (IMBT) bei der Umsetzung der Feedback-Idee, insbesondere Herrn Ferenc Torma.
Die Studien wurden durch die Deutsche Gesetzliche Unfallversicherung (DGUV FR 145 und FR 196) unterstützt, die keinen Einfluss auf die inhaltliche Gestaltung der Projekte nahm. Die Ergebnisse und die Publikation werden ausschließlich von den Projektleitern verantwortet.
Der Autor:
Prof. Dr. Thomas Weiss
Friedrich-Schiller-Universität Jena
Biologische und Klinische Psychologie
Am Steiger 3, H. 1, 07743 Jena
thomas.weiss@uni-jena.de
Begutachteter Beitrag/reviewed paper
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- iOrt – Entwicklung einer überwachenden Orthese mit neuartigem optischen Sensorsystem — 11. Februar 2026
- Weiss T. Phantom Sensations. In: Grunwald M (ed.). Human Haptic Perception – Basics and Applications. Basel: Birkhäuser, 2008: 283–294
- Weiss T, Miltner WHR. Phantomschmerz. In: Standl T, Schulte am Esch J, Treede RD, Schäfer M, Bardenheuer HJ (Hrsg.). Schmerztherapie. Stuttgart: Thieme, 2010: 370–375
- Weiss T. Phantomschmerz. In: Herbert M, Meissner W (Hrsg.). Aktuelle Schmerzmedizin. Landsberg: ecomed, 2014: 1–16
- Weiss T, Miltner WHR, Dillmann J, Meissner W, Huonker H, Nowak H. Reorganization of the somatosensory cortex after amputation of the index finger. Neuroreport, 1998; 9 (2): 213–216
- Weiss T, Miltner WHR, Huonker R, Friedel R, Schmidt I, Taub E. Rapid functional plasticity of the somatosensory cortex after finger amputation. Experimental Brain Research, 2000; 134 (2): 199–203
- Ramachandran VS, Rogers Ramachandran D, Stewart M. Perceptual correlates of massive cortical reorganization. Science, 1992; 258 (5058): 1159–1160
- Knecht S, Henningsen H, Elbert T, Flor H, Hohling C, Pantev C, Taub E. Reorganizational and perceptional changes after amputation. Brain, 1996; 119: 1213–1219
- Knecht S, Henningsen H, Hohling C, Elbert T, Flor H, Pantev C, Taub E. Plasticity of plasticity? Changes in the pattern of perceptual correlates of reorganization after amputation. Brain, 1998: 121: 717–724
- Ramachandran VS, Rogers Ramachandran D, Stewart M. Perceptual correlates of massive cortical reorganization. Science, 1992; 258 (5058): 1159–1160
- Sherman RA. Phantom pain. New York: Plenum, 1997
- Kern U, Busch V, Müller R, Kohl M, Birklein F. Phantom limb pain in daily practice – still a lot of work to do! Pain Medicine, 2012; 13 (12): 1611–1626
- Weiss T, Miltner WHR. Phantomschmerz. In: Standl T, Schulte am Esch J, Treede RD, Schäfer M, Bardenheuer HJ (Hrsg.). Schmerztherapie. Stuttgart: Thieme, 2010: 370–375
- Weiss T. Phantomschmerz. In: Herbert M, Meissner W (Hrsg.). Aktuelle Schmerzmedizin. Landsberg: ecomed, 2014: 1–16
- Sherman RA. Phantom pain. New York: Plenum, 1997
- Weiss T. Phantomschmerz. In: Herbert M, Meissner W (Hrsg.). Aktuelle Schmerzmedizin. Landsberg: ecomed, 2014: 1–16
- Flor H, Nikolajsen L, Jensen TS. Phantom limb pain: a case of maladaptive CNS plasticity? Nature Reviews Neuroscience, 2006; 7 (11): 873–881
- Nyström B, Hagbarth KE. Microelectrode recordings from transected nerves in amputees with phantom limb pain. Neuroscience Letters, 1981: 27 (2): 211–216
- Flor H, Nikolajsen L, Jensen TS. Phantom limb pain: a case of maladaptive CNS plasticity? Nature Reviews Neuroscience, 2006; 7 (11): 873–881
- Iannetti GD, Mouraux A. From the neuromatrix of the pain matrix (and back). Experimental Brain Research, 2010; 205: 1–12
- Flor H, Nikolajsen L, Jensen TS. Phantom limb pain: a case of maladaptive CNS plasticity? Nature Reviews Neuroscience, 2006; 7 (11): 873–881
- Weiss T. Phantom Sensations. In: Grunwald M (ed.). Human Haptic Perception – Basics and Applications. Basel: Birkhäuser, 2008: 283–294
- Weiss T. Phantomschmerz. In: Herbert M, Meissner W (Hrsg.). Aktuelle Schmerzmedizin. Landsberg: ecomed, 2014: 1–16
- Flor H, Nikolajsen L, Jensen TS. Phantom limb pain: a case of maladaptive CNS plasticity? Nature Reviews Neuroscience, 2006; 7 (11): 873–881
- Apkarian AV, Baliki MN, Farmer MA. Predicting transition to chronic pain. Current Opinion in Neurology, 2013; 26 (4): 360–367
- Flor H, Nikolajsen L, Jensen TS. Phantom limb pain: a case of maladaptive CNS plasticity? Nature Reviews Neuroscience, 2006; 7 (11): 873–881
- Preißler S, Feiler J, Dietrich C, Hofmann GO, Miltner WHR, Weiss T. Gray matter changes following limb amputation with high and low intensities of phantom limb pain. Cerebral Cortex, 2013; 23 (4): 1038–1048
- Flor H, Elbert T, Knecht S, Winbruch C, Pantev C, Birbaumer N, Larbig W, Taub E. Phantom-limb pain as a perceptual correlate of cortical reorganization following arm amputation. Nature, 1995; 375 (6531): 482–484
- Makin TR, Scholz J, Filippini N, Henderson Slater D, Tracey I, Johansen-Berg H. Phantom pain is associated with preserved structure and function in the former hand area. Nature Communication, 2013; 4: 1570–1577
- Makin TR, Scholz J, Henderson Slater D, Johansen-Berg H, Tracey I. Reassessing cortical reorganization in the primary somatosensory cortex following arm amputation. Brain, 2015; 138: 2140–2146
- Lotze M, Grodd W, Birbaumer N, Erb M, Huse E, Flor H. Does use of a myoelectric prosthesis prevent cortical reorganization and phantom limb pain? Nature Neuroscience, 1999; 2 (6): 501–502
- Lotze M, Flor H, Grodd W, Larbig W, Birbaumer N. Phantom movements and pain. An fMRI study in upper limb amputees. Brain, 2001: 124: 2268–2277
- Flor H, Nikolajsen L, Jensen TS. Phantom limb pain: a case of maladaptive CNS plasticity? Nature Reviews Neuroscience, 2006; 7 (11): 873–881
- Weiss T, Miltner WHR, Huonker R, Friedel R, Schmidt I, Taub E. Rapid functional plasticity of the somatosensory cortex after finger amputation. Experimental Brain Research, 2000; 134 (2): 199–203
- Ramachandran VS, Rogers Ramachandran D, Stewart M. Perceptual correlates of massive cortical reorganization. Science, 1992; 258 (5058): 1159–1160
- Knecht S, Henningsen H, Elbert T, Flor H, Hohling C, Pantev C, Taub E. Reorganizational and perceptional changes after amputation. Brain, 1996; 119: 1213–1219
- Knecht S, Henningsen H, Hohling C, Elbert T, Flor H, Pantev C, Taub E. Plasticity of plasticity? Changes in the pattern of perceptual correlates of reorganization after amputation. Brain, 1998: 121: 717–724
- Sherman RA. Phantom pain. New York: Plenum, 1997
- Alviar MJ, Hale T, Dungca M. Pharmacological interventions for treating phantom limb pain. Cochrane Database of Systematic Reviews, 2011; 12: CD006380
- McCormick Z, Chang-Chien G, Marshall B, Huang M, Harden RN. Phantom limb pain: a systematic neuroanatomical-based review of pharmacologic treatment. Pain Medicine, 2014; 15 (2): 292–305
- Sherman RA. Phantom pain. New York: Plenum, 1997
- Kern U, Busch V, Müller R, Kohl M, Birklein F. Phantom limb pain in daily practice – still a lot of work to do! Pain Medicine, 2012; 13 (12): 1611–1626
- Hanley MA, Ehde DM, Campbell KM, Osborn B, Smith DG. Selfreported treatments used for lower-limb phantom pain: Descriptive findings. Archives of Physical Medicine and Rehabilitation, 2006; 87 (2): 270–277
- Griffin SC, Tsao JW. A mechanism-based classification of phantom limb pain. Pain, 2014; 155 (11): 2236–2242
- Elbert T, Pantev C, Weinbruch C, Rockstroh B, Taub E. Increased cortical representation of the fingers of the left hand in string players. Science, 1995; 270: 305–307
- Sterr A, Müller MM, Elbert T, Rockstroh B, Pantev C, Taub E. Changed perceptions in Braille readers. Nature, 1998; 391 (6663): 134–135
- Liepert J, Miltner WHR, Bauder H, Sommer M, Dettmers C, Taub E, Weiller C. Motor cortex plasticity during constraint-induced movement therapy in stroke patients. Neuroscience Letters, 1998; 250 (1): 5–8
- Liepert J, Bauder H, Miltner WHR, Taub E, Weiller C. Treatment-induced cortical reorganization after stroke in humans. Stroke, 2000; 31 (6): 1210–1216
- Flor H, Denke C, Schaefer M, Grüsser S. Effect of sensory discrimination training on cortical reorganisation and phantom limb pain. Lancet, 2001; 357 (9270): 1763–1764
- Brückner L, Adler T, Weiss T. Der Wert des aktiven Sauerbruch-Armes und seine positive Auswirkung auf den Phantomschmerz. Medizinisch-Orthopädische Technik, 2001; 121: 3–10
- Weiss T, Miltner WHR, Brückner L. Der Phantomschmerz in Abhängigkeit von der Funktionalität der Muskulatur des Stumpfes. Orthopädie Technik, 2006; 57 (12): 904–907
- Weiss T, Miltner WHR, Brückner L. Der Phantomschmerz in Abhängigkeit von der Funktionalität der Muskulatur des Stumpfes. Orthopädie Technik, 2006; 57 (12): 904–907
- Weiss T, Miltner WHR. Die Bedeutung der sensomotorischen Funktionalität von Prothesen für die Entwicklung von Phantomschmerz und kortikaler Plastizität. Orthopädie Technik, 2003; 54 (1): 11–15
- Makin TR, Scholz J, Henderson Slater D, Johansen-Berg H, Tracey I. Reassessing cortical reorganization in the primary somatosensory cortex following arm amputation. Brain, 2015; 138: 2140–2146
- Ramachandran VS, Altschuler EL. The use of visual feedback, in particular mirror visual feedback, in restoring brain function. Brain, 2009; 132 (7): 1693–1710
- Foell J, Bekrater-Bodmann R, Diers M, Flor H. Mirror therapy for phantom limb pain: Brain changes and the role of body representation. European Journal of Pain, 2014; 18 (5): 729–739
- Diers M, Kamping S, Kirsch P, Rance M, Bekrater-Bodmann R, Foell J, Trojan J, Bach F, Maass H, Cakmak H, Flor H. Illusion-related brain activations: A new virtual reality mirror box system for use during functional magnetic resonance imaging. Brain Research, 2015: 1594: 173–182
- Giraux P, Sirigu A. Illusory movements of the paralyzed limb restore motor cortex activity. Neuroimage, 2003; 20: S107-S111
- MacIver K, Lloyd DM, Kelly S, Roberts N, Nurmikko T. Phantom limb pain, cortical reorganization and the therapeutic effect of mental imagery. Brain, 2008; 131 (8): 2181–2191
- MacLachlan M, McDonald D, Waloch J. Mirror treatment of lower limb phantom pain: a case study. Disability and Rehabilitation, 2004; 26 (14–15): 901–904
- Ramachandran VS, Altschuler EL. The use of visual feedback, in particular mirror visual feedback, in restoring brain function. Brain, 2009; 132 (7): 1693–1710
- Foell J, Bekrater-Bodmann R, Diers M, Flor H. Mirror therapy for phantom limb pain: Brain changes and the role of body representation. European Journal of Pain, 2014; 18 (5): 729–739
- Moseley GL, Gallace A, Spence C. Is mirror therapy all it is cracked up to be? Current evidence and future directions. Pain, 2008; 138 (1): 7–10
- Weiss T, Walter K, Spohn D, Richter M, Torma F, Miltner WHR. Spatial discrimination learning of electrocutaneous stimuli. Neuroscience Letters, 2007; 427 (2): 83–87
- Walter-Walsh K, Weiss T, Spohn D, Torma F, Miltner WHR. Spatial discrimination learning of electrocutaneous stimuli is influenced by the type of stimulation. Brain Research, 2009: 1281: 47–57
- Flor H, Denke C, Schaefer M, Grüsser S. Effect of sensory discrimination training on cortical reorganisation and phantom limb pain. Lancet, 2001; 357 (9270): 1763–1764
- Dietrich C, Walter-Walsh K, Preißler S, Hofmann GO, Witte OW, Miltner WHR, Weiss T. Sensory feedback prosthesis reduces phantom limb pain: Proof of a principle. Neuroscience Letters, 2012; 507 (2): 97–100
- Weiss T, Dietrich C, Preißler S, Möbius H, Gube H, Torma F, Miltner WHR, Hofmann GO. Nutzung einer myoelektrischen Unterarmprothese mit Biofeedback. Reduktion von Phantomschmerz und Erhöhung der Funktionalität. Trauma und Berufskrankheit, 2013; 15 (3): 207–215