1 Klinik und Poliklinik für Dermatologie, Venerologie und Allergologie, Universitätsklinikum Essen
2 Klinik für Gefäßchirurgie und Gefäßmedizin,Schwarzwald-Baar Klinikum, Villingen-Schwenningen
3 Klinik für Dermatologie, Universitätsspital Zürich sowie Dermatologisches Zentrum Zürich, Schweiz
4 Steinhäusl 126, 3033 Altlengbach, Österreich
5 Klinik für Dermatologie, Venerologie und Allergologie und Venenzentrum der Dermatologischen und Gefäßchirurgischen Kliniken, Kliniken der Ruhr-Universität Bochum
Einleitung
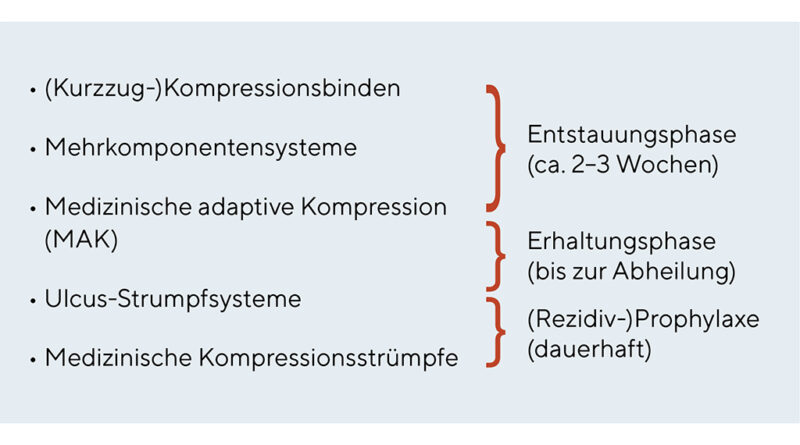
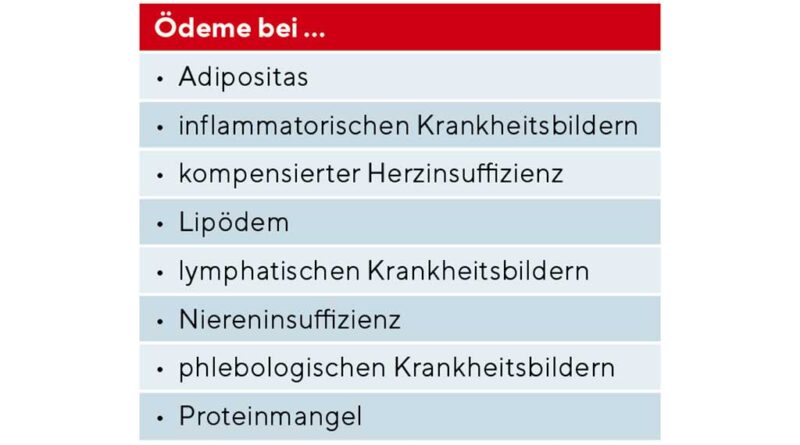
Die Kompressionstherapie ist seit vielen Jahrzehnten eine wichtige und nebenwirkungsarme Säule der konservativen Therapie vieler Patienten mit chronischen Wunden und Ödemen der unteren Extremitäten [1]. Die wissenschaftlich belegte Evidenz ist für keinen anderen Bereich der Wundbehandlung so gut wie für die Kompressionstherapie des Ulcus cruris venosum [2–4]. Neben den Patienten mit chronischer venöser Insuffizienz (CVI) ist die Kompressionstherapie aber nahezu bei allen Patienten mit Wunden und Ödemen indiziert (Tab. 1) [5, 6]. Somit kann man für die zentralen Aspekte des Einsatzes der Kompressionstherapie in der Wundbehandlung zusammenfassend zwei wesentliche Indikationen differenzieren [7], für die dann unterschiedliche Behandlungsoptionen möglich sind (Abb. 1). Einerseits ist es die Verbesserung der Hämodynamik: Für eine Einengung der Venen im Stehen und Gehen werden höhere Druckwerte von mindestens 40 mmHg benötigt. Anderseits die Ödemreduktion. Hier kann eine ausreichende Wirkung auch schon mit niedrigen Ruhedruckwerten um 20 mmHg erzielt werden.
In der täglichen Praxis erhalten allerdings sehr viele Patienten mit chronischen Wunden und Ödemen keine Kompressionstherapie [8]. Einer der Gründe hierfür ist die Angst der Anwender, eine Kompressionstherapie zu verordnen, weil diese eventuell kontraindiziert sein und somit dem Patienten schaden könnte. In den letzten Jahren gibt es zunehmend Erkenntnisse aus klinischen Studien, die belegen, dass bei einer Reihe von Krankheitsbildern, die früher als Kontraindikationen galten, diese Befürchtung unbegründet ist. Bei einigen dieser Krankheitsbilder kann heute sogar eine Empfehlung für die Kompressionstherapie ausgesprochen werden [5].
Es war somit das Ziel dieser Expertengruppe, die heute propagierten Kontraindikationen der Kompressionstherapie kritisch zu hinterfragen und in dieser Übersichtsarbeit zu diskutieren.
Kontraindikationen der Kompressionstherapie
Eine sehr gute erste Orientierung hinsichtlich der Kontraindikationen der Kompressionstherapie stellt die aktuelle S2k-Leitlinie der Deutschen Gesellschaft für Phlebologie und Lymphologie (DGPL) mit dem Titel „Medizinische Kompressionstherapie der Extremitäten mit medizinischem Kompressionsstrumpf (MKS), phlebologischem Kompressionsverband (PKV) und medizinischen adaptiven Kompressionssystemen (MAK)“ dar [9]. Hier sind folgende Kontraindikationen aufgeführt:
- Fortgeschrittene periphere arterielle Verschlusskrankheit
- Dekompensierte Herzinsuffizienz
- Phlegmasia coerulea dolens
- Septische Phlebitis
Fortgeschrittene periphere arterielle Verschlusskrankheit
Die periphere arterielle Verschlusskrankheit (PAVK) bezeichnet eine Einschränkung der Durchblutung der die Extremitäten versorgenden Arterien. Dies kann graduell durch Stenosen oder komplett durch Okklusion verursacht werden. Eine fortgeschrittene PAVK wird auch als „kritische Ischämie“ bezeichnet und liegt vor, wenn mindestens einer der folgenden Parameter gemessen wurde [9]:
- ABI < 0,5
- Knöchelarteriendruck < 60 mmHg
- Zehendruck < 30 mmHg
- TcP02 < 20 mmHg Fußrücken
(ABI: Ankle-Brachial-Index; TcP02: Transkutane Sauerstoffpartialdruckmessung)
Bei dem Vorliegen von einem dieser Befunde ist der Patient einem entsprechend versierten Zentrum mit der Frage nach einer Revaskularisation vorzustellen. Gut tastbare Fußpulse sprechen zwar gegen eine fortgeschrittene PAVK, sind aber nicht beweisend. Vor der ersten Anlage einer Kompressionstherapie sollte daher möglichst auch eine apparative Untersuchung mit Bestimmung des Ankle-Brachial-Index (ABI, synonym auch als ABPI [Ankle-Brachial-Pressure-Index] oder KADI [Knöchel-Arm-Druck-Index] bezeichnet) erfolgen [1]. Alternativ sind einfache Methoden zur Überprüfung der arteriellen Perfusion vor geplanter Kompressionstherapie auch der Buergers Test und der Pole Test [10].
In der DGPL-Leitlinie wird zudem darauf hingewiesen, dass bei Verwendung unelastischer Materialien eine Kompressionsversorgung noch bei einem absoluten Knöchelarteriendruck zwischen 50 und 60 mmHg unter engmaschiger klinischer Kontrolle durchgeführt werden kann [9]. Hier können dann Kurzzugmaterialien mit einem Anfangsdruck bis maximal 40 mmHg eingesetzt werden [11]. Eine weitere Alternative für diese Patienten sind Mehrkomponentensysteme, die meist auch mit geringeren Druckwerten um 20 mmHg erhältlich sind [12]. Viele Firmen bezeichnen diese Systeme als „Lite“-Version. Auch einige der neuen adaptiven Kompressionsbandagen können durch die gezielte Einstellung über Klettverschlüsse unterhalb der gemessenen arteriellen Druckwerte individuell angepasst werden [12]. Mit den verschiedenen Kompressionssystemen können heute somit die meisten Patienten (mit Ulcus cruris mixtum) nach Ausschluss einer fortgeschrittenen PAVK mit einer adäquaten Kompressionstherapie behandelt werden [11, 13].
Dekompensierte Herzinsuffizienz
Als Herzinsuffizienz wird entsprechend der WHO-Definition die verminderte körperliche Belastbarkeit aufgrund einer ventrikulären Funktionsstörung bezeichnet. Die häufigsten Ursachen hierfür sind eine koronare Herzkrankheit (KHK), arterielle Hypertonie und Vorhofflimmern. Erste einfach zu erkennende klinische Zeichen einer Herzinsuffizenz sind beispielsweise Dyspnoe, Lethargie, trockener Husten und Nykturie. Wenn diese Symptome vorliegen, sollten die Patienten möglichst kardiologisch vorgestellt werden. Die Einteilung der Herzinsuffizienz erfolgt dann entsprechend der Klassifikation der New York Heart Association (NYHA) in die Stadien I–IV. Als dekompensierte Herzinsuffizienz, die eine Kontraindikation der Kompressionstherapie darstellt, werden die NYHA-Stadien III und IV bezeichnet [14].
- NYHA III: Höhergradige Einschränkung der körperlichen Leistungsfähigkeit bei gewohnter Tätigkeit. Keine Beschwerden in Ruhe. Geringe körperliche Belastung verursacht Erschöpfung, Rhythmusstörungen, Luftnot oder Angina pectoris.
- NYHA IV: Beschwerden bei allen körperlichen Aktivitäten und in Ruhe. Bettlägerigkeit.
Durch die Kompressionstherapie kommt es zu einer zusätzlichen Mobilisation von Flüssigkeiten aus der Peripherie. Dies kann bei Patienten mit dekompensierter Herzinsuffizienz zu einer Verschlechterung der klinischen Situation mit dem Auftreten von beispielsweise Lungenödemen bis hin zu einem kardialen Schock führen.
Bei dem Großteil der meist älteren Patienten mit Ödemen der unteren Extremitäten liegt jedoch eine Herzinsuffizienz in den NYHA-Stadien I oder II vor. Hier stellt die Kompressionstherapie keine Kontraindikation dar. In der Praxis sind meist folgende Aspekte hilfreich: Patienten, die zwei Stockwerke Treppen steigen können, und Patienten mit einem Ruhepuls unter 100 haben in der Regel keine dekompensierte Herzinsuffizienz und können mit einer Kompressionstherapie behandelt werden [15]. Im Allgemeinen ist bei kardialen Ödemen zu empfehlen, die Kompressionstherapie mit leichteren Drücken zu beginnen. Bei Verschlechterung der klinischen Symptome, wie z. B. Dyspnoe, sollte die Kompressionstherapie sofort beendet werden.
Phlegmasia coerulea dolens
Die Phlegmasia coerulea dolens ist eine sehr selten auftretende, schwerste Verlaufsform der Venenthrombose. Hierbei kommt es perakut durch Störungen der Mikrozirkulation zu dem Verschluss aller Venen einer Extremität. Durch die Abflussstörung resultieren massive Ödeme, so dass der Gewebedruck stark ansteigt. In der Folge kann es zu einer vollständigen Unterbrechung der arteriellen Versorgung kommen. Die Betroffenen haben sehr ausgeprägte Schmerzen. In dieser potentiell lebensbedrohlichen Situation ist die Kompressionstherapie der zyanotischen Extremität strikt kontraindiziert. Vielmehr muss rasch eine Thrombektomie ggf. kombiniert mit einer Fasziotomie und Antikoagulation durchgeführt werden.
Septische Phlebitis
Die septische Phlebitis ist gekennzeichnet durch die Trias venöse Thrombose, Inflammation und Bakteriämie. Die septische Phlebitis nach intravenösen Kathetern gilt als selten, viel häufiger finden sich mechanisch oder chemisch induzierte Phlebitiden [16]. Der klinische Verlauf und die Ausprägung sind sehr variabel. Viele Patienten zeigen einen gutartigen Verlauf, der nach relativ minimaler Therapie rasch abheilt. Seltener kann es zu schwereren systemischen Infektionen bis hin zum Schock kommen. Wesentliche Bausteine der Therapie sind die Sanierung des Infektfokus, wie beispielsweise die Entfernung einer intravenösen Kanüle, sowie die systemische Gabe von Antibiotika. Bei sehr ausgeprägten Befunden muss über eine chirurgische Intervention und/oder eine Antikoagulation nachgedacht werden [17]. Es gibt keine systematischen Untersuchungen zu der Frage der Antikoagulation bei septischer Phlebitis. In Analogie zur Oberflächenthrombose der Beine kann bei größerem Kaliber der betroffenen Vene eine Antikoagulation in Prophylaxedosierung und bei einer Annäherung des Thrombus an die tiefen Venen auf weniger als 3 cm eine Antikoagulation in therapeutischer Dosierung empfohlen werden. Differenziert werden muss die chemisch oder mechanisch induzierte Phlebitis nach intravenösen Kathetern von der septischen Phlebitis, die sich durch ein gestörtes Allgemeinbefinden mit Fieber und eine positive Blutkultur unterscheiden lässt. Eine Thrombophlebitis nach intravenösem Katheter ohne Fieber, Störung des Allgemeinbefindens und ohne positive Blutkultur ist keine septische Phlebitis und sollte daher mit Kompressionstherapie behandelt werden. Anders als bei anderen oberflächlichen Thrombosen gilt bei der septischen Phlebitis traditionell die Kompressionstherapie als kontraindiziert. Nach Kenntnis der Autoren gibt es keine Publikation zu den Folgen einer Kompressionstherapie bei septischer Phlebitis. Vor diesem Hintergrund kann kritisch diskutiert werden, ob die septische Phlebitis tatsächlich eine Kontraindikation für die Kompressionstherapie darstellt.
Krankheitsbilder mit besonderen Risiken
In vielen Leitlinien und Expertenempfehlungen gab es die sehr unglücklich gewählte Bezeichnung der relativen Kontraindikationen [18]. In der aktuellen Version der DGPL-Leitlinie wird bewusst auf diesen Begriff verzichtet. Stattdessen wird auf Krankheitsbilder mit besonderen Risiken hingewiesen. In diesen Fällen sollte die Therapieentscheidung unter Abwägen von Nutzen und Risiko sowie der Auswahl des am besten geeigneten Kompressionsmittels getroffen werden [9].
Konkret benannt werden folgende Risiken:
- Ausgeprägte nässende Dermatosen
- Unverträglichkeit auf Kompressionsmaterial
- Fortgeschrittene periphere Neuropathie
- Schwere Sensibilitätsstörungen der Extremität
- Primär chronische Polyarthritis
Ausgeprägte nässende Dermatosen
Bei ausgeprägten nässenden Dermatosen gilt es, zuerst die Ursache(n) der Hautveränderungen zu klären. Bei Patienten mit beispielsweise CVI ist es häufig eine Stauungsdermatitis, die zu nässenden Ekzemen führen kann. Da sich das An- und Ausziehen ebenso wie die Körperhygiene mit durchnässten Kompressionsmaterialien schwierig gestaltet und die Gefahr der bakteriellen Superinfektion besteht, sollte das Ekzem auch topisch behandelt werden. Meist kommen hier hochpotente Glukokortikoide in einer feuchten Galenik wie beispielsweise eine Betamethason-Lotion für einige wenige Tage zum Einsatz [19]. Alternativ kommt es auch unter Zinkleimverbänden bei mobilen Patienten meist zu einer guten Ödemreduktion und einem raschen Abtrocknen der nässenden Veränderungen.
In der Leitlinie der DGPL findet sich bei den Indikationen der Kompressionstherapie der Hinweis auf „entzündliche Dermatosen der Beine“. Bei solchen Krankheitsbildern ist somit die Kompressionstherapie, eingebunden in ein Gesamtkonzept, mittelfristig ein wichtiger Aspekt der Behandlung.
Unverträglichkeit auf Kompressionsmaterial
Viele Patienten beschreiben subjektive Unverträglichkeiten der Haut wie beispielsweise Juckreiz und Schuppung, die durch die Kompressionstherapie verursacht oder verstärkt werden. Oft liegt hier eine Verschlechterung der vorbestehenden trockenen Haut zugrunde, die durch adäquate Hautpflege beispielsweise mit harnstoffhaltigen Externa wie beispielsweise 5 % Urea in DAC-Basissalbe verhindert werden kann [19].
Wichtig ist es hier, allergische Reaktionen diagnostisch abzugrenzen. In dem Kapitel „Verträglichkeit“ der DGPL-Leitlinie wird darauf hingewiesen, dass eine Allergie in Form einer Urtikaria oder eines allergischen Kontaktekzems auf die eingesetzten Kompressionsmaterialien extrem selten ist. Häufiger kann eine Allergie auf Latex oder Gummi vorkommen, die aber bei modernen Kompressionsmaterialien, mit wenigen Ausnahmen, nicht mehr gebräuchlich sind [20]. Bei dem klinischen Verdacht auf Kontaktallergie sollte eine Epikutantestung durchgeführt werden, um die vermuteten Allergene durch einen Hauttest zu objektivieren [9].
Fortgeschrittene periphere Neuropathie, z. B. bei Menschen mit Diabetes
Auch bei Patienten mit fortgeschrittener peripherer Neuropathie ist eine sachgerecht angelegte Kompressionstherapie grundsätzlich möglich. Allerdings führt die Neuropathie dazu, dass Patienten eine zu kräftige Kompression bzw. zu enge oder schlecht sitzende Materialien nicht spüren. So kann es durch die fehlende Rückmeldung über Schmerzen bei diesen Patienten bei nicht korrekter Anlage gehäuft zu Druckstellen oder Schnürfurchen kommen.
Schwere Sensibilitätsstörungen der Extremität
Hier gelten die gleichen Aspekte wie bei den Patienten mit fortgeschrittener peripherer Neuropathie. Bei den Risiken und Nebenwirkungen der Kompressionstherapie wird in der Leitlinie der DGPL u. a. darauf hingewiesen, dass es durch unsachgemäßes Bandagieren zu Schmerzen und Druckschäden kommen kann. Bei schweren Sensibilitätsstörungen der Extremitäten fehlt diese Warnfunktion des Körpers. Somit ist die regelmäßige klinische Inspektion der Haut hier besonders wichtig.
Primär chronische Polyarthritis
Die primär chronische Polyarthritis wird heute synonym meist als rheumatoide Arthritis bezeichnet. Sie ist die häufigste und schwerste Erkrankung aus der Gruppe der entzündlich-rheumatischen Systemerkrankungen. Etwa zwei Drittel der Betroffenen sind Frauen. Die Patienten berichten insbesondere morgens über Schwellung und Überwärmung der Gelenke sowie über Schmerzen in diesen. Begleitend kommt es oft zu einer Synovitis. Auch bei Patienten mit primär chronischer Polyarthritis ist die Kompressionstherapie nicht kontraindiziert. Die Patienten können allerdings aufgrund von Gelenkschmerzen und/oder Fehlstellungen die Materialien häufig nicht selbstständig an- oder ausziehen. Oft gelingt dies besser, wenn die Patienten entsprechende An- und Ausziehhilfen nutzen [1]. Wenn die Patienten Analgetika einnehmen, kann es zudem sein, dass sie Schmerzen durch Fehlanwendungen der Kompression nicht oder erst spät bemerken.
Diskussion
In einer aktuellen Übersichtsarbeit wurden noch weitere Kontraindikationen der Kompressionstherapie aus verschiedenen internationalen Leitlinien und Expertenempfehlungen zusammengetragen, von denen einige hier exemplarisch diskutiert werden [18].
Diabetes mellitus
Im Rahmen eines diabetischen Fußsyndroms (DFS) kommt es häufig zu teils sehr ausgeprägten Ödemen im Fußbereich. Zudem können Menschen mit Diabetes auch gehäuft andere Ursachen für Ödeme und somit Indikationen für eine Kompressionstherapie haben. Das Vorhandensein eines Diabetes mellitus stellt per se keine Kontraindikation der Kompressionstherapie dar [21]. Allerdings können Patienten mit Diabetes mellitus im Laufe der Erkrankung gehäuft eine PAVK und eine periphere Neuropathie mit Sensibilitätsstörungen der Extremitäten entwickeln [22]. Bei dem Vorliegen dieser Komorbiditäten gelten bei der Durchführung einer Kompressionstherapie die zuvor beschriebenen Aspekte [23].
Thrombosen
In der aktuellen DGPL-Leitlinie werden ebenso wie in den gängigen aktuellen Lehrbüchern thromboembolische Venenkrankheiten bei den Indikationen der Kompressionstherapie explizit aufgeführt. Konkret benannt werden hier oberflächliche Venenthrombosen, tiefe Beinvenenthrombosen, Armvenenthrombosen, Zustand nach Thrombosen, postthrombotisches Syndrom und Thromboseprophylaxe bei mobilen Patienten [9]. Die Kompressionstherapie ist heute, ggf. in Verbindung mit einer rheologischen Antikoagulantien-Therapie, für die Behandlung von Thrombosen der Goldstandard.
Akute Infektionskrankheiten
Die Kompressionstherapie wurde bislang in den akuten Phasen von Infektionskrankheiten wie beispielsweise dem Erysipel nicht empfohlen. Hintergrund ist die Befürchtung der Therapeuten, die Erreger systemisch zu verschleppen, so dass es zu einer Sepsis kommen könnte. Klinische Studien oder Fallberichtserien, die diese Komplikation bestätigen, gibt es nicht. Es entspricht aber einem aktuellen Konsens, die Kompressionstherapie bei Patienten mit akutem Erysipel erst nach dem Abklingen der Akutphase und der Mobilisation der Patienten einzusetzen [1]. In der praktischen Erfahrung der Autoren kann die Kompressionstherapie bei vielen akuten Infektionskrankheiten bereits von Beginn an erfolgreich eingesetzt werden und die Rückbildung von Schmerzen und Ödemen unterstützen. Hierfür werden initial oft Systeme mit niedrigeren Ruhedruckwerten um 20 mmHg eingesetzt [12].
Inflammatorische Krankheitsbilder
Sinnvoll für die Unterstützung des Heilungsprozesses ist eine Kompressionstherapie auch bei Patienten mit Vaskulitis oder Vaskulopathien, Necrobiosis lipoidica und anderen inflammatorischen Krankheitsbildern, bei denen es begleitend zu Ödemen der Extremitäten oder zumindest zu Wundrandödemen kommt. Bei der Livedovaskulopathie treten zudem thrombotische Verschlüsse dermaler Gefäße auf. Daher wird hier die Kompressionstherapie nicht nur für die Unterstützung der Abheilung, sondern auch für die Rezidivprophylaxe empfohlen [1, 12].
Weitere Aspekte
In der Leitlinie der DGPL wird zudem darauf hingewiesen, dass die Kompressionsversorgung sofort zu entfernen ist, wenn eines der folgenden Symptome vorliegt [9]:
- Blau- oder Weißfärbung der Zehen
- Missempfindungen und Taubheitsgefühle
- Zunehmende Schmerzen
- Kurzatmigkeit und Schweißausbrüche
- Akute Bewegungseinschränkungen
Um diese Komplikationen erfassen zu können, sollten Patienten mit Kompressionstherapie über die Risiken und Symptome aufgeklärt und in regelmäßigen Intervallen klinisch gesehen werden.
Fazit für die Praxis
Die wichtigste konservative Behandlungsmaßnahme bei Patienten mit chronischen Wunden und Ödemen ist die Kompressionstherapie. Es zeigt sich unter Berücksichtigung der Literatur und den langjährigen Erfahrungen einer Expertengruppe, dass ein großer Teil der in der Vergangenheit aufgeführten Kontraindikationen der Kompressionstherapie auf der Basis der aktuell verfügbaren Literatur und der klinischen Expertise aus heutiger Sicht nicht gerechtfertigt ist. Für die tägliche Praxis kommt bei Patienten mit chronischen Wunden dem Ausschluss der fortgeschrittenen PAVK („kritische Ischämie“) sicher die größte Bedeutung zu.
Nach Ausschluss der Kontraindikationen stehen dann für die praktische Durchführung der Kompressionstherapie bei Patienten mit chronischen Wunden heute viele verschiedene Systeme zur Verfügung, so dass individuelle Faktoren, Vorlieben und wirtschaftliche Aspekte bei der Auswahl oft berücksichtigt werden können.
Begutachteter Beitrag/reviewed paper
Hinweis:
Dieser Beitrag erschien bereits in ähnlicher Form unter demselben Titel in der Zeitschrift Wundmanagement, 2020; 14 (1): 65–70.
Für die Autoren:
Prof. Dr. med. Joachim Dissemond
Universitätsklinikum Essen
Klinik und Poliklinik für Dermatologie, Venerologie und Allergologie
Hufelandstr. 55
45147 Essen
Tel.: 0201–723-3894
joachim.dissemond@uk-essen.de
Dissemond J et al. Was sind heute noch Kontraindikationen der Kompressionstherapie? Orthopädie Technik, 2026; 77 (1): 30–35
Tabellen/Abbildungen:
Quellenverzeichnis
[1] Dissemond J et al. Compression therapy in patients with venous leg ulcers. Journal der Deutschen Dermatologischen Gesellschaft, 2016; 14 (11): 1072–1087
[2] Nelson EA, Bell-Syer SE. Compression for preventing recurrence of venous ulcers. Cochrane Database of Systematic Reviews, 2014; (9): CD002303
[3] Neumann HAM et al. Evidence-based (S3) guidelines for diagnostics and treatment of venous leg ulcers. Journal of the European Academy of Dermatology and Venereology, 2016; 30 (11): 1843–1875
[4] O’Meara S, Cullum N, Nelson EA, Dumville JC. Compression for venous leg ulcers. Cochrane Database of Systematic Reviews, 2012; 11 (11): CD000265
[5] Dissemond J, Storck M, Kröger K, Stücker M. Indikationen und Kontraindikationen der modernen Kompressionstherapie. Wiener Medizinische Wochenschrift, 2018; 168: 228–235
[6] Rabe E et al. Indications for medical compression stockings in venous and lymphatic disorders: an evidence-based consensus statement. Phlebology, 2018; 33 (3): 163–184
[7] Partsch H et al. Bedeutung des adäquaten Drucks in der Kompressionstherapie. Basis der erfolgreichen Behandlung. Der Hautarzt, 2019; 70 (1): 704–714
[8] Heyer K, Protz K, Augustin M. Compression therapy – cross-sectional observational survey about knowledge and practical treatment of specialised and non-specialised nurses and therapists. International Wound Journal, 2017; 14 (6): 1148–1153
[9] Rabe E et al. Medizinische Kompressionstherapie der Extremitäten mit Medizinischem Kompressionsstrumpf (MKS), Phlebologischem Kompressionsverband (PKV) und Medizinischen adaptiven Kompressionssystemen (MAK). AWMF S2k-Leitlinie der DGP, 2018
[10] Eder S et al. Buergers Test und Pole Test: Einfache Methoden zur Überprüfung der arteriellen Perfusion vor geplanter Kompressionstherapie. Phlebologie, 2020; 49 (2): 108–110
[11] Mosti G, Labichella ML, Partsch H. Compression therapy in mixed ulcers increases venous output and arterial perfusion. Journal of Vascular Surgery, 2012; 55 (1): 122–128
[12] Dissemond J et al. Kompressionstherapie des Ulcus cruris venosum in der Phase der Entstauung. Medizinische Klinik – Intensivmedizin und Notfallmedizin, 2018; 113: 552–559
[13] Stansal A et al. Supervised short-stretch compression therapy in mixed leg ulcers. Journal of Medical Vascular, 2018; 43 (4): 225–230
[14] Butrous H, Hummel SL. Heart failure in older adults. Canadian Journal of Cardiology, 2016; 32 (9): 1140–1147
[15] Reich-Schupke S, Murmann F, Altmeyer P, Stücker M. Compression therapy in elderly and overweight patients. Vasa, 2012; 41 (2): 125–131
[16] van der Sar van der Brugge S, Posthuma EFM. Peripheral intravenous catheter-related phlebitis. Nederlands Tijdschrift voor Geneeskunde, 2011; 155 (40): 3548
[17] Baker CC, Petersen SR, Sheldon GF. Septic phlebitis: a neglected disease. American Journal of Surgery, 1979; 138 (1): 97–103
[18] Andriessen A et al. Compression therapy for venous leg ulcers: risk factors for adverse events and complications, contraindications – a review of present guidelines. Journal of the European Academy of Dermatology and Venereology, 2017; 31 (9): 1562–1568. doi 10.1111/jdv.14390
[19] Stücker M et al. Kompressionstherapie und Hautpflege. Wundmanagement, 2018; 12 (6): 322–324
[20] Mizuno J, In-Nami H. Allergic contact dermatitis to synthetic rubber, neoprene in compression stockings. Masui – The Japanese journal of anesthesiology, 2011; 60 (1): 104–106
[21] Ladwig A et al. Compression therapy of leg ulcers with PAOD. Phlebology, 2014; 29 (1): 7–12
[22] Hoe J et al. Predictors of decrease in ankle-brachial index among patients with diabetes mellitus. Diabetic Medicine, 2012; 29 (9): 304–307
[23] Wu SC et al. Safety and efficacy of mild compression (18–25 mmHg) therapy in patients with diabetes and lower extremity edema. Journal of Diabetes Science and Technology, 2012; 6 (3): 641–647
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- iOrt – Entwicklung einer überwachenden Orthese mit neuartigem optischen Sensorsystem — 11. Februar 2026