Einleitung
Ein anerkanntes Verfahren in der motorischen Neurorehabilitation von Schlaganfallpatienten ist die Funktionelle Elektrostimulation (FES), bei der Bewegungen der betroffenen Extremitäten durch gezielte künstliche Aktivierung gelähmter Muskel generiert werden 1. Mittels elektrischer Reize können in den motorischen (efferenten) Nerven Aktionspotenziale erzeugt werden und so Kontraktionen der gelähmten Muskulatur herbeigeführt werden. Alternativ zur Reizung motorischer Nerven können auch in sensorischen (afferenten) Nerven Aktionspotenziale induziert werden, die zur Auslösung und zur Modulation von Reflexen, meist auf spinaler Ebene (Rückenmark), führen 2. Das Applizieren der elektrischen Reize erfolgt in der Regel über mehrmals wiederverwendbare Hydrogel-Klebeelektroden.
Neben der reinen Erzeugung der Bewegungen stellt die FES dem zentralen Nervensystem intensive Bewegungsreize zur Verfügung. Dies kann das Wiedererlernen der verlorengegangenen motorischen Funktionen beschleunigen.
Erfolgt die Stimulation synchron zur Bewegungsintention des Patienten, so kann die Beeinflussung der neuronalen Plastizität des Gehirns aufgrund der propriozeptiven und somatosensiblen Rückmeldung der künstlich verstärkten Muskelanspannung sogar noch verstärkt werden 3. Dieses Prinzip macht sich die EMG-gesteuerte funktionelle Elektrostimulation zunutze (für eine Übersicht siehe 4). Die schwachen willentlichen Muskelkontraktionen werden über eine Elektromyographie (EMG)-Messung erfasst. Hierfür können die gleichen Elektroden wie für die Stimulation verwendet werden, da nur wechselweise und nicht gleichzeitig gemessen und stimuliert wird. Überschreitet die Muskeleigenaktivität ein zuvor definiertes Maß, so wird ein fest vorgegebenes Stimulationsprofil angewandt. Während der aktivierten Stimulation erfolgt keine weitere Überwachung des Stimulationseffekts oder der Patientenaktivität.
Durch die wesentlich aufwändigere Messung und Auswertung des EMG auch zwischen den Stimulationsimpulsen lassen sich vielfältige Aussagen über die momentane Muskelaktivierung treffen. So können die individuellen Anteile der Muskelkontraktion, die durch Elektrostimulation und durch natürliche Vorgänge hervorgerufen wurden, bestimmt werden. Zu letzteren zählen die willentliche Aktivierung des Muskels sowie Muskelaktivitäten, die auf Reflexe/Spastiken zurückzuführen sind.
Dieser Beitrag beschreibt zunächst die technischen Voraussetzungen zur Erfassung des EMG während der Stimulation sowie die notwendige Signalverarbeitung. Anschließend werden drei mögliche EMG-Anwendungen in der FES vorgestellt:
- Die Unterstützung schwacher willentlicher Muskelkontraktionen durch eine EMG-geregelte Stimulation,
- die Verbesserung der Regulierung des Stimulationseffekts (Regelung des Betrags der durch FES rekrutierten motorischen Einheiten λ) und
- die Beobachtung natürlicher Muskelaktivitäten/der Motorkoordination während der FES am Beispiel des FES-Fahrradfahrens.
Erfassung und Auswertung des Elektromyogramms
Eine EMG-Messung und Auswertung während aktiver Elektrostimulation mithilfe von Oberflächenelektroden ist nicht trivial 5. So werden die EMG-Signale und die Messtechnik durch die Stimulationsimpulse stark gestört. Da EMG-Signale in der Amplitude sehr klein sind (im Bereich von einigen hundert μV), bildet die Verstärkung durch Instrumentenverstärker eine Möglichkeit zur Erfassung. Durch die Stimulationsimpulse kann der Verstärker jedoch in die Sättigung gehen (für eine relativ zur Stimulationsperiode lange Zeit funktionsunfähig sein) oder sogar zerstört werden. Aus diesem Grund müssen EMG-Verstärker für den Einsatz bei der FES spezielle Voraussetzungen erfüllen. So ist es üblich, den Verstärker automatisch während des Stimulationsimpulses durch geeignete Schaltungstechnik kurzzeitig von den Messelektroden zu trennen 6 7 8 9 10 oder es werden Verstärker mit Überspannungsschutz verwendet, die durch spezielle Maßnahmen nur sehr kurz in der Sättigung verweilen 11 12 13.
In den letzten Jahren haben sich, alternativ zu den klassischen EMG-Verstärkern mit hoher Verstärkung, Messsysteme mit hochauflösendem AD-Wandler (21…24 Bit) in der EMG-Messung durchgesetzt. Anstatt zu verstärken, wird in die Signale quasi digital hinein gezoomt. EMG-Messsysteme mit dieser Technologie sind weniger anfällig in Bezug auf Stimulationsartefakte, wenn sie mit einem entsprechenden Überspannungsschutz versehen sind.
Nach der Applikation jedes Stimulationsimpulses kann (auch bei biphasischer Impulsform) zwischen den beiden Messelektroden eine asymmetrische Ladung verbleiben. Der dadurch hervorgerufene Entladungsprozess erzeugt einen weiteren Messartefakt. Dieser vergrößert sich, wenn das EMG direkt von den Stimulationselektroden gemessen wird, da diese wesentlich größer sind als normale EMG-Elektroden. Aus diesem Grund verwenden die meisten in der Forschung eingesetzten Systeme bisher verschiedene Elektroden für Stimulation und EMG-Messung.
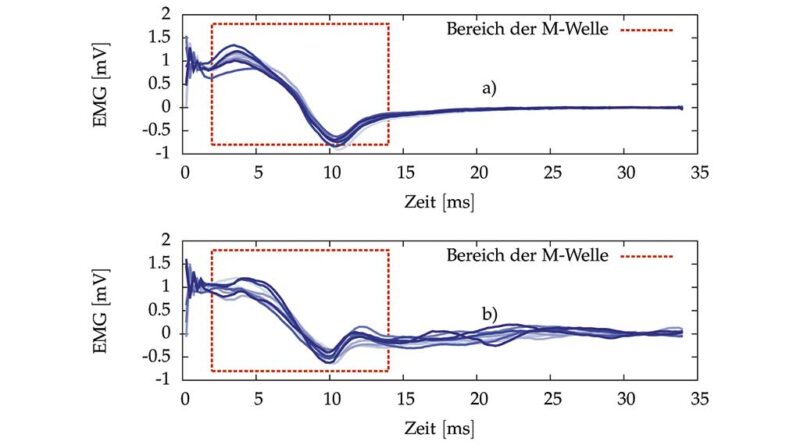
Das eigentliche EMG-Signal setzt sich aus zwei Anteilen zusammen (siehe Abb. 1 und die Arbeiten von Merletti et al. 14 15):
Der erste Anteil steht in Bezug zu der Muskelkontraktion, die durch die Stimulation hervorgerufen wird. Die synchrone Aktivierung vieler motorischer Einheiten durch einen Stimulationsimpuls führt im EMG zur sogenannten M‑Welle (Überlagerung vieler Aktionspotenziale). Die Amplitude dieser Welle liegt dabei im Bereich von einigen mV. Die M‑Welle ist das Ergebnis der direkten Reizung des motorischen Nervs und startet 3 bis 6 ms nach dem Stimulus. Nach etwa 20 ms ist die M‑Welle nahezu abgeklungen.
Die Amplitude (λ) der M‑Welle kann als Maß für die Anzahl der durch Stimulation rekrutierten motorischen Einheiten verwendet werden. Das Frequenzspektrum der M‑Welle sowie die Dauer des Zeitintervalls zwischen Stimulus und Maximum der M‑Welle geben ferner Aufschluss über den Grad der muskulären Ermüdung 16.
Der zweite Anteil des EMG stammt von Muskelaktivitäten, die der Mensch ohne die Elektrostimulation erzeugt hat. Solche Kontraktionen können willentlich oder unwillentlich durch Reflexe, Spastiken oder einen erhöhten Muskeltonus generiert werden. Man spricht bei diesem zweiten EMG-Anteil oftmals von Willkür-EMG, obwohl dies offensichtlich nicht ganz korrekt ist. Die korrektere Bezeichnung wäre „nicht durch FES-induziertes EMG“. Da bei der physiologischen Muskelaktivierung die motorischen Einheiten asynchron aktiviert werden, findet keine synchrone Überlagerung der Aktionspotenziale statt. Das resultierende Willkür-EMG ist daher ein stochastisches Signal, dessen Rauschamplitude im μV-Bereich nahezu proportional zur Kontraktionsstärke ist (unter isometrischen Bedingungen, das heißt, bei konstanter Muskellänge). Das Willkür-EMG hat im Frequenzspektrum seine Hauptanteile im Frequenzband von 30 bis 300 Hz und eine Spitze bei ca. 120 Hz 17.
In der Regel ist man daran interessiert, den Willkür-EMG-Anteil aus dem gemessenen EMG-Signal zu extrahieren. Ungefähr 20 bis 30 ms nach einem Stimulationsimpuls verbleiben von der M‑Welle und vom Entladungsvorgang nur noch niederfrequente Anteile im EMG-Signal. Diese Artefakte (bezüglich des Willkür-EMG) lassen sich durch die Anwendung eines Hochpassfilters mit einer Grenzfrequenz von 100 bis 330 Hz erfolgreich eliminieren 18 19 20 21 22. Durch die Anwendung eines solchen Filters gehen jedoch auch die niederfrequenten Anteile im Willkür-EMG verloren. In dem resultierenden Signal werden Perioden mit Artefakten und Filtertransienten zu Null gesetzt (blanked). Die Blanking-Periode startet üblicherweise kurz vor Beginn des Stimulationsimpulses und endet 20 bis 30 ms nach dem Stimulationsimpuls. Bei einer Stimulationsperiode von 50 ms (Frequenz: 20 Hz) erhält man somit 20 bis 30 ms verwertbares Willkür-EMG. Das entsprechende EMG-Signal kann anschließend klassisch weiterverarbeitet werden, indem man eine Gleichrichtung und Integration (realisiert als Tiefpass-Filter) anwendet.
Ist das EMG-Signal zwischen den Stimulationsimpulsen Artefakt-frei (kein Entladungsvorgang und keine Einschwingvorgänge des Verstärkers oder der Filter), so kann die M‑Welle aus dem aktuellen EMG-Signal und den EMG-Aufzeichnungen der vorherigen Stimulationsperioden geschätzt werden 23 24 25 26 27. Dies erfolgt unter der Annahme, dass M‑Welle und Willkür-EMG nicht miteinander korreliert sind. Ferner wird vorausgesetzt, dass sich die Form der M‑Welle über bis zu 15 Perioden nicht stark ändert. Skalierungen der Amplitude der M‑Welle in Abhängigkeit von der Stimulationsintensität sind jedoch zulässig. Tatsächlich ist die Invarianz der M‑Wellenform für nahezu isometrische Muskelkontraktionen gut erfüllt 28.
Eine Schätzung des Willkür-EMG kann man alternativ zum gerade vorgestellten Ansatz nun auch ermitteln, indem man vom gemessenen EMG-Signal die geschätzte M‑Welle subtrahiert. Ein Vorteil dieses Filteransatzes gegenüber dem vorherigen Hochpass-Filter ist, dass das volle Frequenzspektrum des Willkür-EMG erhalten bleibt und dass über einen größeren Zeitraum zwischen den Stimulationsimpulsen das Willkür-EMG ausgewertet werden kann. Dies liefert ein potenziell rauschärmeres Ergebnis der EMG-Auswertung.
Die Erfassung von M‑Welle und Willkür-EMG ist derzeit nur bei einer EMG-Messung über separate EMG-Elektroden möglich. Bei der direkten Messung über die Stimulationselektroden sind Stimulationsartefakte und Entladungsvorgänge so stark, dass nur eine Erfassung des Willkür-EMGs mittels einer Hochpassfilterung durchführbar ist.
Verstärkung schwacher Bewegungsintentionen
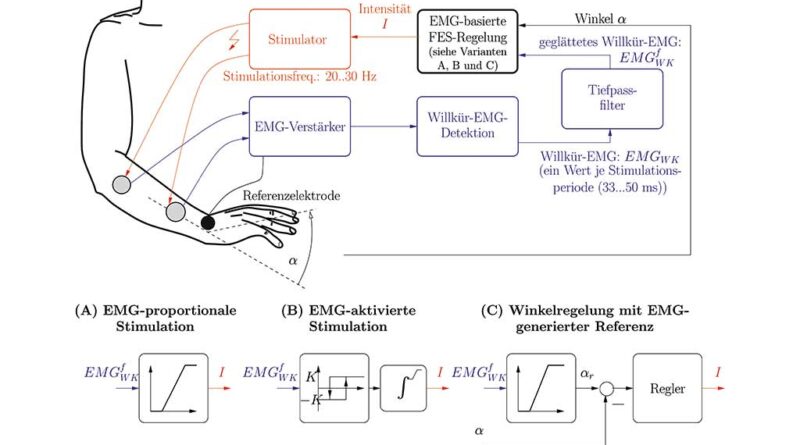
Eine Erweiterung der EMG-gesteuerten FES stellt die EMG-proportionale Stimulation dar 29 30 31 32 33 34 35 36. Hier erfolgt eine kontinuierliche Detektion der Bewegungsintentionen auch während der Stimulation. Die schwachen willentlichen Muskelaktivitäten werden durch die Elektrostimulation verstärkt, indem die Stimulationsintensität proportional zum geglätteten Willkür-EMG gewählt wird (Abb. 2, Variante A). Der durch die EMG-basierte Stimulation geschlossene Regelkreis mit dem Menschen als Regler weist bei einigen wenigen Patienten Schwingungen auf. Ursachen dafür können unter anderem die Zeitverzögerung durch die Filterung oder die Schwierigkeit des Patienten bei der Erzeugung einer gleichmäßigen Muskelkontraktion sein.
Kann ein Patient keine genügend gleichmäßige willentliche Kontraktion generieren, so bietet sich ein Stimulationsverfahren an, welches die Elektrostimulation in Abhängigkeit vom Willkür-EMG über eine Hysterese-Kennlinie aktiviert und deaktiviert (Abb. 2 (Variante B) 37 38. Sobald eine obere Schwelle durch das Willkür-EMG überschritten wird, wird die Stimulationsintensität durch Integration mit dem Anstieg K erhöht, bis ein vorgegebener Maximalwert erreicht wird. Dieser Wert wird solange gehalten, bis der Patient seinen Muskel entspannt und die Amplitude des Willkür-EMG unter eine untere Schwelle fällt. Infolge dessen verringert sich die Stimulationsintensität mit dem Anstieg ‑K und wird dann deaktiviert.
Die beiden zuvor beschriebenen Ansätze haben den Nachteil, dass die maximale Stimulationsintensität zu Beginn festgelegt wird und bei Störungen (z. B. Spastik) oder Ermüdung eventuell nicht mehr ausreichend ist, um die gewünschte Bewegung genügend zu unterstützen. Um dieses Problem zu lösen, kann man, wie in Abbildung 2 (Variante C) dargestellt, das Willkür-EMG in einen Referenzwinkel für das Gelenk transformieren und diesen dann durch eine klassische Regelung mit Erfassung des Ist-Winkels realisieren 39.
Regulierung des Stimulationseffekts
In der Regel wird die durch die Stimulation generierte Muskelkontraktion durch Veränderung der Impulsladung moduliert. Diese lässt sich über die Dauer und Amplitude der applizierten Impulse einstellen. Der Stimulationseffekt, in diesem Fall die Anzahl der durch Elektrostimulation rekrutierten motorischen Einheiten, ist jedoch schwer vorhersehbar. Die Rekrutierungskennlinie der Muskeln besitzt eine Schwelle sowie Sättigung, deren Bestimmung am Patienten zeitaufwändig ist. Die Kennlinie variiert von Tag zu Tag, auch durch geringfügig verschiedene Platzierung von Elektroden, und weist zeitvariantes Verhalten, u. a. aufgrund von Muskelermüdung, auf.
Um den Stimulationseffekt besser vorhersagbar zu gestalten, bietet sich eine Online-Erfassung des Rekrutierungszustands λ und dessen Feedback-Regelung an 40. Nach jedem Stimulus lässt sich λ direkt bestimmen, sodass sich eine sehr schnelle Regelschleife realisieren lässt, die einen vorgegebenen Referenzwert für den Aktivierungsgrad des Muskels einstellt.
Als neue Stellgröße für die Stimulationsstärke verwendet man dann die Referenz des λ‑Regelkreises. Dies erleichtert die FES-Anwendung wesentlich, da der Stimulationseffekt für eine vorgegebene λ‑Referenz nicht mehr so stark von inneren Einflüssen wie z. B. der Ermüdung abhängt. Der Entwurf von überlagerten Gelenkwinkelreglern vereinfacht sich dramatisch, da die Rekrutierungskennlinien durch die λ‑Regelung linearisiert werden und nicht mehr bei der Modellierung/Identifikation berücksichtigt werden müssen.
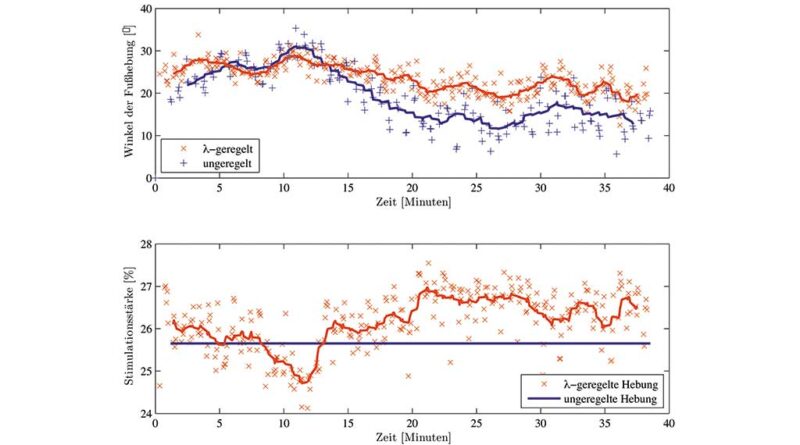
Um den Vorteil eines λ‑geregelten Muskels gegenüber einer normalen ungeregelten Stimulation zu demonstrieren, wurde beispielhaft die Stimulation des Fußhebers M. tibialis anterior betrachtet. Diese spielt bei der Kompensation einer Fußhebeschwäche mittels Peroneusstimulatoren bei Schlaganfallpatienten eine wesentliche Rolle. Bei einer gesunden Testperson, die mit frei hängendem Bein in einem Rollstuhl saß, wurde 40 Minuten lang abwechselnd in einer simulierte Schwungphase der M. tibialis anterior direkt (ungeregelt) und λ‑geregelt stimuliert. Die Intensitäten (Ladung und λ‑Referenz) beider Varianten wurden anfänglich so gewählt, dass eine Fußhebung um 25° erzielt wurde. Abbildung 3 zeigt das Ergebnis dieses Tests. Bei den λ‑geregelten Stimulationsintervallen kommt es im Laufe der Zeit zu einem deutlich geringeren Abfall der Fußhebung. Die Regelung kompensiert intern die auftretende Muskelermüdung durch eine Anpassung (Erhöhung) der wirklichen Stimulationsintensität (Ladung), bis eine zuvor festgelegte Sicherheitsbegrenzung der Ladung erreicht wird. Eine detailliertere Darstellung der Ergebnisse ist Klauer et al. 41 zu entnehmen. Die Übertragbarkeit dieser Ergebnisse auf Schlaganfallpatienten wird derzeit klinisch untersucht. Erste experimentelle Ergebnisse deuten auf einen gleichfalls positiven Effekt der λ‑geregelten Stimulation hin.
Monitoring der Muskelaktivitäten und Motorkoordination
Im Rahmen des BMBF-geförderten Verbundprojektes RehaRobES wurde an der Technischen Universität Berlin ein mehrkanaliges Stimulations- und Messsystem entwickelt, welches erstmals die eingangs beschriebene EMG-Messung direkt über die Stimulationselektroden erlaubt 42 43. Dies reduziert den Aufwand für eine EMG-Messung signifikant, wobei im Vergleich zur klassischen Elektromyographie bei Verwendung größerer Stimulationselektroden die EMG-Aktivität einzelner kleinerer Muskeln nicht mehr selektiv beurteilt werden kann. Um Messartefakte durch Entladungsvorgänge zu verhindern, erfolgt nach jedem Stimulationsimpuls eine erzwungene Entladung durch gezielten kurzzeitigen Kurzschluss der Elektroden. Das Stimulations- und Messsystem kann mit elektromechanischen Therapiegeräten, wie zum Beispiel mit einem FES-Fahrradergometer, kombiniert werden, sodass sich aus den kinematischen Daten des Bewegungstrainers und dem EMG Rückschlüsse auf die Motorkoordination der Patienten ziehen lassen. Basierend darauf können neue Therapieverfahren realisiert werden, wie z. B. die Kombination von Elektrostimulation und EMG-Biofeedback.
Mit der entwickelten EMG-Messung über die Stimulationselektroden kann das Stimulationssystem um eine Diagnose-Komponente erweitert werden. Die mehrkanalige EMG-Messung ermöglicht eine Überwachung der Therapie sowie eine Protokollierung des Therapiefortschritts. Es ist jedoch auch eine Online-Adaption der Therapieparameter oder ‑form möglich. Unter anderem können die richtigen Stimulationsintervalle (z. B. Tretkurbel-Winkelbereiche eines Ergometers) für das paretische Bein eines Schlaganfallpatienten aus den erfassten EMG-Aktivitäten des gesunden Beines ermittelt werden.
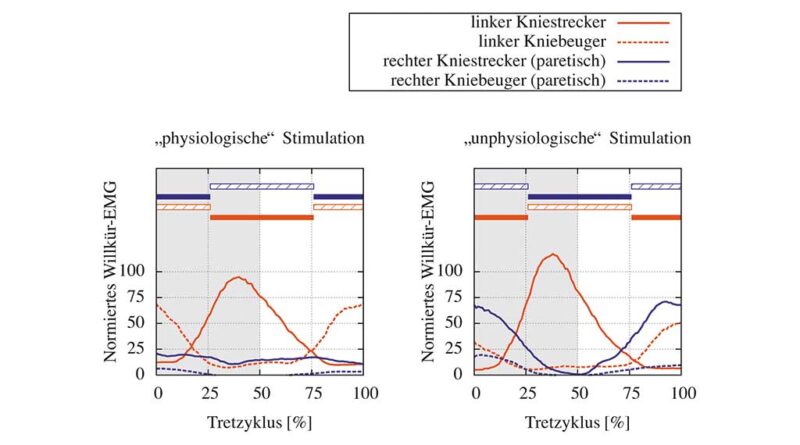
In Abbildung 4 sind die auf das gesunde Bein normierten Muskelaktivitäten der Kniestrecker und ‑beuger einer Schlaganfallpatientin beim isokinetischen FES-Fahrradfahren dargestellt. Mithilfe des Motors im Ergometer wurde die Trittgeschwindigkeit bei 40 U/min konstant gehalten. Der Proband wurde aufgefordert, selbstständig mit beiden Beinen moderat mit zu treten. Die EMG-Messungen wurden bei einer moderaten, eher sensorisch wirkenden Stimulationsintensität von 20 mA und 300 μs über die 9 x 7 cm großen Hydrogel-Stimulationselektroden durchgeführt (dass eine EMG-Messung mit dem System auch bei einer motorisch effektiven Stimulation mit höheren Stimulationsamplituden möglich ist, wurde bereits in Shalaby et al. 44 gezeigt). In Abbildung 4 sind die entsprechenden Stimulationsbereiche als Balken dargestellt. Interessant ist, dass bei einer „physiologisch sinnvollen“ Stimulation (Abb. 4, links, Aktivierung der Strecker kurz vor und während der Extensionsphase sowie Beuger kurz vor und während der Flexionsphase des Beines) nahezu keine Muskelaktivität im paretischen Bein beobachtet werden konnte. Hingegen konnte bei einer „unphysiologischen“ Stimulation, bei der z. B. die Kniestrecker während der Beinbeugung gereizt werden, eine phasengerechte Aktivierung des paretischen Beinstreckers bei dieser Patientin detektiert werden (Abb. 4, rechts).
Dieses illustrative Beispiel macht deutlich, wie wichtig die Überwachung und Auswertung des Stimulationseffektes während der Therapie sein kann. Eine automatische Anpassung der Therapie, z. B. durch Änderung der Stimulationsverläufe, entsprechend der Beobachtungen ist ein interessantes zukünftiges Forschungsfeld.
Zusammenfassung
Die Erfassung und Auswertung des Elektromyogramms zwischen den einzelnen Impulsen einer aktiven funktionellen Elektrostimulation erlaubt die bessere Berücksichtigung der Eigenaktivitäten der Patienten sowie die Überwachung und die Regulierung des Stimulationseffekts. All dies kann die FES-Therapie wesentlich verbessern. Existierende und zukünftige Stimulationssysteme sollten daher um ein entsprechend ausgelegtes EMG-Modul erweitert werden. Für eine einfache Handhabung ohne zusätzlichen Aufwand, insbesondere bei mehrkanaliger Anwendung der FES, ist nur die EMG-Messung über die Stimulationselektroden praktikabel. Leider ist es für diese Form der EMG-Messung bisher noch nicht gelungen, die durch FES erzeugte Muskelaktivität in Form der M‑Welle zu erfassen. Hier besteht dringender Forschungsbedarf.
Für die Autoren:
Dr. Thomas Schauer
Technische Universität Berlin
Fachgebiet Regelungssysteme,
Sekretariat EN 11
Einsteinufer 17
10587 Berlin
schauer@control.tu-berlin.de
Schauer Th, Klauer Ch. Verwendung der Elektromyographie in der funktionellen Elektrostimulation. Orthopädie Technik, 2013; 64 (6): 26–32
- Easypreg – ein Faserverbundwerkstoff zum Tiefziehen — 9. März 2026
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Rushton DN. Functional electrical stimulation. Physiological measurement, 1997; 18: 241–275
- Krames ES, Peckham PH, Rezai AR. Neuromodulation. Academic Press, 2009
- Barsi GI, Popovic DB, Tarkka IM, Sinkjaer T, Grey MJ. Cortical excitability changes following grasping exercise augmented with electrical stimulation. Experimental brain research, 2008; 191 (1): 57–66
- Auer M, Kaus J, Mileusnic M, Kannenberg A, Rakos M, Hahn A. EMG-gesteuerte funktionelle Elektrotherapie zur Unterstützung der motorischen Rehabilitation von Schlaganfallpatienten. Medizinisch-Orthopädische Technik, 2008; 128 (5): 2–10
- Merletti R, Knaflitz M, De Luca CJ. Electrically evoked myoelectric signals. Crit rev biomed eng, 1992; 19 (4): 293–340
- Knaflitz M, Merletti R. Suppression of simulation artifacts from myoelectric evoked potential recordings. IEEE Transactions on biomedical engineering, 1988; 35 (9): 758–763
- Minzly J, Mizrahi J, Hakim N, Liberson A. Stimulus artefact suppressor for EMG recording during FES by a constant-current stimulator. Medical & biological engineering & computing, 1993; 31 (1): 72–75
- Muraoka Y. Development of an EMG recording device from stimulation electrodes for functional electrical stimulation. Frontiers of medical & biological engineering, 2002; 11 (4 ): 323–333
- Schauer T, Salbert R, Negard NO, Raisch J. Detection and filtering of EMG for assessing voluntary muscle activity during FES, Bournemouth, England, Proc. of the 9th annual conference of the international functional electrical stimulation society, 2004;185–187
- Shalaby R, Schauer T, Liedecke W, Raisch J. Amplifier design for EMG recording from stimulation electrodes during functional electrical stimulation leg cycling ergometry. Biomedical engineering, 2011; 56 (1): 23–33
- Rupp R, Vossius G, Gerner HJ. Der Beitrag des EMG zur Beobachtbarkeit für die kontrollierte Elektrostimulation bei Lähmungen: Realisierung einer modularen EMG-Aufnahmehardware. Biomedizinische Technik, 1999; 43 (Ergänzungsband 1): 242–244
- Rupp R, Vossius G, Gerner HJ. Eine bipolare, aktive Elektrode zur Vielkanalableitung des dynamischen EMGs während Elektrostimulation. Biomedizinische Technik, 2002; 47 (Ergänzungsband 1): 609–610
- Thorsen R. An artefact suppressing fast-recovery myoelectric amplifier. IEEE Transactions on biomedical engineering, 1999; 46 (6): 764–766
- Merletti R, Knaflitz M, De Luca CJ. Electrically evoked myoelectric signals. Crit rev biomed eng, 1992; 19 (4): 293–340
- Merletti R, Parker P. Electromyography: physiology, engineering, and noninvasive applications. Wiley-IEEE, 2004
- Merletti R, Parker P. Electromyography: physiology, engineering, and noninvasive applications. Wiley-IEEE, 2004
- De Luca CF, Knaflitz M. Surface electromyography, What’s new? CLUT publishers, 1992
- Muraoka Y. Development of an EMG recording device from stimulation electrodes for functional electrical stimulation. Frontiers of medical & biological engineering, 2002; 11 (4 ): 323–333
- Schauer T, Salbert R, Negard NO, Raisch J. Detection and filtering of EMG for assessing voluntary muscle activity during FES, Bournemouth, England, Proc. of the 9th annual conference of the international functional electrical stimulation society, 2004; 185–187
- Shalaby R. Development of an electromyography detection system for the control of functional electrical stimulation in neurological rehabilitation, Dissertation TU Berlin, 2011
- Shalaby R, Schauer T, Liedecke W, Raisch J. Amplifier design for EMG recording from stimulation electrodes during functional electrical stimulation leg cycling ergometry. Biomedical engineering, 2011; 56 (1): 23–33
- Thorsen R, Spadone R, Ferrarin M. A pilot study of myoelectrically controlled FES of upper extremity. IEEE Transactions on neural systems and rehabilitation engineering, 2001; 9 (2): 161–168
- Frigo C, Ferrarin M, Frasson W, Pavan E, Thorsen R. EMG signals detection and processing for online control of functional electrical stimulation. Journal of electromyography and kinesiology, 2000; 10 (5): 351–360
- Langzam E, Isakov E, Mizrahi J. Evaluation of methods for extraction of the volitional EMG in dynamic hybrid muscle activation. Journal of neuro-engineering and rehabilitation, 2006; 3: 27
- Sennels S, Biering F, Andersen O, Hansen S. Functional neuromuscular stimulation controlled by surface electromyographic signals produced by volitional activation of the same muscle: adaptive removal of the muscle response from the recorded EMGsignal. IEEE Transactions on rehabilitation engineering, 1997; 5 (2): 195–206
- Tabernig CB, Acevedo RC. M‑wave elimination from surface electromyogram of electrically stimulated muscles using singular value decomposition: preliminary results. Medical engineering & physics, 2008; 30 (6): 800–803
- Yeom H, Park Y, Yoon H, Gram-Schmidt M. Wave canceller for the EMG controlled FES. IEICE – Trans inf syst E88‑D, 2005; 9: 2213–2217
- Frigo C, Ferrarin M, Frasson W, Pavan E, Thorsen R. EMG signals detection and processing for online control of functional electrical stimulation. Journal of electromyography and kinesiology, 2000; 10 (5): 351–360
- Chen WL, Chen SC, Chen CC, Chou CH, Shih YY, Chen YL, Kuo TS. Patient-driven loop control for ambulation function restoration in a non-invasive functional electrical stimulation system. Disability & Rehabilitation, 2010; 32 (1): 65–71
- Fujiwara T, Kasashima Y, Honaga K, Muraoka Y, Tsuji T, Osu R, Hase K, Masakado Y, Liu M. Motor improvement and corticospinal modulation induced by hybrid assistive neuromuscular dynamic stimulation (HANDS) therapy in patients with chronic stroke. Neurorehabil neural repair, 2009; 23 (2): 125–132
- Hara Y, Ogawa S, Muraoka Y. Hybrid power-assisted functional electrical stimulation to improve hemiparetic upper-extremity function. American journal of physical medicine & rehabilitation, 2006; 85 (12): 977–985
- Rupp R, Müller-Putz GR, Pfurtscheller G, Gerner HJ, Vossius G. Evaluation of control methods for grasp neuroprostheses based on residual movements, myoelectrical activity and cortical signals. Biomedizinische Technik, 2008; 53 (Suppl. 1): 54–56
- Schauer T, Salbert R, Negard NO, Raisch J. Detection and filtering of EMG for assessing voluntary muscle activity during FES, Bournemouth, England, Proc. of the 9th annual conference of the international functional electrical stimulation society, 2004; 185–187
- Shalaby R. Development of an electromyography detection system for the control of functional electrical stimulation in neurological rehabilitation, Dissertation TU Berlin, 2011
- Thorsen R, Ferrarin M, Veltink P. Enhancement of isometric ankle dorsiflexion by automyoelectrically controlled functional electrical stimulation on subjects with upper motor neuron lesions. Neuromodulation, 2002; 5 (4): 256–263
- Thorsen R, Spadone R, Ferrarin M. A pilot study of myoelectrically controlled FES of upper extremity. IEEE Transactions on neural systems and rehabilitation engineering, 2001; 9 (2): 161–168
- Ambrosini E, Ferrante S, Tibiletti M, Klauer C, Schauer T, Pedrocchi A, Ferrigno G. An EMG-controlled neuroprosthesis for daily upper limb support: A preliminary study, Boston (USA), Proc. of the 33rd annual international IEEE EMBS Conference, 2011
- Shalaby R. Development of an electromyography detection system for the control of functional electrical stimulation in neurological rehabilitation, Dissertation TU Berlin, 2011
- Cologni A, Seel T, Madashi M, Previdi F, Werner C, Schauer T. Automatic adjustment of electromyography-based FES control. Donostia-San Sebastián, Gipzukoa (Spanien), Proc. of the 18th international functional electrical stimulation conference, 2013
- Klauer C, Raisch J, Schauer T. Linearisation of electrically stimulated muscles by feedback control of the muscular recruitment measured by evoked EMG, Miedzyzdroje (Polen), Proc. of the 17th international conference on methods and models in automation and robotics, IEEE, 2012: 108–113
- Klauer C, Raisch J, Schauer T. Advanced control strategies for neuro-prosthetic systems. Berlin, Proc. of the technically assisted rehabilitation – TAR conference, 2013
- Shalaby R. Development of an electromyography detection system for the control of functional electrical stimulation in neurological rehabilitation, Dissertation TU Berlin, 2011
- Shalaby R, Schauer T, Liedecke W, Raisch J. Amplifier design for EMG recording from stimulation electrodes during functionalelectrical stimulation leg cycling ergometry. Biomedical engineering, 2011; 56 (1): 23–33
- Shalaby R, Schauer T, Liedecke W, Raisch J. Amplifier design for EMG recording from stimulation electrodes during functionalelectrical stimulation leg cycling ergometry. Biomedical engineering, 2011; 56 (1): 23–33