Grundlagen zur Gonarthrose
Derzeit leiden etwa 75 % der über 70-jährigen Bundesbürger an einer Arthrose. Betrachtet man die demografische Entwicklung in Deutschland mit zunehmendem Patientenalter und der besorgniserregenden Zunahme adipöser junger Menschen in Deutschland, so ist in den kommenden Jahren mit einer immensen Zunahme der arthrosebedingten Gesundheitsaufwendungen zu rechnen.
Je nach Kausalität der Arthrose 1 unterscheidet man die primäre (idiopathische) von der sekundären Arthrose, bei der systemische Erkrankungen oder Achsdeformitäten zugrunde liegen. Die klassische Klassifikation der Arthrose erfolgt nach den radiologischen Kriterien von Kellgren und Lawrence (1957) 2 – hier werden vier Arthrose-Stadien unterschieden:
- I Fragliche Arthrose: keine Gelenkspaltverschmälerung
- II Geringe Arthrose: geringe Gelenkspaltverschmälerung
- III Mäßige Arthrose: Gelenkspaltverschmälerung, knöcherne Ausziehungen (Osteophyten)
- IV Schwere Arthrose: ausgeprägte Gelenkspaltverschmälerung, Deformierung der beteiligten Knochen
Die Arthrose/Osteoarthrose ist aufgrund der fehlenden Regenerationsfähigkeit des Gelenkknorpels als chronische, progrediente Erkrankung mit zunehmender Funktionseinschränkung zu betrachten, deren Behandlung die langfristige Einbindung des Patienten in ein individuelles Arthrosemanagement erforderlich macht. Das Arthrosemanagement sollte folgende Einzelkomponenten umfassen, die auf die individuellen Bedürfnisse bzw. Voraussetzungen des zu behandelnden Patienten abgestimmt werden müssen:
- Anpassung des Lebenswandels
- gelenkspezifische Bewegungsübungen/Physiotherapie
- Orthesen/Bandagen
- symptomatische medikamentöse Therapie
- Chondroprotektva/disease modifying drugs
- operative Interventionen
Die einzelnen Komponenten des patientenspezifischen Arthrose-Managements sollen sich dabei verzahnt ergänzen.
Die Behandlung von Arthrosepatienten muss als Zusammenarbeit zwischen dem Patienten und allen Gesundheitshelfern (dem behandelnden Hausarzt, dem mitbehandelnden Orthopäden/Unfallchirurgen, dem Orthopädie-Techniker und dem Physiotherapeuten) erfolgen.
Die Gonarthrose (Arthrose des Kniegelenkes) ist die häufigste Erkrankung des Kniegelenkes. Da das Risiko, an einer Gonarthrose zu erkranken, mit zunehmendem Alter steigt, ist sie dem Formenkreis degenerativer Erkrankungen zuzuordnen. Untersuchungen an Zwillingen weisen auf genetische Faktoren hin. Studien mit Bergleuten, Bauarbeitern und Bodenlegern zeigten, dass die berufliche Exposition durch kniende oder hockende Tätigkeit eine nachweisliche Rolle spielt. Übergewichtigkeit stellt sogar einen hohen Risikofaktor mit Dosis-Wirkungs-Beziehung dar.
Der Gelenkknorpel 3 4 ist nach Abschluss des Wachstums nicht mehr regenerationsfähig. Geschützt wird er von Gelenkkapsel, Bändern (Kollateralbänder, Kreuzbänder), Menisken und Muskulatur, die zusammen eine funktionelle Einheit bilden. Unbehandelte Knorpelschäden führen durch Vergrößerung und Affektion des gegenüberliegenden Gelenkpartners zu einer Arthrose. Pathophysiologisch kann eine mechanisch-funktionelle Gelenkstörung zur Degeneration führen. Zu den mechanischen Faktoren zählen in erster Linie Achsabweichungen, Dysplasien und ligamentäre Insuffizienzen sowie pathologische Bewegungsmuster.
Die Behandlung der Gonarthrose erfordert eine rechtzeitige Erkennung einzelner Strukturveränderungen. Sie beinhaltet wesentlich mehr als die Fokussierung auf den Knorpel. Die unterschiedlichen subtilen klinischen Symptome sollten nicht als Gonarthrose-Schmerzen verallgemeinert werden. Dazu gehören Instabilitäten, lokalisierte Schmerzen, Einklemmungen, Meniskus-Zeichen oder schmerzlose Reizzustände nach Belastung. Dank der Magnetresonanztomografie gelingt die Erkennung vieler Kniebinnenschäden bereits in frühen Stadien.
Erkennung und Behandlung von Knorpeldegeneration und Gonarthrose sind interdisziplinär. Manchmal werden Arthrose-Symptome durch internistische Erkrankungen und subtile Formen von Rheuma ausgelöst. Sie können im Frühstadium erkannt und durch Diätmaßnahmen und Medikamente erfolgreich behandelt werden.
Auf dem Röntgenbild lassen sich Fehlstellungen und Deformierungen der Gelenkknochen sowie eine Verschmälerung des Gelenkspalts erkennen. Auf diese Weise kann der Arzt den Grad der Abnutzung recht genau einschätzen. Ohne Einsatz von Röntgenstrahlen kommt bevorzugt die Magnetresonanztomografie (MRT), auch Kernspintomografie genannt, zum Einsatz. Die detailreichen Schnittbilder stellen die Gewebe aufgrund ihres unterschiedlichen Wassergehalts dar. Gerade bei Verletzungen bzw. Veränderungen des Gelenkknorpels, des subchondralen Knochens und der Menisken ist die Magnetresonanztomografie in frühen Stadien der Röntgendiagnostik überlegen.
Knorpeloperationen bei degenerativen Schäden
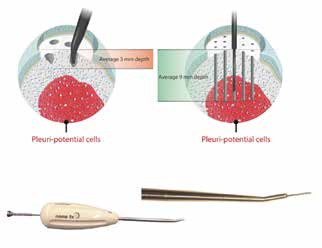
Gelenkknorpel ist auf der einen Seite mechanisch sehr widerstandsfähig und andererseits weder sensibel durch Nerven versorgt noch durchblutet. Reparaturmechanismen und warnende Schmerzen sind daher kaum vorhanden. Die Ernährung des hyalinen Knorpels erfolgt über Diffusion von Nährstoffen aus der Gelenkflüssigkeit. Das subchondrale Knochenmark ist stark durchblutet und sehr schmerzempfindlich. Ist der vor Druckverteilung schützende visko-elastische Gelenkknorpel erst einmal irreversibel geschädigt, entstehen stark schmerzhafte Symptome und deutlich erkennbare Signalveränderungen im MRT des subchondralen Knochens. Zur Behandlung umschriebener Knorpelschäden stehen knochenmarkstimulierende Verfahren wie Mikrofraktur, Nanofraktur und Abrasion zur Verfügung 5 6. Bei diesen Techniken entsteht durch die Eröffnung des subchondralen Knochenmarks eine Einblutung mit Bildung eines Fibrin-Gerinnsels. Einwandernde mesenchymale Stammzellen bilden ein Regenerat aus Faserknorpel. Dieser hat jedoch eine geringere biomechanische Widerstandsfähigkeit als hyaliner Gelenkknorpel.
Als neueste Generation der Knochenmarkstimulation kommt die Nanofraktur zum Einsatz (Abb. 1). Hierbei werden mit Hilfe einer gehärteten Nadel besonders schmale und tiefe Perforationen gesetzt. Der Vorteil liegt in der Erreichung von Schichten mit höherer Stammzelldichte und einer nur geringen Destabilisierung der subchondralen Knochenplatte. Als Knochenmarkstimulation der zweiten Generation kommt die Autologe Matrixinduzierte Chondrogenese (AMIC) 7 zum Einsatz, bei der in den stimulierten Defekt eine Kollagen‑I/III-Membran eingeklebt wird. Die autologe Knorpelzelltransplantation (ACT) 8 oder Matrixinduzierte Autologe Chondrozyten-Implantation (MACI) 9 ist bei Vorliegen einer Gonarthrose kontraindiziert bzw. nicht zugelassen. Die Studien von Minas und Mitarbeitern zu Grenzindikationen („salvage procedures”) zeigen, dass auch multiple degenerative Defekte mit der ACT nur mit niedrigen Erfolgsraten behandelt werden können 10, auch wenn korrekte Achsen, intakte Menisken, stabile Bandführung und keine korrespondierenden Defekte („kissing lesions”) vorhanden sind. Ohne ein vitales subchondrales Knochenlager sind die Erfolgschancen einer Knorpelreparatur limitiert. Frühe Stadien einer nicht aktiven Osteonekrose im höheren Alter (Morbus Ahlbäck) können daher mit einer Spongiosatransplantation und AMIC gelenkerhaltend behandelt werden.
Entfernung von Osteophyten im Kniegelenk
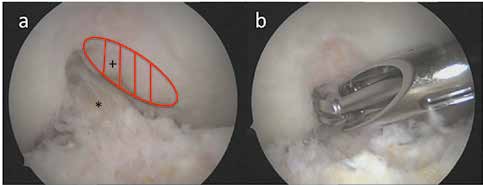
Intraartikuläre symptomatische Veränderungen können arthroskopisch therapiert werden, besonders, sofern mechanische Ursachen für die Beschwerden verantwortlich sind 11 12. Osteophyten sind eine typische Veränderung bei Arthrosen. Es sind knöcherne Sporne, die mit Faserknorpel überzogen sind und häufig am Rand der Gelenkknorpelzone infolge einer periostalen Reaktion entstehen. Auch ohne Knorpelschäden können sich mit zunehmendem Alter Osteophyten bilden und die Ursache für Schmerzen und Funktionsstörungen darstellen. Sie können zu einem Impingement – insbesondere im Bereich der Kollateralligamente und der interkondylären Notch – führen. Am Patella-Rand erzeugen Osteophyten manchmal sichtbare Schleifspuren im korrespondierenden Trochlea-Knorpel. Abgebrochene Osteophyten können sich zu freien Gelenkkörpern entwickeln. Eine Stenose der interkondylären Notch kann zu einer mukoiden Hypertrophie des vorderen Kreuzbandes mit Streckhemmung und sekundärer Instabilität führen. Die arthroskopische Entfernung von Osteophyten und die Notch-Erweiterung haben sich daher in der Arthrosebehandlung mit signifikanter Schmerzreduktion und Extensionsverbesserung bewährt (Abb. 2).
Operationen am degenerativen Meniskus
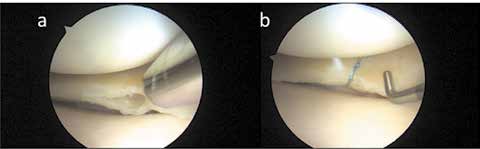
Der Verlust des Meniskus durch Verletzung oder Degeneration hat eine progrediente Gonarthrose zur Folge 13. Die Teilresektion symptomatischer Meniskusrisse degenerativer Genese weist überwiegend exzellente bis gute Resultate im mittleren Zeitverlauf auf. Die Teilresektion reduziert in systematischen Literaturanalysen langfristig die Symptome, wobei es dennoch nach 8 bis 16 Jahren zu radiologischen Zeichen einer Arthrose kommt. Je mehr Meniskusgewebe entfernt werden muss, umso höher ist das Risiko für die Entstehung einer Gonarthrose. Der symptomatische degenerative Riss stellt daher auch im höheren Stadium der Arthrose eine korrekte Indikation zur Arthroskopie dar. Der Erhalt des Meniskusgewebes durch eine Naht zeigt bessere Ergebnisse als die Resektion. Der Erfolg einer Naht nimmt dennoch bei Degeneration ab. Degenerative horizontale Risse neigen zur Progredienz in Richtung Gelenkkapsel und können schmerzhafte Ganglien oder Zysten bilden. Sie entstehen durch eine zentrale Meniskuserweichung mit der Schwächung vertikaler Fasern, wodurch obere und untere Meniskus-Schichten sich gegeneinander verschieben. Um den instabilen Meniskus mit dem Horizontalriss nicht bis zur Kapsel resezieren zu müssen, wird heute auch bei dieser Riss-Form eine All-inside-Naht nach Anfrischen der Rissflächen durchgeführt (Abb. 3).
Behandlung von Bandinstabilitäten am degenerativen Knie
Ligamentäre Insuffizienzen spielen sowohl bei der Arthrose-Entstehung als auch bei der Schmerzauslösung der Gonarthrose eine Rolle. Ein exzessives Debridement mit Entfernung größerer Meniskus‑, Knochen- und Knorpelanteile kann zu einer sekundären Instabilität im Kniegelenk führen. Kreuzband-Insuffizienzen durch eine mukoide Degeneration führen zu einer pathologisch veränderten biomechanischen Belastung des Kniegelenkes. Die Prävalenz einer Gonarthrose 10 Jahre nach Kreuzbandinsuffizienz beträgt 50 bis 80 %. Bei Kreuzbandinsuffizienz lassen sich erhöhte Werte pro-inflammatorischer Zytokine mit katabolen Effekten am Knorpel messen. Die Indikation für einen Kreuzbandersatz wird heute daher auch bei Patienten höheren Alters und bereits fortgeschrittener Degeneration gestellt, sofern die Beschwerden durch eine Instabilität ausgelöst sind.
Die Kreuzbandplastik bei degenerativ geschädigten Kniegelenken ist nach neueren Untersuchungen ein sicheres Verfahren, das die Stabilität wiederherstellt und die Rückkehr zu einer altersentsprechenden Aktivität ermöglicht. Aktuelle Meta-Analysen zeigen, dass nach Kreuzbandplastik die Prävalenz für radiologische Zeichen einer Arthrose geringer ist als bisher angenommen. Die Luxation und Subluxation der Patella bei Insuffizienz der medialen patello-femoralen Ligamente (MPFL) weist eine hohe Prävalenz von femuropatellaren Arthrosen auf. Die Rekonstruktion dieser Ligamente verbessert auch im höheren Alter eine schmerzhafte Instabilität.
Arthroskopisches Debridement
Die resezierende und debridierende arthroskopische Chirurgie hat zum Ziel, freie Partikel oder instabile zerstörte Kniebinnenstrukturen zu reduzieren. Reibungserhöhende Bruchstücke und Gelenkpartikel stimulieren die Inflammation von Synovialis und erhöhen dadurch die Mengen proteolytischer Enzyme, die durch katabole Reaktionen die Regenerationsfähigkeit von Proteoglykanen und Kollagenen schwächen. Arthroskopisches Debridement und Lavage sind jedoch umstritten. Einige Übersichtsarbeiten zeigen vor allem bei fortgeschrittener Arthrose eine geringe Evidenz für den Nutzen. Die arthroskopische Entfernung von größerem Debris, bestehend aus Gelenkknorpel, Meniskus- und Synovialis-Fragmenten, kann jedoch eine substanzielle Verbesserung der Funktion und die Reduzierung von Symptomen bewirken. Effektivität und Dauer der Verbesserung hängen vom Schweregrad der Degeneration ab. Je früher das Stadium der Arthrose ist, desto mehr kann arthroskopisch erzielt werden. Ein positiver Effekt lässt sich bei erweiterten arthroskopischen Eingriffen erreichen, welche die symptomatischen Pathologien an Meniskus (Risse, Einklemmungen) und Knorpel (freie Gelenkkörper, instabile Knorpelaufbrüche) behandeln. Bei einer entzündlichen Synovia-Hypertrophie kann die Synovektomie entzündungshemmend wirken und die Einnahme von Antiphlogistika reduzieren.
Umstellungsosteotomien
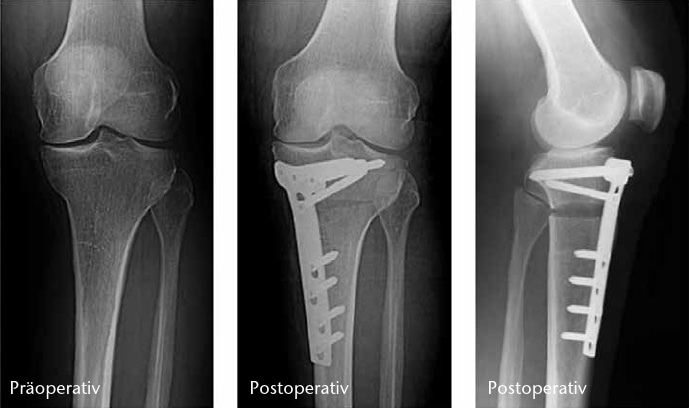
Umstellende Osteotomien am Knie haben zum Ziel, Achsdeformitäten zu korrigieren, um das degenerierte Kompartiment zu entlasten und die Lebensdauer des Gelenkes zu erhöhen 14. Sie eignen sich zur Behandlung von unikompartimentellen Varusoder Valgus-Gonarthrosen. Proximale Tibia-Osteotomien werden bei den weit häufigeren medialen Gonarthrosen bevorzugt, da sie biomechanisch Streckspalt- und Beugespaltweite korrigieren. Distale (suprakondyläre) Femur-Osteotomien verändern ausschließlich die Streckspaltweite und werden seltener bei lateraler Gonarthrose mit tibial physiologischem Varus durchgeführt. Durch die Einführung winkelstabiler Platten ist die öffnende hohe tibiale Osteotomie (HTO) bei Varus-Gonarthrosen erfolgreich etabliert. Sie ist gelenkflächenerhaltend, mit knorpelplastischen Maßnahmen kombinierbar, erfordert keine Knochenresektion und keine Fibula-Osteotomie. Die erhaltene laterale Knochenbrücke dient als Drehpunkt für eine stufenlose und biplanare Korrektur (M/L‑Kippung und A/P‑Neigung). Um einen paradoxen Effekt zu vermeiden, muss beim Aufklappen auch ein Innenband-Release erfolgen.
Osteotomien sind langfristig wirksam, um eine Endoprothese durchschnittlich 15 Jahre hinauszuzögern 15. Nach HTO kann eine spätere Endoprothesen-Implantation technisch anspruchsvoller sein. Ergebnisse bei Knie-Totalendoprothesen nach vorausgegangener Osteotomie zeigten jedoch keine negativen Effekte auf Standzeiten. Übergewichtige, Raucher und Frauen haben ein höheres Risiko des Therapieversagens. Die HTO eignet sich am besten für den normalgewichtigen aktiven Menschen, auch im hohen Alter und insbesondere als gelenkerhaltende Alternative zur Halbschlittenprothese (Abb. 4).
Personalisierter Oberflächenersatz
In der Knie-Endoprothetik verwendet man heute meistens Implantate, bei denen der Knochen mittels unterschiedlich groß abgestufter Schablonen so zugesägt wird, dass eines der Implantate in den vorgegebenen Größen passt. Individualisierte Implantate bedeuten höhere Passgenauigkeit und geringere Knochenresektion.
Die Herstellung eines individuellen Implantates benötigt dreidimensionale Informationen über die individuelle Oberflächenform und die Achsen des Gelenkes. Beim Kniegelenk kann nicht wie bei den Zähnen mit einer formbaren Masse ein Abdruck genommen werden. Hierzu stehen jedoch bildgebende Untersuchungstechniken wie Computertomografie und Magnetresonanztomografie zur Verfügung, die mittels Schnittbildern dreidimensionale Informationen liefern. Diese Informationen ermöglichen die OP-Planung und das Design der Prothese am Computer (Computer Aided Design = CAD). Computergesteuerte Fräsmaschinen wiederum ermöglichen die kontrollierte und beschleunigte Herstellung von Metallimplantaten und Instrumenten (Computer Aided Manufacturing = CAM).
Ziel beim Teilersatz des Kniegelenkes sollte es sein, nur so viel Gelenk zu ersetzen wie nötig, um so viel Knochen und Knorpel zu sparen wie möglich. Teilprothesen bzw. unilaterale Schlittenprothesen 16 sind operationstechnisch anspruchsvoller und haben nach Literaturangaben höhere Lockerungs- und Revisionsraten als Totalprothesen. Die meisten Fehlschläge nach Halbschlittenprothesen ereignen sich innerhalb der ersten 2 Jahre. Dies ist ein Hinweis auf Probleme, die mit der primären Passform und Kinematik zu tun haben. Ein primär nicht gut verankertes unilaterales Implantat hat aufgrund der geringeren Auflagefläche ein höheres Lockerungsrisiko als die Totalendoprothese am Knie. Bei der Einpassung von Standardprothesen kommt es immer noch zu einem Verlust von wertvollem Knochen. Das Implantat-Design von Standardprothesen wird anhand von Durchschnittswerten ermittelt und passt sich nicht immer perfekt der individuellen Kurvatur (J‑Kurve) des Gelenkes an. Der Beuge-Radius und das Verhältnis von Länge (anterior-posterior = AP) und Breite (medial-lateral = ML) sind bei Standard-Implantaten niemals zu 100 % passend. Wenn der Rand des tibialen Implantates übersteht, kann es zu einer schmerzhaften Einklemmung von Weichteilen kommen. Wenn der Rand nicht mit der stabilen Knochen-Kortikalis abschließt, kann das Implantat im weicheren SpongiosaKnochen einsinken.
Individualisierte Implantate können, wie Kadaverversuche gezeigt haben, die natürliche Knie-Kinematik durch Herstellung der anatomischen J‑Kurve erhalten und die Flächen ohne Überstand komplett bedecken. Die Bewegungsabläufe und neurologischen Verschaltungen sind auf die natürliche Knie-Kinematik eingestellt. Werden Anatomie und Ligament-Balancierung durch ein Implantat übermäßig verändert, müssen gewöhnliche Bewegungsabläufe neu erlernt werden. Die Verwendung individualisierter Implantat-Formen mit anatomischen Besonderheiten hat zum Ziel, die Rehabilitation zu erleichtern.
Zur Planung wird ein CT als dreidimensionales Schnittbildverfahren in einer speziellen und standardisierten Technik durchgeführt. Die Daten werden für das CAD an den Hersteller digital versendet. Dort ermitteln Ingenieure in Zusammenarbeit mit dem Arzt das optimale Prothesendesign. Bei diesem Verfahren wird die sogenannte Navigation bereits präoperativ durchgeführt. Informationen über Gelenkform, Beinachsen und Referenzpunkte an Hüfte und Sprunggelenk ermöglichen die Simulation der Operation am Computer. Die Informationen dieser Simulation stecken im sogenannten Navigationschip (Abb. 5).
Ob individualisierte Oberflächenersatz-Implantate auch im klinischen Einsatz über langjährige Beobachtungszeiträume eine Überlegenheit gegenüber bewährten Standardimplantaten haben werden, muss noch durch die Auswertung bereits laufender Studien ermittelt werden.
Diskussion
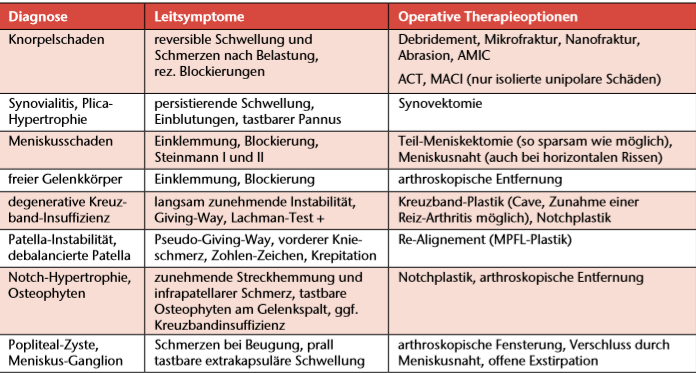
Die gelenkerhaltende Behandlung der Gonarthrose richtet sich nach den Prädiktoren „Leitsymptom” und „Schweregrad der Erkrankung”. Die Therapie sollte individuell stadienadaptiert sein und bereits bei frühen Formen degenerativer Schäden erfolgen (Tab. 1). Je mehr symptomatische Kniebinnenläsionen (Knorpelschäden, Meniskusschäden, Ganglien, Osteophyten, Synovitis) behandelt werden, umso größer ist der Effekt. Je fortgeschrittener die Gonarthrose, umso geringer ist der therapeutische Nutzen.
Die Studie von Mosley über arthroskopische Gelenktoilette versus Placebo-OP bei der Gonarthrose 17 hat zu einer öffentlichen kritischen Auseinandersetzung mit Operationen geführt. Diese Studie mit hoher Evidenzstufe geht nicht auf die einzelnen Kniebinnenschäden ein und wird in Diskussionen häufig zitiert, um darauf hinzuweisen, dass zu viele überflüssige Operationen durchgeführt werden. Eine weitere sehr aktuelle Studie aus dem renommierten New England Journal beschreibt im Abstract, dass zwischen Arthroskopie und Physiotherapie kein Unterschied im Behandlungsergebnis bestehe. Wenn man weiterliest, erfährt man allerdings, dass 30 % der Patienten aus der Physiotherapiegruppe innerhalb von 6 Monaten dennoch operiert wurden. Studien dieser Art werden trotz methodischer Schwächen bei operationskritischen Diskussionen für plakative Aussagen herangezogen. Sie widersprechen der täglichen Erfahrung erfahrener Operateure und bergen die Gefahr, dass oben erwähnte Methoden bei hilfebedürftigen Patienten nicht rechtzeitig angewendet werden können.
Umfassendere und aussagekräftige Meta-Analysen wie von Reichenbach et al. 18 zeigen, dass für den Erfolg das Vorhandensein mechanisch ausgelöster Symptome entscheidend ist. Bei Blockierungen und eingeklemmten Meniskusrissen sollte die Indikation zur Arthroskopie daher auch bei der Gonarthrose keinesfalls zurückhaltend gestellt werden. Die Mitbehandlung ligamentärer Insuffizienzen und Achsfehlstellungen ist essentiell. Symptomatische Bandinstabilitäten am Kniegelenk sind auch bei fortgeschrittener Degeneration und höherem Alter erfolgreich durch Bandplastiken behandelbar. Eine Knorpelstimulation und Meniskusoperation ohne Korrektur einer Varus-Fehlstellung hat keine Chance auf langfristigen Erfolg. Für aktive Patienten stellt die HTO auch im hohen Alter eine Alternative zum Gelenkersatz dar. Nicht nur das Alter, sondern insbesondere auch die Aktivität des Patienten entscheidet über die Wahl der Verfahren. Die Dauer der Symptomverbesserung ist abhängig von der individuellen Progredienz der Arthrose. Der demografische Wandel führt dazu, dass immer mehr Menschen im fortgeschrittenen Alter eine hohe Aktivität aufweisen. Dies erfordert eine gelenkerhaltende und sportorthopädische Herangehensweise an die Gonarthrose-Behandlung.
Bei individualisierten Oberflächenersatzprothesen am Kniegelenk sind Implantate und Instrumente individualisiert. Die Operation wird bereits vor Herstellung des Implantats pränavigiert und simuliert. Durch Onlay-Technik ist es ein Implantat mit geringer Knochenresektion und hoher Passgenauigkeit. Die Knochenoberflächen werden bis zum Rand bedeckt, ohne überzustehen. Die Höhe der anatomischen Gelenklinie wird nicht verschoben, die natürliche J‑Kurve eingehalten und die Prothese tibial mit anatomischem Slope eingebracht. Kurz: Die anatomische Gelenk-Kinematik des ursprünglich gesunden Kniegelenkes wird nicht verändert. Zusammengefasst können der individualisierte Oberflächenersatz am Kniegelenk und eine weitgehend gewebesparende, anatomische Rekonstruktion von Gelenken die Rehabilitation von Patienten durch den Erhalt der natürlichen Gelenk-Kinematik verbessern.
Der Autor:
Priv.-Doz. Dr. med. Erhan Basad
Zentrum für Hüft- und Knie-Endoprothetik/
Regenerative Gelenkchirurgie
ATOS Klinik Heidelberg
basad@atos.de
Begutachteter Beitrag/reviewed paper
Basad E. Operative Therapieoptionen bei Gonarthrose. Orthopädie Technik, 2015; 66 (4): 22–28
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 11. Februar 2026
- Felson DT. Developments in the clinical understanding of osteoarthritis. Arthritis Research & Therapy, 2009, 11 (1): 203. doi:10.1186/ar2531
- Kellgren JH, Lawrence JS. Radiological assessment of osteo-arthrosis. Ann Rheum Dis, 1957; 16 (4): 494–502.
- Benninghoff B, Drenckhahn D. Anatomie. Makroskopische Anatomie, Histologie, Embryologie, Zellbiologie. München: Urban & Fischer, 2003, 128–133
- O’Driscoll SW. The healing and regeneration of articular cartilage. The Journal of Bone and Joint Surgery, American Volume, 1998; 80 (12): 1795–1812
- Steadman JR, Rodkey WG, Briggs KK. Microfracture to treat full-thickness chondral defects: surgical technique, rehabilitation, and outcomes. The Journal of Knee Surgery, 2002; 15 (3): 170–176
- Johnson, LL. Arthroscopic abrasion arthroplasty: a review. Clinical Orthopaedics and Related Research, 2001; 391 Suppl: S306-317
- Benthien JP, Behrens P. Autologous matrix-induced chondrogenesis (AMIC). A one-step procedure for retropatellar articular resurfacing. Acta Orthopaedica Belgica, 2010; 76 (2), 260–263
- Brittberg M, Lindahl A, Nilsson A, Ohlsson C, Isaksson O, Peterson L. Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation. The New England Journal of Medicine, 1992; 331 (14), 889–895
- Behrens P, Bitter T, Kurz B, Russlies M. Matrix-associated autologous chondrocyte transplantation/implantation (MACT/MACI) – 5‑year follow-up. The Knee, 2006; 13 (3), 194–202. doi:10.1016/j.knee.2006.02.012
- Minas T, Gomoll AH, Solhpour S, Rosenberger R, Probst C, Bryant T. Autologous chondrocyte implantation for joint preservation in patients with early osteoarthritis. Clinical Orthopaedics and Related Research, 2010; 468 (1): 147–157. doi:10.1007/s11999-009‑0998‑0
- Herrlin SV, Wange PO, Lapidus G, Hållander M, Werner S, Weidenhielm L. Is arthroscopic surgery beneficial in treating non-traumatic, degenerative medial meniscal tears? A five year follow-up. Knee Surgery, Sports Traumatology, Arthroscopy: Official Journal of the ESSKA, 2013; 21 (2), 358–364. doi:10.1007/s00167-012‑1960‑3
- Laupattarakasem W, Laopaiboon M, Laupattarakasem P, Sumananont C. Arthroscopic debridement for knee osteoarthritis. Cochrane Database of Systematic Reviews (Online), 2008 (1), CD005118. doi:10.1002/14651858.CD005118.pub2
- Mariani PP. Posterior horn instability of the medial meniscus a sign of posterior meniscotibial ligament insufficiency. Knee Surgery, Sports Traumatology, Arthroscopy : Official Journal of the ESSKA, 2011; 19 (7), 1148–1153. doi:10.1007/s00167-011‑1424‑1
- Staubli AE, De Simoni C, Babst R, Lobenhoffer P. TomoFix: a new LCP-concept for open wedge osteotomy of the medial proximal tibia – early results in 92 cases. Injury, 2003; 34 Suppl 2: B55-62
- Gstöttner M, Pedross F, Liebensteiner M, Bach C. Long-term outcome after high tibial osteotomy. Archives of Orthopaedic and Trauma Surgery, 2008; 128 (1), 111–115. doi:10.1007/s00402-007‑0438‑0
- Cartier P, Cheaib S. Unicondylar knee arthroplasty. 2–10 years of follow-up evaluation. The Journal of Arthroplasty, 1987; 2 (2), 157–162
- Moseley JB, O’Malley K, Petersen NJ, Menke TJ, Brody BA, Kuykendall DH, et al. A controlled trial of arthroscopic surgery for osteoarthritis of the knee. The New England Journal of Medicine, 2002; 347 (2): 81–88. doi:10.1056/NEJMoa013259
- Reichenbach S, Rutjes AW, Nüesch E, Trelle S, Jüni P. Joint lavage for osteoarthritis of the knee. Cochrane Database of Systematic Reviews (Online), 2010 (5), CD007320. doi:10.1002/14651858.CD007320.pub2